Для получения бумаги используют малярию
Приготовление мазка и толстой капли крови при малярии.Основной метод лабораторной диагностики малярии - обнаружение эритроцитарных паразитов в толстой капле или мазке крови. В практической работе исследуют преимущественно толстые капли, так как за один и тот же промежуток времени в толстой капле можно просмотреть в 30 - 50 раз больший объем крови, чем в мазке, следовательно, и количество плазмодиев в ней больше. К мазку обращаются лишь в тех случаях, когда видовую принадлежность найденных паразитов по толстой капле установить не удается. Для выявления возбудителей малярии кровь берут при первом же подозрении на эту инфекцию независимо от температуры тела, поскольку паразиты циркулируют в крови и в интервале между приступами.
Предметные стекла, на которых готовят препараты, должны быть хорошо вымыты и обезжирены. Кровь берется с соблюдением правил асептики. Кожу пальца протирают спиртом и прокалывают простерилизованной иглой-копьем или толстой инъекционной иглой. Если кровь из мякоти пальца вытекает плохо, то больного просят сделать несколько энергичных движений рукой, кистью и слегка массируют палец. Первую выступившую каплю крови вытирают сухой ватой, затем палец поворачивают проколом вниз и ко второй капле прикасаются предметным стеклом.
Тонкие мазки крови приготавливают по методике, общепринятой для гематологических исследований. Мазок не должен доходить ни до конца, ни до краев предметного стекла. Поэтому капля крови должна быть диаметром не более 2 - 3 мм. Предметное шлифованное стекло, которым делается мазок, должно быть уже стекла, на которое наносят мазок. Для этого углы шлифованного стекла обламывают пинцетом. В целях приготовления мазка шлифованное стекло ставят перед каплей крови под углом 45° и продвигают вперед до соприкосновения с ней. Когда кровь равномерно распределится между обоими стеклами, быстрым движением делают мазок.
Для приготовления толстой капли крови на предметное стекло наносят каплю крови диаметром около 5 мм. Эту каплю размазывают иглой или углом предметного стекла в диск диаметром 10 - 15 мм. Толщина капли должна быть такой, чтобы сквозь нее можно было читать газетный шрифт Мазки не должны быть толстыми, поскольку после высыхания они растрескиваются и отстают от стекла. Обычно на стекло наносят 2 - 3 капли на некотором расстоянии одна от другой. Взятые капли должны быть отмечены. На обратной стороне стекла восковым карандашом указывается фамилия больного или соответствующий регистрационный номер.
Очень удобно наносить толстую каплю на влажный толстый мазок крови. В этом случае капля самостоятельно растекается в правильный диск. Простым карандашом на мазке делается маркировка препарата Такой препарат удобен еще и тем, что в мазке довольно хорошо сохраняется часть пораженных эритроцитов, а это важно для уточнения вида паразита. Преимущество данного метода в том, что капля, нанесенная на мазок, удерживается более прочно, чем нанесенная непосредственно на стекло.
Приготовленные толстые капли высушивают при комнатной температуре не менее 2 - 3 ч без какого-либо дополнительного подогревания во избежание фиксации крови. После высыхания капли на нее наливают краску Романовского - Гимзы, разведенную как обычно (2 капли краски на 1 мл дистиллированной воды). Продолжительность окраски в среднем составляет 30 - 45 мин. Окрашенную каплю осторожно ополаскивают водопроводной водой (сильная струя может смыть каплю) и просушивают в вертикальном положении. Фильтровальной бумагой ее высушивать нельзя. При окраске капли в водных растворах красок происходит выщелачивание гемоглобина из эритроцитов, вследствие чего в окрашенной капле эритроциты уже не видны. Из форменных элементов сохраняются лейкоциты и тромбоциты.
Мазки фиксируют, помещая их на 3 мин в метиловый или на 10 мин в 96% этиловый спирт. Зафиксированные препараты высушивают на воздухе, защищая от пыли и мух. Потом препараты помещают в специальный контейнер и окрашивают азур-эозиновым красителем по Романовскому - Гимзе на протяжении 20 - 30 мин.
По истечении этого срока контейнер подставляют под слабую струю воды и промывают. После того как из контейнера польется неокрашенная вода, остатки ее сливают и промывают еще раз. Не рекомендуется сначала сливать краску, а затем промывать мазок водой, поскольку пленка, образовавшаяся на поверхности красителя, может попасть на препараты и оказаться причиной диагностической ошибки. Капля на мазке окрашивается так же, как толстая капля.
Промытые препараты высушивают и исследуют под микроскопом. В зараженных эритроцитах видны плазмодии малярии с голубой цитоплазмой и ярко-красным ядром. Нахождение плазмодиев малярии в крови больного является неоспоримым доказательством болезни.
Определение интенсивности паразитемии при малярии. Достаточно точный метод сводится к подсчету среднего числа паразитов на одно поле зрения толстой капли. Если паразитов много, то подсчет ведут в 10 полях зрения, если мало в 100. Численность указывают отдельно для обнаруженных стадий паразита, например, р. falciparum кольца +++, гаметоциты +. Применительно к численности колец ВОЗ рекомендованы следующие символы:
1 – 10 в 100 п. зр = +.
более 10 в п. зр. = + + ++
более 100 в п.зр.=+ + + + +
Лаборанты с высоким уровнем подготовки применяют более точный метод, а именно, подсчитывают численность паразитов по отношению к числу лейкоцитов. Например, в толстой кишке на 100 лейкоцитов найдено 20 паразитов.
Допуская, что у больного 4.000 лейкоцитов в 1 мкл крови, легко установить:
в исследованных полях зрения – 100 лейкоцитов и 20 паразитов в 1 мкл имеется 4000 лейкоцитов и Х паразитов. Следовательно, в 1 мкл: 4000х20/100 = 800 паразитов. Подсчет будет еще более точным, если в формулу ввести конкретное, а не предположительное число лейкоцитов у данного пациента. При очень высокой паразитемии ее интенсивность может быть охарактеризована числом паразитов на 100 эритроцитов, подсчитанных в тонком мазке.
Не нашли то, что искали? Воспользуйтесь поиском:
3.2. ПРОФИЛАКТИКА ПАРАЗИТАРНЫХ ЗАБОЛЕВАНИЙ
Паразитологическая диагностика малярии
Дата введения 2001-01-01
1. Методические указания подготовлены сотрудниками Института медицинской паразитологии и тропической медицины им. Е.И.Марциновского Московской медицинской Академии им. И.М.Сеченова Минздрава России (к.м.н. Рабинович С.А., к.б.н. Кукина И.В., Mа. ская* Е.В., к.м.н. Морозов Е.Н.) и Федерального центра государственного санитарно-эпидемиологического надзора Минздрава России (к.б.н. Цыбина Т.Н., Сыскова Т.Г.).
________________
* Брак оригинала. - Примечание изготовителя базы данных.
2. УТВЕРЖДЕНЫ Главным государственным санитарным врачом Российской Федерации, Первым заместителем Министра здравоохранения Российской Федерации Г.Г.Онищенко 19 октября 2000 г.
3. ВВЕДЕНЫ ВПЕРВЫЕ.
1. Область применения и нормативные ссылки
1. Область применения и нормативные ссылки
Паразитологическую лабораторную диагностику малярии проводят клинико-диагностические лаборатории лечебно-профилактических учреждений (ЛПУ) системы Минздрава, ведомственных учреждений, а также другие лаборатории, независимо от принадлежности и форм собственности (НИИ, вузов, Минобороны, УВД, частных клиник и т.д.), имеющие лицензию и аккредитованные в системе госстандарта и госсанэпиднадзора в установленном порядке.
Органы и учреждения государственной санитарно-эпидемиологической службы Российской Федерации организуют и проводят эпидемиологический надзор за малярией, частью которого является:
контроль за уровнем лабораторной диагностики малярии в клинико-диагностических лабораториях лечебно-профилактических учреждений и других ведомств (в т.ч. исследования: 1) контрольные - не менее 10% препаратов крови, от числа отрицательных; 2) обязательные - 100% сомнительных и положительных препаратов крови с целью подтверждения лабораторного диагноза малярии);
обследование населения в очагах малярии, обследование населения по эпидпоказаниям и с консультативной целью.
В настоящих методических указаниях использованы ссылки на следующие нормативно-методические и правовые документы.
Федеральный закон "О санитарно-эпидемиологическом благополучии населения" (30 марта 1999, N 52-ФЗ).
"Основы законодательства Российской Федерации об охране здоровья граждан" (22 июля 1993, N 5487-1).
Санитарные правила и нормы 3.2.569-96* "Профилактика паразитарных болезней на территории Российской Федерации".
_______________
* Действуют СанПиН 3.2.1333-03. - Примечание изготовителя базы данных.
Санитарные правила 3.1/3.2.558-96* "Общие требования по профилактике инфекционных и паразитарных заболеваний".
_______________
* Действуют СП 3.1/3.2.1379-03. - Примечание изготовителя базы данных.
Санитарные правила 1.2.731-99 "Безопасность работы с микроорганизмами 3-4 групп патогенности и гельминтами".
2. Общие положения
Возможность завоза малярии на территорию Российской Федерации, появление вторичных от завозных и местных случаев заболевания требуют своевременной лабораторной диагностики, необходимой для адекватного лечения и рационального проведения противоэпидемических мероприятий.
Малярию человека вызывают 4 вида паразитических простейших рода Plasmodium: Р. falciparum - возбудитель тропической малярии, Р. vivax - трехдневной малярии, Р. ovale - малярии типа трехдневной, Р. malariae - четырехдневной малярии. Неспецифические клинические проявления малярии, преимущественно в первые дни болезни, при наличии ряда объективных показателей эпидемиологического характера: географический анамнез (пребывание на территории стран с тропическим и субтропическим климатом) и клинического характера: лихорадочное состояние неясной этиологии, анемия, увеличение селезенки и ряд других - обязывают врачей лечебно-профилактических учреждений заподозрить малярию.
Безусловным подтверждением диагноза служит обнаружение малярийного паразита при микроскопическом исследовании крови. Особое значение имеет раннее выявление возбудителя тропической малярии, при несвоевременной диагностике которой возможен летальный исход. Определение вида паразита служит основанием для выбора рациональной терапии и правильной организации противоэпидемических мероприятий.
3. Характеристика развития малярийного паразита в эритроцитах
Проявления малярии обусловлены развитием паразита в эритроците - так называемой эритроцитарной шизогонией. В процессе эритроцитарной шизогонии образуются бесполые и половые формы паразита.
Бесполые формы за период времени, характерный для каждого вида паразита, проходят в эритроцитах ряд последовательных возрастных стадий своего развития, строение которых (морфология) и их окрашиваемость (тинкториальные свойства) хорошо различимы в "тонком мазке" крови. Трофозоиты - одноядерные растущие стадии: кольцевидные, развивающиеся (амебовидные, полувзрослые) и зрелые. Шизонты - делящиеся стадии: развивающиеся (незрелые), с последовательным делением ядер и общей цитоплазмой и зрелые, представляющие скопление дочерних клеток мерозоитов с обособленными ядрами и цитоплазмой. В динамике эритроцитарная шизогония в общем виде протекает следующим образом. Мерозоит, внедрившийся в эритроцит, быстро увеличивается в размере, в цитоплазме появляется пищеварительная вакуоль и образуется - кольцевидный трофозоит. На этой стадии цитоплазма имеет вид узкого ободка, огибающего пищеварительную вакуоль, ядро сравнительно мелкое, компактное с трудно различимой структурой хроматина, оттеснено к одному из полюсов клетки. По мере роста паразита увеличиваются его размеры, количество цитоплазмы нарастает: ядро становится более крупным, менее компактным. В цитоплазме могут появиться асимметричные утолщения, различающиеся по форме и числу, псевдоподии - образуется амебовидный трофозоит. В дальнейшем у развивающегося трофозоита постепенно исчезает вакуоль, продолжает увеличиваться ядро и количество цитоплазмы - образуется зрелый трофозоит. Зрелый трофозоит - округлая или несколько вытянутая клетка с относительно рыхлым ядром, правильной или несколько вытянутой формы, занимающая весь или часть пораженного эритроцита. Затем наступает стадия шизонта, начинается попарное деление ядер, образуется развивающийся (незрелый) шизонт. По окончании деления ядер одномоментно делится цитоплазма, обособляясь вокруг каждого из дочерних ядер - образуется зрелый шизонт, состоящий из мерозоитов; их число, размеры и расположение по отношению к скоплению пигмента характерны для каждого вида плазмодиев (см. таблицы). При отсутствии или неэффективном лечении мерозоиты внедряются в интактные эритроциты, и цикл вновь повторяется с присущей для каждого вида плазмодиев продолжительностью развития одной генерации. У Р. falciparum, P. vivax, P. ovale - 48 ч, Р. malariae - 72 ч.
В процессе роста паразита в его цитоплазме появляется малярийный пигмент - продукт метаболизма гемоглобина, представляющий собой включения от едва заметных мелких зерен и гранул до относительно более крупных, неправильной формы, от золотисто-коричневого до черного цвета. Количество пигмента, размеры его частиц и распределение в цитоплазме паразита меняются по мере его перехода в последовательные стадии развития.
У части трофозоитов деления ядер не происходит и они дифференцируются в половые формы, гаметоциты - женские (макрогаметоциты) и мужские (микрогаметоциты). Мужские и женские гаметоциты различаются между собой по морфологии, в первую очередь по структуре ядра, характеру и окраске цитоплазмы. В отличие от бесполых форм гаметоциты не имеют выраженной вакуоли, характеризуются значительно более обильным и грубым пигментом. Округлая форма присуща гаметоцитам Р. vivax, Р. ovale и Р. malariae, удлиненная серповидная (полулуния) - Р. falciparum. Гаметоцитов образуется меньше, чем бесполых форм. При этом женских гаметоцитов в 3-5 раз больше, чем мужских, что затрудняет выявление последних. Гаметоциты Р. vivax, Р. ovale, P. malariae значительно отличаются от гаметоцитов Р. falciparum по срокам созревания, появления в периферической крови и сохранения способности заражать переносчика (самок комара Р. anopheles).
Р. vivax, Р. ovale и Р. malariae развиваются в эритроцитах, циркулирующих в периферической крови. Развитие Р. falciparum происходит в синусах селезенки и мелких капиллярах внутренних органов в связи с адгезией пораженных эритроцитов к стенкам таких капилляров. В периферической крови обнаруживаются, преимущественно при неосложненном течении, только самые молодые стадии - кольцевидные трофозоиты. Их число очень быстро нарастает, поэтому при однократном исследовании периферической крови в начале болезни можно получить неправильное представление об истинном числе паразитов. При осложненном течении в периферической крови могут быть обнаружены более зрелые возрастные стадии паразита и гаметоциты в связи с нарушением сосудистого тонуса.
При оценке результатов исследования препаратов крови, наряду с типичной морфологией возбудителя, необходимо учитывать ряд особенностей, характеризующих паразитологическое развитие инфекции собственно и привходящих воздействий (предшествовавшее применение противомалярийных препаратов, неправильное приготовление и окраска препаратов крови).
4. Принцип метода паразитологической диагностики малярии
Паразитологическая диагностика малярии основана на обнаружении бесполых и половых форм возбудителя при микроскопическом исследовании крови, что возможно только в период его развития в эритроците. Для обнаружения плазмодиев и определения их вида используют препараты крови, приготовленные методом "тонкого мазка" и "толстой капли", окрашенные по Романовскому-Гимза. Оба метода, имеющие свои преимущества и недостатки, являются взаимодополняющими.
Основной метод - "толстая капля". Благодаря распределению относительно большего объема крови на меньшей площади, за один и тот же промежуток времени просматривается количество крови в 30-40 раз большее, чем в "тонком мазке", что значительно повышает шанс обнаружения паразитов, особенно при низкой паразитемии. Начинать надо всегда с просмотра "толстой капли".
Чувствительность метода "толстой капли" такова, что при просмотре 100-150 полей зрения можно обнаружить около 8 паразитов в 1 мкл крови. Концентрация исследуемой крови на ограниченной площади приводит к многослойному расположению эритроцитов. Для того чтобы паразиты были видимы, "толстую каплю" окрашивают нефиксированной; это приводит к гемолизу эритроцитов, и паразиты подвергаются деформации. Несмотря на определенную специфичность, такая деформация иногда может препятствовать идентификации вида паразита. Ограничиться просмотром "толстой капли" можно только, если вид паразита был первоначально установлен. "Толстая капля" относительно быстро позволяет выявить и других паразитов крови: трипаносом, микрофилярий, спирохет, бабезий и др. Отрицательный паразитологический результат изучения "толстой капли", но повышенное содержание остатков незрелых эритроцитов позволяет предположить перенесенную недавно малярию (при отсутствии соответствующих анамнестических данных), обнаружение повышенного содержания лейкоцитов, их видовой состав, а также повышенное содержание остатков незрелых эритроцитов, позволяют предположить иное заболевание, не связанное с малярией.
В "тонком мазке", фиксированном до окраски, сохраняются морфологические особенности как пораженного эритроцита, так и присущие данному виду паразита. Большое значение для дифференциального диагноза имеет характер изменения пораженных эритроцитов. "Тонкий мазок" крови делают в дополнение к "толстой капле". В тех случаях, когда вид возбудителя в очаге установлен, для эпиднадзора за очагом можно ограничиться методом "толстой капли".
5. Необходимые реактивы и оборудование
1. Этиловый спирт 96°.
2. Азур-эозин по Романовскому-Гимза (промышленный маточный раствор или сухая краска).
3. Метиленовый синий.
4. Этиловый эфир.
6. Тетраборат натрия (бура).
7. Калий фосфат однозамещенный безводный - KH PO .
В распознавании малярии важное значение имеют данные эпидемиологического анамнеза (уровень эндемии и сезон передачи возбудителей в данной местности, возникновение болезни на протяжении 3 лет после пребывания в эндемическом очаге или на протяжении 3 мес после гемотрансфузии или внутривенных инфузий и др.) и выявление характерных клинико-лабораторных признаков (высокая и часто приступообразная лихорадка, сплено- и гепатомегалия, анемия и панцитопения).
Решающее значение в диагностике болезни имеет обнаружение плазмодиев в препаратах крови — толстой капле и мазке. Исследование крови на малярию проводят при первом подозрении на эту болезнь, независимо от температуры тела в момент забора крови.
Для паразитологического исследования используют капиллярную кровь, взятую из пальца, или венозную кровь. Микроскопию препаратов крови, окрашенных по Романовскому-Giemsa, проводят с использованием иммерсионной системы (окуляр 7х, объектив 90х). В каждом препарате изучают не менее 100 полей зрения (0,25 мкл крови), даже в тех случаях когда паразиты выявляются при исследовании меньшей площади препарата, что способствует более четкому изучению эритроцитарных стадий паразитов и выявлению случаев mixt-инвазии.
Ввиду большого объема крови, изучаемого в толстой капли крови, ее исследование позволяет быстрее обнаружить малярийные паразиты и определить интенсивность паразитемии. Изучение мазка крови помогает более точно определить видовую принадлежность паразитов и стадии их эритроцитарного развития. При определении вида возбудителя используют морфологические признаки плазмодиев и пораженных эритроцитов.
Важное клиническое значение имеет не только видовая характеристика возбудителя, но и определение стадий их развития и численности паразитов. Это особенно актуально для диагностики P. falciparum-малярии, при которой наличие в крови зрелых трофозоитов и шизонтов, а также большая интенсивность паразитемии являются прогностически неблагоприятными. Интенсивность паразитемии в толстой капли крови определяют по числу паразитов в поле зрения: 1-100 плазмодиев в 10 полях зрения соответствуют 5-50 паразитам в 1 мкл крови (+); 10-100 плазмодиев в 10 полях зрения— 50-500 паразитов в 1 мкл крови (++); 1-10 плазмодиев в 1 поле зрения — 500-5000 паразитов в 1 мкл крови (+++); 10-100 плазмодиев в 1 поле зрения — 5000-50 000 паразитов в 1 мкл крови (++++), более 100 паразитов в 1 поле зрения — более 50 000 паразитов в 1 мкл крови (+++++); а также по соотношению числа паразитов и лейкоцитов в препарате с последующим перерасчетом на число лейкоцитов в 1 мкл крови. Интенсивность паразитемии может быть вычислена и по количеству паразитов, приходящихся на 100 эритроцитов (в 10 полях зреня) При паразитемии P. falciparum более 100 000 плазмодиев в 1 мкл или поражении более 5% эритроцитов прогноз может быть неблагоприятным у 7-20% больных, а при паразитемии более 500 000 плазмодиев в 1 мкл крови или поражении 10% эритроцитов и более летальные исходы развиваются в 65% случаев. При Р. vivax-малярии редко поражается более 2% эритроцитов.
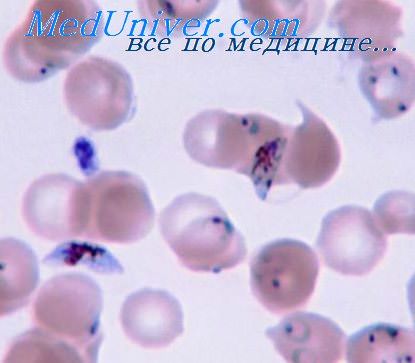
Ввиду возможности развития выраженных симптомов малярии при относительно невысоком уровне паразитемии (обычно у неиммунных лиц) однократный отрицательный результат микроскопии крови не исключает диагноз малярии, а делает необходимым повторное исследование препаратов крови, взятых через 8-12 ч.
У больных с паразитологически подтвержденным диагнозом малярии микроскопию препаратов крови проводят ежедневно, при тяжелых формах Р. falciparum-малярии дважды в день до исчезновения паразитов, а затем еженедельно до 28-го дня лечения для оценки эффективности терапии. При P. falciparum-малярии это позволяет своевременно выявлять резистентность плазмодиев к применяемому препарату.
Определенное диагностическое значение имеют выявляемые в гемограмме признаки анемии (анизопойкилоцитоз, ретикулоцитоз и др.), лейкопения и относительный лимфомоноцитоз.
Серодиагностика малярии включает использование НРИФ, РИФ, ИФА, РИГА и др. и имеет наибольшее значение в неэндемических районах. Обнаружение в НРИФ антител к P. falciparum в титре 1:80 и более свидетельствует о свежей инвазии.
Дифференциальный диагноз малярии проводят с гриппом и другими острыми респираторными вирусными инфекциями, острыми кишечными инфекциями, лептоспирозом, желтой лихорадкой, злокачественными формами вирусных гепатитов, тифо-паратифозными заболеваниями, бруцеллезом, сепсисом, геморрагическими лихорадками инфекциями мочевыделительной и гепатобилиарной систем, заболеваниями системы крови.
Медицинский справочник болезней
Малярия. Виды, симптомы, лечение и профилактика малярии.
Малярия (итал. malaria, от malo—плохой и aria — воздух; в прежнее время считали, что малярия вызывается дурным воздухом), болотная лихорадка,— инфекционное заболевание, возбудителем которого является кровепаразит — малярийный плазмодий, который имеет сложный цикл развития, протекающий в организме человека (бесполый цикл, или т. наз. шизогония ) и в организме комара ( половой цикл, или т. наз. спорогония).
Известно 4 вида плазмодиев — возбудителей различных форм малярии человека:
- Трехдневной малярии-- Plasmodium vivax,
- Тропической малярии -- P. falciparum,
- Четырехдневной малярии -- Plasmodium malariae,
- Plasmodium ovale.
Путь заражения.
Здоровый человек заражается от больного малярией через переносчика плазмодия — самку малярийного комара из рода анофелес.
Инкубационный (скрытый) период может длится от 7-10 дней до нескольких месяцев.
Цикл развития малярийного плазмодия.
В организм человека паразиты малярии попадают при укусе зараженного комара в виде особой формы плазмодия — спорозоитов.
Из тока крови спорозоиты проникают в клетки печени, где проходят особый цикл развития, образуя массу мелких тканевых мерозоитов.
Из клеток печени тканевые мерозоиты выходят в кровь и внедряются в эритроциты (красные кровяные тельца), где развиваются в бесполые формы ( шизонты ) и в незрелые половые формы ( мужские и женские гаметоциты ).
Достигнув зрелости, шизонты делятся на 8 — 24 мерозоита, которые после разрушения оболочки эритроцита выходят в плазму крови и внедряются в свежие эритроциты. Бесполые формы могут размножаться в крови путем последовательных циклов в течение достаточно длительного времени, обусловливая своей жизнедеятельностью приступы малярии.
Гаметоциты (незрелые половые формы) в организме человека дальнейшего развития не претерпевают. Если комар насосется крови больного малярией, то вместе с кровью в его желудок попадают гаметоциты.
В комаре они проходят особый цикл развития, превращаясь в зрелые гаметы. Мужские гаметы сливаются с женскими (оплодотворение), проникают в стенку желудка комара и там проходят ряд превращений, в результате которых спустя 7—30 дней после кровососания в слюнных железах комара появляются особые формы паразита — спорозоиты. При укусе зараженным комаром здорового человека спорозоиты вместе со слюной комара проникают в кровь и затем в печень.
Клинические симптомы.
В течение первых 7--10 дней после заражения, пока паразит проходит цикл развития в печени, никаких признаков болезни еще не бывает — это инкубационный (скрытый) период, который при некоторых формах малярии может затягиваться на многие месяцы, так что человек, заразившийся осенью, заболевает только весной следующего года. Первым признаком заболевания малярии является лихорадка, проявляющаяся серией малярийных приступов.
В развитии малярийных приступов играет роль наличие в крови достаточного количества плазмодиев.
В большинстве случаев приступ начинается ознобом нередко столь сильным, что больного трясет и ему не удается согреться даже под теплой одеждой. Вскоре озноб сменяется жаром. Температура постепенно поднимается до 39—40°; лицо больного краснеет, он тяжело и часто дышит, жалуется на сильную головную боль. Температура затем быстро снижается, иногда ниже нормальной; больной в это время сильно потеет. На следующий день он чувствует себя почти здоровым.
Затем приступ повторяется: при трехдневной форме малярии— каждый третий день, при четырехдневной — каждый четвертый, при тропической — нередко ежедневно. По мере повторения приступов у больных вследствие разрушения паразитами красных кровяных телец развивается малокровие, увеличивается селезенка и печень, значительно уменьшается количество белых кровяных телец.
Малярия истощает силы больного, снижает трудоспособность взрослых, замедляет рост и развитие детей. При отсутствии или несвоевременности лечения может протекать с осложнениями (воспаление почек, малярийные отеки), а при тяжелых формах тропической малярии (так наз. коматозная малярия) или при молниеносной трехдневной форме малярии детей может окончиться смертью.
Диагностика.
Рано начатое лечение сохраняет здоровье больному, исключает возможность заражения комаров от него и тем предохраняет окружающих от заражения.
Диагноз ставится на основании:
ЛЕЧЕНИЕ МАЛЯРИИ.
- Хинин,
- Акрихин (Хинакрин, Гепакрин, Мепакрин, Пентилен),
- Бигумаль ,
- Сочетание их с Плазмоцидом,
- Амодиахин и Сульфадоксин-пириметамин.
Курс лечения продолжается 5—7 дней и проводится по особым схемам, определяемым врачом.
При трехдневной форме прекращение приступов после лечения не значит полного избавления от болезни.
Нередко через 8—10 месяцев после прекращения первичных приступов наступает возврат (рецидив) болезни.
Причиной возникновения рецидивов являются печеночные формы паразита, могущие существовать в организме при трехдневной форме малярии до 1—1,5 лет.
С целью предупреждения рецидивов больные трехдневной малярией должны получать после 5 дней лечения акрихином или бигумалем еще 10-14 дней подряд хиноцид. При раннем и правильном лечении удается, как правило, излечить больного малярией в течение 2—3 недель.Особенно эффективным и надежным является лечение, проведенное в условиях больницы.
Заражение человека малярией происходит в сезон активности комаров — летом и осенью. В южных странах сезон продолжается в течение 4—6 месяцев, с мая--июня по сентябрь--октябрь. Наибопьшее число больных обычно регистрируется в августе--сентябре, когда заражение малярией происходит наиболее интенсивно. В северных областях сезон активности комаров продолжается 1--2 месяцев (июль--август).
Борьба с малярией началась в первые же годы становления советского здравоохранения. Проводилась она планово, в общегосударственном масштабе.
Массовое заболевание практически было ликвидировано уже в 60-х годах на территории всех бывших союзных республик.
В настоящее время мероприятия по ликвидации малярии осуществляются почти во всех странах мира.
Всемирная организация здравоохранения (ВОЗ) координирует усилия стран в реализации этой важной мировой проблемы здравоохранения и оказывает многим странам необходимую техническую и экономическую помощь из средств специального фонда на ликвидацию малярии.
С 2000 года глобальные показатели смертности от малярии по данным ВОЗ снизились более чем на 25%, а в Африканском регионе, эпидемиологически самом опасном— на 33%. В Африке каждую минуту от малярии умирает ребенок. Большое количество больных малярией и в Индии.
Профилактика малярии.
Для профилактики при поездках в районы эпидемии и в наиболее активные для комаров сезоны принимают специальные противомалярийные препараты по рекомендации ВОЗ: Амодиахин, Сульфадоксин-пириметамин, Бигумаль и др.
Выбор препарата зависит от формы малярийного плазмодия, распространенного в данном регионе.
Курс начинают за 1-2 недели до поездки, продолжают прием в течение всего пребывания в зоне эпидемии и еще четырёх недель по возвращении.
Кроме того, необходимо защитить себя от укусов комаров. Для этого используют репелленты и москитные сетки, пропитанные инсектицидом длительного действия (СИДД).
В настоящее время учеными создана вакцина против малярии и находится на стадии клинических испытаний.
Читайте также:


