Определение количества бактерий группы кишечных палочек в воде
Санитарно-бактериологическое исследование воды - Ф. К. Черкес
Исследованию подлежит вода:
1) централизованного водоснабжения;
2) из колодцев различного типа;
3) открытых водоемов (рек, озер, морей);
4) плавательных бассейнов;
Примечание. Пробы хлорированной воды берут во флаконы с дехлоратором (гипосульфитом).
Отбор проб воды. Из открытых водоемов воду берут с помощью специальных бутылей или батометров, снабженных грузилами. Пробу воды рекомендуют брать на глубине 10-15 см от поверхности (так как поверхность подвергается воздействию атмосферных факторов) и на расстоянии 1,5 м от берега (вода у самого берега может быть загрязнена микрофлорой почвы).
Для отбора проб водопроводной воды используют стерильные флаконы вместимостью 500 мл, закрытые ватно-марлевыми пробками и покрытые бумажными колпачками.
Кран предварительно обжигают тампоном, смоченным спиртом, после чего воду спускают в течение 10-15 мин и набирают во флаконы. Заполненные флаконы закрывают стерильными пробками.
Примечание. Исследуют 333 мл воды (табл. 54).

Таблица 54. Эмпирическая таблица ГОСТ 16963-73
В распределительной сети водопровода отбор проб воды осуществляют в зависимости от количества населения, проживающего в зоне обслуживания.
Стандартные методы исследования регламентированы для воды центрального водоснабжения (ГОСТ 18963-73) и предусматривают:
1. Определение общего числа микроорганизмов (в 1 мл исследуемой воды должно быть не более 100).
2. Определение коли-индекса и коли-титра (коли-индекс 3, коли-титр 333 и выше; для Москвы и Ленинграда коли-индекс не более 2, а коли-титр более 500).
3. Исследование по эпидемиологическим показаниям на патогенную микрофлору (патогенных микроорганизмов не должно быть обнаружено).
Согласно ГОСТу 18963-73 общее число бактерий - это то количество микроорганизмов, которое содержится в 1 мл исследуемой воды, способных в течение суток при температуре 37° С образовывать колонии, видимые невооруженным глазом (или при увеличении с помощью лупы).
При исследовании водопроводной воды засевают 2 чашки. В одну из них вносят 1 мл неразведенной воды, в другую 1 мл воды, разведенной в 10 раз (т. е. 0,1 мл исходной пробы).
При исследовании более загрязненной воды засевают 1 мл воды, разведенной в 100 раз. Это соответствует 0,01 и 1 мл .воды, разведенной в 1000 раз (0,001 мл) и т. д. Для получения таких объемов готовят последовательно десятикратные разведения, по 1 мл каждого разведения вносят в чашку и заливают тонким слоем (12-15 мл) растопленного и остуженного до 45° С питательного агара. Для равномерного распределения исследуемой воды залитые агаром чашки перемешивают путем вращения их. После застывания агара посевы ставят в термостат и инкубируют при температуре 37° С 24 ч.
Чашки с посевами вынимают из термостата и подсчитывают число выросших колоний. Учитывают только те чашки, где число колоний находится в пределах 30-300. Если колоний немного, их подсчитывают невооруженным глазом или при помощи лупы.
Если колоний много, то подсчет можно вести с помощью специального прибора для счета микробных колоний (рис. 54).
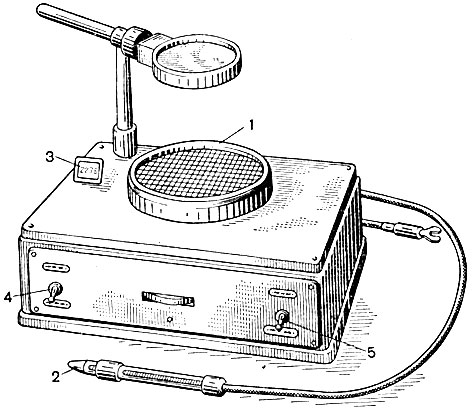
Рис. 54. Прибор для счета колоний микроорганизмов. 1 - столик для чашки Петри; 2 - игла с пружинным устройством; 3 - показатель счетчика; 4 - тумблер для включения импульсного счетчика; 5 - тумблер для включения лампы освещения счетчика
Подсчитанное количество колоний умножают на разведение и узнают число микробов в 1 мл исследуемой воды.
Наличие БГКП (бактерий группы кишечной палочки) является показателем фекального загрязнения, интенсивность которого характеризуют:
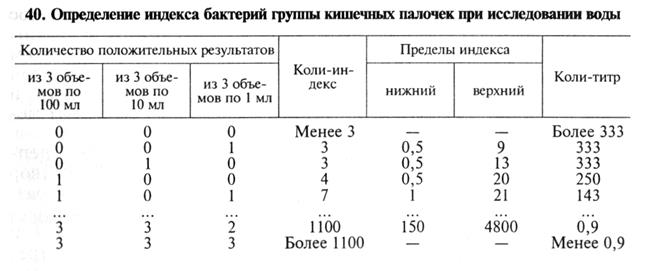
Коли-индекс - количество кишечных палочек, обнаруженных в 1 л воды.
Коли-титр - наименьшее количество воды, в котором обнаруживают присутствие кишечной палочки * .
* ( Коли-титр и коли-индекс - это один показатель, различно выраженный.)
Для выявления в воде БГКП можно пользоваться двумя методами: титрационным (бродильным) и методом мембранных фильтров.
Для исследования воды используют среду накопления глюкозопептонную (ГПС) среду Эйкмана с индикатором и бродильными трубками. Среда готовится концентрированной (в 10 раз) и нормальной концентрации - для посева 1 мл воды.
Исследуемую воду засевают по 100 мл в 3 колбы, по 10 мл в 3 пробирки (с концентрированной средой) и по 1 мл в 3 пробирки (со средой нормальной концентрации) - всего 333 мл. Посевы инкубируют в термостате при 37° С 24 ч.
Вынимают посевы из термостата и просматривают их.
При наличии помутнения в колбах или пробирках из них производят посев петлей на сектора среды Эндо в чашках Петри. Посевы инкубируют в термостате при 37° С.
Вынимают чашки из термостата. Из подозрительных колоний делают мазки. При наличии грамотрицательных палочек ставят пробу на оксидазную активность. Положительная проба на оксидазу дает право дать отрицательный ответ.
Проба на оксидазу. 1-й способ: со среды Эндо снимают петлей 2-3 колонии каждого типа и наносят на поверхность фильтровальной бумаги, смоченной диметилпарафенилендиамином. Положительная реакция характеризуется посинением штрихов, сделанных из колоний.
2-й способ: реактив можно нанести на изолированную колонию на среде Эндо (красная колония - синеет) (рис. 55).
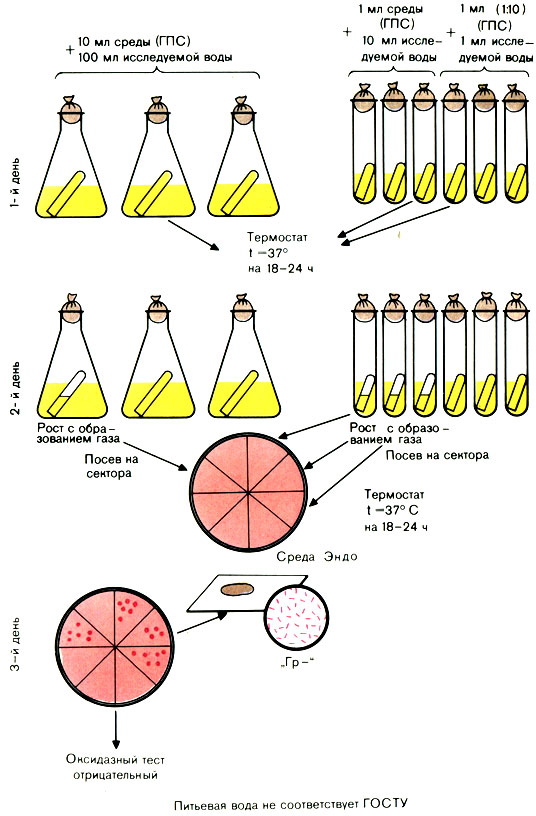
Рис. 55. Определение коли-индекса воды титрационным методом
Отрицательная проба на оксидазу свидетельствует о наличии в воде БГКП. В этом случае вычисляют коли-индекс и коли-титр с помощью стандартных (эмпирических) таблиц ГОСТа 16963-73 (см. табл. 54).
Эти таблицы предусматривают любую возможную комбинацию объемов посева, из которых выделена кишечная палочка.
Для фильтрации воды можно использовать воронку Гольдмана вместимостью 700-800 мл.
В воронку смонтированного и простерилизованного фильтровального прибора Зейтца наливают отмеренный объем исследуемой воды. С помощью насоса создают вакуум в приемном сосуде (обычно воду фильтруют через фильтры № 2 и 3). По окончании фильтрации стерильным или обожженным в огне пинцетом снимают фильтр и накладывают его на среду Эндо в чашке Петри так, чтобы поверхность с осевшими на ней микробами была обращена вверх (на одну чашку можно помещать 3-4 мембранных фильтра).
Посевы инкубируют в термостате при температуре 37° С 18-24 ч.
Чашки с посевами (фильтрами) вынимают из термостата. Отсутствие подозрительных колоний дает право дать отрицательный ответ.
Учету подлежат все красные и розовые колонии с металлическим блеском или без него. Из выросших колоний делают мазки, окрашивают по Граму (рис. 56).
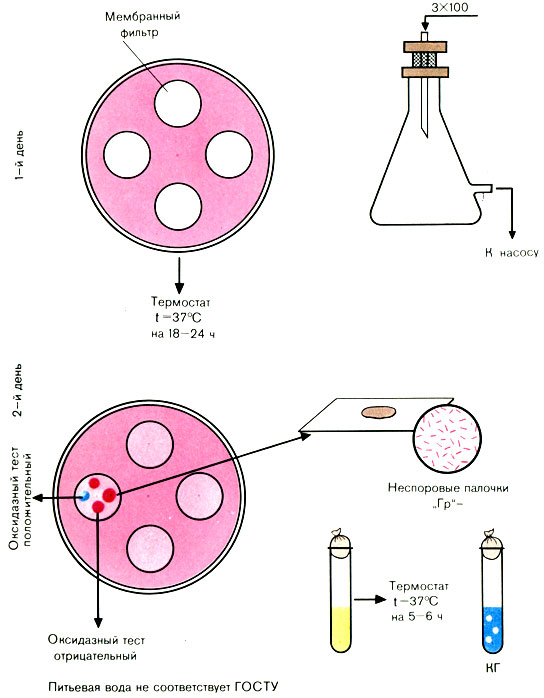
Рис. 56. Определение коли-индекса воды методом мембранных фильтров
При наличии грамотрицательных палочек ставят пробу на оксидазу. Положительная оксидазная проба дает право дать отрицательный ответ. При отрицательной оксидазной пробе производят посев на полужидкую среду с глюкозой и индикатором или на среду ГПС с бродильными трубками - для выявления ферментации углевода до кислоты и газа. При наличии кислоты и газа вычисляют коли-индекс. Например, на всех фильтрах, находящихся на среде Эндо, выросло 3 колонии, пропущено через фильтр было 300 мл воды.
Примечание. Титрационный метод более точный и может быть использован при наличии в воде примесей. Метод мембранных фильтров экономичнее и дает возможность дать ответ на 2-й день.
Для определения наличия в воде свежих фекальных кишечных палочек производят посев воды (3-х объемов) на лактозопептонную среду с борной кислотой. Инкубируют при 43° С 24 ч. Наличие кислоты и газа свидетельствует о свежем фекальном загрязнении.
По эпидемиологическим показаниям в воде определяют сальмонеллы, шигеллы, энтеровирусы.
Примечание. Общепринятым дополнительным показателем фекального загрязнения питьевой воды являются энтерококки. При проведении бактериологического исследования определяют все группы энтерококков, хотя санитарное значение имеют преимущественно фекальные стрептококки, обнаружение которых является показателем свежего фекального загрязнения.
1. Какова основная задача санитарной микробиологии?
2. Что такое санитарно-показательные микроорганизмы?
3. Что такое коли-индекс и коли-титр?
4. Какие Вы знаете методы определения БГКП?
Определите общее число микробов в исследуемой пробе воды. Среда ГПС (Эйкмана).
ГПС (Эйкмана) концентрированная. В 1 л воды растворяют 100 г пептона, 50 г хлорида натрия. Нагревают смесь до кипения, фильтруют, прибавляют 100 г глюкозы, устанавливают рН 7,4-7,6 и разливают по 10 мл в колбы вместимостью 250 мл, по 1 мл в 3 пробирки (концентрированной среды) и по 1 мл в 3 пробирки со средой нормальной концентрации (во всех емкостях среду до нужной концентрации доводят стерильной водой).
Примечание. При исследовании особенно загрязненных вод делают большие разведения (например, 10 -6 , 10 -7 и т. д.).
БГКП – это колиморфные бактерии, которые относятся к семейству энтеробактерий и используются в качестве определителя фекальной контаминации. Они имеют принципиальные отличия от стафилококков – данная категория представлена разнородными микроорганизмами, к которым относятся представители родов Citrobacter, Escherichia, Enterobacter и другие бациллы. Их объединяет схожесть с главной представительницей флоры кишечника – кишечной палочкой. Несмотря на некоторое сходство, на микробиологических питательных средах они способствуют образованию колонии другого цвета и вида.

Эшерихии имеет отличия от цитробактера и энтеробактера и заключаются они в свойствах размножения. Данная особенность позволяет определить, как давно произошло микробное обсеменение. Если при проверке обнаруживается присутствие эшерихий, это может свидетельствовать о том, что загрязнение БГКП было произведено недавно. Цитробактер или энтеробактер указывают на то, что с момента образования бактерий прошло несколько недель.
Важность проведения регулярных проверок на наличие микроорганизмов
Правила, направленные на создание регламентирующих документов, в том числе МУ и СанПиН, разрабатывались на основании данных проводимых исследований микроорганизмов. Они необходимы для определения частоты проверок, рекомендованных методик, объектов, которые подвергаются более пристальному контролю. Учитывая важность обеспечения безопасности населения, легко объяснить скрупулезность действий в СанПиН и МУ.

Фекальные микроорганизмы, которые попадают в окружающую среду из желудочно-кишечного тракта, относятся к одной из наиболее распространенных категорий. Второй категорией является оральная – она представлена микроорганизмами, которые обитают в полости рта. Большинство БГКП по признакам схоже с Escherichia coli – это распространенный представитель группы в связи с легкостью дифференцирования. Также она отличается быстрейшими темпами роста и поэтому служит определителем того, что загрязнение произошло недавно.
В чем опасность БГКП для организма?
БГКП может вызвать острую кишечную инфекцию, проявляемую в виде отравления. Путем распространения заболевания может быть вода, которой моют посуду после употребления пищи, сама посуда или еда. Компоненты постоянно контактируют между собой, за счет чего производится осеменение и последующая передача к здоровому человеку.
Проведение анализа
Следует помнить, что не во всех случаях возбудитель может стать возбудителем заболеваний – подобное происходит при превышении предельно допустимой концентрации микроорганизмов. В нормативных документах указывается безопасный уровень, превышение которого и может вызвать различные осложнения. Обнаружение возбудителей осуществляется при помощи материалов, которые могут потенциально содержать бактерии или контактировать с больным.
Определение безопасности может проводиться в трех направлениях:
- анализ на наличие бактерий;
- установление количества;
- диагностика биохимических характеристик.
Первые варианты используются повсеместно, третий – при необходимости детального изучения возбудителя. В зависимости от целей исследования процедуры, которые необходимы для анализа, могут отличаться.
- Для выявления бактерий потребуется осуществить посев образца в пробирку, в которой будет находиться богатая на лактозу среда. Взятые образцы выдерживаются при температуре 37 C до 48 часов. В подобных условиях производится выращивание колоний группы кишечной палочки.
- Для определения числа бактерий такой же объем материала наносится на специальные чашки Петри. После проведения процедуры инкубации в термостате происходит рост колонии – в данном случае клетки получают название колониеобразующих единиц. С помощью подсчета КОЕ можно определить количество бактерий в 1 л.
- Биохимические свойства устанавливаются при помощи пробирок со средой Гиса. Добавляя необходимые компоненты, можно определить уровень сахаролитической активности микроорганизмов.
В отдельных случаях может использоваться ускоренный метод выявления бактерий группы кишечных палочек. После первичной обработки образца отделяется небольшой фрагмент, который помещается в стерильную пробирку вместе с комочком стерильной фильтровальной бумаги. Далее в емкость наливается среда ХБ или Хейфеца. Пробирка укладывается в термостат на период от 12 до 14 часов. В случае, если в пробе имеются БГКП, среда меняет свой цвет.
Особенности отбора проб
Забор материалов для исследования производится на основании методических указаний и стандартов для каждого продукта. Смыв с рук обследуемого производится при помощи увлажненного средой ватного тампона. Чтобы добиться более точной оценки, требуется протереть каждую ладонь и пальцы не менее пяти раз, также не забыв о межпальцевых промежутках.
При изучении стаканов протирается внутренняя поверхность и верхний наружный край. Во время взятия смывов с санитарной одежды выборочно протирается четыре 25-сантиметровые – чаще всего это касается нижней части рукавов, а также фрагментов передних пол. Отметим, что стерильные тампоны заготавливаются лабораторией заблаговременно, устанавливаясь в пробирки с ватными пробками.
Далее отобранная проба отправляется в центр, помещаясь перед этим в герметично закрытую емкость. При перевозке помимо оптимальных условий хранения, которые препятствуют повреждению образцов, также важно обеспечивать низкий уровень температуры. В связи с этим не рекомендуется осуществлять забор образцов самостоятельно – этим должны заниматься специалисты. В лаборатории БГКП из емкости укладывается в раствор с использованием вибрирующего аппарата. Для проведения исследований достаточно 1 см³ жидкости.
В каких случаях нужно проводить исследования?
Проверка продуктов, а также одежды, посуды и оборудования чаще всего производится с целью оценки санитарно-гигиенического состояния организаций общественного питания, пищевой промышленности, а также больниц, лечено-профилактических и детских учреждений. В зависимости от цели исследования может проверяться наличие БГКП, их тип и общее число.
Определение микробного числа воды.
Порядок выполнения работы.
Микробное число воды – это количество колоний микроорганизмов, вырастающих при посеве 1 мл воды на РПА за 24 часа при температуре 37° С. Этим показателем определяются не все микроорганизмы, а только те, которые способны расти на РПА при указанной температуре, т.е. это сапрофитные, мезофильные, аэробные и часть факультативно-анаэробных микробов. Микробное число воды характеризует общую загрязненность её микроорганизмами и для водопроводной воды не должно превышать 50.
При определении микробного числа водопроводной воды, воды из родников, артезианских скважин пробу сеют без разведения, а воду из открытых водоемов разбавляют стерильной водой. Степень разведения выбирают, исходя из предполагаемой загрязненности воды. Из каждой пробы употребляют для посева не менее двух различных разведений, с тем, чтобы на чашках вырастало от 30 до 300 колоний. Воду вносят стерильной пипеткой в стерильную чашку Петри, соблюдая правила стерильности, затем в чашку вливают 15 мл расплавленного и охлажденного до 45°С РПА или МПА, вращательным движением перемешивают воду с питательной средой. После застывания среды чашки вверх дном помещают в термостат. На крышке записывают все данные об анализе. Посевы водопроводной воды выращивают 24 часа при температуре 37°С, а посевы воды из естественных водоемов ещё 48 часов при температуре 20°С. Подсчитывают колонии как в глубине, так и на поверхности среды. Чашки не учитываются, если при посеве 1 мл воды из разведения 1:100 и более выросло меньше 20 колоний, а также не учитываются чашки при наличии в них роста ползущих колоний, маскирующих более ½ чашки.
Просчитывают среднее арифметическое по параллельным пробам. При малом числе колоний просчитывают колонии на всей поверхности чашки, при обильном росте колоний допустимо просчитать колонии в 10 квадратах по 1 см 2 , определить среднюю по 10 просчетам и пересчитать на площадь чашки Петри по формуле:
М – микробное число воды, кл/мл;
n – среднее число колоний на 1 см 2 площади чашки Петри;
r – радиус чашки Петри = 4,5 см;
Результат просчета округляют следующим образом:
| Количество колоний в чашке | Результат |
| От 1 до 100 | Фактическое число подсчитанных колоний |
| От 101 до 1000 | Округлить до десятка |
| От 1001 до 10000 | Округлить до сотни |
| От 10001 до 100000 | Округлить до тысячи |
| От 100001 до 1000000 | Округлить до десятков тысяч |
E. coli является нормальным обитателем – комменсалом микрофлоры кишечника человека и животных. У рыб, диких птиц и насекомых E. Coli является случайным паразитом и попадает к ним при контакте с фекалиями человека и домашних животных. Так, у домашних уток, гусей она обнаруживается постоянно, а у диких - только в редких случаях. У животных Арктики кишечная палочка обнаруживается только в 10% случаев, такие же результаты получены при исследовании почвы и водоемов. В девственных почвах Арктики, на высокогорьях никаких разновидностей E. coli не встречается. При непостоянном загрязнении почвы в ней обнаруживаются E. coli citrovorum и E. coli aerogenes – результат длительного пребывания E. coli в сапрофитных условиях.
Считается, что сначала E. coli стала непатогенным паразитом кишечника человека, с приручением животных она перешла к ним. При интенсивном обмене кишечной флорой между животными организмами, отдельные разновидности кишечной палочки со свойствами патогенности в больших сообществах получили преимущество (вызывали диарею). Это было полезно для распространения бактерии, поэтому это свойство закрепилось, и при дальнейшей эволюции бактерии появились и более патогенные штаммы.
Кишечная палочка – сборная совокупность бактерий, имеющих общие признаки, которые могут сильно изменяться в зависимости от того биоценоза, в котором микроб развивается. Особенно резко свойства кишечной палочки меняются, когда в организм хозяина внедряются патогенные микробы. В этом случае E. coli может утратить способность сбраживать лактозу (образуются лактозонегативные варианты – штаммы E. coli). Такие бактерии в массовых количествах выделяются от больных брюшным тифом, паратифом, дизентерией в конце болезни и в начале периода выздоровления.
E. coli была открыта в 1885 году Эшерихом. Она представляет собой небольшую грамотрицательную палочку, длина палочки 2,5-3,0 мкм, поперечник 0,5-0,8 мкм, может давать кокковидные формы и нити, спор не образует, некоторые штаммы образуют капсулу, большинство подвижны, имеют 2-6 жгутиков, но встречаются и неподвижные формы.
Кишечная палочка хорошо растет на МПА, РПА, РБ, МБ. На плотных средах она дает круглые мелкозернистые колонии 2-3 мм в диаметре, молочно-голубоватые, колонии могут быть гладкими и шероховатыми. При росте на бульоне сначала появляется диффузное помутнение, через несколько дней образуется осадок, а на поверхности – нежная пленка.
E. coli сбраживает глюкозу, лактозу, мальтозу, маннит с образованием кислоты и газа по типу гетероферментативного молочнокислого брожения, сахарозу не сбраживает. Желатин не разжижает, разлагает триптофан с образованием индола (но встречаются формы, не образующие индол), створаживает молоко через 1-4 суток, сероводород не образует.
Международный стандарт дифференцирует бактерии группы кишечной палочки E. coli и бактерии фекально-кишечной палочки.
Бактерии группы кишечной палочки (БГКП) сбраживают лактозу при температуре 35-37° С, а бактерии группы фекальной кишечной палочки (БГФКП) сбраживают её при 44°С.
Идентификация кишечных палочек осуществляется на основании группы признаков ТИМАЦ (ТЛИМАЦ): Т – температурный тест (тест Эйкмана). Для E. coli этот тест положительный, т.к. она сбраживает углеводы при температуре 43-44° С до кислоты и газа. Большинство бактерий других групп этим признаком не обладают. Однако, имеются сведения о том, что повышенная температура не является оптимальной для E. coli, и рост E. coli, выделенной из фекалий при температуре 37° С интенсивнее, чем при 43° С.
И – образование индола. E. coli образует индол при расщеплении триптофана, тиразина, фенилаланина. Определение индола:
1) по методу Мореля – в пробирку с культурой исследуемой бактерии подвешивают индикаторную бумажку, смоченную 12% раствором щавелевой кислоты. На следующий день в присутствии индола бумажка розовеет. Этот метод достаточно простой и удобный.
2) Метод Легаль-Вейля более чувствителен. К суточной или двухсуточной бульонной культуре добавляют 5 капель 5% раствора нитропруссида натрия, 5 капель 40% раствора NaOH и 7 капель концентрированной СН3СООН. В присутствии индола появляется сине-зеленое или темно-синее окрашивание.
М – реакция с метиловым красным служит для определения интенсивности кислотообразования. К жидкой культуре бактерий добавляют индикатор метиловый красный. При интенсивном кислотообразовании, что характерно для E. coli, окраска культуры меняется на малиновый цвет.
А – реакция образования ацетилметилкарбинола (ацетоин СН3СНОНСООСН3) – реакция Фогес-Проскауэра. К жидкой культуре бактерий добавляют 40% раствор КОН, в присутствии ацетилметилкарбинола появляется розовое окрашивание. E. coli не образует ацетилметилкарбинол.
Ц – цитратный тест. Характеризует способность бактерий усваивать лимонную кислоту или ее соли в жидкой питательной среде Козера или плотной питательной среде Симмонса. Фекальные кишечные палочки не растут на этих средах. Эти бактерии цитратотрицательные. Если бактерия способна усваивать цитраты – цитратположительная, это говорит о том, что кишечная палочка довольно длительное время выживала в природной среде и уже не является показателем свежего фекального загрязнения.
Л – сбраживание лактозы. Санитарно-показательные формы сем. Enterobacteriaceae сбраживают лактозу с образованием кислоты и газа (лактозоположительные формы). Патогенные бактерии из этого семейства – сальмонеллы и шигеллы лактозу не сбраживают.
Дополнительный тест – способность бактерий расщеплять мочевину. E. coli мочевину не расщепляет.
Большинство кишечных палочек подвижны. Подвижность бактерий определяют в столбике питательной полужидкой среды Гисса или среде Пешкова. Посев выполняют уколом. Неподвижные бактерии растут в виде тяжа, подвижные вызывают общее помутнение среды.
Классификация бактерий группы кишечной палочки по Минкевичу, основанная на эволюционном развитии сем. Enterobacteriaceae
| Вид бактерии | Рост на цитратах | Реакция с метилрот | Реакция Фогес-Проскауэра | Образование индола | Бродильная при 44º С | Подвижность | Образование H2S | Расщепление мочевины |
| E. coli commune | - | + | - | + / - | + | + / - | - | - |
| E. coli citrovorum | + | - редко + | - | - редко + | - редко + | + / - | + / - | - |
| E. coli aerogеnes | + | - | + | - | - | + | - | + / - |
Желатин бактерии не разжижают, за исключением E. coli aerogenes, у которой этот признак вариабелен.
Попадая во внешнюю среду, E. coli commune приспосабливается и через полгода превращается в E. coli citrovorum, начинает расти на средах с цитратами, сбраживать сахарозу и прекращает сбраживать сахара при температуре 43º С, далее она превращается в E. coli aerogenes, которая к вышеперечисленным признакам приобретает способность вырабатывать ацетилметилкарбинол.
На питательной среде Левина E. coli образует фиолетовые колонии, на бактоагаре – красные, Киченко – желтые, на среде Ресселя с индикатором Андреде – красные.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Цель занятия.Ознакомить студентов с основными методами и показателями, необходимыми для санитарно-микробиологической оценки объектов внешней среды.
Оборудование и материалы. Прибор для подсчета колоний, колбы с пробами воды, бактериологические пробирки с 9 мл воды, пробирки с 10 мл расплавленного агара, мерные стерильные пипетки на 2 мл, стерильные чашки Петри, чашки Петри с МПА, чашки Петри с кровяным МПА, навески почвы, стерильная водопроводная вода в колбе — 270 мл, пробирки со средой Кесслера, Вильсона—Блера.
Для оценки санитарно-гигиенического состояния объектов окружающей среды проводят санитарно-бактериологические исследования, цель которых состоит в определении эпизоотологической и эпидемиологической безопасности. Показателем неблагополучия служит выявление патогенных микроорганизмов. Однако прямое их обнаружение связано с большими трудностями, и прежде всего с низкой концентрацией данных микробов, которые в основном не могут размножаться в воде, воздухе и почве. Поэтому в санитарно-микробиологической практике используют косвенные методы, направленные на определение микробной обсемененности объекта и обнаружение в нем так называемых санитарно-показательных бактерий. О бактериальной обсемененности судят по микробному числу — общему количеству микроорганизмов, содержащихся в единице объема или массы (1 мл воды, 1 г почвы, 1 м 3 воздуха).
Содержание санитарно-показательных бактерий определяют по двум показателям: титру и индексу. Титром называют минимальный объем или массу, в которых выявляют данные бактерии, индексом — количество санитарно-показательных бактерий, содержащихся в соответствующем количестве среды.
К санитарно-показательным бактериям относят представителей облигатной микрофлоры организма человека и теплокровных животных, для которых среда обитания — кишечник или воздушно-дыхательные пути. Они характеризуются следующими свойствами: 1) постоянно выделяются с калом или капельками слизи из воздушно-дыхательных путей; 2) не имеют других мест обитания; 3) способны сохраняться в окружающей среде то же время, что и патогенные бактерии, паразитирующие в кишечнике или воздушно-дыхательных путях; 4) не способны интенсивно размножаться вне организма хозяина и изменять свои свойства.
Перечисленные признаки присущи бактериям, признанным санитарно-показательными для различных объектов окружающей среды.
Санитарно-показательные бактерии группы кишечных палочек принадлежат к различным родам семейства энтеробактерий.
Обнаружение кишечной палочки в разных объектах окружающей среды считают наиболее достоверным признаком свежего фекального загрязнения. Наличие в этих же объектах бактерий родов Citrobacter и Enterobacter указывает на относительно давнее фекальное загрязнение.
Присутствие С. perfringens, С. sporogenes и других клостридий в почве свидетельствует о ее фекальном загрязнении, причем как свежем, так и давнем, поскольку эти бактерии образуют споры, что позволяет им длительно переживать в окружающей среде (в частности, в почве).
Обнаружение в объектах окружающей среды Streptococcus faecalis также свидетельствует об их фекальном загрязнении. Резкое увеличение количества этих бактерий в саморазогревающемся навозе и компостах может свидетельствовать о загрязнении почвы разлагающимися отбросами.
Гемолитические стрептококки, будучи облигатными обитателями носоглотки и зева, выделяются с капельками слизи орально-капельным путем. Сроки выживания гемолитических стрептококков в окружающей среде практически не отличаются от сроков, характерных для большинства других возбудителей воздушно-капельных инфекций. Обнаружение гемолитических стрептококков в воздухе помещений указывает на возможное его загрязнение микроорганизмами, содержащимися в зеве, носоглотке, верхних дыхательных путях и вызывающими инфекции, передаваемые воздушно-капельным путем.
Staphylococcus aureus — также факультативный обитатель носоглотки и зева. Его присутствие в воздухе помещений служит показателем орально-капельного загрязнения.
Одновременное обнаружение золотистого стафилококка и гемолитических стрептококков свидетельствует о высокой степени загрязнения воздуха.
Санитарно-микробиологическое исследование воды. Вода — естественная среда обитания микробов, которые в большом количестве поступают из почвы, воздуха, с отбросами, стоками. Особенно много микроорганизмов в открытых водоемах и реках. Кроме сапрофитов в воде могут находиться возбудители инфекций животных и человека.
При контроле санитарного состояния воды исследованию подлежат: вода централизованного водоснабжения, колодцев, открытых водоемов (реки, озера), плавательных бассейнов, сточные жидкости.
Отбор проб воды. Из открытых водоемов пробы воды отбирают с глубины 10. 15 см от поверхности и на расстоянии 10. 15 см от дна. Водопроводную воду набирают в стерильные флаконы объемом 0,5 л с притертой пробкой. Предварительно кран обжигают и спускают воду в течение 10. 15 мин. Хлорированную воду перед исследованием нейтрализуют тиосульфатом натрия из расчета 10 мл на 1л воды. Бактериологическое исследование проб воды следует проводить в течение двух часов после отбора или шести часов при температуре хранения 1. 5°С.
Определение микробного числа воды. Водопроводную воду засевают в количестве 1мл, воду открытых водоемов — по 1,0; 0,1; 0,01 мл. Все пробы вносят в стерильные чашки Петри, после чего их заливают 10. 12 мл расплавленного и охлажденного до 40. 45 °С питательного агара, который тщательно перемешивают с водой. Посевы инкубируют при 37 °С в течение 1. 2сут. Воду из открытых водоемов засевают параллельно на две серии чашек, одну из которых инкубируют при 37 ºС в течение суток, другую — 2 сут при 20 °С. Затем подсчитывают количество выросших на поверхности и в глубине колоний и вычисляют микробное число воды — количество микроорганизмов в 1 мл.
Определение коли-титра и коли-индекса воды. Минимальное количество воды в мл, в котором обнаруживают бактерии группы кишечных палочек (БГКП), называют коли-титром воды, количество БГКП, содержащихся в 1л исследуемой воды, называют кол и-и ндексом воды. Коли-титр и коли-индекс воды определяют титрационным (бродильным) методом или методом мембранных фильтров.
Титрационный метод. В глюкозо-пептонную среду (1%-я пептонная вода, 0,5%-й раствор хлорида натрия, 0,5%-й раствор глюкозы, индикатор Андреде и поплавок) проводят посевы различных объемов воды.
Метод мембранных фильтров. Определенный объем воды пропускают под давлением через мембранный фильтр № 3, предварительно стерилизованный кипячением в дистиллированной воде. Водопроводную воду и воду артезианских скважин фильтруют в объеме 333 мл. Чистую воду открытых водоемов фильтруют в объеме 100, 10, 1 и 0,1 мл, более загрязненную воду перед фильтрованием разводят стерильной водой. Фильтры накладывают на агар Эндо в чашки Петри и после инкубации при 37 °С в течение суток подсчитывают количество выросших красных колоний. Из двух-трех колоний делают мазки, окрашивают их по Граму и ставят оксидазный тест. Грамотрицательные палочки, не образующие оксидазу, принадлежат к БГКП. По существующим нормативам (ГОСТ 2874—82) питьевую воду считают качественной, если ее коли-индекс не более 3, а микробное число — не более 100.
Общепринятым дополнительным показателем фекального загрязнения воды служит количество S.faecalis. Для определения его титра цельную воду и ее 10-кратные разведения засевают в жидкую элективную среду (щелочная полимиксиновая среда). После инкубирования при 37 ºС в течение двух суток, а затем еще через сутки и двое суток делают высевы на плотные элективные среды. Фекальные стрептококки идентифицируют по морфологическим, культуральным и тинкториальным свойствам.
Есть данные о корреляции между содержанием в воде фекальных кишечных палочек и фагами бактерий группы кишечных палочек. Поэтому определение данных фагов служит косвенным показателем возможного присутствия кишечных палочек в исследуемой пробе воды.
Санитарно-микробиологическое исследование воздуха. Микрофлора воздуха зависит от микрофлоры почвы и воды. Воздух — неблагоприятная среда для обитания микроорганизмов из-за отсутствия питательных веществ, действия солнечных лучей, высушивания. Наряду с сапрофитами в воздухе могут находиться патогенные бактерии, споры грибов родов Aspergillus, Mucor и др.
Санитарную оценку воздуха осуществляют по двум показателям: 1) определение микробного числа воздуха; 2) определение количества санитарно-показательных бактерий — гемолитических стрептококков и стафилококков.
Количественные микробиологические методы исследования воздуха основаны на принципах осаждения (седиментации), аспирации или фильтрации.
Седиментационный метод осаждения Коха. Чашки Петри с МПА оставляют открытыми на 5. 10 мин. Для определения санитарно-показательных бактерий берут чашки Петри с кровяным МПА и время экспозиции увеличивают до 40 мин. Чашки выдерживают при 37 °С и комнатной температуре 24 ч и подсчитывают выросшие колонии.
Микробное число воздуха (общее количество бактерий в 1 м3) определяют по формуле Омелянского
Х= а * 100 * 1000 * 5 / (b * 10 * T),
где X— количество микробов в 1 м 3 (1000 л) воздуха; а — количество выросших колоний в чашках; b — площадь чашки; Т— время, в течение которого чашка была открыта; 5 — время по правилу Омелянского; 10 — объем воздуха в литрах. (Правило Омелянского предусматривает, что на поверхности агара в чашке Петри площадью 100 см 3 за 5 мин из воздуха оседает такое количество микробов, которое находится в его 10 л.)
Прямое обнаружение патогенных микробов воздуха проводят только при специальных показаниях.

Аспирационный метод. Более точный количественный способ определения микробного числа воздуха, так как посев микроорганизмов из воздуха производят с помощью приборов. При использовании аппарата Кротова воздух с заданной скоростью засасывается через щель плексигласовой пластины и ударяется о поверхность питательной среды открытой чашки Петри, находящейся на вращающейся подставке, благодаря чему происходит равномерный посев бактерий из воздуха на поверхность МПА (при определении микробного числа) или кровяного МПА (при выделении гемолитических стафилококков и стрептококков). После инкубации в термостате в течение двух суток подсчитывают количество выросших колоний и определяют микробное число воздуха. При исследовании воздуха могут быть использованы и другие приборы (Дьякова, Киктенко, ПАБ-1 — прибор аэрозольный бактериологический и ПОВ-1 — прибор для отбора воздуха). В практику входят ускоренные методы индикации микрофлоры воздуха с помощью мембранных фильтров, каскадных им-пакторов, фильтров Петрякова и др.
Санитарно-микробиологическое исследование почвы. Анализ почвы включает в себя определение микробного числа, коли-тит-ра, перфрингенс-титра и титра термофильных бактерий. По эпидемиологическим признакам проводят определение в почве патогенных микроорганизмов: сальмонелл, шигелл, возбудителей столбняка, ботулизма, злокачественного отека, сибирской язвы. Бактериологический анализ почвы нужен при выборе территории под пастбище, ферму, хозяйственные постройки, детские сады, больницы и др.
Предварительно делают отбор проб почвы. На обследуемой территории площадью до 1000 м 3 выделяют два участка по 25 м 3 (один — вблизи источника загрязнения, другой — в отдалении от него), берут пробы из 5 точек (4 — по углам участка, 1 — в центре) на глубине 10. 20 см стерильным совком (из более глубоких мест — с помощью специального бура Некрасова или Френкеля). Пробы почвы по 200. 300 г отбирают в широкогорлые стеклянные банки с ватными пробками (можно все взятые с одного участка пробы перемешать и на исследование направить 1 кг). На банки наклеивают этикетки, отправляют с нарочным и сопроводительным письмом. Пробы почвы полагается исследовать сразу же или в течение 6. 18 ч, сохраняя их при температуре не выше 1. 5ºС.
В лаборатории почву измельчают, освобождают от камней, осколков стекол, корней растений, просеивают через сито, тщательно перемешивают и отвешивают 30 г. В колбу на 500 мл наливают 270 мл стерильной водопроводной воды и вносят в нее отвешенную пробу почвы, все интенсивно встряхивают 10 мин, не давая отстояться частицам суспензии, готовят серию десятикратных последовательных разведений. Для относительно чистых почв достаточно 4 степени разведения, для загрязненных — 6. 9 разведений. В штатив ставят нумерованные пробирки с 9 мл стерильной воды в каждой. В первую вносят 1 мл суспензии пробы почвы, смешивают, затем 1 мл из первой пробирки вносят во вторую, смешивают, из нее — 1 мл в третью и т. д. В результате в пробирке № 1 получается разведение 1 : 100, № 2 — 1 : 1000 и т.д. Подготовленные таким образом пробы почвы исследуют.
Определение общего микробного числа. Из последних 3. 4 пробирок с разведенной суспензией отдельными стерильными пипетками вносят по 1 мл в стерильные чашки Петри (каждое разведение в отдельности). В каждую чашку добавляют еще по 10. 15 мл расплавленного и охлажденного до 45 ºС МПА. Равномерными осторожными круговыми движениями содержимое чашек перемешивают, оставляют на столе для уплотнения (затвердения) агара. С застывшей средой чашки перевертывают вверх дном, надписывают и помещают в термостат для культивирования на 24. 48 ч при 37 °С. Выросшие колонии подсчитывают в каждой чашке, умножают на степень разведения, полученные числа суммируют и вычисляют среднеарифметическое число, что составит количество микробов, содержащихся в 1 г почвы.
Определение коли-титра, перфрингенс-титра и титра термофильных бактерий почвы. Для определения коли-титра почвы различные разведения почвенной взвеси засевают по 1 мл в пробирки со средой Кесслера (на 1л дистиллированной воды — 10г пептона, 50 мл бычьей желчи — 2,5 г лактозы, 4 мл 1%-го водного раствора генцианвиолета) и инкубируют при 43 ºС в течение 48 ч. В дальнейшем исследования проводят по схеме, применяемой при определении коли-титра воды. Наибольшее разведение почвенной суспензии, в котором отмечена ферментация лактозы (газообразование), соответствует коли-титру почвы. Для определения перфрингенс-титра почвы различные разведения почвенной суспензии по 1 мл засевают в пробирки со стерильным обезжиренным молоком или железосульфитной средой Вильсона— Блера, приготовленной ex tempore. Посевы инкубируют при 43 °С в течение 24. 48 ч, после чего учитывают результаты по свертыванию молока или по образованию черных колоний С. perfringens в агаровом столбике среды Вильсона—Блера. Из колоний делают мазки, окрашивают по Граму, микроскопируют и вычисляют перфрингенс-титр, который соответствует наибольшему разведению почвы, вызвавшему почернение и разрыв среды Вильсона— Блера в первые 12 ч роста.
Для определения титра термофильных бактерий разведения почвенной суспензии по 1 мл вносят в чашки Петри, заливают расплавленным и охлажденным агаром. Посевы инкубируют в течение суток при 60 ºС, а затем подсчитывают количество выросших колоний и пересчитывают на 1 г почвы.
Санитарно-микробиологическую оценку почвы проводят по комплексу показателей, из которых наиболее важный ление степени фекального загрязнения.

ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
1. Определить микробное загрязнение воздуха.
2. Провести исследование воды с целью установления микробного числа и коли-титра.
3. Определить микробное число и перфрингенс-титр почвы.
1. Что такое санитарно-показательные микроорганизмы?
2. Как определяют коли-титр воды?
3. Как определяют микробное число почвы?
4. Как определяют перфрингенс-титр почвы?
5. Какие методы применяют для определения микробного числа воздуха?
6. Что такое санитарно-показательные микробы воздуха и как их определяют?
Читайте также:


