Кишечная палочка деление клетки

Рис. 1. Снимок химерных клеток кишечной палочки и дрожжей, сделанный с помощью конфокального флуоресцентного микроскопа. Голубым окрашены клетки дрожжей, фиолетовым — РНК кишечной палочки. Изображение из обсуждаемой статьи в PNAS
Общепринятая на данный момент теория симбиогенеза предполагает, что митохондрии в эукариотических клетках произошли от симбиотических бактерий. Однако поиски предковой бактерии и реконструкция событий симбиогенеза еще далеки от завершения. Авторы новой статьи в журнале PNAS подошли к проблеме с другого конца: они смоделировали симбиогенез на примере хорошо изученной бактерии (Escherichia coli) и хорошо изученной эукариотической клетки (Saccharomyces cerevisiae). Теперь у нас есть отработанная методика получения химерных клеток, с помощью которой можно проверять, какие именно свойства предковой бактерии были необходимы для симбиогенеза.
Общий принцип, которым руководствовались авторы эксперимента, можно сформулировать так: чтобы заставить две клетки вступить в симбиоз, нужно отобрать у них что-то жизненно важное, тогда их существование по отдельности станет невозможно (рис. 2).

Всю работу можно условно разделить на пять шагов.
Шаг 1 — лишить кишечную палочку самодостаточности. Чтобы эндосимбиоз оказался выгодным решением для бактерии, она должна стать ауксотрофом — быть неспособной производить какое-нибудь жизненно необходимое вещество. Для многих бактерий таким веществом является тиамин (витамин B1) — кофермент в реакциях углеводного обмена. Поэтому в геноме E. coli ген биосинтеза тиамина был заменен на кассету (см. Gene cassette) с GFP (зеленым флуоресцентным белком) и геном устойчивости к антибиотику канамицину. Теперь клетки не могут выживать без внешнего источника тиамина (который они сквозь мембрану закачивают внутрь), их можно отобрать под действием антибиотика и отследить во флуоресцентный микроскоп.
Шаг 2 — сделать кишечную палочку полезной. Авторы гипотезы происхождения митохондрии из внутриклеточных паразитов полагают, что одним из ключевых белков был АТФ/АДФ-антипортер (см. Antiporter). Это белок-переносчик, который обменивает АТФ на АДФ, меняя их местами по разные стороны мембраны. У паразитической бактерии он должен работать на благо бактерии: захватывать АТФ снаружи (то есть отбирать у клетки-хозяина) и менять на отработанные АДФ бактерии. Однако этот механизм можно заставить работать и в обратную сторону, если концентрации веществ поменяются местами. При этом бактерия начнет забирать АДФ из цитоплазмы хозяина и отдавать АТФ. Так или иначе, АДФ/АТФ-антипортеры есть как у современных митохондрий, так и у внутриклеточных паразитов. У свободно живущей кишечной палочки такого белка нет, поэтому пришлось снабдить клетки E. coli плазмидой с соответствующим геном.
Шаг 3 — лишить дрожжи самодостаточности. Чтобы заставить дрожжи вступить в симбиоз, их нужно лишить энергии, то есть АТФ. Тогда единственным выходом будет получить его от кишечной палочки. Но у дрожжей, как у почти всех эукариот, есть свои митохондрии. Поэтому авторы эксперимента взяли мутантный штамм дрожжей, лишенный одного из ключевых митохондриальных генов. Такие клетки содержат митохондрии, но не получают от них энергии. Они не могут расти в среде, где из питательных веществ есть только глицерин. Однако оказалось, что и в симбиоз с E. coli они тоже не вступают.

Рис. 3. Ультраструктура химерных клеток: результаты томографии под действием мягкого рентгеновского излучения. Сверху вниз — три плана в разных плоскостях. Левый столбец — просто снимок, средний столбец — снимок с выделенными органеллами, правый столбец — реконструкция клетки с обозначением плоскости среза (пунктирная линия). Изображение из обсуждаемой статьи в PNAS
Шаг 5 — убрать лишнее. В ходе эволюции митохондрия утратила большую часть ДНК (у млекопитающих, например, в ее геноме осталось лишь 37 генов). Это значит, что она становилась всё более зависимой от своей клетки-хозяина. Авторы обсуждаемой статьи попробовали воспроизвести и этот этап тоже. Для этого они удалили у клеток кишечной палочки ген биосинтеза НАД + — еще одного важного кофермента. Клетки, лишенные НАД + , так же как и их предшественники, лишенные тиамина, успешно образовывали химеры с дрожжами. И даже двойные мутанты, неспособные производить ни один из этих коферментов, также вступали в эндосимбиоз (рис. 4).

Рис. 4. Колонии химерных клеток, образованные разными штаммами кишечной палочки. А. Слева направо: контроль (клетки дрожжей), длина масштабного отрезка 10 мкм; химера с E. coli, дефицитными по тиамину, длина масштабного отрезка 5 мкм; химера с E. coli, дефицитными по НАД + ; химера с E. coli, дефицитными по обоим коферментам. Зеленым светится GFP в клетках кишечной палочки. В. Слева направо: контроль, химера с E. coli, дефицитными по тиамину и по НАД + . Дрожжи окрашены голубым (краситель FITC), бактерии — фиолетовым зондом, связывающимся с бактериальной РНК. Желтые стрелки указывают на примеры химерных клеток. Длина масштабного отрезка 10 мкм. Изображение из обсуждаемой статьи в PNAS
Перед нами — отработанная методика, с помощью которой можно моделировать ранние события эндосимбиоза. Клетки кишечной палочки, дефицитные по разным веществам, равно хорошо образуют химеры, которые воспроизводятся из поколения в поколение. Следующий шаг — поиск предельной редукции генома E. coli, возможной в данной ситуации. Авторы статьи отмечают, что удаление всего двух путей биосинтеза уже дало экономию в 7,7 тысяч пар нуклеотидов (для сравнения, весь митохондриальный геном человека составляет примерно 15 тысяч пар). Поэтому нам еще предстоит найти ту грань, на которой экономия размера генома столкнется с возможностью выживания клетки-симбионта.
Кроме того, как ехидно указывают авторы в конце текста, при таком раскладе не очень понятно, кто в этой истории настоящий паразит. Если бактерия, попавшая внутрь археи, лишь постепенно утрачивала свои метаболические пути, то возможно настоящим паразитом здесь стоит считать архею, которая потребляла энергию, производимую бактерией.
Быстрое размножение бактерий имеет свои плюсы и минусы. Использование микроорганизмов в биотехнологиях (дрожжи, молочнокислые, азотфиксирующие организмы, плесневые грибки и т. д.) направлено на улучшение качества жизни. Однако неконтролируемый рост болезнетворных (патогенных) микробов опасен для людей. Навредить здоровью может и собственная микрофлора человека. В медицине существует понятие синдрома избыточного бактериального роста, при котором количество условно-патогенных микробов в организме человека резко увеличивается, что представляет угрозу для здоровья.
С чего все начинается
Рост и размножение клетки – это два различных процесса. Под ростом понимают увеличение массы клетки вследствие формирования всех клеточных структур. Размножение – это увеличение количества клеток в колонии. Различают бинарное деление, почкование и генетическую рекомбинацию (процесс, напоминающий половое размножение).
Большинство прокариотических (безъядерных) клеток, к которым принадлежат все бактерии, размножается путем разделения надвое (бинарное деление). Таким способом размножаются, например, молочнокислые бактерии. Процесс начинается с удвоения бактериальной хромосомы (молекула ДНК, заменяющая ядро) и протекает в несколько этапов:
В результате получаются два идентичных организма.
Есть еще вариант, напоминающий половое размножение, – генетическая рекомбинация. В этом случает происходит обмен генетической информацией и в результате получается клетка, содержащая гены своих родителей. Существуют три способа передачи генетической информации:
- конъюгация – прямая передача (не обмен) части ДНК при контакте от одной бактерии к другой (процесс идет только в одном направлении);
- трансдукция – перенос фрагмента ДНК с помощью бактериофага (вируса бактерий);
- трансформация – поглощение генетической информации отмерших или уничтоженных клеток из окружающей среды.
Таким образом, только в результате бинарного деления и почкования получаются идентичные друг другу клетки. При генетической рекомбинации клетка претерпевает изменения, вырабатывая новые свойства и получая другие функции.
Скорость и фазы роста микроорганизмов
В питательных средах рост и размножение бактерий проходят в несколько стадий, различных по количеству доступной пищи и накоплению отходов жизнедеятельности:
Скорость кинетического роста бактериальной колонии во многом зависит от вида бактерий, состава питательных сред, количества посеянных (внесенных в среду) клеток, возраста культуры, способа дыхания и еще ряда факторов. Например, для размножения молочнокислых бактерий важно поддержание температур в довольно узком диапазоне (25-30⁰С) и определенный уровень кислотности среды (рН). Для размножения аэробных и анаэробных клеток решающим фактором становится наличие или отсутствие кислорода для дыхания, а спорообразующим клеткам необходимо достаточное количество пищи.
Условия выращивания микробов в искусственных средах
Для изучения (медицина, микробиология) и использования (промышленность) выращивают бактериальные культуры на искусственных питательных средах, которые разделяются по консистенции, происхождению и назначению:
- жидкие, полужидкие и плотные (твердые) искусственные среды;
- среды животного, растительного происхождения или синтетические (химически чистые соединения в строго определенной концентрации);
- обычные (универсальные), дифференциальные (различаются по видам бактерий), специальные, избирательные или среды обогащения (подавляющие рост нежелательных микробов).
Существуют бактерии, которым требуются особые условия. Например, анаэробные микроорганизмы (как спорообразующие, так и не спорообразующие) культивируют в анаэробных условиях (без кислорода). Для аэробных клеток решающим фактором размножения становится кислород. Факультативные анаэробы способны менять способ дыхания в зависимости от условий. Спорообразующие аэробные организмы, используемые для получения пробиотиков, очень чувствительны к уменьшению питания и его качеству. Спорообразующие анаэробы требуют полного отсутствия кислорода. Основной принцип культивирования микроорганизмов – создание благоприятных условий (питание, дыхание, температура), что иногда представляет определенные трудности.
Так, для выращивания анаэробов применяют метод глубокого посева, т. е. культуру бактерий вносят в глубину плотной питательной среды, добавляют в атмосферу роста химические вещества, поглощающие кислород, или откачивают воздух, замещая его инертным газом. В случае со спорообразующими бактериями используют внесение в питательную среду ингибитора белкового синтеза, тем самым останавливая процесс спорообразования.
Культивирование микроорганизмов
Под культивированием понимают искусственное выращивание клеток в контролируемых условиях. Конечная цель – получение биопрепарата из бактерий или с помощью бактерий. Такие препараты могут быть лечебными, диагностическими, профилактическими. Существует несколько методов культивирования:
- Стационарный способ характеризуется постоянством среды, какое-либо вмешательство в процесс отсутствует. Однако при таком методе культивирования в жидких питательных средах анаэробные организмы дают незначительный выход.
- Метод глубинного культивирования используют в промышленности для выращивания бактериальной биомассы. Для этой цели применяют специальные емкости. Факторами роста являются поддержание температуры и подача в жидкие среды питательных веществ. Кроме того, при необходимости проводят перемешивание или подачу кислорода (для дыхания аэробных бактерий).
- Метод проточных сред (промышленное культивирование) основан на постоянном поддержании культуры в экспонентной фазе роста. Это достигается непрерывным внесением питательных веществ и выведением токсичных отходов жизнедеятельности клеток. Такая технология позволяет достичь максимального выхода различных биологически активных веществ (антибиотические препараты, витамины и т. д.).
Одним из важнейших промышленных препаратов является культура молочнокислых бактерий, которые используются для приготовления молочной закваски, квашения капусты, силосования кормов, производства заменителя плазмы крови. Для получения гарантированного конечного результата нужно строго контролировать получаемое качество молочнокислых бактерий.
Синдром избыточного бактериального роста
На разных участках желудочно-кишечного тракта обитают различные бактерии. В тонком кишечнике по мере продвижения постепенно меняется состав микрофлоры и количество микроорганизмов. Аэробные (растущие в кислородной среде) виды бактерий постепенно уступают место анаэробным (бескислородная среда). При клиническом синдроме избыточного роста бактериальный спектр смещается в сторону грамотрицательных (большинство патогенных), факультативно-аэробных и анаэробных организмов.
По мере приближения к толстой кишке увеличивается количество анаэробных бактерий (бифидобактерии и бактероиды). Основные представители анаэробной микрофлоры – бифидобактерии – отвечают за синтез белков, витаминов группы В, различных кислот и других необходимых для жизни веществ. Аэробные микроорганизмы (кишечная палочка) вырабатывают целый ряд витаминов и кислот, участвующих в пищеварении и поддерживающих иммунитет.
Молочнокислые бактерии – еще один представитель кишечной микрофлоры. Они относятся к микроаэрофильным организмам, т. е. одним из факторов роста и размножения молочнокислых бактерий является кислород, но в очень небольших количествах. Эти микроорганизмы отвечают за регулирование кислотности желудочно-кишечного тракта, благодаря чему тормозится рост гнилостных бактерий.
Каждый вид бактерий выполняет свою, четко обозначенную функцию. При синдроме избыточного роста фекальная микрофлора, в нормальных условиях обитающая в толстом кишечнике (кишечная палочка или анаэробные клетки), попадает в тонкую кишку. Меняется количественный и качественный состав бактериальной микрофлоры, выполнение некоторых функций замедляется или становится невозможным. Появляются условия для роста и размножения патогенных бактерий.
Клинические критерии заболевания
Критерием развития синдрома избыточного бактериального роста могут служить:
- нарушение пищеварения, снижение иммунитета, изменение кислотности желудка;
- нарушение целостности кишечного тракта;
- последствия оперативного вмешательства;
- заболевания желудочно-кишечного тракта;
- стрессы;
- неконтролируемый прием антибиотических препаратов.
Клинические проявления синдрома избыточного роста бактерий легко спутать с другими заболеваниями, зачастую они наслаиваются друг на друга, полностью искажая картину. Поставить диагноз в таких случаях можно только с помощью специальных тестов, направленных на выявление синдрома избыточного роста, определяющих не только количество, но и видовую принадлежность бактерий. Такой подход позволит подобрать необходимые медикаментозные препараты для коррекции состава микрофлоры.
Клинические симптомы заболевания:
- на ранней стадии болезни появляется диарея и метеоризм;
- вздутие живота и спазматические боли;
- утомляемость, слабость;
- быстрое похудение.
Для лечения синдрома избыточного роста применяют антибактериальные препараты. В дальнейшем для восстановления микрофлоры понадобятся пробиотические и пребиотические препараты.
Большое разнообразие бактериальных клеток (автотрофы и гетеротрофы, аэробные и анаэробные, спорообразующие и неспорообразующие и т. д.) диктует определенные условия для их размножения. Основной принцип культивирования в промышленных масштабах – строгий контроль условий среды и скорости роста. В природе редко существуют идеальные среды для развития микроорганизмов. В противном случае бактерии давно заполонили бы все доступное пространство.
Образование высшее филологическое. В копирайтинге с 2012 г., также занимаюсь редактированием/размещением статей. Увлечения — психология и кулинария.
03 февраля 2020
- 856
- 0,0
- 0
- 2
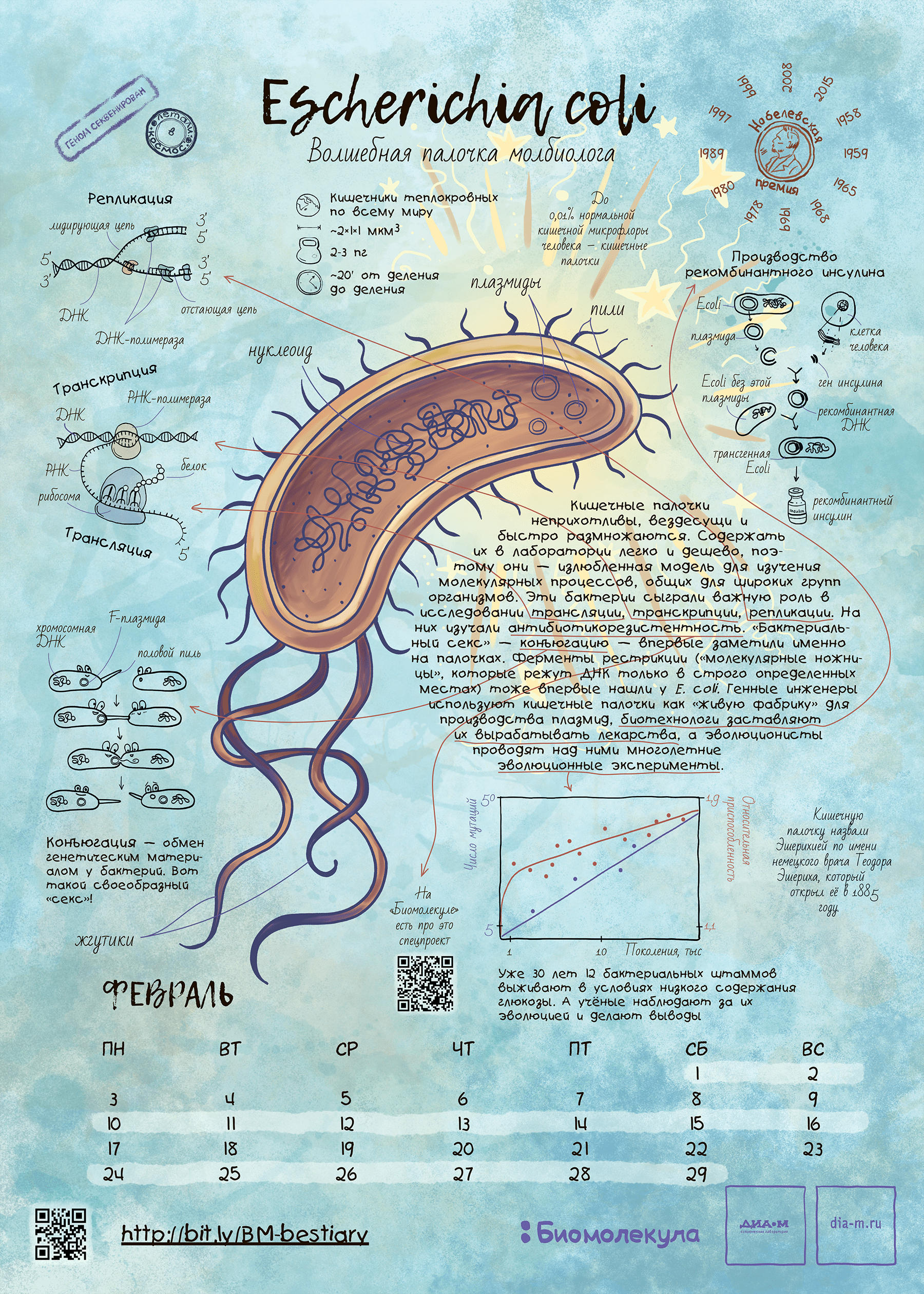
Герой февраля: кишечная палочка Escherichia coli
Скромная бактерия за полстолетия с момента ее открытия в конце XIX в. стала настоящей волшебной палочкой для молекулярной биологии. Сейчас результаты опытов с ее использованием занимают главы и тома профессиональных и популярных изданий. Конечно, в нашем путеводителе по модельным организмам E. coli должна была занять свое почетное место.

Двенадцать модельных организмов
Escherichia и Eschrichtius — Болезнь путешественников — Главная модельная бактерия — Учебник молекулярной генетики — Невезение с CRISPR/Cas
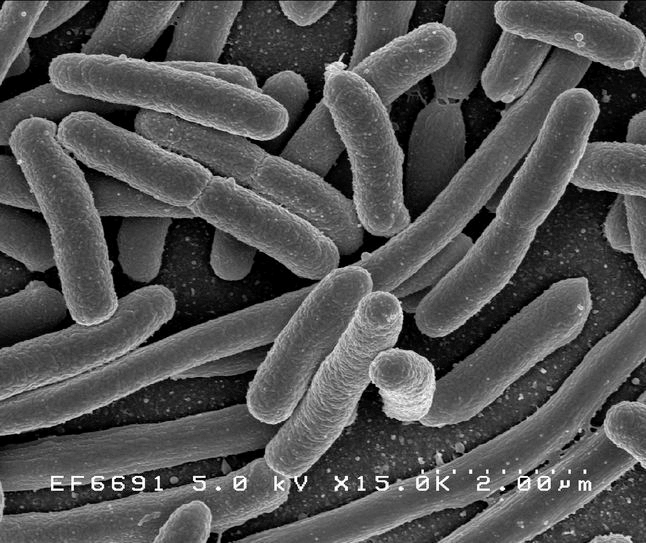
Рисунок 1а. Escherichia длиной 2 мкм

Рисунок 1б. Теодор Эшерих (1857–1911)

Рисунок 1в. Eschrichtius длиной 14 метров

Рисунок 1г. Даниэль Фредрик Эшрихт (1798–1863)
Клетки с относительно тонкой клеточной стенкой, не окрашивающиеся красителем генцианом фиолетовым (окраской бактерий по методу датского микробиолога Кристиана Грама).
Зачем же такую опасную бактерию сделали модельной? Дело в том, что в условиях культивирования кишечная палочка часто теряет патогенность, становится неспособной жить в естественных для себя условиях (то есть одомашнивается). И этим свойством в 1940-е годы воспользовались микробиологи, проведя с лабораторными штаммами E. coli (например, со знаменитым штаммом К12) много прорывных для науки экспериментов.
Так, манипулируя мутированными штаммами кишечной палочки, которые уже научились получать при помощи облучения, Джошуа Ледерберг и Эдуард Лаури Тейтем в 1947 году обнаружили способность разных штаммов обмениваться генетическим материалом и спасать друг друга от образовавшихся дефектов, проявлявшихся в неспособности расти на минимальной питательной среде. Так был открыт процесс конъюгации бактерий, который затем послужил важным инструментом для картирования бактериального генома . Ведь тогда это можно было делать только косвенными, микробиологическими методами — сама природа генетического кода была неизвестна.
Кстати, Джошуа Ледерберг был некоторое время мужем Эстер Ледерберг, первооткрывательницы бактериофага лямбда [3].
С начала 1950-х годов исследования по молекулярной генетике с использованием кишечной палочки и ее вирусов в качестве основного инструмента росли как снежный ком. Не будет преувеличением сказать, что к 70-м годам E. coli написала учебник молекулярной генетики! Вспомним открытие генетического кода, в котором участвовало несколько коллективов физиков и молекулярных биологов, в том числе Френсис Крик, Георгий Гамов и другие выдающиеся люди того времени [6]. Основные эксперименты по расшифровке кода велись на бесклеточных лизатах кишечной палочки.
Позднее обнаружилось, что E. coli хорошо подходит для зародившейся в 1960–1970-е годы биотехнологии [7]. Бактерия хорошо переносит введение в свою клетку гетерологичных (то есть чужеродных) генов и во многих случаях способна синтезировать их продукты без вреда для себя. Белки, полученные таким способом, стали называть рекомбинантными, и теперь они широко используются в медицине и других практических задачах.
Кишечная палочка — возможно, самый исследованный организм с точки зрения молекулярной биологии. Тем не менее у элементов ее генома до сих пор обнаруживают новые свойства. Это одновременно плохо (как же мало мы знаем!) и хорошо (будет чем заняться!). Совсем недавно на защите диссертации я услышал о том, как у одной из генных кассет эшерихии, участвующей в каскаде переработки сульфолипидов, также обнаружена и лактазная активность [8]. До этого такая активность была известна только у знаменитого лактозного оперона Жакоба и Моно, описанного в 1961 году!
Кажется, что E. coli — модельный организм без недостатков. Тем не менее биотехнологам не повезло, что у этой бактерии от природы нет системы бактериального иммунитета CRISPR/Cas [9], о которой я уже упоминал в эссе о бактериофаге лямбда [3]. Именно поэтому эту систему, ныне незаменимую в генной инженерии, открыли относительно поздно.
Кишечная палочка-выручалочка — это здорово (рис. 2). Но теперь пора переместиться в мир ядерных организмов. Удобным инструментом для молекулярной биологии и генетики эукариот оказались одноклеточные грибы — дрожжи — и гаплоидный плесневый гриб — нейроспора. Как они дошли до такой одноклеточной и гаплоидной жизни и что было открыто с их помощью — читайте в следующем материале нашего путеводителя по модельным организмам через месяц.
Благодарность
Размножение бактерий путем деления — самый распространенный метод увеличения численности микробной популяции. После деления происходит рост бактерий до исходного размера, для чего необходимы определенные вещества (факторы роста).
Способы размножения бактерий различны, но для большинства их видов присуща форма бесполового размножения способом деления. Способом почкования бактерии размножаются исключительно редко. Половое размножение бактерий присутствует в примитивной форме.
Рис. 1. На фото бактериальная клетка в стадии деления.
Генетический аппарат бактерий
Генетический аппарат бактерий представлен единственной ДНК — хромосомой. ДНК замкнута в кольцо. Хромосома локализована в нуклеотиде, не имеющем мембраны. В бактериальной клетке имеются плазмиды.
Нуклеоид является аналогом ядра. Он расположен в центре клетки. В нем локализована ДНК — носитель наследственной информации в свернутом виде. Раскрученная ДНК достигает в длину 1 мм. Ядерное вещество бактериальной клетки не имеет мембраны, ядрышка и набора хромосом, не делится митозом. Перед делением нуклеотид удваивается. Во время деления число нуклеотидов увеличивается до 4-х.
Рис. 2. На фото бактериальная клетка на срезе. В центральной части виден нуклеотид.
Плазмиды представляют собой автономные молекулы свернутые в кольцо двунитевой ДНК. Их масса значительно меньше массы нуклеотида. Несмотря на то, что в ДНК плазмид закодирована наследственная информация, они не являются жизненно важными и необходимыми для бактериальной клетки.
Рис. 3. На фото бактериальная плазмида.
Этапы деления
После достижения определенных размеров, присущих взрослой клетке, запускаются механизмы деления.
Репликация ДНК предшествует клеточному делению. Мезосомы (складки цитоплазматической мембраны) удерживают ДНК до тех пор, пока процесс деления (репликации) не завершится.
Репликация ДНК осуществляется с помощью ферментов ДНК-полимеразами. При репликации водородные связи в 2-х спиральной ДНК разрываются, в результате чего из одной ДНК образуются две дочерние односпиральные. В последующем, когда дочерние ДНК заняли свое место в разделенных дочерних клетках, происходит их восстановление.
Как только репликация ДНК завершилась, в результате синтеза клеточной стенки появляется перетяжка, разделяющая клетку пополам. Вначале делению подвергается нуклеотид, затем цитоплазма. Синтез клеточной стенки завершает деление.
Рис. 4. Схема деления бактериальной клетки.
У сенной палочки процесс репликации ДНК завершается обменом участками 2-х ДНК.
После деления клетки образуется перемычка, по которой ДНК одной клетки переходит в другую. Далее обе ДНК сплетаются. Некоторые отрезки обоих ДНК слипаются. В местах слипания происходит обмен отрезками ДНК. Одна из ДНК по перемычке уходит обратно в первую клетку.
Рис. 5. Вариант обмена ДНК у сенной палочки.
Типы делений бактериальных клеток
Если клеточное деление опережает процесс разделения, то образуются многоклеточные палочки и кокки.
При синхронном клеточном делении образуются две полноценные дочерние клетки.
Если нуклеотид делится быстрее самой клетки, то образуются многонуклеотидные бактерии.
Способы разделения бактерий
Деление с помощью разламывания характерно для сибиреязвенных бацилл. В результате такого деления клетки переламываются в местах сочленения, разрывая цитоплазматические мостики. Далее отталкиваются друг от друга, образуя цепочки.
При скользящем разделении после деления клетка обосабливается и как бы скользит по поверхности другой клетки. Данный способ разделения характерен для некоторых форм эшерихий.
При секущемся разделении одна из разделившихся клеток свободным концом описывает дугу круга, центром которого является точка ее контакта с другой клеткой, образуя римскую пятерку или клинопись (коринебактерии дифтерии, листерии).
Рис. 6. На фото бактерии палочковидной формы, образующие цепочки (сибиреязвенные палочки).
Рис. 7. На фото скользящий способ разделения кишечных палочек.
Рис. 8. Секущийся способ разделения коринебактерий.
Вид скоплений бактерий после деления
Скопления делящихся клеток имеют разнообразную форму, которая зависит от направления плоскости деления.
Шаровидные бактерии располагаются по одному, по двое (диплококки), пакетами, цепочками или как гроздья винограда. Палочковидные бактерии — цепочками.
Спиралевидные бактерии — хаотично.
Рис. 9. На фото микрококки. Они круглые, гладкие, имеют белую, желтую и красную окраску. В природе микрококки распространены повсеместно. Живут в разных полостях человеческого организма.
Рис. 10. На фото бактерии диплококки — Streptococcus pneumoniae.
Рис. 11. На фото бактерии сарцины. Кокковидные бактерии соединяются в пакеты.
Рис. 14. На фото извитые бактерии лептоспиры — возбудители многих заболеваний.
Рис. 15. На фото палочковидные бактерии рода Vibrio.
Скорость деления бактерий
Скорость деления бактерий крайне высока. В среднем одна бактериальная клетка делится каждые 20 минут. В течение только одних суток одна клетка образует 72 поколения потомства. Микобактерии туберкулеза делятся медленно. Весь процесс деления занимает у них около 14 часов.
Рис. 16. На фото отображен процесс деления клетки стрептококка.
Половое размножение бактерий
В 1946 году учеными было обнаружено половое размножение в примитивной форме. При этом гаметы (мужские и женские половые клетки) не образуются, однако некоторые клетки обмениваются генетическим материалом (генетическая рекомбинация).
Передача генов осуществляется в результате конъюгации — однонаправленного переноса части генетической информации в виде плазмид при контакте бактериальных клеток.
Плазмиды представляют собой молекулы ДНК небольшого размера. Они не связаны с геномом хромосом и способны удваиваться автономно. В плазмидах содержаться гены, которые повышают устойчивость бактериальных клеток к неблагоприятным условиям внешней среды. Бактерии часто передают эти гены друг другу. Отмечается так же передача генной информации бактериям другого вида.
При отсутствии истинного полового процесса именно конъюгация играет огромную роль при обмене полезными признаками. Так передается способность бактерий проявлять лекарственную устойчивость. Для человечества особо опасным является передача устойчивости к антибиотикам между болезнетворными популяциями.
Рис. 17. На фото момент конъюгации двух кишечных палочек.
Фазы развития бактериальной популяции
При посевах на питательную среду развитие бактериальной популяции проходит несколько фаз.
Исходная фаза — это период от момента посева до их роста. В среднем исходная фаза длится 1 — 2 часа.
Это фаза интенсивного роста бактерий. Ее длительность составляет около 2-х часов. Она зависит от возраста культуры, периода приспособления, качества питательной среды и др.
В эту фазу отмечается пик скорости размножения и увеличения бактериальной популяции. Ее длительность составляет 5 — 6 часов.
В эту фазу отмечается спад скорости размножения, уменьшается количество делящихся и увеличивается число погибших бактерий. Причина отрицательного ускорения — истощение питательной среды. Ее длительность составляет около 2-х часов.
В стационарную фазу отмечается равное количество погибших и вновь образованных особей. Ее длительность составляет около 2-х часов.
В эту фазу прогрессивно нарастает количество погибших клеток. Ее длительность составляет около 3-х часов.
В эту фазу клетки бактерий отмирают с постоянной скоростью. Ее длительность составляет около 5-и часов.
В эту фазу оставшиеся живыми клетки бактерий переходят в состояние покоя.
Рис. 18. На рисунке отображена кривая роста бактериальной популяции.
Рис. 19. На фото колонии синегнойной палочки сине-зеленого цвета, колонии микрококков желтого цвета, колонии Bacterium prodigiosum кроваво-красного цвета и колонии Bacteroides niger черного цвета.
Рис. 20. На фото колонии бактерий. Каждая колония — потомство одной-единственной клетки. В колонии число клеток исчисляется миллионами. вырастает колония за 1 — 3 суток.
Деление магниточувствительных бактерий
Рис. 21. На фото момент деления магниточувствительной бактерии.
Рост бактерий
Вначале деления бактериальной клетки две молекулы ДНК расходятся в разные концы клетки. Далее клетка делится на две равноценные части, которые отделяются друг от друга и увеличиваются до исходного размера. Скорость деления многих бактерий составляет в среднем 20 — 30 минут. В течение только одних суток одна клетка образует 72 поколения потомства.
Масса клеток в процессе роста и развития быстро поглощает питательные вещества из окружающей среды. Этому способствуют благоприятные факторы внешней среды — температурный режим, достаточное количество питательных веществ, необходимая pH среды. Для клеток аэробов необходим кислород. Для анаэробов он представляет опасность. Однако безграничное размножение бактерий в природе не происходит. Солнечный свет, сухой воздух, недостаток пищи, высокая температура окружающей среды и другие факторы губительно действуют на бактериальную клетку.
Рис. 22. На фото момент деления клетки.
Факторы роста
Для роста бактерий необходимы определенные вещества (факторы роста), часть из которых синтезируется самой клеткой, часть поступает из окружающей среды. Потребность в факторах роста у всех бактерий разная.
Потребность в факторах роста является постоянным признаком, что позволяет использовать его для идентификации бактерий, подготовке питательных сред и использовать в биотехнологии.
Факторы роста бактерий (бактериальные витамины) — химические элементы, большинством из которых являются водорастворимые витамины группы В. В эту группу входят так же гемин, холин, пуриновые и пиримидиновые основания и другие аминокислоты. При отсутствии факторов роста наступает бактериостаз.
Бактерии используют факторы роста в минимальных количествах и в неизменном виде. Ряд химических веществ этой группы входят в состав клеточных ферментов.
Рис. 23. На фото момент деления палочковидной бактерии.
Бактерии сапрофиты питаются органическими веществами погибших организмов. Они потребляют минимум питательных веществ. Бактерии паразиты нуждаются в повышенном количестве аминокислот и других факторов роста.
Ауксотрофы для обеспечения жизнедеятельности нуждаются в поступлении химических веществ из вне. Например, клостридии не способны синтезировать лецитин и тирозин. Стафилококки нуждаются в поступлении лецитина и аргинина. Стрептококки нуждаются в поступлении жирных кислот — компонентов фосфолипидов. Коринебактерии и шигеллы нуждаются в поступлении никотиновой кислоты. Золотистые стафилококки, пневмококки и бруцеллы нуждаются в поступлении витамина В1. Стрептококки и бациллы столбняка — в пантотеновой кислоте.
Прототрофы самостоятельно синтезируют необходимые вещества.
Изучение потребности бактерий в факторах роста позволяет ученым получать большую микробную массу, так необходимую при изготовлении антимикробных препаратов, сывороток и вакцин.
Подробно о бактерияx читай в статьях:
Размножение бактерий является механизмом повышения числа микробной популяции. Деление бактерий — основной способ размножения. После деления бактерии должны достигнуть размеров взрослых особей. Рост бактерий происходит путем быстрого поглощения питательных веществ их окружающей среды. Для роста необходимы определенные вещества (факторы роста), часть из которых синтезирует сама бактериальная клетка, часть поступает из окружающей среды.
Изучая рост и размножение бактерий, ученые постоянно открывают полезные свойства микроорганизмов, использование которых в повседневной жизни и на производстве ограничивается только их свойствами.
Читайте также:


