Эксперимент с кишечной палочкой
![]()
Что за сообщество такое, просветите :)
Ученые подвели первые итоги самого продолжительного в истории научного эксперимента
Группа учены из Великобритании (Шотландия), Германии и США подвела первые результаты самого долгосрочного научного эксперимента в истории. Цель эксперимента состоит в изучении жизнеспособности микробов в изоляции за 500-летний период. Окончательно итоги будут подведены аж в 2514 году, а сейчас микробиологи представили результаты первых пяти лет исследования – это около 1 процента от общей протяженности эксперимента, говорится в статье, опубликованной в журнале PLOS ONE.
Объектом исследования является сенная палочка (Bacillus subtilis), открытая в 1835 году и являющаяся одним из наиболее изученных представителей рода бацилл. По словам ученых, бактериальные споры представляют собой невероятно устойчивые формы жизни. В ответ на экстремальные условия они способны перестраивать свою ДНК, чтобы адаптироваться под них.
Самый продолжительный эксперимент в истории науки должен ответить сразу на несколько вопросов, которые в конечном итоге позволят лучше разобраться в том, как развивалась жизнь на нашей планете более 3,5 миллиарда лет назад и возможно ли существование жизни на других планетах с другими условиями окружающей среды.
В частности, ученых интересует как долго жизнеспособность сохраняется при отсутствии влаги и воздуха, как быстро бактерии возродятся, вернувшись к привычной среде, какова скорость гибели спор и когда это происходит?
При подготовке эксперимента высушенные бактерии сенной палочки поместили в сотни герметично запечатанных колб. Колбы поместили в два ящика – один находится в Эдинбургском университете, другой – в лондонском Музее естествознания. Еще несколько образцов подвергаются воздействию очень низких температур и радиации. В течение первых 24 лет с начала эксперимента каждые 2 года ученые будут открывать по несколько колб и проверять состояние бактерий. После этого проверка образцов будет проводиться 1 раз в 25 лет.
В первых подведенных результатах ученые отмечают, что полная изоляция пока никак не повлияла на состояние сенной палочки. Образцы оказались такими же жизнеспособными, как и на начало эксперимента. Часть образцов Bacillus subtilis, подвергавшихся воздействию низкой температуры (-80 градусов Цельсия) и радиации погибли, однако у выживших ученые не обнаружили изменений в ДНК – она не отличается от образцов бактерий, которые находятся в герметичных колбах.
Исследователи прекрасно понимают, что окончательные результаты эксперимента смогут подвести лишь потомки спустя множество поколений, поэтому все результаты первых лет наблюдений тщательно конспектируются как на цифровых носителях, так и на бумаге с учетом всех установленных правил, которые также будут копироваться каждые 25 лет и впоследствии передаваться будущим поколениям.
![]()
В ходе эволюционного эксперимента патогенный гриб превратился в полезного симбионта
Эволюционные эксперименты, проведенные сингапурскими биологами, показали, что потенциально патогенный гриб Candida albicans всего за несколько недель жизни в кишечнике мыши может превратиться в полезного симбионта, защищающего хозяина от грибных и бактериальных инфекций посредством активации систем врожденного иммунитета. Эта эволюционная трансформация происходит при условии, что бактерии в мышином кишечнике были предварительно уничтожены антибиотиками. В отсутствие конкуренции со стороны бактерий отбор поддерживает мутации, лишающие гриб способности образовывать гифы и попутно придающие ему свойства, потенциально полезные для хозяина. При наличии в кишечнике нормальной бактериальной микрофлоры те же самые мутации делают гриб неконкурентоспособным. Поэтому если не кормить мышь антибиотиками, то гриб, в зависимости от возраста мыши, либо вообще не выживает в ее кишечнике, либо выживает, но не эволюционирует в полезного симбионта.
Взаимоотношения между животными и обитающими в их кишечнике микроорганизмами варьируют от антагонистических до мутуалистических (взаимовыгодных). Понимание причин, от которых зависит, будут ли наши микробы враждовать с нами или дружить, важно для развития медицины. Однако о факторах, которые направляют эволюцию кишечных микробов в сторону взаимовыгодного сотрудничества с хозяином, до сих пор известно немного.
Гриб Candida albicans часто встречается у людей в пищеварительном тракте и половых путях. Обычно он ведет себя как мирный комменсал, но иногда вызывает серьезные заболевания (см. Candidiasis). Изучение взаимоотношений C. albicans c хозяином затрудняется тем, что привычные лабораторные животные, такие как мыши, не являются естественными хозяевами этого гриба. В кишечнике взрослой мыши C. albicans не выживает, по-видимому, не выдерживая конкуренции с обычными кишечными микробами. Однако ученые всё-таки нашли два способа поселить C. albicans в мышином кишечнике. Во-первых, можно накормить мышь антибиотиками, чтобы убить бактериальную микрофлору. После этого C. albicans успешно колонизирует пищеварительный тракт мыши. Во-вторых, можно заразить грибом юного мышонка, у которого нормальная микрофлора еще не сформировалась. В этом случае можно обойтись без антибиотиков. Кроме того, можно ввести клетки C. albicans в кровь, но это плохо заканчивается для мыши: гриб разрастается в почках и других органах, и животное погибает.
Микробиологи и иммунологи из Сингапура решили выяснить, как гриб C. albicans адаптируется к новой для него среде обитания — кишечнику мышей, лишенных бактериальной микрофлоры.
Для начала мышам, регулярно получающим антибиотики, скормили по порции C. albicans. Заражение прошло успешно: гриб прижился в кишечнике подопытных животных. После этого каждую неделю гриб пересаживали в следующего хозяина — другую мышь, сидящую на антибиотиках, — скармливая ему фекалии предыдущего.
За ростом приспособленности гриба к новым условиям следили, оценивая скорость его размножения в кишечнике безбактериальных мышей по сравнению с исходным штаммом. Уже через 10 недель (то есть после 10 пересаживаний из одной мыши в другую) приспособленность подопытных штаммов C. albicans увеличилась на 10–15%. Таким образом, грибы успешно адаптировались к новой среде. Теперь нужно было выяснить, как им это удалось и почему.
Сначала ученые проверили, играет ли какую-то роль в адаптации гриба к мышиному кишечнику взаимодействие с системой адаптивного (приобретенного) иммунитета хозяина. Для этого эксперимент повторили на мышах, которые не только сидели на антибиотиках, но еще и были лишены способности вырабатывать приобретенный иммунитет. У этих мышей не работает ген Rag1, необходимый для формирования функциональных B- и T-лимфоцитов. Результат воспроизвелся: приспособленность гриба за 10 недель выросла примерно так же, как и в случае с обычными безбактериальными мышами. Это значит, что для успешной адаптации гриба к жизни в мышином кишечнике не требуется взаимодействие с адаптивным иммунитетом хозяина.
Помешают ли бактерии, в норме обитающие в мышином кишечнике, успешной адаптации гриба? Заразить грибом взрослых мышей с нормальной кишечной микрофлорой (не принимающих антибиотики) авторам не удалось, как это никому не удавалось и раньше. По-видимому, сложившаяся бактериальная микрофлора не позволяет грибу размножаться в мышином кишечнике. Тогда исследователи перешли к экспериментам с двухнедельными мышатами, в чьем кишечнике C. albicans приживается даже без антибиотиков.
Оказалось, что если мышатам, зараженным грибом, не давать антибиотиков, то гриб в их кишечнике хотя и выживает, но не может так же хорошо адаптироваться к новой среде, как в случае с антибиотиками. После 5–10 недель жизни в мышатах, которых кормили антибиотиками, приспособленность C. albicans к новым условиям выросла почти так же сильно, как и после 10 недель жизни во взрослых безбактериальных мышах. Однако после тех же 5–10 недель жизни в мышатах, не получавших антибиотики, приспособленность гриба осталась на исходном уровне.
Эти и другие эксперименты показали, что в присутствии нормальных мышиных кишечных бактерий грибу не удается приобрести какие-то свойства, которые повышают его конкурентоспособность в кишечнике безмикробных мышей.
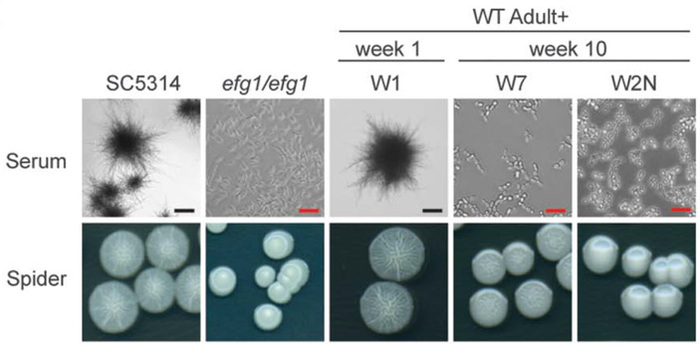
Что же это за свойства? Оказалось, что все штаммы C. albicans, чья приспособленность к жизни в мышином кишечнике увеличилась в ходе проведенных экспериментов (и во взрослых безбактериальных мышах, и в мышатах, и в мышах без адаптивного иммунитета) утратили способность к формированию многоклеточных нитей — гиф. Эти штаммы могут существовать только в дрожжевой форме, то есть как отдельные клетки (рис. 1). По-видимому, умение образовывать гифы помогает грибу выживать в присутствии кишечных бактерий, но замедляет размножение в кишечнике безмикробной мыши.
Чтобы понять генетические основы произошедших изменений, авторы отсеквенировали геномы 28 штаммов C. albicans, успешно адаптировавшихся к жизни в кишечнике безмикробных мышей, и сравнили их с геномом исходного штамма.
Оказалось, что у всех адаптированных штаммов закрепились значимые (несинонимичные, меняющие кодируемый белок) мутации хотя бы в одном из 34 белок-кодирующих генов, функции которых связаны с гифообразованием, построением клеточной стенки и регуляцией транскрипции (рис. 2).

Рис. 2. Мутации, закрепившиеся у 28 штаммов C. albicans, адаптировавшихся к жизни в мышином кишечнике. По горизонтальной оси — штаммы гриба, по вертикальной — 34 гена, в которых хотя бы у одного штамма закрепилась несинонимичная мутация. Красным цветом показаны мутации, находящиеся в отсеквенированных геномах в гомозиготном состоянии, синим — в гетерозиготном. Видно, что чаще всего отбор поддерживал мутации гена FLO8, который кодирует регулятор транскрипции (Transcription factor), влияющий на формирование гиф (Filamentation). Изображение из обсуждаемой статьи в Science
Чаще всего (у 22 штаммов из 28) закреплялись мутации, выводящие из строя ген FLO8. Этот ген кодирует транскрипционный фактор, регулирующий гифообразование. Все закрепившиеся в нем мутации делают кодируемый белок нефункциональным (посредством появления преждевременного стоп-кодона или сдвига рамки считывания). Дополнительные эксперименты подтвердили, что грибы с инактивированным геном FLO8, во-первых, не образуют гиф, во-вторых, обладают повышенной конкурентоспособностью в кишечнике безбактериальных мышей.
Таким образом, ход адаптации C. albicans к жизни в кишечнике безбактериальных мышей оказался предсказуемым и воспроизводимым: всегда утрачивается способность к гифообразованию, причем чаще всего это происходит за счет мутаций, выводящих из строя ген FLO8.
Ранее было показано, что и гифообразование, и FLO8 влияют на вирулентность C. albicans, определяя способность гриба вызывать системную инфекцию при попадании в кровь (F. Cao et al., 2006. The Flo8 Transcription Factor Is Essential for Hyphal Development and Virulence in Candida albicans). Поэтому авторы предположили, что штаммы, приспособившиеся к жизни в мышином кишечнике, могли при этом стать менее вредоносными.
Эксперименты по совместному культивированию C. albicans с клетками млекопитающих (мышиными макрофагами и человеческими клетками эпителия толстой кишки) подтвердили, что штаммы C. albicans, приспособившиеся к жизни в кишечнике безбактериальных мышей, не так сильно повреждают клетки, как исходный штамм. Введение исходного штамма в кровь приводит к разрастанию грибных гиф в почках уже через двое суток, а через 3–4 дня все мыши погибают. Инъекцию такого же количества клеток C. albicans, адаптированных к безбактериальному мышиному кишечнику, мыши благополучно переживают. При этом гриб обнаруживается в тканях только в дрожжевой форме. Штаммы, эволюционировавшие в кишечнике мышат, не получавших антибиотики, не только не разучились образовывать гифы, но и в полной мере сохранили свою смертоносность при попадании в кровь.
Таким образом, в ходе адаптации к жизни в кишечнике безбактериальных мышей гриб C. albicans действительно стал менее опасным для хозяина.
Авторы допускают, что на основе выведенных ими штаммов удастся в будущем разработать вакцины нового типа, которые будут защищать даже людей с нарушенной системой адаптивного иммунитета (больных СПИДом, людей после трансплантации и др.)
Возможно, новые открытия в этой области позволят нам в будущем эффективно управлять эволюцией наших микроскопических сожителей, превращая врагов в друзей и не позволяя мирным комменсалам становиться опасными патогенами.
Рис. 1. Ход молекулярной эволюции в 12 популяциях кишечной палочки. Показаны изменения частоты встречаемости всех зарегистрированных новых мутаций. По горизонтальной оси — время в поколениях. Рисунок из обсуждаемой статьи в Nature
Но главное открытие, сделанное авторами, состоит не в этом. Эволюционная динамика, отображенная на рис. 1, не вписывается в простейшую модель, согласно которой адаптивная эволюция монокультуры бесполых организмов в стабильных условиях сводится к последовательной фиксации отбором вновь возникающих полезных мутаций.
Статистическая обработка данных, приведенных на рис. 1, показала, что эта простейшая модель не может объяснить наблюдаемую картину даже с учетом таких осложняющих обстоятельств, как генетический автостоп и клональная интерференция (конкуренция между клонами бактерий с разными полезными мутациями; см.: Clonal interference). Например, многие мутации, достигнув некоторой частоты, вдруг перестают распространяться, то есть двигаться дальше в сторону фиксации (таков естественный ход событий, если клон с данной мутацией имеет более высокую приспособленность, чем другие бактерии в популяции). Но эти клоны и не вымирают, проиграв конкуренцию клонам с более удачными мутациями. Вместо этого частота мутации начинает колебаться вокруг какого-то уровня. Эти колебания могут продолжаться десятки тысяч поколений, причем уровень, вокруг которого происходят колебания, может со временем меняться.
Метагеномные данные, полученные для каждой из 1440 проб, представляют собой множество отсеквенированных кусочков ДНК, принадлежащих разным индивидам. Поэтому нельзя сразу понять, какие мутации относятся к одному и тому же клону, а какие — к разным. Однако авторам удалось разобраться в этом, проанализировав согласованность изменения частот мутаций во времени (поскольку частоты мутаций, находящихся в одном и том же геноме, меняются синхронно). В итоге выяснилось, что по крайней мере в девяти из двенадцати подопытных популяций в течение длительного времени (свыше 10 000 поколений) имело место устойчивое сосуществование как минимум двух клад (эволюционных линий). Внутри этих клад шли свои собственные эволюционные процессы, то есть появлялись и фиксировались различные мутации (рис. 3).
Это значит, что в большинстве подопытных популяций произошла экологическая диверсификация. Разные клады как-то поделили между собой экологические ниши и стали устойчиво сосуществовать, приспосабливаясь теперь уже не к изначально заданным стабильным условиям среды, а к специфическому и переменчивому биотическому окружению.
Данное явление ранее было обнаружено в одной из двенадцати популяций (Ara-2). Две клады, сосуществующие в этой популяции, имеют разный обмен веществ и используют к своей выгоде продукты жизнедеятельности другой клады. Устойчивое сосуществование обеспечивается частотно-зависимым балансирующим отбором. Это значит, что относительная приспособленность клады тем выше, чем ниже ее численность (J. Plucain et al., 2014. Epistasis and allele specificity in the emergence of a stable polymorphism in Escherichia coli). Новые данные показали, что аналогичная ситуация сложилась как минимум в девяти из двенадцати популяций. Таким образом, экологическая диверсификация — не случайный эпизод, а общая закономерность.
Статистический анализ распределения мутаций во времени показал, что в одних генах мутации преимущественно фиксировались в начале эксперимента (на ранних этапах адаптации), тогда как в других генах мутации начали фиксироваться лишь на поздних этапах. Это объясняется тремя причинами, причем все три, по мнению авторов, реально работают в ходе эксперимента (строго доказать это пока нельзя, но есть косвенные статистические аргументы в пользу реальности всех трех причин).
Таким образом, долгосрочный эволюционный эксперимент опроверг чрезмерно упрощенные представления о том, как должна идти адаптация бесполой популяции к стабильным условиям среды. Ничего похожего на замедление и остановку адаптивной эволюции по мере приближения к оптимуму (пику на ландшафте приспособленности) не наблюдается, запас потенциально полезных мутаций не исчерпывается, и даже темп их накопления практически не снижается. Вместо этого мы видим самопроизвольное усложнение эволюционирующего сообщества, которое из монокультуры превращается в экосистему с подразделенными нишами и коэволюционирующими кладами и явно не собирается в обозримом будущем переходить в состояние эволюционного стазиса. Так что Лесли Оргел был, конечно, прав насчет того, кто умнее — эволюция или теоретики, считающие, что всё про нее знают.
Как самый долгий биологический эксперимент породил новое существо

Долговременный эксперимент по эволюции E.coli — попытка ученых в экспериментальных условиях наблюдать эволюционные процессы. Может возникнуть вопрос, почему для этих нужд ученые использовали именно кишечную палочку, а не собаку или лошадь? Одна из причин в том, что E.coli очень быстро размножается. Другая особенность, делающая бактерию удобной для исследований, — небольшой размер генома, который позволяет достаточно быстро определить, какие мутации возникают в генах со сменой поколений. Кроме того, E.coli можно без вреда для нее заморозить на длительное время.
Материалы по теме


Долговременный эксперимент по эволюции E.coli оказался удобной платформой для того, чтобы решить данную проблему. Ученые под руководством Ричарда Ленски проанализировали полные геномы 264 клонов из 12 популяций, в которых, в конечном итоге, сменилось 50 тысяч поколений. Предварительные результаты продемонстрировали, что приспособленность микроорганизмов, которая определяется как скорость роста популяции, увеличилась на 70 процентов по сравнению с той, что была у предкового штамма.

Молекулярные биологи расшифровали геномы кишечных палочек, принадлежащих поколениям 500, 1000, 1500, 2000, 5000, 10 000, 15 000, 20 000, 30 000, 40 000, 50 000, с помощью метода секвенирования нового поколения. Всего было найдено более 14 тысяч мутаций, которые привели к потере 1,4 процента общего генома. При этом на половину популяций (Ara−1, Ara−2, Ara−3, Ara−4, Ara+3 и Ara+6) приходилось 96,5 процента точечных мутаций (мутаций, затрагивающих один нуклеотид). Это объясняется тем, что некоторые изменения в генах привели к нарушению процессов восстановления поврежденной ДНК, в результате чего скорость мутирования у этих штаммов значительно повысилась. Склонность к мутациям также придавали IS-элементы (Insertion Sequence) — короткие фрагменты ДНК, которые способны перемещаться и размножаться внутри генома, не выполняя никакую полезную функцию. Например, в популяции Ara+1 31,8 процента мутаций представляли собой вставки IS-элементов, а у популяции Ara−5 (поколение 30 000) доля этого же типа мутации достигала 38,7 процента.
Ученые отмечают, что склонность к генетическим изменениям лишь незначительно повышала приспособляемость организма, поскольку в то же время увеличивалось число не только полезных, но и вредных мутаций. В гипермутированных E.coli отличить полезные генетические изменения от моря остальных мутаций (нейтральных и негативных) становится очень затруднительно. Поэтому исследователи обратили свое внимание на популяции, где скорость генетических изменений осталась на предковом уровне. На основе данных они построили модель зависимости между временем и числом полезных мутаций, которая позволяла точно предсказать уровень приспособленности у микроорганизмов из поколения 50 000. Чтобы снизить влияние статистической неопределенности, биологи обратились к дополнительным доказательствам.

Во-первых, так как нейтральные мутации не оказывают никакого влияния на приспособляемость, на них не действует естественный отбор, поэтому скорость их накопления должна быть сравнима с общей частотой мутаций. К таким генетическим изменениям, в частности, относят синонимичные замены, при которых изменение одного нуклеотида в гене на другой не приводит к замене аминокислоты в белке. Ученые рассчитали, во сколько раз несинонимичные мутации накапливаются быстрее, чем синонимичные. Результаты показали, что после 500-го поколения скорость была больше в 17,1 раза, а после 50 000-го — в 3,4 раза. Это говорит о том, что большинство несинонимичных мутаций были полезными и повышали приспособляемость организмов.
Исследователи также выяснили, что большинство мутаций, произошедших в ранних поколениях, были драйверными и оказывались полезными для кишечной палочки. С течением времени их доля снижалась, однако они не пропадали полностью.
Авторы статьи подчеркивают, что штаммы E. coli, участвующие в долговременном эксперименте, могут отличаться от многих природных популяций в важных аспектах, включая низкую частоту мутаций, отсутствие полового размножения и стабильные условия окружающей среды. Эффекты, которые могут накладывать неучтенные факторы на скорость накопления различных видов мутаций, должны быть учтены в будущих экспериментах.


Рис. 1. Ход молекулярной эволюции в 12 популяциях кишечной палочки. Показаны изменения частоты встречаемости всех зарегистрированных новых мутаций. По горизонтальной оси — время в поколениях. Рисунок из обсуждаемой статьи в Nature

Но главное открытие, сделанное авторами, состоит не в этом. Эволюционная динамика, отображенная на рис. 1, не вписывается в простейшую модель, согласно которой адаптивная эволюция монокультуры бесполых организмов в стабильных условиях сводится к последовательной фиксации отбором вновь возникающих полезных мутаций.
Статистическая обработка данных, приведенных на рис. 1, показала, что эта простейшая модель не может объяснить наблюдаемую картину даже с учетом таких осложняющих обстоятельств, как генетический автостоп и клональная интерференция (конкуренция между клонами бактерий с разными полезными мутациями; см.: Clonal interference). Например, многие мутации, достигнув некоторой частоты, вдруг перестают распространяться, то есть двигаться дальше в сторону фиксации (таков естественный ход событий, если клон с данной мутацией имеет более высокую приспособленность, чем другие бактерии в популяции). Но эти клоны и не вымирают, проиграв конкуренцию клонам с более удачными мутациями. Вместо этого частота мутации начинает колебаться вокруг какого-то уровня. Эти колебания могут продолжаться десятки тысяч поколений, причем уровень, вокруг которого происходят колебания, может со временем меняться.
Метагеномные данные, полученные для каждой из 1440 проб, представляют собой множество отсеквенированных кусочков ДНК, принадлежащих разным индивидам. Поэтому нельзя сразу понять, какие мутации относятся к одному и тому же клону, а какие — к разным. Однако авторам удалось разобраться в этом, проанализировав согласованность изменения частот мутаций во времени (поскольку частоты мутаций, находящихся в одном и том же геноме, меняются синхронно). В итоге выяснилось, что по крайней мере в девяти из двенадцати подопытных популяций в течение длительного времени (свыше 10 000 поколений) имело место устойчивое сосуществование как минимум двух клад (эволюционных линий). Внутри этих клад шли свои собственные эволюционные процессы, то есть появлялись и фиксировались различные мутации (рис. 3).


Это значит, что в большинстве подопытных популяций произошла экологическая диверсификация. Разные клады как-то поделили между собой экологические ниши и стали устойчиво сосуществовать, приспосабливаясь теперь уже не к изначально заданным стабильным условиям среды, а к специфическому и переменчивому биотическому окружению.
Данное явление ранее было обнаружено в одной из двенадцати популяций (Ara-2). Две клады, сосуществующие в этой популяции, имеют разный обмен веществ и используют к своей выгоде продукты жизнедеятельности другой клады. Устойчивое сосуществование обеспечивается частотно-зависимым балансирующим отбором. Это значит, что относительная приспособленность клады тем выше, чем ниже ее численность (J. Plucain et al., 2014. Epistasis and allele specificity in the emergence of a stable polymorphism in Escherichia coli). Новые данные показали, что аналогичная ситуация сложилась как минимум в девяти из двенадцати популяций. Таким образом, экологическая диверсификация — не случайный эпизод, а общая закономерность.
Статистический анализ распределения мутаций во времени показал, что в одних генах мутации преимущественно фиксировались в начале эксперимента (на ранних этапах адаптации), тогда как в других генах мутации начали фиксироваться лишь на поздних этапах. Это объясняется тремя причинами, причем все три, по мнению авторов, реально работают в ходе эксперимента (строго доказать это пока нельзя, но есть косвенные статистические аргументы в пользу реальности всех трех причин).
Таким образом, долгосрочный эволюционный эксперимент опроверг чрезмерно упрощенные представления о том, как должна идти адаптация бесполой популяции к стабильным условиям среды. Ничего похожего на замедление и остановку адаптивной эволюции по мере приближения к оптимуму (пику на ландшафте приспособленности) не наблюдается, запас потенциально полезных мутаций не исчерпывается, и даже темп их накопления практически не снижается. Вместо этого мы видим самопроизвольное усложнение эволюционирующего сообщества, которое из монокультуры превращается в экосистему с подразделенными нишами и коэволюционирующими кладами и явно не собирается в обозримом будущем переходить в состояние эволюционного стазиса. Так что Лесли Оргел был, конечно, прав насчет того, кто умнее — эволюция или теоретики, считающие, что всё про нее знают.
Параллельная эволюция изучена в эксперименте на бактериях
|




