Днк в клетках кишечной палочки
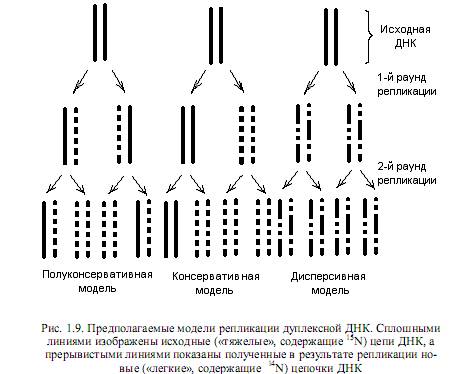
Основной функцией ДНК является ее способность к самоудвоению (репликации). Репликация — очень точный механизм, практически не допускающий ошибок. В самой ДНК (у некоторых вирусов — в РНК) закодирована информация о структуре ферментов, осуществляющих удвоение нуклеиновых кислот, синтез новых нуклеотидов — строительную базу репликации, исправление ошибок репликации, а также репарацию повреждений ДНК, вызванных разными факторами. Наконец, сама структура ДНК, а именно наличие двух цепей в ее составе, является условием, облегчающим процесс копирования, поскольку в таком случае каждая из цепочек может выполнять роль матрицы при синтезе новых молекул ДНК. Подобное предположение высказали Джеймс Уотсон и Фрэнсис Крик еще в 1953 г., и оно получило экспериментальное подтверждение. Такой механизм копирования ДНК, когда каждая из цепей выполняет функцию шаблона, а вновь синтезированные молекулы являются гибридными (состоят из одной старой и одной новой цепей), называется полуконсервативным.
Кроме полуконсервативной, были предложены еще две модели репликации: консервативная и дисперсивная. Особенности этих моделей репликации ДНК состоят в следующем. Согласно дисперсивной модели, родительская спираль ДНК при удвоении разрывается на каждом полуобороте путем множественной фрагментации, а синтез новых цепей происходит на фрагментах (рис. 1.9). По консервативной модели раскручивания спирали ДНК не происходит вовсе, и она служит матрицей для двух новых цепей, в результате чего родительская спираль целиком состоит из старого, а дочерняя — из нового материала. Доказательство реальности полуконсервативного механизма репликации ДНК предоставили Месельсон и Сталь в 1958 г. в экспериментах с ультрацентрифугированием меченой бактериальной ДНК.
Суть этих экспериментов состояла в следующем: ДНК E.coli метили радиоактивным изотопом 15 N, а затем давали осуществиться одному раунду репликации ДНК, выращивая клетки в течение
Итак, все изученные к настоящему времени способы репликации нуклеиновых кислот сводятся к полуконсервативному механизму, согласно которому после каждого раунда репликации одна нить в каждой из двух дочерних молекул является родительской, т. е. консервативной, а другая — синтезированной заново. Репликация одно- и двухцепочечных нуклеиновых кислот, представляющих геномы разных организмов, осуществляется с соблюдением определенных закономерностей при реализации разных механизмов, которые рассмотрены ниже. Общим для всех этих процессов является: 1) участие сложного комплекса ферментов, которые осуществляют репликацию; 2) наличие трех основных стадий процесса — инициации, элонгациии терминации; 3) соблюдение принципа комплементарности при построении новых цепей, при котором шаблоном (матрицей) служит родительская цепочка; 4) высокая точность процесса; 5) возможность исправления ошибок репликации в ходе корректорской правки.
Репликация двухцепочечных ДНК. Двухцепочечные ДНК формируют геномы всех клеточных организмов — и прокариот и эукариот. Наилучшим образом механизм репликации ДНК изучен по отношению к прокариотическим клеткам, в частности бактерий E.coli. В экспериментах с прокариотами показано, что в условиях, ограничивающих синтез белка, репликация ДНК не происходит, из чего можно сделать вывод, что этот процесс нуждается в участии белков. В настоящее время показано, что в процессе репликации ДНК участвуют продукты более чем 10 генов. Это, в первую очередь, ДНК-полимеразы, а также топоизомеразы, геликазы и лигазы. Появляется все больше данных в пользу участия в процессе репликации ДНК высокоорганизованного мультиферментного комплекса —реплисомы, включающей праймосомо-праймазный комплекс, геликазы, Pol III-холофермент и гиразы.
ДНК-полимеразы — это ключевые ферменты репликативного процесса, которые собственно и осуществляют наращивание полинуклеотидных цепей, используя принцип комплементарности. Наиболее полно изучены ДНК-полимеразы кишечной палочки. В клетках этих бактерий обнаружено три различных типа ДНК-полимераз (Pol-I, Pol-II и Pol-III), которые различаются в первую очередь скоростью катализа и нуклеазной активностью. ДНК-полимераза I (Pol-I) представляет собой одиночный полипептид, содержащий порядка 1000 аминокислотных остатков. В клетке E.coli насчитывается около 400 молекул этого фермента. Pol-I обладает следующими активностями: полимеразной — присоединение комплементарных матричной цепи дезоксинуклеотидов к свободной 3’-ОН-группе праймера в направлении от 5’- к 3’-концу (5’→3’) строящейся молекулы ДНК; экзонуклеазной — гидролиз фосфодиэфирных связей (отщепление нуклеотидов) в одной цепи ДНК или на неспаренном конце дуплексной ДНК, начиная с 3ў-конца цепи (3’→ 5’) и 5’-конца цепи (5’→3’). Экзонуклеазные активности играют очень большую роль в репликации и репарации хромосомной ДНК E.coli. 3’→5’-экзонуклеазная активность обеспечивает контроль за присоединением каждого нуклеотида и удаление ошибочных нуклеотидов с растущего конца цепи (корректорская правка), а 5’→3’-экзонуклеазная активность используется для удаления димеров пиримидинов и рибонуклеотидов фрагментов Оказаки.
ДНК-полимераза II (Pol-II) присутствует в клетках кишечной палочки в значительно меньшем числе копий и осуществляет полимеразную активность гораздо медленнее, чем Pol-I (составляет только 5% активности ДНК-полимеразы I). В отличие от Pol-I этот фермент не обладает 5’→3’-экзонуклеазной активностью. Роль этой полимеразы в репликации до конца не выяснена. Считается, что этот фермент не обязателен для репликации ДНК, но может заменять отдельные функции Pol-I при ее повреждении.
ДНК-полимераза III (Pol-III) — основной фермент, ответственный за репликацию хромосомальной ДНК E.coli. В каждой клетке содержится только 10—20 молекул этого фермента, но работает он примерно в 60 раз быстрее ДНК-полимеразы I. Кроме того, Pol-III обладает повышенным сродством к матрице и обеспечивает более высокую эффективность копирования. Для данного фермента, так же как и для Pol-II, не присуща 5’→3’-экзонуклеазная активность. Поэтому для репликации отстающей цепи необходимо участие Pol-I, чтобы произошло удаление РНК-праймеров на 5’-конце фрагментов Оказаки.
В эукариотических клетках выявлено большее количество ДНК-полимераз, но их функции изучены хуже.
Геликазы осуществляют образование и продвижение вдоль спирали ДНК репликативной вилки — участка молекулы с расплетенными цепями. Эти ферменты используют для расплетения цепей энергию, высвобождающуюся при гидролизе АТР. Для обеспечения более высокой скорости раскручивания несколько геликаз действуют в комплексе с белками второго типа, которые связываются с одноцепочечными участками молекулы и тем самым стабилизируют расплетенный дуплекс.
Наконец, ДНК-лигазы катализируют процессы воссоединения фрагментов цепей ДНК, участвуя в образовании ковалентных связей (фосфодиэфирных мостиков) между 5’-P- и 3’-ОН-группами соседних дезоксирибонуклеотидов. Эти ферменты также используют энергию макроэргических связей, образующуюся при гидролизе АТР или GTP.
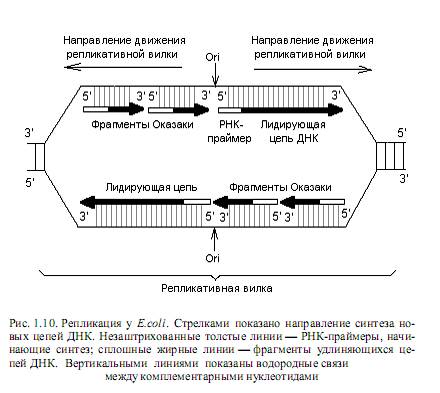
Механизм репликации двухцепочечной ДНК лучше всего исследован для бактерий E.coli и будет рассмотрен на данном примере. Инициация репликации Д НК. Процесс репликации ДНК кишечной палочки начинается в строго определенной точке, которая называется origin (ori), или точкой начала репликации, и расположена на 85 мин. генетической карты хромосомы этих бактерий. В ori репликации на ДНК действуют ферменты (топоизомеразы, геликазы), обусловливающие формирование репликативной вилки, в которой собственно и происходит копирование цепей. Для репликации необходимо наличие: ДНК-матрицы в виде одноцепочечного участка ДНК, смеси дезоксирибонуклеозидтрифосфатов, реплисомы (ансамбля ферментов, принимающих участие в репликации) и 3’-ОН–группы нуклеиновой кислоты —затравки, к которой ДНК-полимераза должна присоединять следующий нуклеотид. Дело в том, что ни одна из ДНК-полимераз не может начинать процесс полимеризации нуклеотидов de novo. Эту функцию выполняют РНК-полимеразы, которые узнают ori репликации в репликативной вилке и синтезируют коротенькие (10—60 рибонуклеотидов) последовательности — РНК-затравки (праймеры). При этом синтез затравок осуществляется в направлении от 5’- к 3’-концу, и в результате образуется свободный 3’-ОН-конец, который может использовать ДНК-полимераза для продолжения процесса полимеризации цепей на стадии элонгации репликации (рис. 1.10).
Элонгация репликации ДНК. Синтез новых цепей ДНК осуществляется с соблюдением принципа комплементарности: каждый подбираемый в растущую цепь нуклеотид должен быть комплементарен соответствующему (расположенному напротив) нуклеотиду в исходной (матричной) цепи.
Поскольку все ДНК-полимеразы осуществляют процесс полимеризации нуклеотидов только в одном направлении (5’→3’), а репликативная вилка движется вдоль ДНК в обоих направлениях, непрерывно синтезироваться в каждом из направлений может лишь одна нить, которую называют лидирующей. Вторая (противоположная) нить синтезируется короткими фрагментами (фрагменты Оказаки) и называется отстающей (рис. 1.10). Фрагменты Оказаки у прокариот содержат порядка 1000 нуклеотидов, а у эукариот — 100—200 нуклеотидов.
Кроме полимеризации цепей, которую осуществляет в основном ДНК-полимераза III, в процессе репликации ДНК происходят следующие события:
— вырезание РНК-затравок из лидирующей цепи и из каждого фрагмента Оказаки. Эту функцию выполняет Pol-I с помощью своей 5’→3’-экзонуклеазной активности;
— заполнение “брешей”, оставшихся после вырезания РНК-затравок. Эту работу также осуществляет ДНК-полимераза I, используя свободную 3’-ОН–группу соседнего фрагмента Оказаки;
— соединение фрагментов ДНК в отстающей цепи с помощью фермента ДНК-лигазы: когда растущий 3’-гидроксильный конец каждого фрагмента Оказаки доходит до 5’-дезоксинуклеотидного конца соседнего фрагмента, вступает в действие ДНК-лигаза и образуется непрерывная отстающая цепь;
— исправление ошибок репликации — корректорская правка. Этот механизм характерен как для Pol-I, так и для Pol-III и основывается на их 3’→5’-экзонуклеазной активности. Известно, что ДНК-полимераза проверяет комплементарность подбираемого нуклеотида, контролируя размер новой предполагаемой пары нуклеотидов в своем активном центре, и ее полимеразная активность включается лишь тогда, когда эта комплементарность установлена. С другой стороны, каждый вновь встроенный нуклеотид также проверяется на соответствие своей паре в активном центре фермента. Если размер образовавшейся пары нуклеотидов не соответствует истинному (когда основания противоположных нуклеотидов не комплементарны друг другу), с помощью своей 3’→5’-экзонуклеазной активности фермент вырезает некомплементарный нуклеотид и ищет ему замену. Дополнительным механизмом, уменьшающим ошибки репликации, служит репарация ДНК. В результате частота ошибочного включения нуклеотидов в образующуюся при репликации цепь ДНК крайне низка (10 -8 —10 -10 ).
Терминaция репликации . При двунаправленной репликации кольцевого генома (как у кишечной палочки) репликативные вилки встречаются на расстоянии 180° от точки репликации, и в этом месте репликация завершается. Кольцевые ДНК в месте встречи соединяются лигазой, при этом они оказываются попарно сцепленными, и в дальнейшем происходит их разделение на отдельные геномы с помощью топоизомеразы типа II.
Скорость репликации ДНК у бактерий E.coli составляет примерно 1500 пар нуклеотидов в секунду. Таким образом, полный геном кишечной палочки (4*10 6 п. н.) реплицируется примерно за 40 мин. Однако клетки E.coli делятся быстрее — каждые 20 мин, и это означает, что при прежней скорости копирования увеличивается частота актов инициации в той же самой точке начала репликации. Т. е. еще до завершения первого раунда репликации генома в сайте ori инициируется второй раунд репликации. Скорость движения репликативной вилки в эукариотических клетках значительно меньше (10—100 п.н. в секунду), но завершение репликации в разумное время обеспечивается одновременной инициацией во множестве точек. В результате хромосома дрозофилы, например, содержащая 6,5*10 7 п.н., реплицируется за несколько минут.
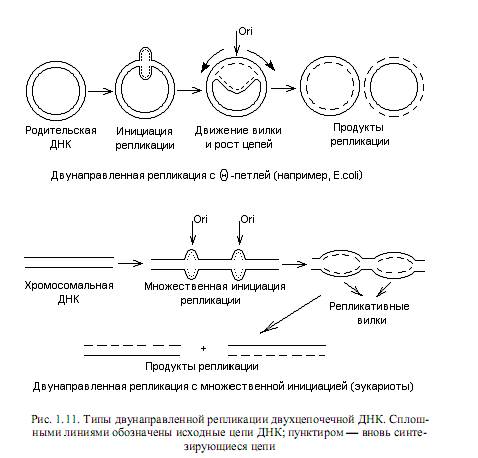
В целом закономерности репликации, выявленные для прокариот, характерны и для большинства эукариотических геномов. Отличия состоят, в первую очередь, в наличии у эукариот множества сайтов инициации репликации на каждой хромосоме, иных, чем у прокариот, механизмах исправления ошибок репликации, а также в ферментативном оснащении процесса репликации. Схематическое изображение процессов репликации циклических, формирующих геномы прокариот и плазмид, и линейных (эукариотических) геномов представлены на рис. 1.11.
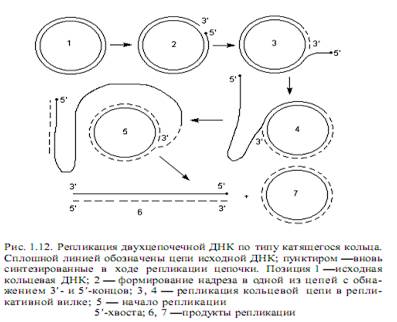
В линейной ДНК раскручивание цепей осуществляется путем вращения одной цепи вокруг другой. В кольцевой ДНК раскручивание и репликация ведут к образованию структуры, напоминающей кольцо с внутренней петлей. Ее называют тэта-петлей, поскольку по форме она похожа на греческую букву Q. Такие петли можно наблюдать на радиоавтографахреплицирующихся бактериальных ДНК, что впервые осуществил Кэрнс для ДНК E.coli. Приведенный механизм двунаправленной репликации ДНК является наиболее распространенным, но не единственным. ДНК фагов Р22, 186, Р2, а также фагов Т4 и l на поздних стадиях литического цикла реплицируется по однонаправленному механизму (тип катящегося кольца). В этом случае двухцепочечная кольцевая ДНК надрезается специфическим ферментом в уникальном сайте одной цепи (точке начала катящегося кольца). Образовавшийся в результате надреза 5’-конец цепи связывается с ферментом, осуществившим надрез. Синтез ДНК начинается с вытеснения 5’-конца, связанного с ферментом, в раствор, что позволяет ДНК-полимеразе присоединять нуклеотиды к 3’-ОН-концу. Происходит полуконсервативная репликация, в ходе которой 5’-конец разорванной цепи вытесняется в виде свободного хвоста и его длина все увеличивается, а матрицей служит интактная замкнутая цепь. Эту реплицирующуюся структуру (рис. 1.12) называют катящимся кольцом, так как разматывание свободной одиночной цепи сопровождается вращением двухцепочечной матрицы вокруг своей оси.
Если этот механизм используется для репликации двухцепочечной ДНК, то 5’-концевые хвосты служат матрицами для синтеза небольших фрагментов ДНК, которые сразу же сшиваются вместе под действием ДНК-лигазы. В результате растущие хвосты вскоре после своего образования приобретают двухцепочечную структуру. Элонгация хвостов приводит иногда к
тому, что их длина многократно превышает общую длину исходной кольцевой молекулы. Такой способ репликации использует, например, фаг l. При упаковке ДНК в капсиды в специальных участках, называемых cos-сайтами и отстоящих друг от друга на длину вирусного генома, образуются надрезы, в результате чего длинные дуплексы многократно повторенной фаговой ДНК расчленяются на фрагменты, соответствующие по размерам зрелой ДНК, обнаруживаемой в вирионах бактериофага l. Репликация по типу катящегося кольца характерна также для образования копии бактериальной хромосомы E.coli Hfr и фактора F + , передающихся при конъюгации в реципиентную клетку.
Репликация одноцепочечных ДНК. У фагов М13 или fХ174, чьи зрелые геномы представлены одиночными кольцевыми ДНК, репликация осуществляется по механизму катящегося кольца (рис. 1.12). Это происходит на поздних стадиях инфекционного процесса, после того, как
Репликация РНК. Образование РНК-содержащих вирусов происходит путем репликации их РНК, тогда как все клеточные РНК образуются в результате транскрипции ДНК. За исключением ретровирусов репликация РНК в основном повторяет процесс репликации ДНК. Как и при репликации ДНК, порядок расположения нуклеотидов определяется комплементарным копированием матрицы, в данном случае обязательно цепи РНК. Ферменты, осуществляющие этот процесс, называются РНК-зависимыми репликазами. РНК бактериальных вирусов R17 и MS2, а также полиовирусов и вируса Синдбис, инфицирующих животных, всегда обозначается знаком (+), поскольку последовательность их РНК-геномов идентична последовательности мРНК. Таким образом, геном инфицирующего вируса может служить в качестве мРНК и содержит информацию о синтезе некоторых, если не всех, вирусных белков. Специфическая репликаза, кодируемая геномом вируса и образующаяся вскоре после инфекции, связывается с одним или несколькими белками клетки-хозяина и инициирует процесс копирования (+)-цепи с ее 3’-конца с образованием полной (-)-цепи, ассоциированной с (+)-цепью-матрицей. Затем та же репликаза синтезирует множество копий (+)-цепи РНК, используя новосинтезированную (-)-цепь в качестве матрицы. Геномы некоторых вирусов (вирус везикулярного стоматита, гриппа) представлены одной или несколькими (-)-цепями. В этом случае они служат матрицами для синтеза (+)-цепей, которые играют роль мРНК и используются при синтезе дочерних (-)-цепей.
Отличительной особенностью репликации геномов ретровирусов является то, что после проникновения их РНК в клетку хозяина вирусный геном подвергается обратной транскрипции. При этом сначала образуется дуплекс РНК-ДНК, а затем — двухцепочечная ДНК. Фермент, катализирующий комплементарное копирование РНК с образованием ДНК, называется обратной траскриптазой (ревертазой). Он содержится в ретровирусных частицах (вирионах) и активируется после попадания в клетку. Появляется все больше данных о том, что обратная транскрипция происходит в самых разных эукариотических клетках, а обратная транскриптаза играет важную роль в процессах перестройки генома. Репликация двухцепочечной формы ретровирусной ДНК не начинается до тех пор, пока она не встроится в клеточную ДНК. Механизм рекомбинационного встраивания пока полностью не установлен. После интеграции ретровирусная ДНК реплицируется как часть клеточной ДНК. РНК дочерних вирионов образуется в результате транскрипции интегрированных копий вирусной ДНК.
Не нашли то, что искали? Воспользуйтесь поиском:
03 февраля 2020
- 855
- 0,0
- 0
- 2
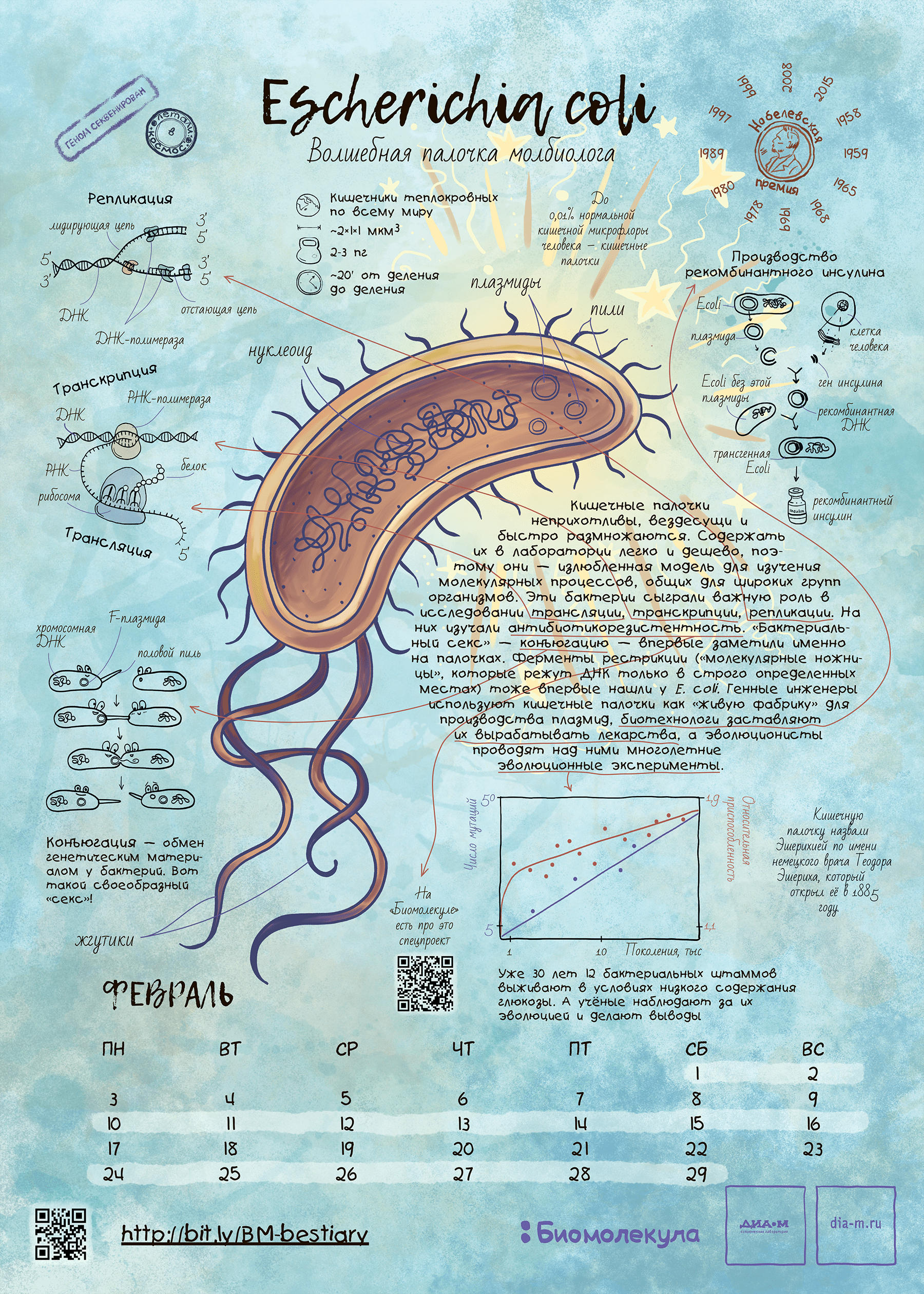
Герой февраля: кишечная палочка Escherichia coli
Скромная бактерия за полстолетия с момента ее открытия в конце XIX в. стала настоящей волшебной палочкой для молекулярной биологии. Сейчас результаты опытов с ее использованием занимают главы и тома профессиональных и популярных изданий. Конечно, в нашем путеводителе по модельным организмам E. coli должна была занять свое почетное место.

Двенадцать модельных организмов
Escherichia и Eschrichtius — Болезнь путешественников — Главная модельная бактерия — Учебник молекулярной генетики — Невезение с CRISPR/Cas
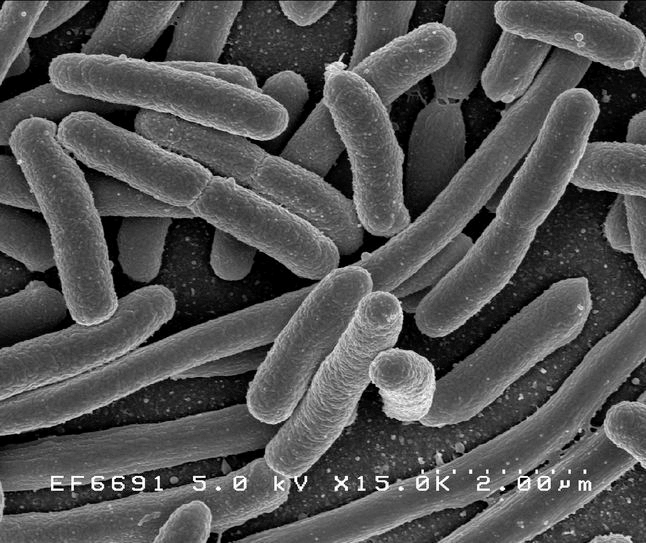
Рисунок 1а. Escherichia длиной 2 мкм

Рисунок 1б. Теодор Эшерих (1857–1911)

Рисунок 1в. Eschrichtius длиной 14 метров

Рисунок 1г. Даниэль Фредрик Эшрихт (1798–1863)
Клетки с относительно тонкой клеточной стенкой, не окрашивающиеся красителем генцианом фиолетовым (окраской бактерий по методу датского микробиолога Кристиана Грама).
Зачем же такую опасную бактерию сделали модельной? Дело в том, что в условиях культивирования кишечная палочка часто теряет патогенность, становится неспособной жить в естественных для себя условиях (то есть одомашнивается). И этим свойством в 1940-е годы воспользовались микробиологи, проведя с лабораторными штаммами E. coli (например, со знаменитым штаммом К12) много прорывных для науки экспериментов.
Так, манипулируя мутированными штаммами кишечной палочки, которые уже научились получать при помощи облучения, Джошуа Ледерберг и Эдуард Лаури Тейтем в 1947 году обнаружили способность разных штаммов обмениваться генетическим материалом и спасать друг друга от образовавшихся дефектов, проявлявшихся в неспособности расти на минимальной питательной среде. Так был открыт процесс конъюгации бактерий, который затем послужил важным инструментом для картирования бактериального генома . Ведь тогда это можно было делать только косвенными, микробиологическими методами — сама природа генетического кода была неизвестна.
Кстати, Джошуа Ледерберг был некоторое время мужем Эстер Ледерберг, первооткрывательницы бактериофага лямбда [3].
С начала 1950-х годов исследования по молекулярной генетике с использованием кишечной палочки и ее вирусов в качестве основного инструмента росли как снежный ком. Не будет преувеличением сказать, что к 70-м годам E. coli написала учебник молекулярной генетики! Вспомним открытие генетического кода, в котором участвовало несколько коллективов физиков и молекулярных биологов, в том числе Френсис Крик, Георгий Гамов и другие выдающиеся люди того времени [6]. Основные эксперименты по расшифровке кода велись на бесклеточных лизатах кишечной палочки.
Позднее обнаружилось, что E. coli хорошо подходит для зародившейся в 1960–1970-е годы биотехнологии [7]. Бактерия хорошо переносит введение в свою клетку гетерологичных (то есть чужеродных) генов и во многих случаях способна синтезировать их продукты без вреда для себя. Белки, полученные таким способом, стали называть рекомбинантными, и теперь они широко используются в медицине и других практических задачах.
Кишечная палочка — возможно, самый исследованный организм с точки зрения молекулярной биологии. Тем не менее у элементов ее генома до сих пор обнаруживают новые свойства. Это одновременно плохо (как же мало мы знаем!) и хорошо (будет чем заняться!). Совсем недавно на защите диссертации я услышал о том, как у одной из генных кассет эшерихии, участвующей в каскаде переработки сульфолипидов, также обнаружена и лактазная активность [8]. До этого такая активность была известна только у знаменитого лактозного оперона Жакоба и Моно, описанного в 1961 году!
Кажется, что E. coli — модельный организм без недостатков. Тем не менее биотехнологам не повезло, что у этой бактерии от природы нет системы бактериального иммунитета CRISPR/Cas [9], о которой я уже упоминал в эссе о бактериофаге лямбда [3]. Именно поэтому эту систему, ныне незаменимую в генной инженерии, открыли относительно поздно.
Кишечная палочка-выручалочка — это здорово (рис. 2). Но теперь пора переместиться в мир ядерных организмов. Удобным инструментом для молекулярной биологии и генетики эукариот оказались одноклеточные грибы — дрожжи — и гаплоидный плесневый гриб — нейроспора. Как они дошли до такой одноклеточной и гаплоидной жизни и что было открыто с их помощью — читайте в следующем материале нашего путеводителя по модельным организмам через месяц.
Благодарность

Кишечная палочка (E.coli) представляет собой грамотрицательные, палочковидные бактерии, которые обычно находятся в нижней части кишечника теплокровных (эндотермических) организмов. Большинство штаммов кишечной палочки безвредны, но некоторые серотипы являются патогенными и могут вызвать серьезное пищевое отравление у людей, и их наличие в продукции может даже повлечь за собой отзыв продуктов с рынка. Безвредные штаммы являются частью нормальной флоры кишечника, и могут быть полезны для организма, поскольку производят витамин К2 и предотвращают производство патогенных бактерий в кишечнике. 1)
Введение
Кишечная палочка и родственные бактерии составляют около 0,1% от кишечной флоры, и фекально-оральный путь передачи является основным маршрутом, через который патогенные штаммы бактерии вызывают болезни. Клетки способны выживать вне тела в течение ограниченного промежутка времени, что делает их идеальными индикаторными организмами для тестирования проб окружающей среды относительно фекального загрязнения. Бактерия также может быть выращена легко и недорого в лабораторных условиях, и интенсивно исследуется на протяжении более 60 лет. Кишечная палочка является наиболее широко изученной прокариотической моделью организма, а также важным видов в области биотехнологии и микробиологии, где служит в качестве организма-хозяина для большей части работ с рекомбинантной ДНК. Немецкий врач-педиатр и бактериолог Теодор Эшерих обнаружили кишечную палочку в 1885 году, и теперь она классифицируется как часть семейства Enterobacteriaceae гамма-протеобактерий. 2)
Серотипы
Патогенные штаммы E. coli могут быть категоризированы на основании элементов, которые могут вызывать иммунный ответ у животных, а именно: O антиген: часть липополисахаридного слоя K антиген: капсула H антиген: флагеллин Например, штамм Е. coli EDL933 принадлежит к группе O157: H7.
Наружная мембрана клетки палочки Е. содержит миллионы молекул липополисахаридов (LPS), которые состоят из:
Антиген O используется для серотипирования кишечной палочки и эти обозначения группы O идут от O1 до O181, за исключением некоторых групп, которые исторически были удалены, а именно, O31, O47, O72, О67, O93 (ныне K84), O94 и O122; группы 174 до 181 являются предварительными (O174 = OX3 и O175 = OX7) или изучаются (от 176 до 181 – STEC / VTEC). Кроме того, существуют подтипы для многих групп O (например, O128ab и O128ac). Следует отметить, однако, что антитела по отношению к нескольким антигенам O перекрестно реагируют с другими антигенами O и частично с K антигенами не только из E.coli, но и от других видов бактерий Escherichia и вида Enterobacteriaceae. 3) Антиген O кодируется генным кластером rfb. Рол (cld) ген кодирует регулятор длины липополисахаридной O-цепи.
Кислый капсульный полисахарид (КПС) представляет собой толстый слизистый слой полисахарида, который окружает некоторые патогены E.coli. Существуют две отдельные группы K-антигеновых групп, называемые группа I и группа II (в то время как небольшая промежуточная группа (K3, K10 и K54 / K96) была классифицирована как группа III). Первая (I) группа состоит из 100 кДа (крупных) капсульных полисахаридов, а вторая (II) связана с внекишечными заболеваниями и имеет размер меньше 50 кДа. Группа IK антигенов обнаруживаются только с определенными О-антигенами (группы О8, O9, O20 и O101), далее они подразделяются на основании отсутствия (IA, аналогично видам Klebsiella в структуре) или присутствия (IB) аминосахаров и некоторые K-антигены группы I прикреплены к липидному А-ядру липополисахарида (KLPS), аналогичным образом, как антигены O (и, будучи структурно идентичны антигенам O, в некоторых случаях рассматриваются только как K антигены при совместной экспрессии с другим подлинным антигеном O). Антигены из группы II K напоминают антигены грам-положительных бактерий и сильно различаются по составу и далее подразделяются в соответствии с их кислотными компонентами. Как правило, 20-50% цепей КПС связаны с фосфолипидами. В общей сложности, насчитывается 60 различных K антигенов, которые были признаны (K1, K2A / переменного тока, К3, К4, К5, К6, К7 (= K56), К8, К9 (= O104), K10, K11, K12 (K82), K13 (= K20 и = K23), K14, K15, K16, K18a, K18ab (= K22), K19, K24, K26, K27, K28, K29, K30, K31, K34, K37, K39, K40, K41, K42 , K43, K44, K45, K46, K47, K49 (o46), K50, K51, K52, K53, K54 (= K96), K55, K74, K84, K85ab / акр (= O141), K87 (= O32), K92, K93, K95, K97, K98, K100, K101, K102, K103, KX104, KX105, и KX106).
Антиген Н является основным компонентом жгутиков, участвующим в движении кишечной палочки. Он, как правило, кодируется геном FLIC. Существует 53 идентифицированных антигена H, пронумерованных от H1 до Н56 (Н13 и Н22 не были антигенами E.coli, но входят в группу Citrobacter freundii и было обнаружено, что Н50 – это то же самое, что H10). 4)
Роль в развитии болезней
У людей и у домашних животных, вирулентные штаммы кишечной палочки могут вызывать различные заболевания. В организме человека: гастроэнтерит, инфекции мочевых путей, а также менингит у новорожденных. В более редких случаях, вирулентные штаммы также могут вызывать гемолитико-уремический синдром, перитонит, мастит, септицемию и грамотрицательную пневмонию.
Каждая отдельная бактерия представляет собой округлый цилиндр. Некоторые штаммы кишечной палочки, такие как O157: H7, O104: H4, O121, O26, O103, O111, O145 и O104: H21, производят потенциально смертельные токсины. Пищевое отравление, вызванное кишечной палочкой, может быть вызвано употреблением в пищу немытых овощей или плохо разделанного и плохо приготовленного мяса. O157: H7 также печально известно благодаря тому, что вызывает серьезные и даже угрожающие жизни осложнения, такие как гемолитико-уремический синдром. Этот штамм связан со вспышками кишечной палочки 2006 года в США из-за свежего шпината. O104: H4 штамм является одинаково вирулентным. Против него не так хорошо развиты методы лечения антибиотиками и поддерживающие протоколы лечения (он может быть очень энтерогеморрагическим, как O157: H7, вызывая кровавый понос, но и более энтероагрегативным, то есть, он хорошо адгезируется и прилипает к кишечным мембранам). Этот штамм ответственен за смертельную вспышку кишечной палочки в Европе в июне 2011 года. Степень тяжести заболевания значительно варьирует; это может привести к летальному исходу, особенно у детей младшего возраста, пожилых людей или лиц с ослабленным иммунитетом, но чаще протекает в более мягкой форме. Ранее, в 1996 году, плохая гигиена при приготовлении мяса в Шотландии вызвала гибель семи человек из-за отравления кишечной палочкой, и сотни человек получили заражение. Кишечная палочка может питать как термостойких, так и термолабильных энтеротоксинов. Последние, названные LT, содержат одну А субъединицу и пять В субъединиц, расположенных в одном голотоксине, и в высокой степени сходны по своей структуре и функции с холерными токсинами. В субъединицы способствуют присоединению и вступлению токсина в кишечные клетки-хозяева, в то время как А субъединица расщепляется и предотвращает поглощению воды клетками, вызывая диарею. LT секретируется в ходе типа 2 пути секреции. Если бактерии кишечной палочки избегают желудочно-кишечного тракта через перфорацию (например, от язвы, разорванного аппендикса, или из-за хирургической ошибки) и проникают в живот, они обычно вызывают перитонит, который могут привести к летальному исходу без своевременного лечения. Тем не менее, кишечная палочка чрезвычайно чувствительна к таким антибиотикам, как стрептомицин или гентамицин. Последние исследования показывают, что лечение энтеропатогенной кишечной палочки антибиотиками может не улучшить исход заболевания, поскольку это может значительно увеличить вероятность развития гемолитического-уремического синдрома. 5) E.coli в слизистой оболочке кишечника наблюдаются в повышенных количествах при воспалительных заболеваниях кишечника, болезни Крона и неспецифическом язвенном колите. Высокие количества инвазивных штаммов E.coli существуют в больших количествах в воспаленной ткани, а количество бактерий в воспаленных участках коррелирует с тяжестью воспаления кишечника. Желудочно-кишечные инфекции могут привести к развитию Т-клеток памяти, которые атакуют микробы кишечника в кишечном тракте. Пищевое отравление может вызвать иммунный ответ на микробные бактерии кишечника. Некоторые исследователи предполагают, что это может привести к воспалительным заболеваниям кишечника.
Передача патогенной кишечной палочки часто происходит фекально-оральным путем. Общие пути передачи включают в себя:. Негигиеничное приготовление пищи, фермерское загрязнение из-за навоза, орошение посевов загрязненной или грязной водой из неочищенных сточных вод, наличие одичавших свиней на пахотных землях, или прямое потребление сточных загрязненных вод. Молочный и крупный рогатый скот являются основными резервуарами кишечной палочки O157: H7, и они могут переносить его бессимптомно и распространять через свои фекалии. Пищевые продукты, связанные со вспышками E.coli, включают огурец, сырой мясной фарш, сырые ростки семян или шпинат, сырое молоко, непастеризованный сок, непастеризованный сыр и продукты, загрязненные инфицированными работниками пищевой промышленности фекально-оральным путем. В соответствии Управлением по безопасности продуктов питания и лекарственных средств США, фекально-оральный цикл передачи может быть нарушен при правильном приготовлении пищи, предотвращении перекрестного загрязнения, использовании барьеров, таких как перчатки, для пищевых работников, политика здравоохранения, обращение сотрудников пищевой промышленности за медицинской помощью, если они больны, пастеризация сока или молочных продуктов и соответствующие требования для мытья рук. Кишечная палочка, продуцирующая Шига токсин (STEC), в частности, серотип O157: H7, также передавался через мух, а также при непосредственном контакте с сельскохозяйственными животными, животными из мини-зоопарка, и частицами, распространяющимися в воздухе, в среде, где содержатся животные. 7)
Уропатогенные кишечные палочки (UPEC) являются причиной примерно 90% инфекций мочевыводящих путей (ИМП), наблюдаемых у людей с обычной анатомией. При восходящих инфекциях, фекальные бактерии колонизируют уретру и распространяются от мочевого тракта до мочевого пузыря, а также в почки (вызывая пиелонефрит), или простату у мужчин. Поскольку женщины имеют более короткий мочеиспускательный канал, чем мужчины, они в 14 раз чаще страдают от восходящих ИМП. Уропатогенные кишечные палочки используют P фимбрии (пиелонефрит-ассоциированные пили), чтобы связать уротелиальные клетки мочевых путей и колонизировать мочевой пузырь. Эти адгезины специфически связывают фрагменты D-галактоза-D-галактозы на антигене P групп крови эритроцитов и уроэпителиальных клетках. Примерно 1% населения Земли испытывает недостаток этого рецептора, и его присутствие или отсутствие опосредует восприимчивость или не восприимчивость человека к инфекции мочевых путей E.coli, соответственно. Уропатогенные кишечные палочки производят альфа- и бета-гемолизины, которые вызывают лизис клеток мочевых путей. Другим фактором вирулентности, который обычно присутствует в UPEC, является семейство Dr из адгезинов, которые особенно связаны с циститом и ассоциированным с беременностью пиелонефритом. Адгезины Dr связывают антиген Dr группы крови (DRA), который присутствует на распад ускоряющем факторе (DAF) на эритроцитах и других типах клеток. Там, Dr адгезины индуцируют развитие длинных клеточных расширений, которые обертываются вокруг бактерий, сопровождаясь активацией нескольких сигнальных каскадов, включая активацию PI-3-киназы. UPEC может обойти врожденную иммунную защиту организма (например, систему комплемента), вторгаясь в поверхностные клетки с образованием внутриклеточных бактериальных сообществ (ВБС). Кроме того, они обладают способностью к образованию K антигена, капсульных полисахаридов, которые способствуют образованию биопленки. Кишечные палочки, производящие биопленку, являются недостижимыми для иммунных факторов и антибактериальной терапии, и часто влияют на развитие хронических инфекций мочевых путей. Инфекции E.coli, производящие K антиген, обычно встречаются в верхних мочевых путях. Нисходящие инфекции возникают, хотя и сравнительно редко, когда клетки кишечной палочки входят в органы верхних мочевых путей (почки, мочевой пузырь или мочеточники) из потока крови.
Производится серотипом кишечной палочки, которая содержит капсульный антиген под названием K1. Колонизация кишечника новорожденного этими штаммами, которые присутствуют во влагалище матери, приводит к бактериемии, которая, в свою очередь, приводит к менингиту. И из-за отсутствия антител класса IgM от матери (они не пересекают плаценту, потому что FcRn опосредует только передачу IgG), к тому же, стоит учитывать также тот факт, что организм распознает антиген K1 как часть себя, поскольку он напоминает церебральные гликопептиды, и приводит к развитию серьезной степени менингита у новорожденных.
Существуют некоторые штаммы кишечной палочки, которые содержат геномный остров поликетидсинтазы (PKS), чья функция заключается в кодировании мульти-ферментативного механизма, который производит генотоксическое вещество, называемое колибактин. Колибактин может вызывать клеточное старение или рак, повреждая ДНК. Тем не менее, барьер слизистой оболочки препятствует достижению E.coli поверхности энтероцитов. Только тогда, когда совместно с инфекцией E. coli развиваются некоторые воспалительные поражения, бактерия способна вводить колибактин в энтероциты, вызывая развитие опухоли.
У животных, вирулентные штаммы E.coli вызывают различные заболевания, среди прочих – септицемия и диарея у новорожденных телят, острый мастит у молочных коров, колибактериоз также ассоциируется с хроническими респираторными заболеваниями с микоплазмой, вызывая перигепатит, перикардит, септические легкие, перитонит и т.д. у домашней птицы, и гниль Алабама у собак. Большая часть серотипов, выделенных из птицы, являются патогенными только для птиц. Таким образом, птичьи источники кишечной палочки не кажутся важными источниками инфекций у других животных.
Лабораторная диагностика
Антибактериальная терапия и резистентность
Фаготерапия – использование вирусов, которые направленно воздействуют на патогенных бактерий, была разработана в течение последних 80 лет, в основном, в странах бывшего Советского Союза, где она использовалась для предотвращения диареи, вызванной кишечной палочкой. В настоящее время, фаготерапия для людей доступна только в центре фаготерапии в Республике Грузия и в Польше. Тем не менее, 2 января 2007 года FDA Соединенных Штатов дало одобрение для компании Omnilytics на применение фага, убивающего кишечную палочку O157: H7 для живых животных, которые будут зарезаны для потребления человеком. Фага энтеробактерии Т4, широко изученная фага, направлена на кишечную палочку.
Читайте также:


