Анализ молока на кишечную палочку
Санитарно-бактериологическое исследование молока и молочных продуктов Ф. К. Черкес, Н. А. Бельская
Молоко и молочные продукты являются благоприятной средой для размножения микроорганизмов.
При изготовлении некоторых молочных продуктов: творога, кефира, простокваши, ряженки и других используют специальную микрофлору, например молочнокислые стрептококки, молочно-кислые ацидофильные палочки и др. Микрофлора, используемая для приготовления этих продуктов, является для них специфичной и не учитывается.
Неспецифической микрофлорой, встречающейся в молоке и молочных продуктах, являются аэробные бактерии: БГКП, стафилококки и др.
С молоком могут передаваться возбудители туберкулеза, бруцеллеза, сальмонеллеза, сибирской язвы, вирус полиомиелита, анаэробные бациллы и т. д.
Обсеменение молока и молочных изделий неспецифической микрофлорой может произойти в момент удоя, транспортировки, хранения и т. д.
Исследование молока и молочных продуктов проводят согласно ГОСТу 9225-68.
Отбор проб. Пробы жидких и полужидких продуктов после тщательного их перемешивания отбирают в количестве 50-100 мл в стерильные колбы. Пробы сливочного масла, сыра, творога отбирают с помощью стерильного щупа из глубины продукта. Перед взятием пробы масла, творога верхний слой продукта тщательно зачищают, а поверхность сыра в месте отбора пробы прижигают раскаленным ножом. Из расфасованных продуктов берут по 2 образца в оригинальной упаковке. Взятые образцы сопровождают документом, в котором указывают:
1. Номер образца.
2. Наименование и сорт продукта.
3. Дату изготовления.
4. Дату и час отбора пробы.
5. Объем необходимых исследований.
6. Должность и подпись лица, отобравшего пробу.
Микробиологическое исследование продукта должно производиться не позднее чем через 4 ч с момента отбора пробы. При транспортировке температура не должна превышать 6° С.
ГОСТ для молока и молочных изделий предусматривает определение общего числа бактерий в 1 г (мл) и определение титра цитратотрицательных (цитратнегативных) разновидностей БГКП (коли-титр).
Подготовка образцов для исследования. Из молока и других молочных продуктов готовят десятикратные разведения (по общепринятой методике). Количество разведений для каждого вида продукта готовят с учетом наиболее вероятного микробного обсеменения (табл. 56).

Таблица 56. Разведение молока и молочных продуктов
Примечание. Для определения общего количества бактерий следует выбирать те разведения, при посевах которых на чашках вырастает не менее 50 и не более 300 колоний.
Посев. По 1 мл каждого разведения вносят в 2-3 стерильные чашки Петри и заливают 12-15 мл растопленного и остуженного до 45° С питательного агара. Предварительно чашки маркируют. Сразу после заливки содержимое чашки перемешивают (путем легкого вращательного покачивания) для равномерного распределения посеянного материала. Посевы ставят в термостат при 37° С на 48 ч.
По истечении срока инкубации чашки вынимают и подсчитывают число колоний при помощи счетчика. Число колоний, выросших на каждой чашке, умножают на соответствующее разведение. Полученные результаты по отдельным чашкам складывают, делят на количество чашек и получают среднее арифметическое, которое является показателем общего числа бактерий в 1 г (мл).
Соответствующие ГОСТы регламентируют качество продуктов, что устанавливают по допустимым показателям: общему числу микробов и коли-титру. Пример для двух видов продуктов представлен в табл. 57.

Таблица 57. Показатели общего числа бактерий и коли-титра в молоке
Примечание. Для других молочных продуктов также имеется ГОСТ обусловливающий допустимое количество микробов в 1 мл (г) продукта. Буквы А и Б обозначают категорию продукта.
В кисломолочных продуктах (кефир, простокваша, творог, сметана и др.), содержащих обильную специфическую микрофлору, общее количество бактерий не определяют, а контролируют состав микрофлоры. Для этого из кисломолочных продуктов готовят препараты и красят метиленовым синим. В поле зрения препарата должны находиться только специфические для данного продукта микроорганизмы. Например, для простокваши - молочно-кислые стрептококки и палочки; для кефира - молочно-кислые стрептококки и палочки, единичные дрожжи. Микроскопия позволяет выявить микроорганизмы порчи (плесени и большое количество дрожжей).
Обсемененность молока и молочных продуктов бактериями группы кишечной палочки определяют бродильным методом. Бродильный титр - это то наименьшее количество продуктов, выраженное в граммах или миллилитрах, в котором присутствует кишечная палочка. Согласно ГОСТу 9225-68 учитываются только цитратнегативные разновидности кишечной палочки (рис. 57).
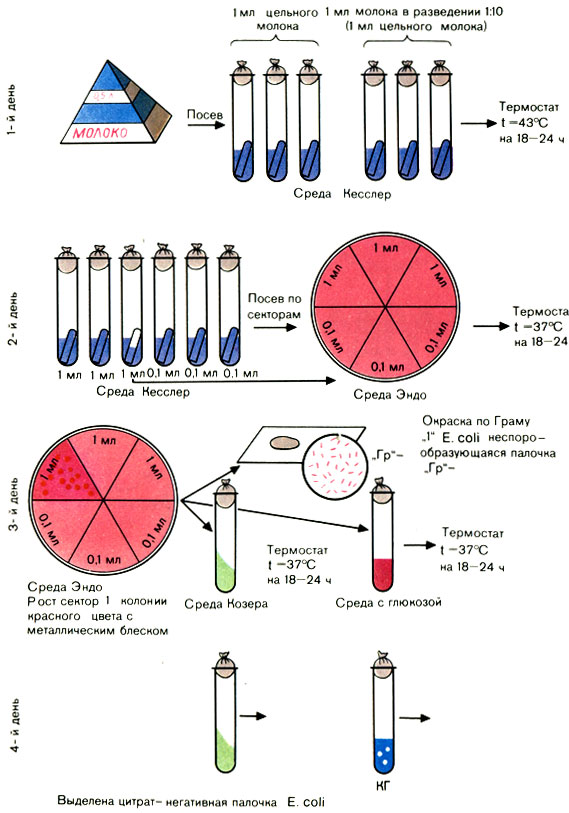
Рис. 57. Определение коли-титра молока
Посев молока и молочно-кислых продуктов производят в 6 пробирок с 5 мл среды Кесслер. В 3 пробирки засевают по 1 мл цельного продукта, в другие 3 пробирки по 1 мл из разведения 1:10 (0,1 мл). Посевы инкубируют в термостате при 43° С 18-24 ч.
Из каждой забродившей пробирки производят посев на сектор среды Эндо и инкубируют при 37° С 18-24 ч.
При отсутствии типичных для БГКП колоний продукт считают незагрязненным кишечной палочкой.
При наличии типичных для БГКП колоний делают мазки, окрашивают по Граму и микроскопируют. При обнаружении грамотрицательных палочек ставят пробу на оксидазу и производят посев на среду с глюкозой и среду Козера.
Производят учет результатов. Наличие кислоты и газа на среде с глюкозой и отсутствие роста на среде Козера свидетельствует о наличии цитратнегативных разновидностей кишечной палочки. Коли-титр вычисляют по табл. 58.
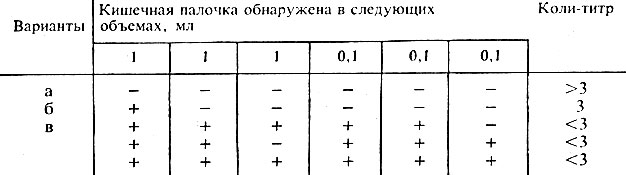
Таблица 58. Вычисление коли-титра в пастеризованном молоке, сливках, кефире, простокваше, ацидофильном молоке
Примечание. Вычисление коли-титра для масла, сыра, творожных изделий, мороженого и молочных консервов проводят по другим таблицам, указанным в ГОСТе.
Присутствие патогенных микроорганизмов в молоке и молочных продуктах недопустимо.
1. Как определяют в молоке и молочных продуктах общее число микробов?
2. Как определяют коли-титр?
3. Какие микроорганизмы могут встречаться в молоке и молочных продуктах?
Среда Кесслер. См. с. 484.
Среда Козера. К 1 л дистиллированной воды добавляют 1,0 г фосфата однозамещенного калия, 0,2 г сульфата магния, 2,5-3,0 г цитрата натрия. Раствор стерилизуют в автоклаве при 1 атм в течение 15 мин, добавляют 10 мл 0,5% спиртового раствора бромтимолового синего и разливают в стерильные пробирки.
Среда глюкозой. См. главу 7.
Желточно-солевая среда. См. главу 14.
В нашем организме живут миллионы бактерий — их общий вес составляет около двух килограммов. Кишечная палочка занимает среди них далеко не последнее место. Эта бактерия может долгое время помогать человеку в формировании микрофлоры и пищеварении, а может в один момент превратиться в серьезную медицинскую проблему. В нашей статье мы расскажем о способах выявления кишечной палочки.
Кишечная палочка, или Escherichia coli (Эшерихия коли) — это палочковидная бактерия, которая обитает в кишечнике человека и некоторых животных. Существует более сотни разновидностей этой палочки. Большинство из них совершенно безвредны, но некоторые могут вызвать серьезные заболевания.
У здорового человека Escherichia coli живет в толстом кишечнике. Ее количество обычно составляет 104–1010 КОЕ в 1 мл содержимого. В кишечнике эта бактерия участвует в переваривании пищи, синтезирует нужные нам витамины, а также производит органические кислоты. Эти кислоты создают благоприятную среду для развития лакто- и бифидобактерий.
Чаще всего кишечная палочка попадает в другие органы при нарушении гигиены или при снижении иммунитета. Попадая в женскую половую систему, она вызывает кольпит, аднексит, другие воспалительные заболевания. Особенно опасно заражение при беременности и после родов. Это может вызвать внутриутробную инфекцию у ребенка и стать причиной послеродового эндометрита у матери. Мужчин эта опасность тоже не обходит стороной. Кишечная палочка, попавшая в уретру, может вызвать уретрит, простатит, воспаление придатков и яичек.
Кроме этого, нормальная кишечная палочка может мутировать и становиться действительно опасной. Некоторые виды этой бактерии, например O157:H7, O104:H4, O121 и O104:H21, выделяют сильные токсины. Они могут вызвать гемолитико-уремический синдром, перитонит, пневмонию, пищевые отравления.
Чаще всего мутировавшая кишечная палочка попадает в организм вместе с продуктами питания, такими как немытые овощи, плохо обработанное мясо, молоко. Но в некоторых случаях такие штаммы могут образоваться внутри организма в результате мутаций и обмена генами.
Патогенная кишечная палочка нередко вызывает диарею. Обычно эшерихиозом страдают дети младшего возраста и люди, путешествующие в страны с низким уровнем гигиены (так называемая диарея путешественников). Вовремя проведенный анализ позволит выявить кишечную палочку и начать лечение.
Некоторые опасные штаммы кишечной палочки могут вызвать гемолитико-уремический синдром (ГУС). Это тяжелое состояние, при котором в мелких сосудах образуется большое количество тромбов, собственные эритроциты разрушаются и возникает полиорганная недостаточность — тяжелая стресс-реакция организма. При любом подозрении на ГУС обязательно проводят анализ на энтеропатогенные (опасные) эшерихии.
Обычный бактериологический анализ, который проводят при воспалительных заболеваниях органов половой системы, послеродовых эндометритах и других, — также может показать наличие кишечной палочки.
Еще одним показанием к проведению исследования является дисбактериоз. Изменение состава микрофлоры кишечника может привести к проблемам с пищеварением, к урчанию и болям в животе. Нарушение образования витаминов и повышенное всасывание токсинов приводит к слабости, утомляемости и другим неспецифическим симптомам.
Кишечную палочку можно обнаружить в кале, в моче, в мазках с поверхности половых органов или из ран, при посеве промывных вод. Также во время исследований она может быть обнаружена в ране, в легких.
Основным методом анализа для обнаружения кишечной палочки является бактериологический посев. Для этого небольшое количество материала помещают в питательную среду, на которой бактерии очень хорошо размножаются. Результат подсчитывают через несколько дней по количеству образовавшихся колоний. Единица измерения — КОЕ/мл, то есть количество бактерий, из которых при исследовании выросли колонии, в миллилитре материала.
Также существует метод ПЦР-диагностики. Он позволяет сказать, присутствует ли в материале патогенная кишечная палочка. Но ни количество бактерий, ни их чувствительность к лекарственным препаратам этот метод не покажет.
Другие методы, которые не подразумевают выделение чистой культуры кишечной палочки, могут сказать о заражении только косвенно. Например, в общем анализе мочи могут обнаружить бактерии в виде палочек. Но для того чтобы определить их вид придется сдавать дополнительно бактериологический посев. Похожая ситуация и с копрограммой. Анализ может дать представление о состоянии желудка и кишечника, но не позволяет выявить конкретные бактерии.
Общий анализ крови позволяет выявить характерные для воспалительных заболеваний сдвиги. Но они могут быть вызваны не только эшерихиозом, но и дизентерией, пневмонией или любым другим воспалительным заболеванием.
Любое бактериологическое исследование нужно проводить до начала лечения антибиотиками. В противном случае можно получить ложноотрицательный результат.
Анализ кала на кишечную палочку собирается в стерильную пробирку с транспортной средой. Для этого нужно заранее подготовить судно или другую емкость, тщательно вымыть ее и ополоснуть кипятком. В эту емкость собирается кал после естественной дефекации. Из специальной пробирки с транспортной средой нужно достать аппликатор, погрузить его в несколько участков собранного биоматериала и снова убрать в пробирку, плотно закрыв крышку. Если в собранном материале присутствуют кишечные палочки, бактериологический анализ это покажет.
Анализ мочи на бактериологическое исследование тоже собирают в специальную стерильную емкость. Собрать материал можно в любое время суток. Перед этим обязательно нужно принять душ, чтобы в емкость не попали бактерии с поверхности кожи. Чем скорее получится доставить материал в лабораторию, тем лучше.
Мазки и соскобы урогенитального тракта при подозрении на уретрит, вагинит и любые другие мочеполовые заболевания, вызванные кишечной палочкой, забирают сразу в лаборатории или на приеме врача. Специальной щеточкой делается соскоб из уретры, со стенок влагалища или с шейки матки. Это не очень приятная процедура, но без нее не обойтись.
Быстрый анализ, который позволяет выявить в материале ДНК кишечной палочки, проводится за 1–2 рабочих дня. Результат бактериологического анализа на кишечную палочку придется ждать дольше — от 5 до 7 дней. За это время выращивается культура клеток, определяется их вид, проводится анализ на чувствительность к антибиотикам и бактериофагам.
В норме кишечной палочки не должно быть нигде, кроме толстого кишечника. То есть если вы сдаете мочу или мазок, то лучший результат — это отрицательное заключение. Если речь идет о содержимом кишечника, то здесь не должно обнаруживаться энтеропатогенных кишечных палочек, таких как O157:H7. В некоторых лабораториях проводят быстрый ПЦР-тест на целую группу таких бактерий.
При определении чувствительности к антибиотикам или бактериофагам выдается бланк, на котором напротив каждого наименования написана степень влияния препарата на рост бактерии. По такому бланку врач за несколько минут подберет наиболее эффективный для конкретного случая антибиотик.
Анализ на эшерихиоз можно сдать как в обычной поликлинике, так и в частной лаборатории. Желательно заранее уточнить, какой метод исследования при этом используется.
Бактериологические исследования лучше проводить в клиниках и лабораториях, оснащенных автоматическими и полуавтоматическими анализаторами. Это исключает человеческий фактор, позволяет проводить исследование с широким перечнем антибиотиков и бактериофагов. Такие оснащенные лаборатории имеют как современные государственные больницы, занимающиеся лечением инфекционных болезней, так и частные медицинские центры.
Также стоит обратить внимание на время проведения исследования. Для бактериологического исследования это не менее пяти дней. Раньше бактерия просто не успеет вырасти в достаточном для анализа количестве. Время больше 7–10 дней говорит о том, что исследование будет проводиться в сторонней лаборатории. Это существенный недостаток, поскольку речь идет о транспортировке биоматериала, что нежелательно: чем раньше был доставлен материал, тем более достоверным будет результат.
Кишечная палочка — неотъемлемая часть микрофлоры кишечника. Пока она находится под контролем организма, ее клетки помогают синтезировать витамины, переваривать пищу, создавать благоприятную среду для жизни других полезных микробов. Но любое нарушение этого равновесия грозит патологиями вплоть до серьезных воспалительных заболеваний. К счастью, медицина помогает нам вовремя выявить отклонения от нормы и приять соответствующие меры.
Основными источниками попадания микробов в молоко являются вымя и кожный покров животного, руки доярки, посуда, воздух и др. В процессе хранения молока микроорганизмы изменяют его свойства. Для более длительного сохранения первоначальных свойств молока необходимо снижать до минимума возможности попадания в него микроорганизмов в процессе хранения и транспортирования.
При исследовании необходимо обращать внимание на количественный и видовой состав микрофлоры молока. Это дает возможность правильно вести борьбу с возбудителями порчи молока.
В молоко при нарушении санитарных требований могут попасть бактерии кишечной группы, маслянокислые, гнилостные (аэробы и анаэробы), дрожжи, микроскопические грибы, которые вызывают различные пороки молока и молочных продуктов.
Отбор проб. Для бактериологического исследования молока и сливок после тщательного перемешивания отбирают около 50 см 3 продукта стерильным пробоотборником или черпаком в стерильную колбу, которую затем закрывают пробкой. Взятые пробы необходимо сразу же исследовать. Если взятые пробы предназначены для отправки в лабораторию, то их необходимо охладить до 5…6°С. При такой температуре можно перевозить или хранить пробы, но не более 4 ч с момента отбора. Перед отправкой образцы пломбируют или опечатывают, оформляют сопроводительный документ, в котором указывают дату, час отбора пробы, температуру продукта, должность и подпись бравшего пробу.
Определение общего количества микроорганизмов. При определении общего количества микроорганизмов в молоке рекомендуются следующие нормы разведения: молоко сырое 1, 2, 3, 4, 5. Молоко пастеризованное 1, 2, 3.
По 1 см 3 соответствующих разведений высевают в чашки Петри и заливают расплавленной питательной средой, охлажденной до температуры 45 °С (сусло-агар, МПА) в количестве 12…15 см 3 . Сразу после заливки содержимое тщательно перемешивают, покачивая чашки для равномерного распределения посевного материала. Выращивание ведут в течение 2 сут при температуре 37°С.
Для определения общего количества бактерий следует выбирать те разведения, при посевах которых на чашках вырастает не менее 30 и не более 300 колоний. Количество выросших колоний подсчитывают в каждой чашке, поместив ее вверх дном (без крышки) на темном фоне, пользуясь лупой с увеличением в 8…10 раз. Каждую подсчитанную колонию отмечают на дне чашки чернилами. При подсчете колоний рекомендуется пользоваться счетчиками.
Для подсчета общего количества бактерий в 1 см 3 или 1 г образца число колоний, выросших на каждой чашке, умножают на соответствующее разведение. Полученные результаты по отдельным чашкам складывают, делят на количество подсчитанных чашек и выводят среднее арифметическое, которое принимают за окончательное. Полученные числа округляют.
Количественный учет молочнокислых бактерий. Количество молочнокислых бактерий учитывают чашечным методом и методом предельных разведений.
Чашечным методоммолочнокислые бактерии учитывают путем посева соответствующего разведения продукта по 1 см 3 в чашки Петри, где его заливают агаром с гидролизованным молоком и мелом. Посевы выдерживают в термостате при температуре 30 °С в течение 3 сут. Колонии молочнокислых бактерий распознают по зонам просветления, которые образуются в результате растворения мела молочной кислотой.
Метод предельных разведенийприменяют при анализе продуктов, в которых молочнокислая микрофлора состоит из молочнокислых стрептококков и палочек (сыры, южные кисломолочные продукты).
В качестве питательной среды для молочнокислых бактерий используют обезжиренное молоко. Берут ряд последовательных разведений исследуемого продукта в стерильной воде с таким расчетом, чтобы последние не содержали молочнокислых бактерий.
Например, если в 1 см 3 исследуемого продукта содержится 1000 клеток молочнокислых бактерий, то приготовляют следующие разведения:
| I разведение | II разведение | III разведение | IV разведение | V разведение |
| 1/10 | 1/100 | 1/1000 | 1/10 000 | 1/100 000 |
| 100 клеток в 1 см 3 | 10 клеток в 1 см 3 | 1 клетка в 1 см 3 | 1 клетка в 10 см 3 | 1 клетка в 100 см 3 |
Из приготовленных разведений делают посевы по 1 см 3 в стерильное обезжиренное молоко (по две пробирки из каждого разведения). Заведомо не содержавшее бактерий (последнее) разведение берут для доказательства того, что определено то наименьшее количество исследуемого продукта, в котором уже не содержится молочнокислых бактерий.
Посевы ставят в термостат при 30 °С на 7 сут. В течение этого времени во всех пробирках, в которых содержались молочнокислые бактерии, должно свернуться молоко. В каждой пробирке со свернувшимся молоком определяют кислотность и из сгустка готовят микроскопический препарат.
Если кислотность сгустка не ниже 60 °Т и в препарате видны стрептококки или палочки, делают вывод, что в нем содержатся молочнокислые бактерии.
При подсчете количества молочнокислых бактерий пользуются специальной таблицей.
Таблица 4 – Количественный учет микроорганизмов методом предельных разведений
| Числовая характеристика | НВЧ микробов при обсеменении параллельных пробирок в количестве | Числовая характеристика | НВЧ микробов при обсеменении параллельных пробирок в количестве | ||
| 0,0 | 0,0 | 5,0 | |||
| 0,5 | 0,3 | - | 2,0 | ||
| - | - | - | - | ||
| - | - | 6,0 | 2,5 | ||
| 0,5 | 0,3 | 13,0 | 2,0 | ||
| 0,9 | 0,6 | 20,0 | 3,0 | ||
| - | - | - | - | ||
| - | - | 25,0 | 2,0 | ||
| 0,9 | 0,6 | 70,0 | 3,0 | ||
| - | - | 110,0 | 3,5 | ||
| - | - | - | 4,0 | ||
| - | - | - | 3,0 | ||
| - | - | - | 3,5 | ||
| - | - | - | - | 4,0 | |
| - | - | - | - | - | - |
| 0,6 | 0,4 | - | - | - | |
| 1,2 | 0,7 | - | 2,5 | ||
| - | 1,1 | - | 4,0 | ||
| - | - | - | 6,5 | ||
| 1,3 | 0,7 | - | - | ||
| 2,0 | 1,1 | - | 4,5 | ||
| - | - | - | 7,5 | ||
| - | - | - | 11,5 | ||
| 2,0 | 1,1 | - | 16,0 | ||
| 3,0 | 1,5 | - | 9,5 | ||
| - | - | - | 15,0 | ||
| - | - | - | 20,0 | ||
| - | 1,6 | - | 30,0 | ||
| - | - | - | 25,0 | ||
| - | - | - | 45,0 | ||
| - | - | - | - | 110,0 | |
| - | - | - | - | 140,0 | |
| 2,5 | 0,9 | - | - | - |
Сначала составляют числовую характеристику. Она состоит из трех цифр, указывающих число пробирок со свернувшимся молоком в трех последних разведениях. Первая слева цифра числовой характеристики должна начинаться с того разведения, в котором во всех пробирках молоко свернулось (пример 1).
Разведения 1/10 1/100 1/1000 1/10 000
Число засеянных пробирок 2 2 2 2
со свернувшимся молоком - 2 2 1 1
В данном примере первая цифра числовой характеристики 2 (молоко свернулось в двух пробирках разведения 1/100), вторая – 1 (сгусток имеется в одной пробирке следующего разведения 1/1000) и третья – 1 (также сгусток есть в одной пробирке разведения 1/10 000).
Следовательно, числовая характеристика будет 211. Она соответствует по таблице 4 (при посеве в две параллельные пробирки) числу 13. Это число надо умножить на то разведение, с которого начиналась первая цифра числовой характеристики (в нашем примере это разведение равно 1/100). Таким образом, в 1 см 3 содержится 1300 молочнокислых бактерий.
При небольшом содержании молочнокислых бактерий (сырое или пастеризованное молоко) возможно свертывание молока в одной пробирке I разведения. В этом случае первая цифра числовой характеристики будет 1 (пример 2).
Разведения 1/10 1/100 1/1000
Число засеянных пробирок 2 2 2
Число пробирок со свернувшимся молоком 1 1 0
В данном случае числовая характеристика будет 110, что соответствует числу 1,3 (табл. 4). Умножая его на разведение, с которого начиналась числовая характеристика (1/10), получаем количество молочнокислых бактерий в 1 см 3 , оно будет равно 13.
Определение эффективности пастеризации. Для определения эффективности пастеризации молока или сливок проводят не менее двух исследований: перед пастеризацией и тотчас после нее. Пробы для исследования берут непосредственно из аппарата в стерильную посуду и сразу же охлаждают.
Для учета остаточной микрофлоры проводят посев молока с разведениями 1/10, 1/100 в чашки Петри на МПА. При исследовании молока перед пастеризацией берут разведения 1/100, 1/1000, 1/10 000 и засевают в чашки Петри на МПА. Эффективность пастеризации можно считать достаточной, если объем остаточной микрофлоры составляет не более 0,01 % объема первоначальной. Существуют и другие методы определения эффективности пастеризации, например метод Н.С. Королевой.
Определение коли-титра молока. Коли-титром называется наименьшее количество исследуемого продукта, в котором устанавливается наличие бактерий из группы кишечной палочки (род кишечной палочки должен быть установлен путем идентификации).
Коли-титр характеризует санитарно-гигиенический режим получения и обработки молока и условия содержания лактирующих коров.
В сыром молоке и сливках определяют бродильный титр. Под бродильным титром понимают наименьшее количество продукта, в котором присутствует хотя бы одна клетка бактерий группы кишечной палочки. Титр кишечной палочки определяют методом бродильных проб.
Коли-титр определяют в три этапа: первая бродильная проба (посев на среду Кесслера), вторая бродильная проба (пересев со среды Кесслера на среду Эндо), третья бродильная проба (пересев со среды Эндо на среду Симмонса или Козера). Бродильный титр определяют только первой бродильной пробой.
Для определения коли-титра засевают молоко в шесть пробирок со средой Кесслера: в три – по 1 см 3 и в три – по 0,1 см 3 . После инкубации в термостате при температуре 43…45°С в течение 18. .24 ч (первая бродильная проба) просматривают и устанавливают бродильный титр сырого молока. Отсутствие газа во всех пробирках свидетельствует о том, что продукт не загрязнен бактериями группы кишечных палочек. Появление газа свидетельствует о возможном загрязнении продукта кишечной палочкой. Для подтверждения наличия кишечной палочки проводят пересев из пробирок, в которых обнаружено газообразование, на среду Эндо в чашки Петри. Выращивают в течение 18. .24 ч при температуре 37°С (вторая бродильная проба).
При появлении в среде Эндо красных с металлическим блеском или розовых слизистых колоний их изучают выборочно. Изолируют 1…2 наиболее типичные колонии из каждого сектора чашки Петри. Из них делают мазки, окрашивают по Граму, микроскопируют.
При наличии в мазках грамотрицательных палочек, неспорообразующих, подозрительных в отношении бактерий группы кишечной палочки, проводят высев на среду Симмонса с целью идентификации и дифференциации рода Escherichia и бактерий родов Citrobacter и Enterobacter (третья бродильная проба).
Кишечная палочка (Е. coli) относится к цитратотрицательным бактериям, она не способна усваивать углерод из солей лимонной кислоты и расти на этой среде. Штаммы кишечной палочки, выросшие на среде Симмонса с изменением ее цвета из оливково-зеленого в светло-синий являются цитратположительными и относятся к родам Citrobacter или Enterobacter и не учитываются.
Коли-титр пастеризованного молока и сливок устанавливают по следующим показателям:
-ни в одной из пробирок газообразование не обнаружено – коли-титр более 3;
-в одной из трех засеянных по 1 см 3 пробирок обнаружены признаки брожения – коли-титр 3;
-брожение обнаружено более чем в одной пробирке с 1 см 3 или хотя бы в одной из пробирок с 0,1 см 3 – коли-титр 0,3;
-брожение обнаружено во всех пробирках с посевами от обоих разведений, а также в том случае, если брожение обнаружено в трех пробирках любогоразведения и в двух пробирках другого – коли-титр менее 0,3.
Коли-титр исследуемого пастеризованного молока или сливок вычисляют, руководствуясь табл. 5.
Коли-титр кефира, ацидофильного молока, простокваши, ацидофильно-дрожжевого молока, напитка Южный вычисляют так же, как и у пастеризованного молока.
Во всех видах молочных продуктов и в молоке не должно содержаться патогенных микроорганизмов. Об этом судят по коли-титру. В продуктах детского питания в 1 см 3 (1 г) допускается присутствие не более 5000 бактерий (коли-титр более 3).
Таблица 5 – Расчет коли-титра
| Вариант | Наличие кишечной палочки в 1 см 3 продукта | Коли-титр | ||||||||||||||||||||||||||||||||||||||
| 1,0 | 1,0 | 1,0 | 0,1 | 0,1 | 0,1 | |||||||||||||||||||||||||||||||||||
| а | - | - | - | - | - | - | >3,0 | |||||||||||||||||||||||||||||||||
| б | + | - | - | - | - | - | 3,0 | |||||||||||||||||||||||||||||||||
| в | + | + | - | - | - | - | 0,3 | |||||||||||||||||||||||||||||||||
| г | + | + | + | - | - | - | >0,3 | |||||||||||||||||||||||||||||||||
| д | + | + | + | + | - | - | 0,3 | |||||||||||||||||||||||||||||||||
| е | + | + | + | + | + | - | о С. Колонии подсчитывают через 36…48 ч. Протеолитические бактерии на вышеуказанной среде при своем росте образуют широкие зоны просветления (протеолиза) вокруг колоний. Пептонизирующие бактерии (микрококки, маммококки) образуют узкие зоны пептонизации.
Определение титра маслянокислых бактерий. Вначале делают соответствующие разведения исследуемого материала, затем засевают в пробирки со стерильным цельным молоком. После посева пробирки нагревают в водяной бане до 85°С в течение 10 мин и помещают в термостат, где выдерживают при 30°С в течение 3 дней. Наличие маслянокислых бактерий определяют по образованию газа, запаху масляной кислоты, наличию в мазке спорообразующих бактерий, имеющих форму барабанных палочек, дающих с йодом положительную реакцию на гранулезу. По результатам исследования определяют титр. Титром считают то наибольшее разведение молока, в котором обнаруживается рост маслянокислых бактерий. Определение количества дрожжей и микроскопических грибов. Делают различные разведения исследуемого материала и проводят посев в чашки Петри с сусло-агаром. Посевной материал выдерживают в термостате в течение 3 дней при 30°С. Подсчитывают отдельно колонии дрожжей и колонии плесневых грибов. Затем умножают на разведение и получают количество тех и других в 1 см 3 . При подсчете колоний в нескольких чашках определяют среднее их количество. Определение общего количества бактерий в молоке косвенным методом. Для определения бактериальной чистоты и свежести молока проводят пробу на редуктазу, основанную на способности бактерий выделять редуктазу, восстанавливающую краски (метиленовый синий, резазурин). Обесцвечивание метиленового синего и резазурина наступает тем быстрее, чем больше микробов в молоке. Проба с метиленовым синим: в пробирки наливают 20 см 3 молока и 1 см 3 метиленового синего или 10 см 3 молока и 0,5 см 3 метиленового синего. После тщательного смешивания пробирки помещают в редуктазник или водяную баню с температурой воды 38°С. Такую температуру поддерживают в течение всего опыта до полного обесцвечивания молока. Первые 20 мин наблюдения ведут непрерывно, в дальнейшем просмотр пробирок проводят периодически через 2 и 5,5 ч после начала анализа. Пробы проводят не реже 1 раза в декаду. Раствор метиленового синего готовят следующим образом: 5 см 3 насыщенного спиртового раствора метиленового синего прибавляют к 195 см 3 дистиллированной воды. Смесь хорошо перемешивают. Срок хранения полученного раствора не более 7 сут. По скорости обесцвечивания метиленового синего молоко разделяют на 4 класса (табл. 6). Таблица 6 – Оценка качества молока в зависимости от результатов пробы на редуктазу
Проба с резазурином: в стерильные пробирки вносят по 1 см 3 рабочего раствора резазурина и по 10 см 3 исследуемого молока, закрывают корковыми пробками, смешивают путем трехкратного переворачивания пробирок. Пробирки помещают в редуктазник или ставят на водяную баню с температурой воды 38 °С и защищают от действия прямых солнечных лучей. Показания снимают через 20 мин и через 1 ч, не встряхивая и не переворачивая пробирки. Через 20 мин пробирки с обесцвеченным молоком удаляют из редуктазника или водяной бани. Появление окрашивания молока в этих пробирках при встряхивании не учитывается. Оставшиеся пробирки однократно переворачивают и оставляют в редуктазнике до конца анализа. Основной раствор готовят следующим образом: 100 г резазурина растворяют в 200 см 3 стерильной дистиллированной воды, хранят в холодильнике, защищая от света. Рабочий раствор готовят, разбавляя основной раствор водой в соотношении 1:2,5 (например, к 10 см 3 основного раствора добавляют 25 см 3 воды). Срок хранения рабочего раствора при температуре 8…10°С в течение 7 сут. В зависимости от времени обесцвечивания и изменения окраски молоко относят к одному из четырех классов (табл. 6). Контрольные вопросы. 1. Какие методы используют для определения общего количества микроорганизмов в молоке? 2. Как определяют эффективность пастеризации молока? 3. Как определяют коли-титр молока? 4. Какие методы вы знаете для определения молочнокислых бактерий в молоке и в чем их сущность? 5. Как определяют протеолитические, маслянокислые бактерии, дрожжи и плесневые грибы в молочных продуктах? 6. В чем сущность определения качества молока путем постановки пробы на редуктазу? Читайте также:
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу. Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
|

