Отравление желтой кровяной солью
Никому не хочется исследовать то, что воняет - неприятную, обычно скрытую от населения сторону нашей жизни.
И я ни за что не стал бы этого делать!
Но, увы, эта неприятная сторона жизни в последние пару десятков лет вошла внутрь меня и начала убивать меня изнутри.
Я начал буквально подыхать от хронических болезней: постоянные боли в горле, воняющие от грибка ногти, приступы глубокой слабости и головокружения, странная длительная тупость, постоянные боли в животе и жуткий метеоризм, депрессия, утрата работоспособности до степени инвалидности, многолетний бронхит, беспричинная агрессия и многое другое.
Этот "запах" медленного гниения моей плоти в конце-концов и "пробил" меня на самые глубокие исследования - да что же это со мною творится?
В чем причина моих бед?
И что делать, как выкарабкиваться из могилы?
Предлагаю один из многих плодов моих многолетних исследований.
СОЛЬ И ДОБАВКИ В НЕЕ
Ну, что же, спасибо Евросоюзу, теперь все станет как надо!
Но вот что странно…
Добавки-то небезобидные!
Трудно в это поверить, но, если сложились условия, они способны превращаться в сильный яд.
Что именно добавляют нынче в соль, что за антислеживатели?
Вот краткие сведения.
Применение антислеживателей помогает решить несколько вопросов:
• обеспечивает равномерную подачу и правильную дозировку при производстве;
• предотвращает слеживаемость при хранении;
• помогает сохранить товарный вид;
• увеличивает срок хранения продукта.
Для каждого вида пищевого продукта – свой антислеживатель.
Что именно подкладывают в нашу российскую соль?
Преимущественно Е536 - ферроцианид калия.
Это вещество покрывают поверхность частиц соли, после чего за счёт их сильной гигроскопичности на поверхности частиц образовывается буферная (постоянная) влажность.
Из-за чего становится невозможным образование/высыхание жидких солевых менисков, которые связывают (склеивают) частицы между собой, образуя брикет.
Синонимы (другие названия):
желтая кровяная соль, гексацианоферрат калия, железистосинеродистый калий, желтый цианид калия, ферроцианид калия, гексацианоферриат калия тригидрат.
Заметим, что это производное цианида калия или иначе цианистого калия, известного яда мгновенного действия.
ПРОИЗВОДИТЕЛИ ДОБАВКИ Е536 О СВОЕЙ ПРОДУКЦИИ
Физ.-хим. данные:
Температура плавления: 69-70°C
Температура разложения: 400°C
Получение: В настоящее время калий железистосинеродистый (Е536) в промышленности получают из отработанной массы (содержит цианистые соединения) после очистки газов на газовых заводах.
Внешний вид: Кристаллы желтого цвета
Давайте еще раз прочитаем:
"Е536 не ядовит, но в присутствии свободных кислот или кислых солей, в особенности при нагревании до 40-50 °С, разлагается с выделением синильной кислоты — сильного яда. При попадании в организм человека, под действием кислоты желудочного сока, образуется синильная кислота, вызывающая отравление."
Не странно ли?
Пищевая добавка признается производителем опасной, но это никого не волнует?
Е536 В ПИЩЕ И ВНУТРИ НАС
Итак, это не шутка.
Современная соль - потенциально ядовита.
Температура 36, 6 градусов внутри нас мало отличается от 40 градусов.
Внутри нас эта добавка способна начать превращаться в яд: "в присутствии свободных кислот или кислых солей."
Что касается супов и каш, мяса и рыбы, то они готовятся при температуре свыше 100 градусов.
Если при этом в пище откуда-то взялись "свободные кислоты или кислые соли", то при приготовлении пищи на плите антислеживатель точно и полностью разложится на яды.
Если "свободных кислот или кислых солей" в пище не обнаружится, то антислеживатель в еде не разложится на яды (нужна температура 400 градусов), но потом, внутри нас, это вполне может произойти.
Итак, когда мы едим современную соленую пищу, то вместе с нею, вполне возможно, принимаем немножко сильного яда - синильной кислоты.
Подождите пугаться!
Это, наверное, не так уж и страшно…
Дело в том, что синильная кислота есть, к примеру, и в ядрах плодовых косточек!
Мы же не умираем, поев абрикосовых косточек, кунжута или иных горьких семечек.
Отчего, кстати, не умираем?
Оттого, что количество принятого яда слишком мало и он обезвреживается печенью и почками.
А вот при употреблении большого количества еды, содержащей яд, может произойти отравление.
Если съесть пару горстей горького миндаля или стакан кунжута - серьезное отравление обеспечено.
Кстати, антидотом является обычный сахар, поэтому никто не травится, поев казинаки из кунжута.
А что будет при употреблении - небольшом,но ежедневном - еды, содержащей немного яда?
Особенно в том случае, если этот яд способен накапливаться в организме?
Через несколько месяцев или лет количество вполне может перерасти в качество и может начаться серьезное снижение иммунитета.
Которое выразится в какой-нибудь хронической болезни.
Мы не едим ядра плодовых косточек каждый день.
А вот соль едим – хотя и понемногу, но каждый день.
Способна ли образующаяся при этом синильная кислота накапливаться в организме?
ДОБАВКИ В ДОБАВКЕ
Есть и еще одна "фишка".
В наши дни Е536 получают на производстве из отработанной массы, содержащей цианистые соединения, после очистки газов на заводах.
Очистить газы трудно - химический продукт совершенно чистым бывает редко.
Поэтому в готовом продукте имеются и побочные вещества.
Это дополнительные цианиды, включая синильную кислоту (в зависимости от способа получения E-536).
То есть добавка E536 может содержать в себе, как примеси, иные гадости.
В связи с малым количеством примесей, считается, что они не представляют серьезной опасности для здоровья.
А как насчет накапливания в организме?
Ведь мы едим соль каждый день!
Что делать?
Накапливать в себе яды, провоцирующие снижение иммунитета и различные заболевания?
Или сражаться за свое здоровье?
В Нижнем Новгороде мне удалось купить мешок галита (природной соли) производства фирмы Артемсоль.
Расфасовал ее по небольшим пластиковым пакетам.
И уложил пакеты в бочку, даже не завязывая.
Достаю по мере надобности.
Кстати, в хороших, плотных полиэтиленовых пакетах соль совершенно не слеживается.
Это и понятно - полиэтилен не пропускает воздух и влагу.
Так зачем же тогда нужны антислеживатели?
Если есть полиэтилен?
На всякий случай я запросил производителя относительно моей соли.
ВОТ ОТВЕТ:
«Уважаемый Константин, в продукте который Вы приобрели согласно "Удостоверения качества и безопасности" нет противослеживающей добавки - это однозначно.
Если добавка вводится, то на ярлыке к каждому мешку и в "Удостоверении" отмечается "Состав" продукта, в названии добавляется фраза "с противослеживающей добавкой", а также указывается ее количество.
Природная соль серого цвета.
Магазинная - белого
Из этого население заключает, что производители соли очищают ее.
На самом деле это вовсе не так, соль вовсе не очищают.
Это миф.
Напротив, производители соли загрязняют ее вредными добавками - с коммерческими целями.
Чтоб она не слеживалась и хорошо раскупалась.
А белый цвет - именно и только результат размалывания в порошок.
Я проверил - взял серые кристаллы натуральной соли и размолол.
Соль стала беслоснежная.
Получение
В настоящее время в промышленности получают из отработанной массы (содержит цианистые соединения) после очистки газов на газовых заводах; эту массу обрабатывают суспензией Ca(OH)2, фильтрат содержащий Ca2[Fe(CN)6], перерабатывают путём последовательного добавления сначала KCl, а затем K2CO3.
Он так же может быть получен путём взаимодействия суспензии FeS с водным раствором KCN. Реакцию можно представить следующей схемой:
1. цианид калия переводит Fe 2+ в белый осадок гексацианоферрата(II) железа(II) (а не в цианид железа(II), как считалось ранее, что вытекает из взаимодействия этого цианида со щёлочью: 3Fe(CN)2 + 4KOH → 2Fe(OH)2↓ + K4[Fe(CN)6]):
Свойства
Светло-жёлтые кристаллы с тетрагональной решеткой, существующие в виде тригидрата K4[Fe(CN)6]·3Н2О.
Плотность 1,853 г/см³ при 17 °C. Растворимость в воде 31,5 г/100 г при 25 °C, 48,3 при 50 °C. Практически не растворяется в эфире, этаноле, пиридине, анилине, этилацетате.
Гексацианоферрат(II) калия диамагнитен.
Выше 87,3 °C (по другим данным, выше 120 °C) превращается в безводную соль с плотностью 1,935 г/см³. Выше 650 °C разлагается:
В реакции с соляной кислотой выделяется белый осадок железистосинеродистой кислоты (H4[Fe(CN)6]).
С концентрированной серной кислотой реагирует по уравнению:
Этим способом можно пользоваться в лаборатории для получения монооксида углерода.
В водных растворах окисляется хлором и другими окислителями, такими, как перекись водорода до K3[Fe(CN)6]:
Применение
Применяют при изготовлении пигментов, крашении шёлка, в производстве цианистых соединений, ферритов, цветной бумаги, как компонент ингибирующих покрытий и при цианировании сталей, для выделения и утилизации радиоактивного цезия.
Гексацианоферрат(II) калия применяется в аналитической химии как реактив для обнаружения некоторых катионов:
или, в ионной форме
2. Zn 2+ : образуется белый осадок гексацианоферрата(II) цинка-калия:
или, в ионной форме
3. Cu 2+ : из нейтральных или слабокислых растворов выпадает красно-бурый осадок гексацианоферрата(II) меди(II):
или, в ионной форме
Может использоваться для получения синильной кислоты:
В пищевой промышленности ферроцианид калия зарегистрирован в качестве пищевой добавки E536, препятствующей слёживанию и комкованию. Применяется как добавка к поваренной соли.
Мнемоническое правило
Для того, чтобы запомнить формулу желтой кровяной соли K4[Fe(CN)6] и не спутать ее с красной кровяной солью K3[Fe(CN)6], существует мнемоническое правило:
- Число атомов калия соответствует числу букв в английских названиях солей: "gold" - 4 буквы, то есть 4 атома калия - желтая кровяная соль K4[Fe(CN)6]. "Red" - три буквы, то есть три атома калия - красная кровяная соль - K3[Fe(CN)6].
См. также
Ссылки
Wikimedia Foundation . 2010 .
Соль - получить на Академике актуальный промокод на скидку GRACY или выгодно соль купить с дисконтом на распродаже в GRACY
желтая кровяная соль — kalio heksacianoferatas(II) statusas T sritis chemija formulė K₄[Fe(CN)₆] atitikmenys: angl. ferrous potassium cyanide; yellow prussiate of potash; potassium ferrocyanide; potassium hexacyanoferrate(II) rus. желтая кровяная соль; калия… … Chemijos terminų aiškinamasis žodynas
Красная кровяная соль — Гексацианоферрат (III) калия (красная кровяная соль) Гексацианоферрат(III) калия (железосинеродистый калий, феррицианид калия, гексацианоферрат калия) комплексное соединение трёхвалентного железа K3[Fe(CN)6]. Содержание 1 Тривиальные названия … Википедия
Жёлтая кровяная соль — Гексацианоферрат(II) калия (железистосинеродистый калий, ферроцианид калия, гексацианоферриат калия) комплексное соединение двухвалентного железа K4[Fe(CN)6], существуюшее обычно в виде тригидрата K4[Fe(CN)6]·3H2O. Содержание … Википедия
Желтая или кровещелочная соль — или синь кали, или железисто синеродистый (цианистый) калий (das gelbe Blatlaugensalz, eisenblausaures Kali, Kaliumeisencyanür; lessive de sang, ferrocyanure de potassium, prussiate jaune de potasse; yellow prussiate of potash, ferrocyanide of… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Е536 — Жёлтая кровяная соль Гексацианоферрат(II) калия (железистосинеродистый калий, ферроцианид калия, гексацианоферриат калия) комплексное соединение двухвалентного железа K4[Fe(CN)6], существуюшее обычно в виде тригидрата K4[Fe(CN)6]·3H2O. Содержание … Википедия
Железистосинеродистый калий — Жёлтая кровяная соль Гексацианоферрат(II) калия (железистосинеродистый калий, ферроцианид калия, гексацианоферриат калия) комплексное соединение двухвалентного железа K4[Fe(CN)6], существуюшее обычно в виде тригидрата K4[Fe(CN)6]·3H2O. Содержание … Википедия
Желтое синькали — Жёлтая кровяная соль Гексацианоферрат(II) калия (железистосинеродистый калий, ферроцианид калия, гексацианоферриат калия) комплексное соединение двухвалентного железа K4[Fe(CN)6], существуюшее обычно в виде тригидрата K4[Fe(CN)6]·3H2O. Содержание … Википедия
Жёлтое синькали — Жёлтая кровяная соль Гексацианоферрат(II) калия (железистосинеродистый калий, ферроцианид калия, гексацианоферриат калия) комплексное соединение двухвалентного железа K4[Fe(CN)6], существуюшее обычно в виде тригидрата K4[Fe(CN)6]·3H2O. Содержание … Википедия
Калий железосинеродистый — Жёлтая кровяная соль Гексацианоферрат(II) калия (железистосинеродистый калий, ферроцианид калия, гексацианоферриат калия) комплексное соединение двухвалентного железа K4[Fe(CN)6], существуюшее обычно в виде тригидрата K4[Fe(CN)6]·3H2O. Содержание … Википедия
Калия гексацианоферриат — Жёлтая кровяная соль Гексацианоферрат(II) калия (железистосинеродистый калий, ферроцианид калия, гексацианоферриат калия) комплексное соединение двухвалентного железа K4[Fe(CN)6], существуюшее обычно в виде тригидрата K4[Fe(CN)6]·3H2O. Содержание … Википедия

| Калий железистосинеродистый | |
|---|---|
 | |
 |
наименование
тригидрат — бледно-жёлтые кристаллы
650 °C
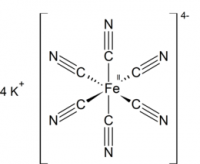
Гексацианоферрат (II) калия (железистосинеродистый калий, ферроцианид калия, гексацианоферроат калия, жёлтая кровяная соль) — комплексное соединение двухвалентного железа K4[Fe(CN)6], существующее обычно в виде тригидрата K4[Fe(CN)6]·3H2O.
Содержание
- 1 История открытия и тривиальные названия
- 2 Получение
- 3 Химические свойства
- 4 Токсичность
- 5 Применение
- 6 Мнемоническое правило

История открытия и тривиальные названия
- жёлтая кровяная соль — кристаллогидрат K4[Fe(CN)6]·3H2O.
- жёлтое синькали
- жёлтая соль
- кровещелочная соль
Получение
В настоящее время в промышленности получают из отработанной массы после очистки газов на газовых заводах (содержит цианистые соединения); эту массу обрабатывают суспензией Ca(OH)2; фильтрат, содержащий Ca2[Fe(CN)6], перерабатывают путём последовательного добавления сначала KCl, а затем K2CO3.
Он также может быть получен путём взаимодействия суспензии FeS с водным раствором KCN. Реакцию можно представить следующей схемой:
1. цианид калия переводит Fe 2+ в белый осадок гексацианоферрата(II) железа(II) (а не в цианид железа(II), как считалось ранее, что вытекает из взаимодействия этого цианида со щёлочью: 3Fe(CN)2 + 4KOH → 2Fe(OH)2↓ + K4[Fe(CN)6]):
Fe2[Fe(CN)6] + 12CN − → 3[Fe(CN)6] 4− 
Химические свойства
Светло-жёлтые кристаллы с тетрагональной решеткой, существующие в виде тригидрата K4[Fe(CN)6]·3H2O.
Плотность 1,853 г/см³ при 17 °C. Растворимость в воде 31,5 г/100 г при 25 °C, 48,3 г при 50 °C. Практически не растворяется в эфире, этаноле, пиридине, анилине, этилацетате.
Гексацианоферрат(II) калия диамагнитен.
Выше 87,3 °C (по другим данным, выше 120 °C) превращается в безводную соль с плотностью 1,935 г/см³. Выше 650 °C разлагается:
В реакции с соляной кислотой выделяется белый осадок железистосинеродистой кислоты (H4[Fe(CN)6]).
С концентрированной серной кислотой реагирует по уравнению:
Этим способом можно пользоваться в лаборатории для получения монооксида углерода.
В водных растворах окисляется хлором и другими окислителями, такими, как пероксид водорода до K3[Fe(CN)6]:
Анион [Fe(CN)6] 4− очень прочен (константа нестойкости 8⋅10 -36 ), не разлагается ни щелочами, ни кислотами, устойчив по отношению к воздуху; поэтому растворы ферроцианидов не показывают реакций ни на Fe 2+ , ни на CN − .
Токсичность
Нейтральное вещество, не разлагается в воде и внутри человеческого организма. Летален при приёме перорально дозы в 6400 мг/кг (испытания на крысах).

Применение
Применяют при изготовлении пигментов, крашении шёлка, в производстве цианистых соединений, ферритов, цветной бумаги, как компонент ингибирующих покрытий и при цианировании сталей, для выделения и утилизации радиоактивного цезия.
В Российской Федерации широко применяют при производстве продуктов питания - соли, творожных продуктов, в виноделии и пр.
Гексацианоферрат(II) калия применяется в аналитической химии как реактив для обнаружения некоторых катионов:
или, в ионной форме
2. Zn 2+ : образуется белый осадок гексацианоферрата(II) цинка-калия:
или, в ионной форме
3. Cu 2+ : из нейтральных или слабокислых растворов выпадает красно-бурый осадок гексацианоферрата(II) меди(II):
или, в ионной форме
В пищевой промышленности ферроцианид калия зарегистрирован в качестве пищевой добавки E536, препятствующей слёживанию и комкованию. Применяется как добавка к поваренной соли.

Мнемоническое правило
Для того, чтобы запомнить формулу желтой кровяной соли K4[Fe(CN)6] и не спутать её с красной кровяной солью K3[Fe(CN)6], существует мнемоническое правило:
[Fe(CN)6] 4–
аммония • бария • железа(II) • железа(III) • калия • кальция • кобальта • магния • марганца • меди(II) • натрия • никеля • олова • свинца • стронция • таллия • цинка • Железистосинеродистая кислота H4[Fe(CN)6]
[Fe(CN)6] 3–
железа(II) • железа(II,III) • калия • кальция • кобальта • меди(I) • натрия • неодима(III) • олова • свинца • Железосинеродистая кислота H3[Fe(CN)6]

Поваренная соль — составная часть рациона всех видов животных. У свиней в дозе 0,2-0,5г на 1 кг веса она улучшает аппетит и усвоение поступивших в организм питательных веществ. Но если давать ее в чрезмерно больших дозах или по доведенных до животных нормах после длительного солевого голодания, то у всех видов животных, особенно у свиней и птицы, появляется солевое отравление. Среди пушных зверей к отравлению поваренной солью наиболее чувствительны норки, соболи; несколько слабее реагируют на поваренную соль песцы, лисицы и еноты .
Этиология. В некоторых ЛПХ, КФХ да иногда и сельхозпредприятиях животные страдают хроническим солевым голоданием, в результате неправильного использования поваренной соли, когда ее кладут в кормушки или оставляют на выгульных двориках в виде лизунцов, а также когда владельцы не додают в рационы положенной нормы поваренной соли.
Владельцам животных необходимо знать, что смертельными дозами поваренной соли являются: для крупного рогатого скота 1,5-3кг, для лошадей 1-1,5кг, для овец и свиней 125-250г, для собак 30-60г на голову, для зверей 3-4г на 1 кг веса и для средних по весу кур 4,5г. В тоже время, если в рационе подсвинков содержится недостаточное количество минеральных веществ, то отравление и гибель поросят происходит при дозе соли 0,5-2г на 1кг веса, а жеребят – при 1,5 -2,5г. И наоборот, при достаточно высоком обеспечении подсвинков минеральными веществами подсвинки погибали при дозе соли 9-13г, а жеребята – 6г на 1 кг веса.
У животных солевое отравление наступает при использовании крупных кусков кристаллической соли, плохо растворенных в воде, а у свиней, при скармливание соленой рыбы, соленых огурцов и помидор, отходов столовых, кафе и ресторанов, при скармливании селедочных и мясных рассолов. При скармливании рассолов отравление наступает не только в результате содержания в них высокой концентрации соли, но также из-за наличия токсических продуктов распада белков (птоманны) корма.
Патогенез. Механизм действия поваренной соли на организм животного сводится к резкому нарушению ионного состава крови. Происходит преобладание одновалентных катионов (Na,К) над двухвалентными (Са,Mg) вызывает перевозбуждение нервной системы. В этом отношение действие двухвалентных и одновалентных ионов напоминает собой действие медиаторов (ацетилхолина и адреналина).
При смертельном отравлении свиней содержание натрия в крови у них увеличивается в 1,5-2раза, а в эритроцитах – в 3-5раз (до 150-280мг%); концентрация хлора в плазме и эритроцитах бывает в 1,5-2 раза больше. Во всех органах происходит накопление натрия и хлора. Гемоглобин во время переноса кислорода из легких к тканям находится в соединение с калием. В случае отравления поваренной солью избыточный натрий, заменяет в гемоглобине калий, что влечет за собой нарушение функции гемоглобина в организме, на почве чего развивается кислородное голодание тканей, к нарушению обмена веществ, отеку легких и смерти отравившегося животного от асфиксии.
Клиническая картина. Симптомы острого отравления наступают у животных вскоре после приема корма и сопровождаются:
У свиней симптомы отравления поваренной солью появляется обычно через 12-24часа и характеризуется жаждой, саливацией, учащением дыхания и мышечной дрожью. Повышается температура тела. Во время возбуждения отравившиеся свиньи совершают манежные движения, натыкаются на препятствия. При клиническом осмотре ветеринарный специалист отмечает расширение зрачков, зрение ослаблено или полностью потеряно, нарушена координация движений, наблюдает покраснение или посинение кожи. В течение 3-5 минут тетанические и клонические судороги у животного сменяются угнетением. В результате пареза глотки свиньи отказываются от корма и питья. У отравившихся животных возможна рвота, изо рта выделяется много слюны. Наблюдается понос, иногда в каловых массах находим кровь. Сердечная деятельность ослаблена, пульс слабый, частый, дыхание напряженное. Отравившиеся животные принимают позу сидячей собаки. Смерти животных предшествует их коматозное состояние. При не смертельном отравлении животные выздоравливают в течение нескольких дней.
У крупного рогатого скота отравление поваренной солью протекает в форме гастроэнтерита с усиленной жаждой, рвотой и поносом. В случаях отравления селедочным рассолом к этим симптомам присоединяются скрежетание зубами и тризм жевательных мышц. Стельные коровы абортируют. После нормального отела или аборта у коровы может выпасть матка.
У овец отравление поваренной солью сопровождается сильной жаждой. При клиническом осмотре ветеринарный специалист регистрирует красноту и сухость слизистой оболочки ротовой полости, колики, понос, иногда полиурию. Смерть овец наступает от асфиксии в результате отека легких.
У зверей отравление поваренной солью характеризуется острым гастроэнтеритом, рвотой, поносом. Часто у отравившихся животных возникают эпилептические припадки, во время которых владельцы отмечают сильное слюнотечение. Звери визжат. Температура тела нормальная или ниже нормы.
Птицы при солевом отравлении часто пьют, становятся малоподвижными, вялыми и сидят с опущенными крыльями. При клиническом осмотре отравившейся птицы ветеринарный специалист регистрирует у них понос, судороги, поражение вестибулярного аппарата, которое клинически проявляется перекручиванием шеи, параличом крыльев и ног. Отравившиеся поваренной солью куры почти все время сидят неподвижно на одном месте, безучастны к окружающему, перья у них взъерошены.
Течение болезни, как правило, острое.
Патологоанатомические изменения. При вскрытии павших животных обнаруживаются множественные точечные кровоизлияния, очаговые отеки, некротические изменения тканей. Особенно резко эти изменения выражены в слизистой желудочно-кишечного тракта. Лимфатические узлы увеличены, сочные, иногда геморрагичны. Почки увеличены в объеме, темно-красного цвета, капсула снимается с трудом, граница между корковым и мозговыми слоями не выражена, имеются кровоизлияния. Селезенка и печень увеличены, темно-красные. Легкие увеличены, с явлениями застойной гиперемии и отека. Под эпикардом и эндокардом множественные точечные кровоизлияния, сердечная мышца дряблая. Мочевой пузырь переполнен мочой, его слизистая оболочка гиперемирована. Сосуды оболочки мозга резко инъецированы. Вещество мозга отечное. Кровь светло-красная, не свернувшаяся. У жвачных особенно сильные изменения обнаруживаются в сычуге: слизистая оболочка утолщена, покрасневшая, с множественными кровоизлияниями. У птиц при вскрытии находим признаки острого воспаления пищеварительного тракта, начиная с зоба. Скелетная мускулатура бледная.
Диагноз на отравление животных поваренной солью ставят на основании данных анамнеза, клинической картины отравления, результатов патологоанатомического вскрытия, химико-токсикологического исследования кормов и содержимого желудочно- кишечного тракта.
Дифференциальный диагноз. При проведении дифференциальной диагностики ветеринарный врач должен исключит болезнь Ауески, отравление хлопчатниковым жмыхом, картофелем, гастроэнтериты незаразного, инфекционного и инвазионного происхождения.
Лечение. С целью предупреждения нарушения водного обмена и обезвоживания организма больным животным дают или вводят через зонд и в виде клизм обильное количество воды. Свиньям назначают 5-10%-ный раствор кальция хлорида(1мг/кг массы животного). Внутривенно вводят 40% раствор глюкозы. При отравление хороший лечебный эффект у свиней получают от внутримышечного введения глюконата кальция в дозе 20-30мл.
Жвачным животным внутривенно вводят 10% -ный раствор хлорида кальция: коровам -200мл, овцам 40-50мл. Одновременно с применением кальция, внутривенно вводят 40%-ный раствор глюкозы с кофеином. В дальнейшем отравившимся животным назначают слизистые отвары, легко усвояемые питательные корма.
Профилактика солевых отравлений у животных заключается в том, чтобы владельцы ЛПХ, КФХ и сельхозпредприятий организовали правильное минеральное кормление своих животных. Большое значение имеет содержание в рационе свиней достаточного количества поваренной соли, фосфорных и кальциевых солей (трикальций фосфат, мясо-костная мука и т.д.), витаминов (рыбий жир, морковь, сенная мука, зеленая трава, пророщенный овес). Если свиньи длительное время не получали поваренную соль, то ее первое скармливание начинают с малых доз; так, поросятам – отъемышам ее дают в количестве не более 3-5г на голову в сутки. К соли или солевому корму обязательно примешивают мел или трикальцийфосфат. Скармливать комбикорма, содержащие поваренную соль, необходимо только по назначению. Отходы производства пищевой промышленности, содержащие большое количество соли (рассол и др.), в пищу свиньям не допускаются. Среди обслуживающего персонала необходимо проводить разъяснительную работу о недопустимости скармливания кухонных отходов с большим содержанием поваренной соли.
Зверям нельзя скармливать большое количество соленого мяса. Если другого корма для зверей нет, то соленое мясо следует вымачивать 2-3 суток, меняя за этот срок воду 6-7раз. Проварка мяса позволяет снизить содержание соли в мясе до 2%. Проваренное мясо можно давать из такого расчета, чтобы соли было не больше 5г для лисицы, 2 г для песца и 0,5г для норки. В питьевой воде для кур содержание хлоридов не должно превышать 0,4%, для цыплят – 0,2%.
Читайте также:
- Может ли быть отравление от асд
- Бананы при отравлении отзывы
- Что делают при отравлении таблетками в больнице
- Что делать если постоянно тошнит при алкогольном отравлении
- Патологические изменения внутренних органов при отравлении
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.

