Одонтогенная интоксикация что это такое

Еще в XIX в. врач Понтер заметил нездоровый цвет лица некоторых больных, наличие у них невротических расстройств, анемии, нарушений пищеварения. При этом в последствии выявилось, что у всех пациентов в полости рта имелись зубы с некротизированной пульпой. После удаления таких зубов наступило значительное улучшение состояния больного или полное выздоровление. В 1910 г. Гюнтер сформулировал понятие об очаговой инфекции полости рта и ротовом сепсисе, которое быстро распространилось за рубежом и имело много сторонников.
В XX в. в работах американских ученых Биллингса и Розенау была разработана доктрина ротового сепсиса. В своей работе ученые обращали внимание на то, что стрептококки и стафилококки могут изменять свою вирулентность в зависимости от условий внешней среды, а именно от содержания в ней кислорода. Кроме этого, патогенные микроорганизмы через ток крови могут проникать из очага одонтогенной инфекции во внутренние органы, по отношению к которым они обладают определенным сродством. Отсюда следовал вывод, что любой зуб с некротизированной пульпой подлежит обязательному удалению. На практике данная доктрина проявлялась массовым удалением зубов с хроническими очагами одонтогенной инфекции и некрозом пульпы.
В дальнейшем доктрина подверглась критике, так как были получены новые данные и вскрыт ряд методических ошибок в экспериментах, проведенных Биллингсом и Розенау. Также были разработаны новые методы консервативного лечения, направленные на сохранение зубов.
Под понятием эндогенная интоксикация подразумевают нарушение жизнедеятельности, вызванное токсическими веществами, образовавшимися в организме. В качестве токсических веществ могут выступать активированные ферменты, продукты обмена веществ в высоких концентрациях, продукты перекисного окисления липидов, медиаторы воспаления, компоненты комплемента, бактериальные токсины [5].
Важную роль в этиологии хронических очагов одонтогенной инфекции играет микробный фактор. В очагах одонтогенной инфекции обнаруживаются ассоциации стрептококков, стафилококков, грамположительных и грамотрицательных палочек, спиралевидных форм бактерий.

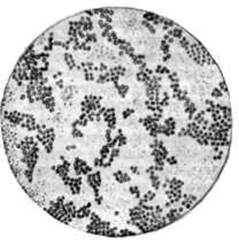
Микроорганизмы рода Микроорганизмы рода
Основным звеном патогенеза синдрома эндогенной интоксикации является токсемия. Выделяемые токсины нарушают тонус периферических сосудов, механические свойства форменных элементов крови, вследствие этого развивается тканевая гипоксия, которая является одним из важных звеньев патогенеза эндогенной интоксикации [4]. Токсины также блокируют места связывания молекул альбумина, это в свою очередь приводит к снижению эффективности медикаментозного лечения, так как данный белок является транспортным агентом для многих фармакологических препаратов.
В течение последних лет были выяснены некоторые механизмы хронизации острых инфекционных одонтогенных. Данные механизмы заключается в том, что в период острого воспаления в периодонте накапливаются антигены, прежде всего эндотоксины грамотрицательных бактерий. Эндотоксины оказывают антигенное воздействие на иммунное состояние периодонта и окружающих его тканей. Реакция тканей периодонта на непрерывное раздражение антигенами, поступающими из канала корня зуба, проявляется в виде антигенозависимых и клеточно-обусловленных процессов [4]. К антигенозависимым относятся иммунокомплексы реакции типа Артюса и IgЕ-обусловленные реакции, к клеточно-обусловленным — реакции гиперчувствительности замедленного типа [2].
Хроническое воспаление в периодонте при нормальном состоянии иммунной системы рассматривается как защитный барьер, предотвращающий распространение продуктов распада тканей, микроорганизмов и их токсинов в общий кровоток из зоны инфекционного воспаления.
Масштаб иммунного ответа может быть различным, он может протекать на уровнях всего организма, то есть генерализовано или быть локализованным, например, при пульпите отмечаются изменения в иммунологических показателях преимущественно материала из десневой борозды, в меньшей степени — в иммунограмме ротовой жидкости, и совсем едва заметные сдвиги — в иммунограмме периферической крови [4].
К хроническим стоматогенным очагам инфекции относят верхушечные периодонтиты, околокорневые и фолликулярные кисты зубов, многие заболевания краевого пародонта и слизистой оболочки полости рта (гингивиты, пародонтиты, язвенно-некротические стоматиты и т. п.), кариес зубов и др. Хронические стоматогенные очаги инфекции составляют более 50 % очагов хронической инфекции организма.
При появлении стоматогенной инфекции происходит мобилизация защитных сил организма человека, которая достаточна для компенсации влияния этого очага за его пределами. Такое состояние компенсации может поддерживаться неопределенно длительное время. Однако самые различные экзогенные и эндогенные факторы, чаще неспецифического характера (перегревание или переохлаждение организма, переутомление, резкое изменение микроклимата или условий труда и быта человека, перенесенные заболевания и т. п.), приводят к быстрому истощению компенсаторных возможностей организма, активизации инфекции и возникновению обусловленных заболеваний [3].
Взаимосвязь очага хронической стоматогенной инфекции и организма имеет весьма сложный характер. Условно можно выделить несколько основных патогенетических механизмов.
1. Рефлекторный механизм.
Главным фактором является сам инфекционный агент (микробы и их токсины), который создает в очаге активные рецепторные поля раздражения. Рецепторные поля в свою очередь рефлекторно через центры головного мозга вызывают нарушение функции вегетативной нервной системы и регуляции работы внутренних органов и систем организма с последующим развитием в них функциональных и дистрофических изменений.
В клинической практике можно наблюдать такое явление, как проглатывание больным гноя, выделяющегося из зубодесневых карманов при пародонтите или из свища при хроническом гранулематозном или гранулирующем периодонтите и околокорневой кисте челюсти.
3. Низкий уровень иммунологической реактивности организма человека.
Под этим механизмом подразумевается, что микробы из очага стоматогенной инфекции проникают в кровеносное русло, что клинически определяется как острый сепсис. С целью подтверждения диагноза проводят бактериологическое исследование, то есть посев крови на питательные среды для выявления возбудителя и определения его антибиотикорезистентности.
Поступление в кровь токсинов микроорганизмов, находящихся в очаге хронической стоматогенной инфекции, обусловливает затяжной субфебрилитет, изменения в картине крови и другие характерные клинические симптомы.
5. Аллергические механизмы.
Бактерии, находящиеся в очагах инфекции, вызывают образование специфических антител и как следствие, сенсибилизацию организма. При вторичном инфицировании человека тем же видом микроорганизма возникают более выраженные симптомы воспалительной реакции.
6. Аутоиммунный механизм.
В крови человека появляются цитотоксины (антигены тканевого происхождения), которые образуются вследствие повреждения тканей и распада белка. Цитотоксины, являясь аутоантигенами, также изменяют чувствительность организма человека и вызывают его сенсибилизацию и хронизацию воспалительного процесса.
Воспалительные процессы, локализующиеся в челюстно-лицевой области, сопровождаются эндогенной интоксикацией, которая связана с поступлением в кровь эндотоксинов лизосомального происхождения, продуктов распада тканей, токсинов микроорганизмов и других токсических продуктов, которые образуются в самом организме в результате нарушений жизненных функций.
Клинические симптомы эндогенной интоксикации могут быть вариабельны, они зависят от иммунологической реактивности организма человека.
К субъективным проявлениям хронической стоматогенной интоксикации относятся головная боль, головокружение, быстрая утомляемость, чувство тяжести в голове, общая слабость, дрожание рук, потливость, плохой сон.
К объективным проявлениям относятся субфебрильная лихорадка, лимфаденит в области подчелюстных и подбородочных лимфатических узлов, изменения в картине крови. Отмечается лабильность лейкоцитарной формулы (лимфо- и моноцитоз, лейкопения, эозинофилия). Уменьшается количество гемоглобина и снижается количество эритроцитов (вторичная анемия). СОЭ возрастает до 40 мм/ч и более. Отмечаются сдвиги в белковых фракциях крови за счет увеличения процента глобулинов [1].
Для определения нарушений капиллярного кровообращения в очаге воспаления были предложены: 1) методика капилляроскопии;
2) гистаминовая проба;
4) проба на конгорот;
5) определение чувствительности к адреналину;
6) вакцинодиагностика и некоторые другие.
Наиболее доступным методом является гистаминовая проба. Ее проводят в виде гистаминового подслизистого теста, для этого в слизистую оболочку десны в области предполагаемого хронического одонтогенного очага вводят 0,3—0,5 мл гистамина (1: 1000). Через 1 - 2 ч в области пораженного периодонтитом зуба появляются самопроизвольные боли, а также положительная перкуторная реакция (боли при накусывании).
Более практичным методом является конъюнктивальная гистаминовая проба, для ее проведения в конъюнктивальный мешок закапывают 1 - 2 капли гистамина в разведении 1: 100 000 или 1 :500 000 [1]. При наличии в челюстно-лицевой области очагов хронической интоксикации уже через 1 мин появляется расширение капилляров и покраснение слизистой оболочки глазного яблока и века. Реакция не сопровождается неприятными ощущениями и исчезает через 10 мин.
Однако, по мнению многих авторов, чувствительность этой пробы недостаточна высока, так как положительная реакция может наблюдаться у лиц с аллергическими заболеваниями.
Более точным способом является электротест. Методика проведения заключается в том, что пассивный электрод от аппарата постоянного тока больной удерживает в руке, а активным электродом в виде кисточки, смоченной в изотоническом растворе хлорида натрия, проводят по обследуемому участку кожи в течение нескольких секунд. Сила тока при проведении исследования доводят до 15 мА, а напряжение в пределах 15—25 В. При наличии очага на коже лица появляется реакция в виде покраснения с одновременным покалыванием в области проекции больного зуба [1,2].
Лечение при стоматогенных очагах инфекции и интоксикации оно должно быть строго индивидуально. Больной с подозрением на ротовую интоксикацию должен быть детально обследован в условиях стационара.
Выявление одонтогенных очагов производится по следующей схеме:
1) клинически выявляют все зубы с некротизированной пульпой и находящиеся под искусственными коронками;
2) производят рентгенологическое обследование всех корней и каждого в отдельности зуба, подозреваемого на первичный инфекционный очаг;
3) выявляют десневые и пародонтальные карманы, особенно те, которые вызывают обострение воспалительного процесса;
4) исследуют регионарные лимфатические узлы (подбородочные, подчелюстные, шейные);
5) производят анализ крови;
6) делают гистаминовую пробу, электротест и т. д.
На первом этапе стоматологической санации проводят хирургическое удаление инфекционных околозубных очагов воспаления. Стоматологическое вмешательство должно сочетаться с лечением основного заболевания. Клинические проявления обострений ликвидируются уже на 3—4-й день после хирургического удаления стоматогенных очагов инфекции, а восстановление биохимических показателей наблюдается через 1,5—2 недели [2].
На втором этапе санации проводят консервативное лечение кариеса зубов, а также болезней пародонта, хронических заболеваний слизистой оболочки рта.
В качестве профилактики хронической стоматогенной интоксикации служит плановая санация полости рта как у организованного населения (в детских садах, школах, на промышленных предприятиях), так и у всех лиц, обратившихся за стоматологической помощью. Необходимо 2 раза в год проводить профилактические осмотры, которые позволяют выявить новые инфекционные локальные очаги хронической инфекции и интоксикации организма и своевременно провести их консервативное или хирургическое лечение.
ОДОНТОГЕННАЯ ХРОНИЧЕСКАЯ ИНФЕКЦИЯ И ИНТОКСИКАЦИЯ (ХРОНИОСЕПСИС)
При хрониосепсисе между макро- и микроорганизмом как бы устанавливается нестойкое равновесие, которое может тянуться годами, и лишь под влиянием внешних или внутренних воздействий возникает обострение септического состояния.
Влияние заболеваний зубов на состояние внутренних органов было отмечено еще египетскими врачами (VII век до н. э.). У Гиппократа (V век) имеются указания на необходимость оздоровления полости рта при заболеваниях суставов. В дальнейшем многие авторы на протяжении многих десятилетий приводили факты излечения некоторых заболеваний внутренних органов после удаления больных зубов. В начале XX столетия американские авторы сформулировали, доктрину ротового сепсиса, по которой каждый депульпированный зуб, корневые гранулемы, воспаленные миндалины и т. д. расценивались как несомненные первичные очаги инфекции, способные вызвать образование в организме вторичных очагов путем механического переноса бактерий. Основные положения Rosenow — одного из авторов этой теории — заключались в способности бактерий стрепто-стафилококковой группы переходить друг в друга с изменением вирулентности. Кроме того, данным автором был установлен феномен избирательной локализации бактерий, по которому патогенные микроорганизмы способны поражать лишь те органы и ткани, по отношению к которым они обладают сродством.
В целях подтверждения теории ротового сепсиса проводились и экспериментальные наблюдения над животными [Гунтер В., 1918]. Однако, как правило, удавалось получить острый, а не хронический септический процесс. Американские ученые игнорировали и тот факт, что массовое удаление зубов с некротизированной пульпой, как правило, не приводило к благоприятному исходу с ликвидацией основного заболевания.
Американская теория ротового сепсиса была подвергнута серьезной критике учеными многих стран, в том числе и стоматологами Советского Союза. В 20-е годы текущего столетия появились работы отечественных ученых — Я. С. Пеккер, С. С. Стериопуло и др. В докладе на II Одонтологическом съезде в 1925 г. С. С. Стериопуло подтвердил патогенетическую роль хронических инфекционных очагов в зубах. Скрытые очаги инфекции, по его мнению, способны вызывать в организме человека различные заболевания токсического, септического или септикопиемического характера. Однако этот автор поставил под сомнение упрощенный механизм поступления бактерий из одонтогенных очагов в другие органы. Рядом дальнейших исследований Μ. М. Приселкова и соавт. (1933), И. Г. Луком-ского (1933), Д. А. Энтина (1938) и др. не только оказалась развенчанной бактериогенная концепция американских и-английских авторов, но и обоснованы собственные представления о механизме возможного влияния стоматогенных локальных очагов. При этом в основу было положено учение об иммунитете, роли нервной системы, явлении первичной сенсибилизации организма и т. д. Не отрицая возможности возникновения в некоторых случаях очагов ротового сепсиса, тем не менее отечественные авторы своими экспериментами и клиническими наблюдениями отвергли такую большую его распространенность (в том числе одонтогенного сепсиса). Феномен избирательной локализации бактерий как основы доктрины очаговой инфекции не получил достоверного подтверждения в работах отечественных стоматологов, как и данные об обязательной бактериемии при наличии хронических очагов в полости рта. Д. А. Энтин, основываясь на фундаментальных работах А. Д. Сперанского о роли нервно-трофических механизмов в генезе ряда потологических процессов макроорганизма, обосновал свою концепцию патогенеза одонтогенного ротового сепсиса. По Д. А. Энтину, в патогенезе очагового сепсиса ведущую роль следует отводить не инфекционному фактору, а нервно-дистрофическому процессу, возникающему в результате локального раздражения нервных элементов этого первичного очага. Последствием раздражения и интоксикации нервных центров является развитие на периферии какого-либо хронического заболевания, что подтверждается сдвигами в периферическом составе крови, количественным изменением ее белков и другими признаками сенсибилизации организма.
Аллергологический механизм одонтогенного сепсиса обосновал своими экспериментальными работами отечественный микробиолог Μ. М. Приселков (1933). Путем введения в пульпу кроликов и собак непатогенных для них молочнокислых стрептококков он добивался образования в организме этих экспериментальных животных специфических антител, что сопровождалось изменением отдельных участков кожи, заболеванием суставов, почек и сердца. Удаление искусственно созданного инфекционного очага у собак и кроликов изменяло течение патологического процесса. Следует отметить тот факт, что удаление первичного очага не всегда приводило к излечению, так как, видимо, оставались вторичные очаги, вырабатывающие такие же или подобные аллергены. Большую частоту поражения сердца и почек при экспериментальной инфекции пытались обосновать особенностями их васкуляризации и большим контактом этих органов с антигеном.
По современным представлениям, в патогенезе хронической стоматогенной интоксикации ведущая роль отводится аллергическому состоянию, которое неизбежно возникает при хронической стрепто-стафилококковой инфекции. По данным Л. Н. Ребреевой (1962), в очагах одонтогенного воспаления стафилококки обнаруживаются в большом проценте случаев. В дальнейшем отечественными и зарубежными учеными были разработаны методы диагностики одонтогенных очагов, а также описана клиническая картина хронической инфекции и интоксикации. Каковы же анатомические и патофизиологические предпосылки к развитию хронических воспалительных очагов в тканях полости рта? Полость рта является началом пищеварительного тракта и отчасти дыхательных путей и потому представляет собой ворота для поступления в организм массы разнообразных микробов. Бактериальная флора полости рта разнообразна и богата. Способствует этому анатомо-физиологическая специфика мягких и твердых тканей полости рта: 1) большое количество ретенционных мест, где могут задерживаться как сами микроорганизмы, так и пища — питательная среда для бактерий; 2) влага; 3) благоприятная температурная среда.
Ретенционными пунктами являются складки и другие естественные углубления на эмали коронки зуба, кариозные полости, десневые и пародонтальные карманы, отложения мягкого зубного налета и твердого зубного камня и т. д. В 1 мм3 зубного налета содержится до 12 млн. стрептококков.
Бактерицидность слюны и нормальной слизистой оболочки действует на микрофлору и удерживает ее в состоянии пониженной вирулентности, однако этот иммунитет не является абсолютным. Во время приема пищи проглатывается масса микробов; при этом количество их во рту понижается на 30—50%,. но через 30 мин снова достигает первоначального уровня.
Вирулентность стрептококка, попавшего в корневой канал, меняется в зависимости от реактивности местных тканей и всего организма. Искривленные узкие корни и ответвления корневой пульпы часто недоступны для терапевтического вмешательства при лечении пульпита и периодонтита. В этих участках инфицированная ткань пульпы может сохраняться годами. Через живую ткань пульпы микробы не проникают, так как она обладает мощной ретикулоэндотелиальной системой. Микрофлора воспаленной пульпы непостоянна: в зависимости от стадии воспаления в ней можно обнаружить представителей как коккового, так и фузоспириллярного симбиоза. При распаде пульпы образуется большое количество птомаинов, которые отличаются высокой токсичностью. После удаления омертвевшей пульпы (под влиянием мышьяковистых препаратов) в периодонте иногда образуется рваная рана, вяло гранулирующая. Если оставшаяся культя пульпы зуба не инфицирована, она может сохранить жизнеспособность, что имеет важное значение в профилактике воспалений периодонта. Клиническое благополучие в случае неполного пломбирования канала зуба является относительным: оно может быть нарушено и зависит от реактивности организма, состояния культи корневой пульпы.
Нервная, сосудистая и лимфатическая сеть периодонта очень богата, что способствует связи его с костным мозгом альвеолярного отростка и тела челюсти. Обильная сеть сосудов обеспечивает большую всасываемость инфекционного и токсического материала из периодонта.
Хронический гингивит, пародонтит, а также пародонтоз (их локальная и особенно генерализованная форма) в развившихся стадиях также могут оказаться хроническими локальными очагами интоксикации, как и очаги хронического верхушечного периодонтита. Микрофлора, гнездящаяся в десневых и пародонтальных карманах и в грануляционной ткани, находит при указанных заболеваниях оптимальные условия для своего существования и развития.
Нередко после лечения зубов у пациентов возникают одонтогенные инфекции. Что это такое? После неудачной терапии кариеса, пародонтита или пульпита бактерии могут попасть в другие органы и вызвать воспалительный процесс. Это отмечается и при запущенных стадиях стоматологических заболеваний, если больной не обращается к врачу и не занимается лечением. Такие патологии довольно опасны и в тяжелых случаях могут стать причиной заражения крови - сепсиса.
Классификация
Выделяют несколько видов бактериальных заболеваний, первопричиной которых становится попадание микробов в полость зуба:
- В первую группу входят истинно одонтогенные инфекции. Что это такое? К этому виду патологий относятся воспаления, развивающиеся непосредственно в полости зуба. К ним относится кариес и пульпит.
- Во вторую группу входят болезни, развивающиеся в близлежащих тканях: полости рта и периодонте. К таким патологиям относится гингивит, стоматит, периодонтит.
- В третью группу входят болезни горла и придаточных пазух носа, а также тканей шеи, лимфоузлов, мозга и костей. Воспалительный процесс образуется в довольно отдаленных органах. В этих случаях бывает очень трудно определить этиологию одонтогенных инфекций. Пути распространения бактерий проходят по лимфатическим и кровеносным сосудам. Вместе с током крови или лимфы инфекция попадает в другие органы и вызывает воспаление.
Причины
В больном зубе образуется первичный одонтогенный очаг инфекции. Возникает местное воспаление. Это является причиной таких болезней, как кариес, пульпит, пародонтит.
Если пациент откладывает визит к стоматологу, то инфекция распространяется на близлежащие ткани. Также бактерии могут попасть через кровь и лимфу в отдаленные органы. Чаще всего причиной хронических и острых одонтогенных инфекций являются запущенные болезни зубов.

Воспаления в различных органах могут развиться и при некачественном лечении зубов. Неудачно проведенное пломбирование или удаление больного зуба может спровоцировать инфекционный процесс в других тканях. В этом случае врачам бывает очень сложно определить этиологию болезни. Необходимо тщательно изучать анамнез пациента, чтобы выявить все перенесенные стоматологические процедуры.
Группы риска
Острые и хронические одонтогенные инфекции чаще всего развиваются у больных со сниженным иммунитетом. В группу риска входят следующие категории пациентов:
- дети;
- люди старше 60 лет;
- больные со злокачественными опухолями (особенно после химиотерапии);
- пациенты, принимающие цитостатики и кортикостероиды (эти препараты снижают иммунитет);
- люди с тяжелыми внутренними болезнями (сахарным диабетом, патологиями печени, почек и сердца);
- больные с гепатитом и ВИЧ-инфекцией.
Всем вышеперечисленным группам больных необходимо своевременно посещать стоматолога. Запускать болезни зубов при сниженном иммунитете очень опасно.
Возбудители
Врачи нередко сталкиваются с высокой устойчивостью возбудителей одонтогенных инфекций. Что это такое? Со временем бактерии вырабатывают невосприимчивость к многим видам антибиотиков. Это создает большие трудности при лечении таких заболеваний. Поэтому очень важно назначить наиболее эффективный антибактериальный препарат. Обычно в терапии используют антибиотики, воздействующие на широкий круг бактерий.
Чаще всего возбудителями патологий одонтогенного происхождения являются следующие бактерии:
- стрептококки;
- золотистый стафилококк;
- пневмококки;
- фузобактерии;
- энтеробактерии.
Кроме этого, одонтогенные воспаления могут быть вызваны грибковыми микроорганизмами (актиномицетами) или простейшими. В этом случае возникает тяжелое поражение лимфоузлов.
Чаще всего отмечается комбинированное происхождение одонтогенных инфекций. Что это такое? Воспалительный процесс может быть вызван не одним микроорганизмом, а сразу несколькими. Ведь, как известно, в полости рта обитает большое количество бактерий. В большинстве своем они являются условно-патогенными, они приводят к воспалению только при сильном снижении иммунитета.

Возможные заболевания
К возникновению одонтогенных инфекций обычно приводят нагноения в полости рта. Например, если в результате нелеченного кариеса у пациента возникает флюс (нагноение надкостницы), то такая патология очень часто приводит к появлению вторичных очагов воспаления. У пациентов могут диагностироваться следующие заболевания:
- флегмона тканей лица и шеи;
- воспаление мягких тканей дна ротовой полости (ангина Людвига);
- менингоэнцефалит;
- тромбофлебит лицевых сосудов;
- гнойное воспаление лимфоузлов;
- медиастинит (воспаление средостения);
- остеомиелит костей;
- гайморит.

Самым тяжелым осложнением зубных инфекций является сепсис. При этом заболевании бактерии постоянно циркулируют в кровотоке, поражая разные органы. Одонтогенный сепсис нередко становится причиной летального исхода.
Симптоматика
Симптоматика одонтогенных инфекций может быть разнообразной. Клинические проявления зависят от разновидности патологии. Однако можно выделить общие признаки таких заболеваний:
- Лихорадка. При тяжелых гнойных воспалениях температура может повышаться до +40 градусов.
- Общая интоксикация организма. У пациента резко ухудшается самочувствие. возникает озноб, недомогание, ломота в суставах, головная боль.
- Болевой синдром. Возникает боль в пораженной области, при скоплении гноя появляется ощущение пульсации.
- Отек. Пораженная область припухает и краснеет.

Признаки воспалительной реакции в других органах нередко сопровождаются усилением боли в причинном зубе. Отмечается покраснение и припухлость десен, окружающих зубную ткань.
Если воспаление локализуется в области горла или полости рта, то у пациента нередко отекает язык и гортань. Человеку становится трудно говорить и дышать. Такая клиническая картина наблюдается, например, при ангине Людвига.
Диагностика
Как уже упоминалось, одонтогенные заболевания бывает сложно диагностировать. Поэтому врачу необходимо обращать внимание на состояние зубов больного. Нужно также тщательно изучать медицинскую карту пациента. Это поможет установить: проходил ли пациент стоматологическое лечение в недавнем прошлом.
Пациенту назначают клинические исследования крови и мочи. По анализам можно установить наличие воспаления. При инфекциях одонтогенного происхождения у больных увеличиваются показатели лейкоцитов и СОЭ.
Дополнительно проводят УЗИ и МРТ очага воспаления. Эти исследования особенно полезны при диагностике воспалительных процессов в области средостения. Такая патология практически незаметна при внешнем осмотре и пальпации.
Очень важно провести анализы на бактериологический посев. При этом важно не только выявить возбудителя, но и определить его чувствительность к антибактериальным лекарствам. Это поможет подобрать наиболее эффективный антибиотик.
Лечение
Лечение одонтогенных инфекций начинают с санации полости рта. Необходимо провести терапию первичного очага инфекции. Причинный зуб удаляют или пломбируют.
Затем проводят санацию вторичных гнойных полостей в других органах. Под анестезией проводят вскрытие абсцесса или флегмоны. В настоящее время такие операции делают эндоскопическим путем под ультразвуковым контролем. После надреза абсцесса гной удаляют, а воспаленную полость промывают асептическими растворами. При необходимости устанавливают дренажи для выведения экссудата.
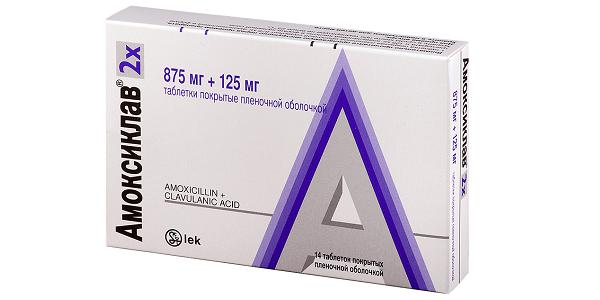
После хирургического вмешательства приступают к антибактериальной терапии одонтогенных инфекций. Антибиотики назначают после получения результатов исследования биоматериала на бакпосев.Чаще всего назначают следующие препараты:
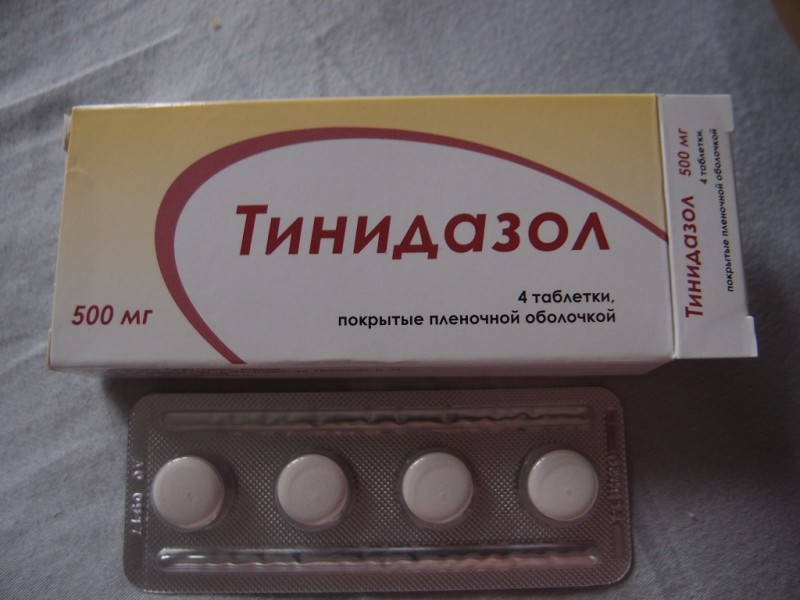
Эти антибиотики способны воздействовать на различные виды микроорганизмов. При необходимости в схему лечения включают антипротозойные препараты: "Трихопол", "Тинидазол", "Ко-тримаксазол". Они эффективны при воспалениях, вызванных простейшими и грибками.
Профилактика
Как предотвратить развитие одонтогенных инфекций? Необходимо вовремя проводить качественное лечение зубных патологий. Даже при небольшой боли в зубах нужно незамедлительно обращаться к стоматологу. Также нужно не менее 1 раза в год проходить профилактические осмотры полости рта.
При склонности к кариесу и пульпиту нужно регулярно очищать зубы от остатков еды. Зубную щетку следует заменять не реже 1 раза в месяц, иначе на ней могут скопиться бактерии.
Важно помнить, что порой даже небольшой кариес может привести к таким тяжелым осложнениям, как заражение крови и менингоэнцефалит. Ведь зубы находятся в непосредственной близости от головного мозга.
Читайте также:


