Донатор сульфгидрильных групп при отравлении тяжелыми металлами
ВЕРОФАРМ ОАО
ВЕРОФАРМ, ОАО
Форма выпуска, состав и упаковка
| 1 капс. | |
| димеркапрол (унитиол) | 250 мг |
2 шт. - упаковки ячейковые контурные (1) - пачки картонные.
4 шт. - упаковки ячейковые контурные (1) - пачки картонные.
10 шт. - банки темного стекла (1) - пачки картонные.
Клинико-фармакологическая группа: Донатор сульфгидрильных (тиоловых) групп
Антидот, донатор сульфгидрильных (тиоловых) групп. Оказывает дезинтоксикационное действие (в т.ч. по отношению к продуктам полураспада этанола).
Механизм действия препарата состоит в том, что за счет наличия сульфгидрильных групп унитиол образует водорастворимые нетоксичные комплексы с блокаторами тиоловых групп ферментов (тиоловыми ядами, находящимися в крови и тканях, продуктами распада этанола), ускоряя их выведение из организма. Прочное связывание с блокаторами сульфгидрильных групп и быстрое выведение образующихся комплексов предупреждает связывание тиоловых групп ферментов, способствует восстановлению их активности и приводит к уменьшению и полному устранению симптомов отравления.
Препарат увеличивает выведение некоторых катионов (особенно меди и цинка) из металлосодержащих ферментов клеток.
У больных диабетической полиневропатией способствует уменьшению болевого синдрома, улучшению функции периферической нервной системы, нормализации проницаемости капилляров.
После приема внутрь Cmax в плазме достигается через 1.5 ч и находится в пределах 90-140 мкг/мл (в среднем - 114.62±7.53 мкг/мл).
Среднее время удержания препарата в организме составляет 9-11 ч (в среднем - 10.16±0.39 ч). Кажущийся Vd - 166.5 мл/кг.
T1/2 составляет 7.5±0.46 ч. Препарат не накапливается в организме.
—алкогольный абстинентный синдром;
—хронический алкоголизм (в составе комплексной терапии);
—острые и хронические отравления органическими и неорганическими соединениями мышьяка, ртути, золота, хрома, кадмия, кобальта, меди, цинка, никеля, висмута, сурьмы;
—интоксикация сердечными гликозидами;
Капсулы принимают внутрь, за 30 мин до еды, запивая небольшим количеством воды.
При алкогольном абстинентном синдроме, отравлениях соединениями мышьяка и солями тяжелых металлов назначают по 250-500 мг(1-2 капс.)/сут, при необходимости дозу можно увеличить до 750 мг(3 капс.)/сут. Суточную дозу следует разделить на несколько приемов. Лечение следует проводить до прекращения симптомов интоксикации.
При хроническом алкоголизме назначают по 500 мг(2 капс.) 2 раза/сут в составе курсовой комплексной терапии.
При диабетической полиневропатии назначают по 1 капс./сут в течение 10 дней.
Возможно: тошнота, головокружение, тахикардия, бледность кожных покровов (при длительном применении в высоких дозах).
—тяжелые заболевания гепатобилиарной системы;
—повышенная чувствительность к компонентам препарата.
Применение при беременности и кормлении грудью
Данные о возможности применения препарата при беременности и в период лактации не предоставлены.
Применение при нарушениях функции печени
Противопоказан при тяжелых заболеваниях гепатобилиарной системы.
При лечении острых отравлений следует проводить дополнительные лечебные мероприятия (промывание желудка, оксигенотерапия, введение растворов декстрозы).
Проявления передозировки могут появиться при превышении рекомендуемой дозы более чем в 10 раз.
Симптомы: одышка, гиперкинезы, заторможенность, вялость, оглушенность, кратковременные судороги.
Лечение: промывание желудка, назначение активированного угля, слабительных препаратов, симптоматическая терапия.
Несовместим с препаратами, содержащими соли тяжелых металлов, а также с щелочами (быстро разлагается).
Условия и сроки хранения
Список Б. Препарат следует хранить в сухом, защищенном от света месте при температуре не выше 25°C. Срок годности - 2 года.
Условия отпуска из аптек
Препарат разрешен к применению в качестве средства безрецептурного отпуска.
Для понимания механизмов действия тиоловых ядов необходимо вначале рассмотреть химические свойства сульфгидрильной (-SH) группы цистеина, дисульфидной (-S-S-) группы цистина и тиоэфирной (-S-CH3) группы метионина, а также данные о роли серосодержащих групп в ферментах и других биологически активных белках.
Участие этих групп в ферментативном катализе и связывании субстратов и кофакторов (ионов металлов и коферментов) нередко определяет спектр изменений в организме при поступлении тиоловых реагентов, в том числе арсенита и тяжелых металлов.
В отличие от реакций алкилирования реакции меркаптидирования носят обратимый характер, но равновесие смещено в сторону образования слабодиссоциирующих меркаптидов. Ионы металлов легко реагируют как с RS-ионами, так и с недиссоциированными SH-группами. Одновалентные катионы серебра, меди, золота и двухвалентные катионы ртути, свинца, кадмия и цинка, а также соединения трехвалентного мышьяка и сурьмы обладают особенно высоким сродством к SH-группам. Старое название тиолов "меркаптаны" происходит от латинского "mercurio aptum" — соединенный с ртутью. Сродство ионов двухвалентных металлов к SH-группам уменьшается в такой последовательности: Hg2+>Pb2+>Cd2+>Zn2+. Однако если ионы ртути блокируют сульфгидрильные группы белков, цистеина, унитио-ла, гемоглобина и небелковых гемолизатов эритроцитов, то не отмечалось, например, блокирования тиоловых групп унитиола ионами кадмия, олова и свинца. В то же время ионы кадмия и свинца блокировали SH-группы цистеина на 27 и 50 % соответственно.

Существенные различия выявлены в степени связывания ионов тяжелых металлов с SH-группами гемоглобина. Подобные результаты получены также на гемолизатах эритроцитов. Так, ионы ртути блокировали их на 100%, ионы свинца — на 18%, ионы кадмия — на 11%, а ионы олова вообще не вступали в реакцию с сульфгидрильными группами данного белка. В связи с тем что SH-группы в белках обязаны своему наличию остаткам цистеина, это обстоятельство служит подтверждением того факта, что реакционная способность SH-групп во многом зависит от структуры соединения, в которое они входят, о чем свидетельствуют многочисленные экспериментальные исследования.
Так, на основании сравнения данных амперометрического титрования и реакции с нитратом серебра было показано, что между серебром и кадмием в организме существуют конкурентные взаимоотношения, что связано с различной прочностью соединений типа металл— сера при взаимодействии тяжелых металлов с тиоловыми соединениями. С аминотиолами и дитиолами ионы этих металлов образуют также более прочные комплексы, чем с монотиолами. Логарифмы констант стабильности комплексов Zn2+ с тиолами и ЭДТА составляют для меркаптоэтанола 5,9, меркаптоэтиламина и цистеина — 9,9, дитиотреитола — 10,3, димеркаптопропанола — 13,5, для ЭДТА — 16,4. Данный показатель учитывают при разработке системы лечебно-профилактических мероприятий, в том числе реагентов, прочно соединяющихся с тяжелыми металлами. Уже в 1953 г. Е.С.Баррон упоминает 17 реагентов на SH-группы и 42 тиоловых фермента. Представители всех классов ферментов, почти все известные дегидрогеназы, ферменты обмена аминокислот, углеводов и жиров, биосинтеза белков ингибируются реагентами на SH-группы.
Показана роль этих групп в мышечном сокращении, окислительном фосфорилировании, нервной деятельности, делении клеток, действии отравляющих веществ и радиации.
Влияние тиоловых реагентов на упомянутые физиологические функции обусловлено блокированием SH-групп ферментов и других белков, а также низкомолекулярных, функционально важных тиолов, выполняющих роль кофакторов или простатических групп в различных ферментных системах.
В ферментативных реакциях участвуют и другие функциональные группы белков: имидазольная группа гистидина, гидроксильная — серина, е-аминогруппы лизина, со -карбоксильные группы аспарагиновой и глутаминовой кислот, фенольная группа тирозина и др. Однако SH-группы отличаются исключительно высокой реакционной способностью и многообразием химических реакций. Они вступают в реакции алкилирования, ацилирования, окисления, тиолдисульфидного обмена, реакции с сульфенилгалоидами, образования меркаптидов, полумеркапталий, меркаптолов, комплексов с переносом заряда и др.
Большинство реагентов на различные функциональные группы белка наиболее быстро реагируют со свободными SH-группами. Во многих из этих реакций SH-группы принимают участие в форме меркаптидного иона. Он реагирует с а- и р-ненасыщенными соединениями (например, акрилонитрилом) в 280 раз быстрее, чем непротонированная аминогруппа. Скорость реакции с 2,4-динитрофторбензолом у SH-группы цистеина в 90 раз выше, чем у фенольного гидроксила; в 160 раз выше, чем у аминогрупп, и в 1600 раз выше, чем у имидазола. Меркаптидные группы, таким образом, — более сильные нуклеофилы, чем другие группы белка. Сильная нуклеофильность меркаптидных ионов обусловлена главным образом высокой поляризуемостью относительно большого атома серы. Атом серы метионина образует координационную связь с ионом ртути. Тиоэфирная группа метионина алкилируется бромбензилом в 50 раз быстрее, чем неионизированная SH-группа, и в 33 раза быстрее, чем нейтральная имидазольная группа гистидина или индольное кольцо триптофана. Лишь меркаптидный ион превосходит ее по нуклеофильной реакционноспособности.
Тиоэфирные и дисульфидные группы вступают не в столь разнообразные реакции, как SH-группа. Устойчивость -S-S-связей при физиологических значениях рН хорошо соответствует их основной функции — участию стабилизации макромолекулярной структуры белков. Дисульфидные группы в активных центрах окислительных ферментов подвергаются обратимому превращению в SH-группы при взаимодействии с субстратами и участвуют в кататической реакции.
Помощь при отравлении металлами направлена на то, чтобы ограничить, затруднить дальнейшее всасывание их в кровь (из желудочно-кишечного тракта или других областей организма) и на борьбу с всосавшимся металлом.
В организме человека обнаруживаются многие металлы. Ряд из них выполняет при этом важные биологические функции. Всосавшись, металлы либо откладываются в тканях, либо находятся в крови в ионном, или в связанном, состоянии (с белками или форменными элементами крови).
При длительном контакте, особенно в производственных условиях, металлы накапливаются в организме, что вызывает токсические явления.
Помощь при отравлении тяжелыми металлами осуществляется на основе двух методов. Во-первых, применяются вещества (сульфиды), которые переводят ионы металла в труднорастворимые соединения, но последние обладают способностью усиленно откладываться в тканях.
При таком способе лечения терапевтический эффект носит временный характер, так как при известных условиях (изменения кислотно-щелочного равновесия) возможен переход металла в растворимое состояние, благодаря чему симптомы отравления вновь обостряются.
Второй метод более рационален. Он основан на том, что используются вещества, способствующие обезвреживанию и выведению металла из организма. Однако до последнего времени этот метод не находил широкого применения из-за отсутствия достаточно эффективных средств.
Помимо малой эффективности препаратов, их применение ограничивалось также возникновением в процессе лечения острых вспышек отравлений металлами.
Однако поиски эффективных средств с подобным механизмом действия диктуются тем обстоятельством, что с каждым годом увеличивается число людей, контактирующих с радиоактивными изотопами. Ускорение выведения излучателей из организма является важным моментом в профилактике лучевой болезни. За последнее время испытан ряд препаратов, получивших название комплексонов, образующих с металлами устойчивые хорошо растворимые внутрикомплексные соединения, в которых металл целиком деионизирован. Из числа подобных препаратов широкое применение нашли азотсодержащие поликарбоксильные кислоты; из них наибольшее практическое значение имеют этилендиаминтетрауксусная кислота (ЭДТА) и ее соли.
ЭДТА — белый кристаллический порошок, нерастворимый в воде, спирте и эфире, но растворимый в щелочах. Она имеет следующее строение:
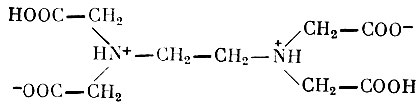
ЭДТА
При титровании NaOH сначала связываются 2 атома водорода от двух карбоксильных групп, а затем от двух аминогрупп. При этом образуются двух-, трех- и четырехнатриевые соли ЭДТА, хорошо растворимые в воде; рН растворов составляет соответственно 5,0; 7,3; 10,5. При добавлении к раствору натриевой соли ЭДТА металлов образуются хорошо растворимые комплексные соединения (клешневидные, или хелатные, соединения), отличающиеся стойкостью в широком диапазоне рН. Металл, находясь в составе комплекса, утрачивает способность откладываться в тканях и легко выделяется почками. Наиболее интенсивно выделяется из организма под влиянием ЭДТА свинец, в меньшей степени — иттрий, церий, плутоний. На выведение стронция ЭДТА влияния не оказывает.
Токсичные металлы проникают в организм преимущественно через желудочно-кишечный тракт и через легкие, частично через кожу. Поступая в кровь, ионы металла довольно быстро покидают кровяное русло, откладываясь главным образом в костях и других органах и тканях. Этот процесс идет до известного предела, пока не установится равновесие между концентрациями металла в крови и в тканях. Выведение металла через почки или другими путями нарушает это динамическое равновесие, в результате чего новые порции металла поступают из органов в общий ток крови. Комплексен ускоряет этот процесс, так как он образует с ионом металла комплексы; при этом металл теряет свой заряд и становится биологически неактивным. Образовавшийся комплекс (из металла и комплексона) отличается малым молекулярным весом и хорошей растворимостью, благодаря чему легко выделяется через почки. Комплексон переводит также труднорастворимые соединения (гидроокиси, фосфаты) в растворимые.
ЭДТА оказывает положительный терапетический эффект как в ранних, так и в поздних стадиях отравления различными металлами. Имеются сообщения, что ЭДТА способствует растворению почечных камней, если в их составе имеется кальций.
При парентеральном введении ЭДТА очень быстро распространяется по всему организму, за исключением спинномозговой жидкости, где ЭДТА обнаруживается в количествах в 20 раз меньших, чем в крови. Выводится препарат почками. Половина введенного количества выводится примерно за 1—1,5 часа. Полностью выведение заканчивается за 5—6 часов.
Из желудочно-кишечного тракта ЭДТА всасывается с трудом (до 5%), через кожные покровы не проникает. Наиболее рациональным является внутривенный метод введения препарата.
С увеличением дозы ЭДТА терапевтический эффект усиливается, но не беспредельно. Такое нарастание эффективности наблюдается при введении ЭДТА в дозах, не превышающих 24 мг на 1 кг веса.
В медицинской практике находит применение калыщй-динатриевая соль этилендиамин-тетра-уксусной кислоты. В организме это соединение способно обменивать имеющийся в его молекуле кальций на ионы металла. Образующийся при этом комплекс выделяется почками.
Препарат рекомендуется при острых и хронических отравлениях тяжелыми и редкоземельными металлами и противопоказан при заболеваниях печени и почек.
В последнее время с большим вниманием изучается вопрос о функциональной роли в организме сульфгидрильных или тиоловых групп (—SH) ферментных белков. Многочисленными исследованиями показано, что сульфгидрильные группы белков играют существенную роль в проявлении активности многих ферментов, с помощью которых обеспечивается нормальное течение углеводного, белкового и жирового обмена. Вещества, содержащие сульфгидрильные группы, принимают участие во многих процессах, протекающих в организме (передача нервного возбуждения, условнорефлекторная деятельность, мышечное сокращение, клеточное деление и т. д.).
Действие многих факторов на организм в настоящее время объясняется с точки зрения их влияния на тиоловые группы белков. Их них особое значение имеют тиоловые яды, обладающие способностью блокировать ферментные системы. К ним относятся соединения мышьяка и тяжелые металлы. Побочное действие некоторых антибиотиков (стрептомицин) также объясняется подавлением функциональной активности соединений, содержащих — SH. Аналогичные процессы, т. е. блокада сульфгидрильных групп, имеют место и при воздействии на организм радиоактивных веществ.
После того как была выяснена роль групп — SH в токсическом действии многих веществ, были предприняты попытки синтезировать вещества (тиолы), имеющие в своей молекуле активные сульфгидрильные группы. При введении их в организм они образуют в организме с тиоловыми ядами стойкие и малотоксичные соединения.
Одним из первых препаратов этого типа был синтезированный в Англии 2,3-димеркаптопропанол, или дитиоглицерин. В литературе этот препарат часто называют БАЛ (Британский антилюизит).
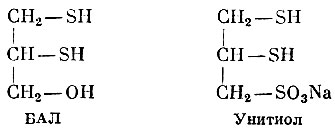
БАЛ, Унитиол
БАЛ оказывает профилактический и терапевтический эффект при отравлении соединениями мышьяка (в частности, при поражении слизистых оболочек и кожи люизитом, при побочных явлениях, возникающих под влиянием новарсенола и осарсола).
Но БАЛ обладает многими отрицательными свойствами: малой терапевтической широтой, малой стойкостью, плохой растворимостью в воде.
В Советском Союзе синтезирован сходный по химическому строению и фармакологическим свойствам с БАЛ препарат, названный унитиолом. В отличие от БАЛ в его молекуле гидроксильная группа заменена сульфогруппой. Унитиол при наличии хорошо выраженных антидотных свойств менее токсичен, чем БАЛ, и лучше растворим в воде.
Унитиол применяется как антидот при отравлении соединениями мышьяка, ртути и другими тяжелыми металлами. Отмечена хорошая переносимость препарата. Полагают, что при отравлении мышьяком и тяжелыми металлами сульфгидрильные группы унитиола реагируют с циркулирующим в крови мышьяком, предотвращая его дальнейшую фиксацию в тканях. С другой стороны возможно непосредственное вытеснение мышьяка из ферментных систем.
Реакция взаимодействия мышьяка с унитиолом представляется следующим образом:
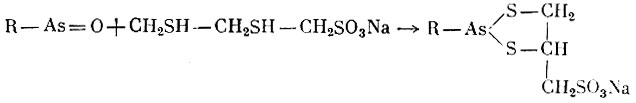
Взаимодействие мышьяка с унитиолом
Образующийся при этом циклический комплекс малотоксичен и отличается стойкостью.
При отравлениях необходимо вводить унитиол возможно быстрее. Его обычно применяют повторно в течение 3—7 дней. При необходимости промывают желудок. Лечение унитиолом отравлений, в частности ртутью, приводит к высвобождению соединений ртути из депо организма. Благодаря такому процессу в организме усиливается циркуляция токсических соединений металлов, однако, несмотря на это обстоятельство, в большинстве случаев усиления симптомов интоксикации не наблюдается. Полагают, что комплекс металл+унитиол является более прочным соединением, чем комплекс металл+ферментные белки. В процессе лечения унитиолом наблюдается усиленное выведение металлов и мышьяка преимущественно почками. Через желудочно-кишечный тракт металлы выделяются в незначительной степени. По окончании лечения унитиолом выделение металлов из организма резко падает. Имеются литературные данные о целесообразности применения унитиола в качестве защитного средства при лучевых поражениях (см. Противолучевые средства). Лечение унитиолом сопровождается иногда побочными явлениями (тошнота, головокружение, тахикардия), обычно не требующими отмены препарата. Кроме того, при отравлении металлами (особенно сулемой), а также некоторыми металлоидами (мышьяком) применяют внутрь Antidotum metallorum или противоядие от металлов. Препарат представляет собой стойкий пересыщенный щелочной раствор H2S в воде. Механизм обезвреживающего действия антидота основан на том, что он образует с металлами нерастворимое соединение, которое не всасывается. По литературным данным, 100 мл препарата достаточно для обезвреживания 4 г сулемы.
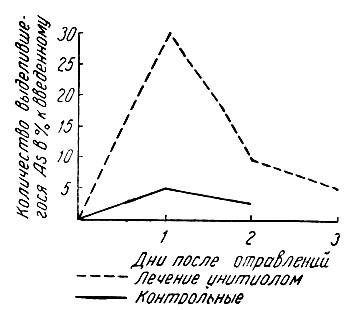
Рис.51. Выделение мышьяка у кроликов, отравленных мышьяковистым ангидридом и леченных унитиолом (по А. И. Черкесу)
Кальций-динатриевая соль этилендиамин-тетрауксусной кислоты. Белый порошок, растворимый в воде. Применяется внутривенно капельным методом в дозе 2 г в 5% растворе глюкозы или изотоническом растворе хлористого натрия. Суточная доза 4—5 г. Длительность лечения 1 месяц.
Унитиол (Unithiolum) (Б). Белый мелкокристаллический порошок, растворимый в воде. Применяется подкожно или внутримышечно из расчета по 1 мл 5% раствора на каждые 10 кг веса больного. Количество инъекций в первые дни отравления составляет 2—4. В дальнейшем число их уменьшают.
Антидот для металлов (Antidotum metallorum), ФVIII.
Прозрачная жидкость лимонно-желтого цвета с запахом сероводорода, содержащая в 1 л 3,75 г сульфата магния, 12,5 г бикарбоната натрия, 1 г едкого натра, 0,4% сероводорода. Применяется внутрь по 50—100 мл на прием при отравлении солями тяжелых металлов. Антидот выпускают в склянках по 100 и 200 мл.
СУЛЬФГИДРИЛЬНЫЕ ГРУППЫ (син.: тиоловые группы, меркапто-группы) — функциональные группы в молекулах органических соединений, в т. ч. белков, в к-рых эти группы принадлежат остаткам ци-стеина; играют существенную роль в создании и поддержании нативной структуры белков, определяющей их специфические функциональные свойства. Функции С. г. в белках (см.), в частности в ферментах (см.), весьма разнообразны. В нек-рых ферментах — папаине (см.), дегидрогеназе 3-фосфоглицеральдегида и др. они играют каталитическую роль, т. е. непосредственно участвуют в образовании промежуточных соединений в ходе катализируемой ферментом реакции. Обратимое превращение С. г. в дисульфидные группы (— S — S —) обнаружено в активных центрах нек-рых оксидоредуктаз (см.), напр, в глутатионредуктазе (КФ 1. 6. 4. 2), в липоамид-дегидрогеназе (КФ 1. 6. 4. 3), в тиоредоксинредуктазе (КФ 1. 6. 4. 5); это превращение играет важную роль в переносе электронов и протонов от субстратов к акцепторам. Во многих белках и ферментах — ферредоксине, рубредоксине, металло-тионеине, цитохроме с (см. Цитохромы), моноаминоксидазе (см.), алкогольдегидрогеназе (см.) и др. SH-группы участвуют в образовании связей между белком и ионом металла или коферментом (см. Коферменты). С. г. играют также важную роль в образовании и стабилизации нативной трехмерной структуры белков, образуя в них внутримолекулярные связи: водородные, координационные (с участием иона металла) и — S — S-связи. Последние обеспечивают жесткое скрепление либо отдельных полипептидных цепей, напр, в иммуноглобулинах (см.), либо различных участков одной и той же цепи, напр, в лизоциме (см.), пепсине (см.), папаине, альбумине сыворотки крови (см. Альбумины). Особенно велико содержание — S — S-связей в белках волос, шерсти, рогов, копыт и ногтей — кератинах (см.); — S — S-связи обнаружены также в белково-пептидных гормонах (см.) — инсулине (см.), ва-зопрессине (см.), окситоцине (см.), соматостатине (см.) и соматотропном гормоне (см.). Расщепление (напр., восстановлением) — S — S-связей в этих гормонах (за исключением соматотропного гормона) приводит к резкому снижению их биол. активности.
Нарушение ряда физиол. и биохим. процессов (напр., деления клеток, мышечного сокращения, окислительного фосфорилирования, фотосинтеза и др.) под действием тио-ловых реагентов (SH-реагентов), т. е. веществ, избирательно реагирующих с SH-группами, объясняется блокированием С. г. ферментов и других белков, а также С. г. низкомолекулярных, функционально важных тиолов — кофермента А, 4'-фосфопантотеина (см. Витамины), липоевой кислоты (см.) и глутатиона (см.), выполняющих роль кофакторов в различных ферментных системах. Успешное применение дитиолов, таких как БАЛ (2,3-димеркаптопропанол) и унитиол (2,3-димеркаптопропансульфонат натрия), при лечении отравлений, вызванных соединениями мышьяка (см.) или тяжелых металлов (см. Антидоты ОВ), объясняется способностью дитиолов деблокировать С. г.
С. г. выделяются среди других функциональных групп белков высокой реакционной способностью и многообразием хим. реакций, в к-рые они вступают. По реакционной способности в белках различают три типа С. г.: легко доступные модификации, частично замаскированные и полностью замаскированные, к-рые доступны модификации лишь после денатурации белка. Наиболее важными хим. свойствами С. г. являются: относительная легкость их окисления с образованием дисульфидной связи (— S — S-связи); образование ацилтиоэфиров при взаимодействии с ацилирующими реагентами, напр, ангидридами органических к-т; образование S-карбамильной группы при реакции с цианатом; алкилирование галоид-кислотами и соединениями с поляризованной или легко поляризующейся двойной связью, напр. N-этилимидом малеиновой к-ты; арилирование фтординитробензолом и хинонами; взаимодействие с альдегидами (см.) и кетонами (см.) с образованием полумеркапталей и полумеркаптолов; взаимодействие с ионами тяжелых металлов и ртуть-органическими соединениями с образованием слабодиссоциирующих меркаптидов; реакция с соединениями трехвалентного мышьяка с образованием моно- и дитиоарсени-тов. С. г. вступают также в реакцию тиолдисульфидного обмена: 2RS - + R'S-SR' 2R'S - + RS — SR, где R и R' — органические радикалы. В этой и в большинстве других реакций С. г. участвуют в форме меркаптидного иона RS-. На реакции тиолдисульфидного обмена между —S —S-группами кератина волос и неорганическими сульфидами (напр., сульфидом бария) основано применение последних с косметическими целями в качестве депиляториев (см. Эпиляция). Реакция обмена особенно легко протекает с ароматическими дисульфидами, напр, с 5,5'-дитиобис-(2-нитробензоатом) — реагентом Эллмана, и нередко останавливается на промежуточной стадии смешанного дисульфида:

Эта реакция, а также реакция с n-хлормеркурибензоатом наиболее широко используется для количественного спектрофотометрического определения С. г. в белках. С. г. определяют также путем амперометрического титрования р-рами нитрата серебра AgNO3 или двухлористой ртути HgCl2.
С. г. слабо ионизированы; они способны образовывать водородные связи с электроотрицательными группировками, однако значительно более слабые, чем аналогичные связи, образуемые гидроксильными группами (ОН-группами).
Библиография: Торчинский Ю. М. Сера в белках, М., 1977; Friedman М. Chemistry and biochemistry of the sulf-hydryl group in amino acids, peptides and proteins, Oxford — N. Y., 1973; Jocelyn P. C. Biochemistry of the SH group, L.— N. Y., 1972.
Для понимания механизмов действия тиоловых ядов необходимо вначале рассмотреть химические свойства сульфгидрильной (-SH) группы цистеина, дисульфидной (-S-S-) группы цистина и тиоэфирной (-S-CH3) группы метионина, а также данные о роли серосодержащих групп в ферментах и других биологически активных белках.
Участие этих групп в ферментативном катализе и связывании субстратов и кофакторов (ионов металлов и коферментов) нередко определяет спектр изменений в организме при поступлении тиоловых реагентов, в том числе арсенита и тяжелых металлов.
В отличие от реакций алкилирования реакции меркаптидирования носят обратимый характер, но равновесие смещено в сторону образования слабодиссоциирующих меркаптидов. Ионы металлов легко реагируют как с RS-ионами, так и с недиссоциированными SH-группами. Одновалентные катионы серебра, меди, золота и двухвалентные катионы ртути, свинца, кадмия и цинка, а также соединения трехвалентного мышьяка и сурьмы обладают особенно высоким сродством к SH-группам. Старое название тиолов "меркаптаны" происходит от латинского "mercurio aptum" — соединенный с ртутью. Сродство ионов двухвалентных металлов к SH-группам уменьшается в такой последовательности: Hg2+>Pb2+>Cd2+>Zn2+. Однако если ионы ртути блокируют сульфгидрильные группы белков, цистеина, унитио-ла, гемоглобина и небелковых гемолизатов эритроцитов, то не отмечалось, например, блокирования тиоловых групп унитиола ионами кадмия, олова и свинца. В то же время ионы кадмия и свинца блокировали SH-группы цистеина на 27 и 50 % соответственно.

Существенные различия выявлены в степени связывания ионов тяжелых металлов с SH-группами гемоглобина. Подобные результаты получены также на гемолизатах эритроцитов. Так, ионы ртути блокировали их на 100%, ионы свинца — на 18%, ионы кадмия — на 11%, а ионы олова вообще не вступали в реакцию с сульфгидрильными группами данного белка. В связи с тем что SH-группы в белках обязаны своему наличию остаткам цистеина, это обстоятельство служит подтверждением того факта, что реакционная способность SH-групп во многом зависит от структуры соединения, в которое они входят, о чем свидетельствуют многочисленные экспериментальные исследования.
Так, на основании сравнения данных амперометрического титрования и реакции с нитратом серебра было показано, что между серебром и кадмием в организме существуют конкурентные взаимоотношения, что связано с различной прочностью соединений типа металл— сера при взаимодействии тяжелых металлов с тиоловыми соединениями. С аминотиолами и дитиолами ионы этих металлов образуют также более прочные комплексы, чем с монотиолами. Логарифмы констант стабильности комплексов Zn2+ с тиолами и ЭДТА составляют для меркаптоэтанола 5,9, меркаптоэтиламина и цистеина — 9,9, дитиотреитола — 10,3, димеркаптопропанола — 13,5, для ЭДТА — 16,4. Данный показатель учитывают при разработке системы лечебно-профилактических мероприятий, в том числе реагентов, прочно соединяющихся с тяжелыми металлами. Уже в 1953 г. Е.С.Баррон упоминает 17 реагентов на SH-группы и 42 тиоловых фермента. Представители всех классов ферментов, почти все известные дегидрогеназы, ферменты обмена аминокислот, углеводов и жиров, биосинтеза белков ингибируются реагентами на SH-группы.
Показана роль этих групп в мышечном сокращении, окислительном фосфорилировании, нервной деятельности, делении клеток, действии отравляющих веществ и радиации.
Влияние тиоловых реагентов на упомянутые физиологические функции обусловлено блокированием SH-групп ферментов и других белков, а также низкомолекулярных, функционально важных тиолов, выполняющих роль кофакторов или простатических групп в различных ферментных системах.
В ферментативных реакциях участвуют и другие функциональные группы белков: имидазольная группа гистидина, гидроксильная — серина, е-аминогруппы лизина, со -карбоксильные группы аспарагиновой и глутаминовой кислот, фенольная группа тирозина и др. Однако SH-группы отличаются исключительно высокой реакционной способностью и многообразием химических реакций. Они вступают в реакции алкилирования, ацилирования, окисления, тиолдисульфидного обмена, реакции с сульфенилгалоидами, образования меркаптидов, полумеркапталий, меркаптолов, комплексов с переносом заряда и др.
Большинство реагентов на различные функциональные группы белка наиболее быстро реагируют со свободными SH-группами. Во многих из этих реакций SH-группы принимают участие в форме меркаптидного иона. Он реагирует с а- и р-ненасыщенными соединениями (например, акрилонитрилом) в 280 раз быстрее, чем непротонированная аминогруппа. Скорость реакции с 2,4-динитрофторбензолом у SH-группы цистеина в 90 раз выше, чем у фенольного гидроксила; в 160 раз выше, чем у аминогрупп, и в 1600 раз выше, чем у имидазола. Меркаптидные группы, таким образом, — более сильные нуклеофилы, чем другие группы белка. Сильная нуклеофильность меркаптидных ионов обусловлена главным образом высокой поляризуемостью относительно большого атома серы. Атом серы метионина образует координационную связь с ионом ртути. Тиоэфирная группа метионина алкилируется бромбензилом в 50 раз быстрее, чем неионизированная SH-группа, и в 33 раза быстрее, чем нейтральная имидазольная группа гистидина или индольное кольцо триптофана. Лишь меркаптидный ион превосходит ее по нуклеофильной реакционноспособности.
Тиоэфирные и дисульфидные группы вступают не в столь разнообразные реакции, как SH-группа. Устойчивость -S-S-связей при физиологических значениях рН хорошо соответствует их основной функции — участию стабилизации макромолекулярной структуры белков. Дисульфидные группы в активных центрах окислительных ферментов подвергаются обратимому превращению в SH-группы при взаимодействии с субстратами и участвуют в кататической реакции.
Читайте также:
- Можно ли отравиться от адамова яблока
- Может ли после отравления быть молочница
- Что принимали при отравлениях а османской империи
- Какую помощь необходимо оказать пострадавшему при алкогольном отравлении
- Средство при отравлении фов что это
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.

