Простой герпес самгин халдин
Ключевые слова: простой герпес, этитропные средства, иммунная терапия, алгоритм выбора.
Одним из основных практических вопросов связанных с проблемой простого герпеса (ПГ) в дерматологии продолжает оставаться отсутствие единого подхода к лечению и вторичной профилактике рецидивов инфекции. Несмотря на достаточно большой выбор противогерпетичееких препаратов направленных как на купирование обострений, так и на восстановление иммунного контроля над латентным состоянием вируса простого герпеса (ВПГ), их назначение в большинстве случаев остается империческим. Это, безусловно, отражается на степени эффективности терапии и нередко приводит к дискредитации лекарственных средств. Более того, отсутствие общепризнанных критериев выбора тактики лечения, патогенетически обоснованных подходов к назначению этиотропных или иммунных препаратов не позволяет сегодня реально оценить степень клинической эффективности предлагаемых фармацевтическим рынком лекарственных средств, особенно иммунной направленности.
Мы не раз подчеркивали, что разработка подходов к ведению больных ПГ, должна базироваться не только на оценке частоты манифестаций и локализации высыпаний, но и на степени и характере иммунных нарушений, лежащих в основе обострений заболевания, которые достаточно четко коррелирует с тяжестью течения герпес-вирусного процесса ( 3, 4, 6, 7 ). Основанием для данного заключения являются выявленные нами особенности иммунных нарушений, в зависимости от частоты рецидивов вирусного процесса, которые легли в основу предложенной в 2000 году классификации типов иммунопатогенеза обострений ПГ (таблица 1). Понимание неоднородности нарушений механизмов иммунорезистентности, в результате которых происходит потеря контроля над латентным состоянием ВПГ, позволяет по-новому посмотреть на тактику и стратегию лечения и вторичной профилактики ПГ и предложить патогенетически обоснованный алгоритм ведения больных (таблица 2).
Необходимо отметить, что при разработке алгоритма мы учитывали как личный опыт, так и опыт наших коллег, в том числе и зарубежных, что позволило аккумулировать два разных подхода (этиотропный и иммунный) в единую концепцию. Более того, наше отношение к вопросу не как к чисто дерматологической проблеме, а как к системной герпетической болезни, а также многочисленные совместные исследования с психоневрологами, гинекологами, урологами, эндокринологами и другими специалистами дало возможность унифицировать не только терапевтическую тактику, но также объем и направленность обследования пациентов ( 5, 10, 12 ).
После подтверждения диагноза ПГ собственно и начинается индивидуальный выбор тактики и стратегии ведения пациента, основой которых являются оценка спектра жалоб, анамнеза заболевания и жизни, а также, при необходимости, лабораторное или иное, обследование больного.
Пожалуй, главным, в дальнейшей работе, становиться выяснение тяжести течения вирусного процесса, т.е. частоты обострений в год. В основном мы сталкиваемся с тремя вариантами: легкого течения – 1 – 2 рецидива в год, умеренной тяжести – 3 – 4 манифестации вирусного процесса и с тяжелым проявлением заболевания, когда у пациента наблюдается от 6 до 12 эпизодов инфекции. Таким образом, формируется три основных варианта тактики ведения больных имеющих свои особенности (Графологическая структура алгоритма).
Новые инструкции по медицинскому применению препаратов:
Второй вариант, когда течение герпес-вирусной инфекции характеризуется как умеренное (3 – 4 раза в год) можно назвать пограничным. В данных случаях необходим тщательный сбор анамнеза заболевания, который помогает сориентироваться в необходимости и направленности дальнейшего обследования. Здесь важно оценить динамику течения заболевания и его длительность. В том случае, если пациент страдает ПГ несколько лет, и обострения изначально имели такую частоту, то это монотонный тип, свидетельствующий о транзиторности иммунных нарушений и ведение больного должно быть аналогично таковому при легком варианте течения. Более сложными являются ситуации, когда у пациента наблюдается нарастание частоты рецидивов (нарастающий вариант ПГ) или же они появились недавно. В таких случаях необходимо обязательное иммунологическое тестирование (интерфероновый статус и цитокиновый профиль) для выявления степени и характера иммунодефицита. От результатов обследования и зависит выбор терапевтической тактики. Если нет тенденции к формированию вторичного иммунодефицита, то лечение пациента должно ограничиваться этиотропной терапией, если иммунные нарушения носят более выраженный характер, то необходима консультация клинического иммунолога для назначения иммуннотропной терапии, которая направлена не на купирование обострений, а на их профилактику за счет восстановления контроля над латентностью ВПГ.
На основании многолетних клинико-иммунологических исследований с одновременной оценкой эффективности различных профилактических подходов, мы сегодня можем предложить патогенетически обоснованный выбор терапевтической тактики. Он напрямую зависит от выявленного в результате иммунного тестирования типа иммунопатогенеза ПГ (см. таблица 2).
Наиболее благоприятным вариантом является вторичный иммунодефицит по Т-клеточному типу. В данном случае, методом выбора вторичной профилактики является иммунокоррекция, которая может предусматривать назначение герпетической вакцины, интерфероногенов или кислоро-озоновой терапии. Единственно, о чем важно знать и помнить, это сроки проведения данного профилактического метода лечения – только в межрецидивном периоде, не ранее чем через две недели после купирования обострения.
Как было сказано выше, пациентам, страдающим ПГ, особенно с часто рецидивирующими формами или с локализацией высыпаний в области гениталий, наряду с фармакологической помощью, нередко требуется психореабилитация. Существенную помощь в ней оказывает грамотное консультирование больных ( 2 ). Для проведения консультирования врач должен не только знать суть вопроса, т.е. проблему ПГ, но обладать навыками и владеть инструментами, которые используются с этой целью. Главная задача консультирования по вопросам ПГ – это помощь пациенту в адаптации к нормальной жизни после выставленного диагноза. Необходимо нивелировать эмоции и переживания, постараться убрать фобии, изменить ложные представления о заболевании и научить управлять самим вирусным процессом. Залогом успеха консультирования является установление конфиденциальных, доверительных отношений между врачом и больным, базирующихся на высоком профессионализме консультанта.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
ММА имени И.М. Сеченова
С реди многих проблем, связанных с вирусом простого герпеса (ВПГ), особого внимания заслуживает вопрос лечения рецидивов и профилактики обострений простого герпеса (ПГ). Его актуальность в связи с увеличением степени инфицированности возбудителем и частоты клинических проявлений вирусного процесса все более возрастает. Вместе с тем успешная терапия невозможна без понимания патогенеза заболевания, что не раз подчеркивали многие исследователи. Именно его расшифровка является ключом к решению самой важной задачи, стоящей перед клиницистом, в лечении хронически персистирующей герпес–вирусной инфекции [1,2,3].
Сегодня существует достаточно большой арсенал противогерпетических средств. Однако оценка их фармакологического действия говорит о наличии всего лишь двух приоритетных направлений терапии ПГ – иммунного и этиотропного. Оба они патогенетически обоснованы. Первое базируется на восстановлении контроля системы иммунитета над латентным состоянием ВПГ в сенсорных паравертебральных ганглиях ЦНС. Второе основано на нарушении репликации и активации возбудителя в случае выхода провируса герпеса из–под иммунного контроля [4].
Терапия иммунной направленности, т.е. патогенетический подход, по–видимому, – наиболее естественный метод профилактики ПГ. Ее обоснованием служит принципиальная возможность управлять формированием и уровнем напряженности приобретенного противогерпетического иммунитета [1]. Этиотропные же препараты наиболее эффективны при купировании клинических проявлений инфекции. Но, как показывает опыт, различные средства патогенетического (иммунного) влияния позволяют добиться искомого результата далеко не во всех случаях, а противовирусные средства оказывают действие только на активные формы возбудителя.
В разные годы предпринимались многочисленные попытки повысить эффективность лечения ПГ путем комбинированной терапии. С этой целью использовались различные сочетания средств иммунного влияния, а также препаратов, отличающихся по этиопатогенетическому механизму действия.
Однако следует отметить, что анализ полученных во всех случаях клинических результатов не позволяет говорить о достижении при таких подходах достоверно значимого повышения профилактического влияния комбинированных методов лечения по сравнению с монотерапией, например, герпетической вакциной или индукторами интерферона.
Также безуспешными явились попытки разработки комплексных программ терапии, включающих использование на разных этапах лечения синтетических нуклеозидов, герпетической вакцины и иммуностимулирующих средств.
Таким образом, ни этиотропная, ни иммуностимулирующая терапия не гарантируют 100% клинического эффекта. Это связано с рядом причин, например, с хронической персистенцией возбудителя. Следствием последней является восстановление репликации ВПГ и возобновление обострений заболевания после прекращения сколь угодно продолжительного по времени приема противовирусных химиопрепаратов. Неудачи иммунокоррекции можно объяснить назначением различных по патогенетическому действию препаратов без учёта особенностей нарушений системы иммунитета [1,4].
Сложившаяся ситуация свидетельствует о необходимости дифференцированного подхода к выбору терапевтической тактики при ПГ.
С этой целью нами было проведено изучение особенностей клинического течения заболевания и углублённое исследование иммунного статуса больных. Выявленные в результате закономерности между тяжестью течения вирусного процесса и глубиной дефектов иммунитета позволили разработать методологический подход к дифференцированному выбору терапии ПГ, который имеет математическое выражение.
Иммунологические исследования включали определения интерферонового статуса (ИФС), отдельных составляющих T–клеточного звена (CD–4 и CD–8 – клетки, индекс цитотоксической активности естественных киллеров), а также цитокинового профиля (интерлейкины 1, 2, 4, 6, 8, факторы некроза опухоли) и уровня специфических иммуноглобулинов к ВПГ. Изучение иммунограмм больных ПГ позволило констатировать их неоднородность. Различия имелись как количественные, так и качественные.
Количественные варианты отличались глубиной нарушений иммунитета, в первую очередь системы интерферона и цитотоксичности естественных киллеров (ЕК). Было выделено два типа иммунной несостоятельности. При редких рецидивах она носила транзиторный характер. В случаях частых обострений имела свойства вторичного иммунодефицита со снижением уровня интерферонов и индекса активности ЕК в 2 и более раз.
Качественные различия соответствовали механизму формирования вторичного иммунодефицитного состояния. Их характеристики были связаны с медиаторами иммунитета – интерлейкинами (ИЛ) и продуцирующими их клетками. На фоне общего снижения уровня цитокинов и способности к индукции иммунокомпетентных клеток в 65% случаев отмечалось превалирование выработки ИЛ–6, в 25% – ИЛ–4. В 10% иммунограмм выявлено выраженное снижение синтеза всех исследованных ИЛ и значительное понижение функциональной активности Т–хелперов.
Выявление указанных иммунологических различий позволило сделать заключение о неоднородности иммуногенеза рецидивов ПГ, выделив несколько его вариантов (табл. 1).
Иммунологические особенности, свидетельствующие о разнообразии формирования противогерпетического ответа, наглядно подтверждают необходимость различных подходов к тактике ведения и выбору терапии больных ПГ. Это обусловлено тем, что определенные иммунологические нарушения должны восстанавливаться соответствующими патогенетически обоснованными методами.
Работа с пациентом начинается со сбора анамнеза. Выявление нами прямой корреляции между тяжестью течения вирусного процесса и глубиной дефектов иммунитета привело к созданию клинического индекса терапевтической тактики (КИТТ). Он позволяет, на основании оценки клинических составляющих заболевания, определить подход к ведению больного ПГ. Возможны два варианта – купирование каждого конкретного рецидива или системная терапия с целью профилактики последующих обострений. Раньше выбор основывался исключительно на частоте манифестаций ВПГ. Однако анализ совокупности клинических данных говорит о значимости и других анамнестических параметров.
Расчёт КИТТ основан на введении в его формулу числовых значений соответствующих шкал.
КИТТ= [(a–1)x(3a+2d+e+2z–9,14)] / (3,66a–3,62),
a – значение по шкале частоты рецидивов;
z – значение по шкале склонности к нарастанию частоты обострений;
d – значение по шкале их длительности;
e – значение по шкале продолжительности самого заболевания.
При показаниях к проведению терапии направленной только на купирование рецидива наиболее эффективными препаратами являются ациклические синтетические нуклеозиды. Так, назначение Фамвира в дозе 250 мг достаточно быстро купирует клинические проявления заболевания. Однако при этом необходимо ориентировать пациента на необходимость приема противовирусных средств на ранних сроках обострения, что позволяет значительно повысить эффективность лечения.
КИТТ позволяет также определить, когда пациенту показано проведение системной терапии, направленной на профилактику рецидивов. Однако он не дает ответа на вопрос о том, какой она должна быть по этиопатогенетическому действию. Это связано с тем, что сходные нарушения противовирусного иммунитета возникают при разных по характеру изменениях продукции медиаторов иммунитета и продуцирующих их клеток.
Поэтому для того, чтобы учесть это важное обстоятельство, был создан второй клинико–иммунологический индекс этиопатогенетической терапии (КИИЭПТ).
Его расчёт также основан на введении в формулу значений соответствующих шкал, где за единицу уровня продукции принято значение нормы.
i – значение по шкале ИЛ–4
f – значение по шкале ИЛ–6
t – значение по шкале отношений CD–4/CD–8.
На основании анализа значений индекса и клинико–иммунологических результатов лечения больных ПГ различными методами был разработан следующий алгоритм выбора этиопатогенетической терапии заболевания, направленной на профилактику рецидивов (табл. 3).
Для пролонгированной терапии наиболее эффективными и удобными являются фамцикловир (Фамвир) (по 250 мг два раза в день) и валацикловир (по 500 мг дважды в сутки). Фамцикловир является предшественником пенцикловира и обладает рядом существенных преимуществ по сравнению с ацикловиром: высокое сродство к тимидинкиназе вируса (в 100 раз выше) и более выраженное блокирование репликации вируса между приемами препарата; фамцикловир обладает самой высокой биодоступностью (77% против 10–20% у ацикловира) и самым длительным периодом нахождения в инфицированной вирусом клетке (до 20 часов); постоянная концентрация препарата в инфицированных клетках обеспечивает длительный противовирусный эффект и дает возможность реже принимать препарат; фамцикловир обладает свойством проникать в шванновские клетки, окружающие нервные волокна. В клетках, инфицированных ВЗВ, периоды полувыведения составляют 9 часов для фосфорилированного пенцикловира и 0,8 часа для фосфорилированного ацикловира. Поэтому фамцикловир является единственным противовирусным препаратом, уменьшающий длительность постгерпетической невралгии при опоясывающем лишае (на 100 дней по сравнению с плацебо).
В качестве индукторов интерферона могут использоваться различные препараты данной группы.
Схема вакцинотерапии носит традиционный характер и состоит из двух курсов по 5 внутрикожных инъекций, при разовой дозе 0,2 мл, с интервалами 3–4 дня и двухнедельным перерывом между ними.
Для иммунозаместительной терапии наиболее эффективным препаратом сегодня является интерферон a–2b. Он назначается по одной ректальной свече, содержащей 1 млн МЕ действующего начала, дважды в сутки в течение первого месяца с последующим переходом на дозировку 500000 МЕ по той же схеме, как минимум, еще 5 месяцев.
Несомненным преимуществом данного индекса является объективный подход к назначению лечения больных ПГ. Он исключает предпочтение одних методов терапии другим. Позволяет избегать случаев утяжеления герпесвирусного процесса. Его практическое применение показало, что при подходе к лечению пациента с помощью КИИЭПТ во всех случаях достигается нормализация иммунного статуса. Как следствие этого, наблюдается 100% клинический эффект, чего не удается достичь при выборе терапии без учёта иммунологических особенностей патогенеза заболевания [7].
2. Баринский И.Ф., Шубладзе А.К., Каспаров А.А., Гребенюк В.Н. Герпес:этиология, диагностика и лечение, Медицина, Москва, 1986, 268 с.
3. Сухих Г. Т., Ванько Л. В., Кулаков В. И. Иммунитет и генитальный герпес. Нижний Новгород. 1997, 220 с.
4. Халдин А. А. Простой герпес. Российский журн. кожных и венерических болезней. 2002, №2, с. 42–50.
5. Spruance S.L., Kriesel J.D. Treatment of Herpes Simplex Labials, Herpes, V. 9, № 3, 2002, p. 64 –69
6. Spruance S.L., Jones T.M., Blatter M.M., Oral valaciclovir for the treatment of herpes labialis two trials of early, high–dose, short–course therapy. Antiviral Res., 2002, 53, A. 53.

В своей практической деятельности врачи многих специальностей встречаются с заболеваниями, вызванными вирусами семейства Herpesviridae, которые широко распространены в человеческой популяции. Они способны поражать практически все органы и системы организма хозяина, вызывая латентную, острую и хроническую формы инфекции при этом, спектр клинических проявлений, развитие которых они обусловливают, чрезвычайно широк [7]. Особого внимания заслуживает рецидивирующая форма герпетической инфекции (ГИ), относящаяся к числу наиболее распространенных психосоматических кожных заболеваний. Хроническое течение, зуд, частая локализация и характер высыпаний на лице или интимно значимых участках кожного покрова сопровождаются изменениями эмоциональной сферы. В свою очередь, состояния стресса, восприятие самим пациентом проявлений болезни оказывает влияние на интенсивность и частоту рецидивов простого герпеса (ПГ) [24].
Многочисленные исследования в области проблемы ГИ, особенно вызванные вирусами простого герпеса (ВПГ) 1 и 2 типов, не теряют своей актуальности в настоящее время [21, 16].
Серьёзной проблемой является высокая инфицированность здорового населения, преимущественно молодого, трудоспособного возраста. В мире ежегодно заражаются от 16 до 800, а в России – от 40 до 80 человек на 100 тыс. населения. В настоящее время заболеваемость ПГ крайне высока, по статистике ВОЗ, она занимает второе место среди вирусных поражений, уступая лишь гриппу. ВПГ-1 инфицировано около 90 % взрослого населения планеты, распространенность ВПГ-2 колеблется от 7 до 40 %. В США ежегодно регистрируется до 98 млн случаев лабиального герпеса и 20 млн случаев рецидивирующего герпеса гениталий, 500 тыс. случаев офтальмогерпеса и более 5 тыс. случаев герпетического энцефалита, около 1 тыс. случаев герпеса новорожденных. По мнению ведущих специалистов, в нашей стране ежегодная заболеваемость герпесом губ составляет 10 млн, герпесом кожи – 1 млн, офтальмогерпесом – 250 тыс. случаев. Рецидивирующими формами герпеса страдают от 10 до 20 % населения, а ежегодный прирост увеличивается на 15–17 % [3, 13, 23].
Литературные данные свидетельствуют, что большинство населения Земли инфицировано ВПГ-1, ВПГ-2 или тем и другим вирусом одновременно. Первичная инфекция, ассоциированная с ВПГ-1 или ВПГ-2, может протекать в клинически выраженной форме в очаге инфицирования (например, в орофациальной или генитальной области) либо как бессимптомная или нераспознанная инфекция. Генитальная форма простого герпеса может быть связана с ВПГ-1, так же как и лабиальная форма – с ВПГ-2. После первичного инфицирования у 50–75 % больных отмечается рецидивирующее течение простого герпеса. В течение первых 12 месяцев после инфицирования ВПГ-2 рецидив возникает у 80 % пациентов, ВПГ-1 – у 55 % [15, 26].
Современная медицина не располагает методами лечения, позволяющими элиминировать ВПГ из организма человека. Целью лечения герпеса является: 1) подавление репродукции ВПГ в период обострения (купирование рецидива); 2) снижение частоты и длительности рецидивов заболевания, тяжести их течения; 3) формирование адекватного иммунного ответа и его длительное сохранение с целью блокирования реактивации ВПГ в очагах персистенции.
Всё разнообразие методов терапии и профилактики обострения герпесвирусных инфекций можно сгруппировать в направления этиотропного, патогенетического и симптоматического лечения с применением химиотерапии, иммунотерапии и комплексного лечения [1, 7, 11].
Большое внимание уделяется антигерпетическим соединениям растительного происхождения, природным антиоксидантам, адаптогенам из лекарственного растительного сырья и витаминно-минеральным комплексам, ввиду изменения иммунного статуса пациентов [14, 19].
Патогенетическая терапия направлена на нормализацию функции иммунной системы организма, в том числе на активацию системы интерфероновой защиты, как правило, связанная с применением интерферонов (ИФН), индукторов ИФН и иммуномодуляторов. Специфическая иммунотерапия состоит в применении герпетической вакцины, хотя ряд исследователей считает, что надежды, возлагаемые на специфическую вакцинопрофилактику, не оправдали себя [11, 19]. Иммунотропные препараты, обладающие активностью против вируса герпеса, разнообразны и представлены в таблице.
Иммунотропные препараты, обладающие активностью против вируса герпеса
Использование противовирусной химиотерапии велико при лечении рецидивирующих форм простого герпеса с поражением кожи и слизистых оболочек. В лечении простого герпеса с применением противогерпетических химиопрепаратов можно выделить два принципиально отличающихся друг от друга подхода: 1) эпизодическое лечение – прием ациклических нуклеозидов (АН) в момент рецидива в терапевтических дозах при соблюдении кратности и длительности лечения; 2) супрессивная терапия – длительный, иногда многолетний, постоянный прием препаратов АН вне рецидива в более низких дозах [9, 25].
Согласно проведенным исследованиям, биодоступность (per os) противогерпетических препаратов из группы ациклических нуклеозидов возрастает следующим образом: ацикловир – 20 %, валацикловир – 54 % и фамцикловир – 77 % [24]. Тем не менее применение ацикловира по-прежнему остаётся востребованным среди врачей и пациентов в настоящее время, и одновременно ведутся исследования по увеличению растворимости ацикловира [5] и синтезу его производных [8].
В разные годы предпринимались многочисленные попытки повысить эффективность лечения ПГ путем комбинированной терапии. С этой целью использовались различные сочетания средств иммунного влияния, а также препаратов, отличающихся по этиопатогенетическому механизму действия [20].
Возможно сочетанное использование противовирусной терапии и глюкокортикостероидов. Выявлено, что такая комбинация эффективнее монотерапии противовирусными препаратами, особенно для лечения острой боли и коррекции различных аспектов качества жизни пациентов. Комбинация ацикловир + преднизолон значительно быстрее купирует острую боль и возвращает пациента к обычной жизнедеятельности в случае постгерпетической невралгии [2].
Наружные средства дополняют системную противовирусную терапию. Многочисленные наблюдения подтверждают, что в случае назначения таблетированных форм ациклических нуклеозидов на стадии предвестников в сочетании с наружной противовирусной терапией значительно чаще удается полностью прервать дальнейшее развитие рецидива или наблюдать его абортивное течение [20].
Местная терапия противовирусных лекарственных средств при герпесе кожи и слизистых оболочек требуется для уменьшения отёка, экссудации, боли и зуда, ускорения заживления язвочек и эрозий и сокращения длительности выделения вируса на участках поражения [22]. Применение данных лекарственных форм начинают при появлении первых признаков активации инфекции (чувство жжения, зуд и т.д.) и продолжают вплоть до эпителизации эрозий. Рано начатое местное лечение может предотвратить развитие везикул.
В комплексную терапию пациентов с простым герпесом необходимо включать местные противовирусные средства, способствующие стабилизации и разрешению процесса [12].
При анализе ассортимента противовирусных средств на российском рынке установлено, что большинство противовирусных препаратов выпускается в виде твёрдых лекарственных форм – 66 %, в виде мягких лекарственных форм – 22 %, а в форме жидких – 12 % [22], лидером же является ацикловир [6].
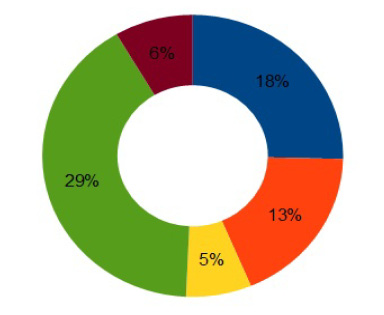

Ассортимент лекарственных форм, содержащих ацикловир
Следует отметить, что современная фармакотерапия герпеса эффективно уменьшает его клинические проявления, положительно влияет на психическое состояние пациентов и приобретает комплексный подход. Несмотря на различные достижения в лечении герпеса, ацикловир по-прежнему играет значительную роль в данном направлении и привлекает внимание исследователей по созданию комбинированных препаратов. В связи с чем актуальными являются исследования по разработке лекарственной формы комбинированного состава, обладающей противогерпесным эффектом – медицинские карандаши.
Рецензенты:
Степанова Э.Ф., д.фарм.н., профессор, профессор кафедры технологии лекарств ПМФИ – филиала ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск;
Хаджиева З.Д., д.фарм.н., профессор, профессор кафедры технологии лекарств ПМФИ – филиала ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск.
В.А.Исаков
Д.м.н., профессор кафедры инфекционных болезней и эпидемиологии
Первого СПб ГМУ им. акад. И.П.Павлова, академик РАЕН
Трудности, связанные с лечением больных часто рецидивирующими (повторяющимися) формами герпесвирусных инфекций, обусловлены большим разнообразием герпесвирусов и их пантропизмом (способность инфекции вызывать заболевание в не зависимости от пути проникновения). В то же время применение даже комплексной терапии с использованием различных препаратов (противогерпетические химиопрепараты, интерфероны и индукторы интерферонов) не всегда позволяет существенно повлиять на частоту рецидивирования (повторения) герпеса. При лечении герпеса у лиц со сниженным иммунным статусом возможно формирование резистентности (устойчивости) вирусов герпеса к базовым препаратам (1, 2).
Показано, что у больных часто рецидивирующей герпетической инфекцией имеется дисбаланс в системе клеточного и гуморального иммунитета, дефицит интерферонов и др.Для повышения эффективности терапии наряду с противовирусными средствами необходимо включать иммунобиологические (интерфероны и индукторы интерферонов) препараты.
На сегодняшний день высокую эффективность в лечении и профилактике рецидивируюших герпесвирусных инфекций показал препарат Циклоферон.
Циклоферон относится к группе индукторов интерферона. У него выявлены противовирусный, иммуномодулирующий, противовоспалительный и др. эффекты. Препарат обладает прямым и опосредованным противовирусным действием. Прямое противовирусное действие связано с непосредственным влиянием Циклоферона на вирус, что приводит к уменьшению его размножения. Опосредованное противовирусное действие связано с системой интерферонов.
Таким образом, Циклоферон, как индуктор интерферона, обладает бифункциональной активностью – он способен подавлять размножение вирусов и вызывать иммуномодулирующий эффект.
Циклоферон выпускается в виде 12,5% раствора в ампулах по 2 мл для внутривенного и внутримышечного введения, таблеток по 0,150 г, покрытых кишечнорастворимой оболочкой и линимента 5% для наружного применения в тубах по 5 и 30 мл.
Все три формы Циклоферона прошли клинические исследования, подтверждающие их эффективность и безопасность в лечении герпесвирусных инфекций.
Так, например, в исследовании по применению таблеток Циклоферона в лечении рецидивирующих герпесвирусных инфекций приняло участие 125 пациентов обоего пола от 18 до 50 лет, страдающих либо лабиальным герпесом (на губах), либо генитальным герпесом. Препарат сравнения: Ацикловир таблетки по 0,2 г.
Как показали результаты исследования, наиболее эффективными оказались таблетки Циклоферона и сочетанное использование таблеток Циклоферона и Ацикловира. В обоих случаях заметно снижалась частота, интенсивность и длительность обострений герпесвирусной инфекции (3,4).

В исследовании по применению 12,5% внутримышечного раствора Циклоферона в лечении рецидивирующих герпесвирусных инфекций приняло участие 100 человек обоего пола в возрасте от 24 до 42 лет, страдающих рецидивирующим генитальным герпесом (5-8 рецидивов в год). Как показали исследования, продолжительность ремиссии (межрецидивный период) у 80% пациентов пролеченных раствором Циклоферона увеличилась в 2,5 раза (3,5).
Подобноее исследование, по применению 12,5% внутримышечного раствора Циклоферона в лечении рецидивирующего генитального герписа, так же подтвердило увеличение продолжительности ремиссии заболевания до 2,9 раз (6)
Более того, исследователями подтверждены эффективность и безопасность 12,5% внутримышечного раствора Циклоферона у детей с генерализованной формой простого герпеса. В исследовании приняло участие 40 детей в возрасте от 2,5 до 14 лет.
Как показало исследование, включение Циклоферона в комплексную терапию сопровождалось выраженной клинической эффективностью. Так, при лечении Циклофероном, нормализация температуры тела, купирование кожных проявлений и кератоконъюктивита наблюдалось в 2 раза быстрее, чем при использовании только комплексной терапии (7).
| Комплексная терапия | Комплексная терапия + Циклоферон амп. | |
| Температура тела, (дни) | 7 | 4 |
| Кожные проявления, (дни) | 12 | 8 |
| Кератоконъюктивит, (дни) | 13 | 6 |
Побочных действий и аллергических реакций на введение препарата не наблюдалось.
В исследовании по изучению переносимости и эффективности 5% линимента Циклоферона при лечении герпетических поражений кожи и слизистых оболочек приняло участие 120 человек в возрасте от 18 до 60 лет. 70 человек из них имели среднетяжелую форму простого герпеса с поражением губ и кожи лица, 30 человек были больны опоясывающим герпесом и 20 человек были здоровы (группа сравнения). Как показало данное исследование, применение линимента Циклоферона совместно с базисной терапией в 1,5 – 2,0 раза снижает продолжительность симптомов, как простого герпеса, так и опоясывающего герпеса (7).
| Базисная терапия | Базисная терапия + Циклоферон линимент | |
| Везикуляция, (дни) | 5,1 | 2,4 |
| Боли, зуд, жжение, (дни) | 2,4 | 1,5 |
| Отек, гиперемия, (дни) | 1,7 | 1,0 |
| Интоксикация, (дни) | 2,9 | 2,0 |
| Длительность рецидива, (дни) | 9,8 | 5,3 |
| Базисная терапия | Базисная терапия + Циклоферон линимент | |
| Везикуляция, (дни) | 14,1 | 9,5 |
| Эпителизация, (дни) | 16,4 | 13,1 |
| Лихорадочный период, (дни) | 6,0 | 4,6 |
Таким образом, Циклоферон сочетается с основными препаратами базисной терапии, хорошо переносится больными, высокоэффективен при системном и местном применении. Циклоферон может быть рекомендован для купирования рецидивов и профилактики обострений герпесвирусной инфекции с поражением различных органов и систем.
Читайте также:


