Пересадка почки при герпесе
Герпес – это распространенная вирусная инфекция. Трудно найти человека, который никогда не встречался с этим заболеванием. Оно давно известно и изучено.
Опасность герпеса
Внешне заболевание вирусом герпеса представляет собой скопление воспаленных пузырьков на коже. Они заполнены лимфатической жидкостью, в которой и содержится вирус. Течение болезни нередко сопровождается зудом, болезненными ощущениями и температурой.
Но неярко выраженная клиническая картина заболевания не уменьшает его опасности. Однажды попав в человеческий организм, вирус герпеса не покидает его никогда. Любые неблагоприятные для человека обстоятельства могут стать сигналом для активности вируса.

Герпес имеет около 100 модификаций, но наиболее часто человека атакует восемь видов. К ним относятся:
- Простой герпес 1 типа (ВПГ-1). В обиходе он называется простудой на губах. Появляется вследствие ослабления иммунитета: при переохлаждении, стрессе, переутомлении, сопутствующем заболевании. Такой вирус можно получить, заразившись через предметы личного пользования, поцелуй и общаясь с больным человеком.
- Простой герпес 2 типа (ВПГ-2). Называется генитальным герпесом. Заражение происходит при половом контакте.
- Вирус 3 типа (вирус Зостера). Заболевание этим вирусом у детей проявляется болезнью ветрянка. У взрослых заболевание протекает в виде опоясывающего лишая. Часто оно является рецидивом ветряной оспы, полученной в детстве.
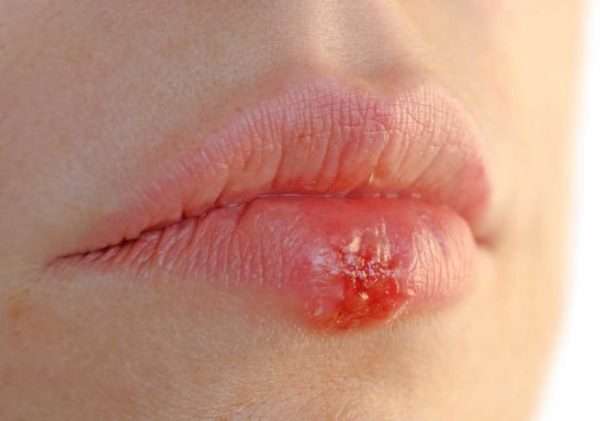
- Человеческий вирус герпеса 4 типа (вирус Эпштейна-Барр). В данном случае поражается в основном лимфатическая система. Нахождение этого вируса в организме увеличивает вероятность развития онкологии.
- Человеческий вирус герпеса 5 типа (цитомегаловирус). Для него характерно бессимптомное присутствие в организме. Но последствия герпеса этого типа могут быть достаточно серьезными. В ослабленном организме с низким иммунитетом поражаются внутренние органы: печень, сердце, легкие, почки.
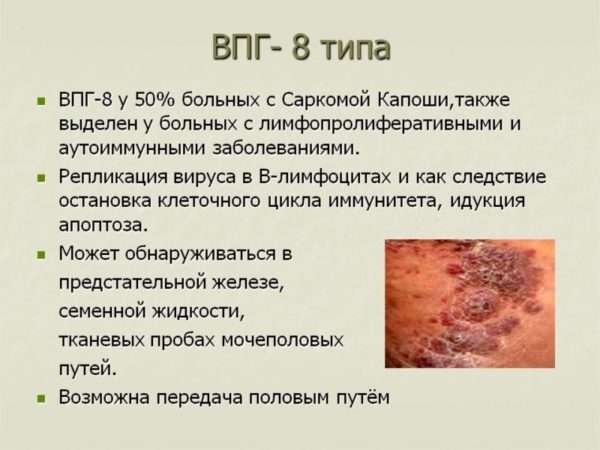
- Вирусы 6, 7, и 8 типов. Эти разновидности открыты только в последние десятилетия. Они до конца не изучены, но основные принципы их воздействия уже понятны: 6-й вызывает развитие синдрома хронической усталости, 7-й провоцирует онкозаболевания системы кроветворения, 8-й развивает саркомы Капоши (рака кожи).
Коварность герпеса заключается в его способности легко находить себе среду обитания. Он может выживать при любых неблагоприятных условиях, оставаясь в замершем состоянии. В ослабленном организме вирус моментально активизируется.
Каждый из типов вируса поражает определенное место на теле человека, имеет свою специфику и несет угрозу для окружающих.
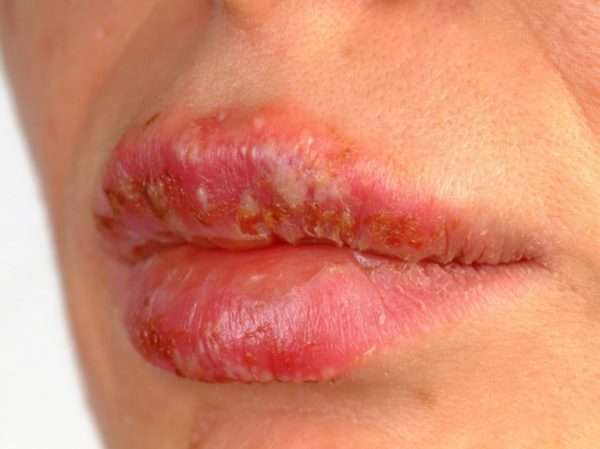
Герпес на губах
Герпес 1 типа, локализующийся на губах, является наиболее распространенной формой заболевания. Из лопнувшего пузырька вирус может попасть на любую часть тела заболевшего человека. Близость таких жизненно важных органов, как глаза, уши, ротовая полость и нос, делает небольшое воспаление на губе потенциально опасным для всего организма. При этом могут развиться:
- офтальмогерпес (поражение глазного яблока),
- заболевания органов пищеварения,
- стоматит,
- эрозия слизистой оболочки полости рта.
Герпес на коже
Кожные покровы человеческого тела поражают вирусы герпеса двух видов:
- Простой герпес 1 типа (ВПГ-1). Этот тип вируса наблюдается обычно на носогубном треугольнике лица, в обиходе называется простудой. Если режим жизни у человека особенно не меняется, то серьезных последствий такое заболевание не несет.
- Вирус герпеса 3 типа(Зостера). У детей вызывает ветряную оспу, у взрослых диагностируется как опоясывающий лишай. Поражаются большие участки кожи в разных местах: на лице, груди, спине. При этом наблюдаются повышенная температура, отеки и покраснения в местах высыпания, зуд, болезненные ощущения.
Назначать лечение при выявлении ветряной оспы или опоясывающего лишая должен только специалист.
Герпес на гениталиях
Генитальный герпес вызывается ВПГ-2, локализуется в виде высыпаний на половых органах, бедрах, крестцовой части тела.

У женщин он может спровоцировать:
- воспалительные процессы мочеполовой системы,
- молочницу,
- хламидиоз,
- онкозаболевания шейки матки,
- выкидыш или преждевременные роды,
- бесплодие.
Генитальный герпес особенно опасен для развивающегося плода в чреве матери. Его формирование может происходить с патологиями, в отдельных случаях – прерваться совсем.
У мужчин инфицирование вирусом генитального герпеса заметно понижает защитные функции организма. Оно может вызвать:
- аденому или онкозаболевание предстательной железы,
- бесплодие,
- простатит,
- везекулит,
- бактериальный уретрит.
Бесплодие как осложнение инфекции
Вирус герпеса опасен тем, что у заболевшего человека существует угроза развития бесплодия. Она одинаково реальна и для мужчин, и для женщин.
У мужчин присутствие в организме вируса значительно снижает качество, активность и количество сперматозоидов. Итог – вероятность зачатия заметно уменьшается. Даже если оно произошло, развитие плода в утробе матери может иметь патологии. Существует риск того, что рожденный ребенок в дальнейшем будет иметь проблемы со здоровьем.
Следует иметь в виду: состав спермы у мужчины обновляется не ранее, чем через 75 дней с момента начала лечения.
Женщины, инфицированные вирусом герпеса, часто испытывают проблемы с зачатием. Это объясняется тем, что из-за присутствия вируса оплодотворенная яйцеклетка не может закрепиться в матке.

При наступившей беременности все равно остаются угрозы выкидыша, преждевременных родов, патологий внутриутробного развития у плода, инфицирования ребенка при родах.
В случае заражения на последнем триместре беременности роды рекомендуется проводить с помощью кесарева сечения.
Неврологические осложнения
Особо следует обозначить осложнения, возникающие в функционировании центральной нервной системы. Последствиями инфицирования вирусами герпеса могут стать такие неврологические заболевания:
- Болезнь Альцгеймера. Нарушение функций мозга происходит как ответ организма на вторжение инфекции, в данном случае – на активизацию ВПГ-1. Известно, что 90% пациентов с болезнью Альцгеймера являются носителями герпеса этого типа.
- Асептический менингит. Обычно появляется одновременно с первичным заражением ВПГ-2.
- Энцефалит и менингоэнцефалит. Диагностируются при наличии в организме вирусов герпеса ВПГ-1 и ВПГ-2. При этом наблюдаются изменение сознания, мозговые невропатии, паралич мышц.
- Радикулит. На возникновение этой болезни влияет множество факторов, в том числе и ВПГ-2.
- Некроз сетчатки. Возможен при инфицировании вирусами герпеса 1, 2 или 3 типов.
Иммунодефицитные состояния и герпетическая инфекция
Большую опасность представляют герпесовирусные инфекции для больных, имеющих иммунодефицит. К этой группе относятся:
- онкобольные,
- лица с ВИЧ-инфекцией,
- больные, проходящие иммуносупрессивную, лучевую или химиотерапию.
Для таких людей увеличен риск развития не только латентного герпесвируса, но и первичного инфицирования. Медицинская практика показывает, что половина онкологических больных, перенесших операцию, имеют вирус герпеса в развитии.
Наиболее часто инфекциям подвергаются пациенты, имеющие:
- лейкоз,
- миеломы,
- лимфогранулематоз,
- гемобластоз,
- после трансплантации костного мозга.
Проявления герпеса у таких больных особенно разнообразны. Пострадать может любая часть тела: слизистые оболочки, кожа, внутренние органы. Не исключается вспышка других (кроме текущей онкологии) заболеваний:
Клиника инфицирования герпесом иммунодефицитных больных имеет ряд особенностей:
- проявление атипичных форм вируса герпеса,
- более тяжелое протекание заражения,
- поражение значительных участков тела,
- сильные болезненные ощущения,
- длительный период заживления.
Для людей с иммунодефицитом вирус герпеса представляет гораздо большую угрозу, чем для здоровых людей.
Опасность инфекции при беременности
Появление герпесвирусов у женщины опасно на любом сроке беременности и, в первую очередь, для будущего малыша. Здесь важно определиться – было это первичное инфицирование или вирус уже проявлял себя в организме женщины ранее.
Если вирус впервые проник в организм женщины, то у нее еще не успел сформироваться иммунный ответ к нему. Поэтому есть вероятность беспрепятственного проникновения инфекции через плаценту к плоду. В этих случаях заболевание может протекать со следующими последствиями:
- Первичное заражение в течение первого триместра. При заболевании на этом сроке велик риск выкидыша. Также возможны появления патологий дальнейшего развития: обычно им подвержены кости черепа и глаза.
- Первичное заражение во второй половине беременности. Вирус на этом сроке может спровоцировать преждевременные роды. Плод также подвергается опасности остановки развития в утробе матери.
- Заражение во время родового процесса. Даже если внутриутробный период прошел для ребенка без последствий, то все равно существует угроза его заражения во время родов, при прохождении через родовые пути. Практика показывает, что это наиболее распространенный способ инфицирования младенца.
Рецидив вируса герпеса представляет гораздо меньшую опасность, чем вышеописанный случай. Это связано с тем, что женский организм уже встречался с подобной инфекцией и выработал механизм борьбы с ним.
Иммунитет передается и ребенку, находящемуся в материнской утробе. Устойчивость к нему малыш сохраняет некоторое время после рождения.
Женщина, на любом сроке беременности обнаружившая признаки заражения, обязательно должна пройти курс лечения. Способ и длительность его определяет лечащий врач после проведенных обследований.
Особенности герпеса у детей
Спецификой детского герпеса является наибольшая беззащитность организма ребенка перед вирусом. Дети болеют этой формой заболевания значительно чаще, чем взрослые. Симптоматика у них выражена более ярко, и появление осложнений имеет большую вероятность.
Даже если для ребенка созданы все условия, трудно уберечь его от встречи с вирусом. Распространенность герпеса очень велика, и уже в течение первых двух лет малыш, скорее всего, столкнется с этой болезнью.
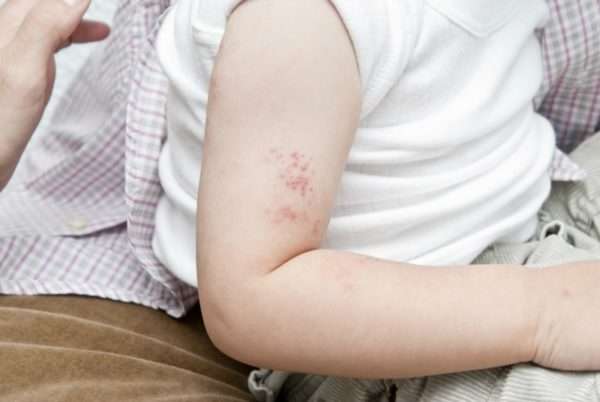
Как правило, в первые годы своей жизни дети болеют следующими видами герпеса:
- 1 и 2 типы – проявляются в виде пузырчатых высыпаний. Локализуются обычно на губах, потому что заносятся в рот с помощью рук.
- 3 тип – вызывает у детей заболевание, известное как ветрянка.
- 4 тип или вирус Эпштейна-Барр – статистика показывает, что, пройдя первое десятилетие своей жизни, 50% детей уже встречались с этим вирусом в той или иной форме. Нередко такое заболевание протекает бессимптомно. Его опасность заключается в том, что возможно дальнейшее развитие инфекционного мононуклеоза или онкозаболеваний.
У детей существует угроза заболевания и другими типами вируса герпеса, однако перечисленные являются наиболее распространенными. Определять тип вируса и назначать схему лечения должен только специалист.
Отсутствие полноценного иммунитета не дает возможности ребенку избежать инфицирования. Но создание чрезмерно стерильных условий может сослужить плохую службу – они не позволят выработать в детском организме собственную защиту.
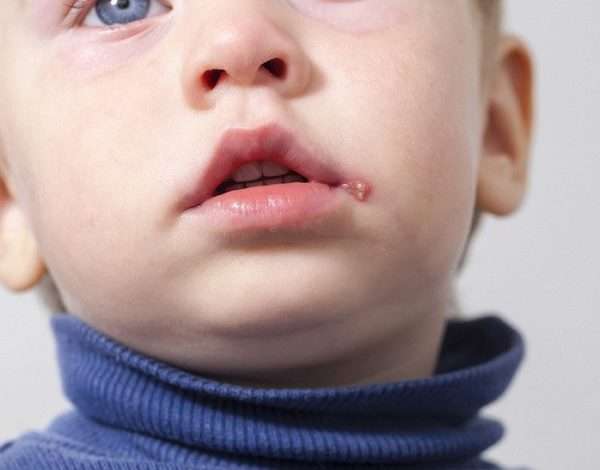
Перенесенное в раннем возрасте заболевание вирусом герпеса создаст надежный барьер на последующие годы. Задача взрослых состоит в том, чтобы малыш в этот период находился под наблюдением не только семьи, но и врача.
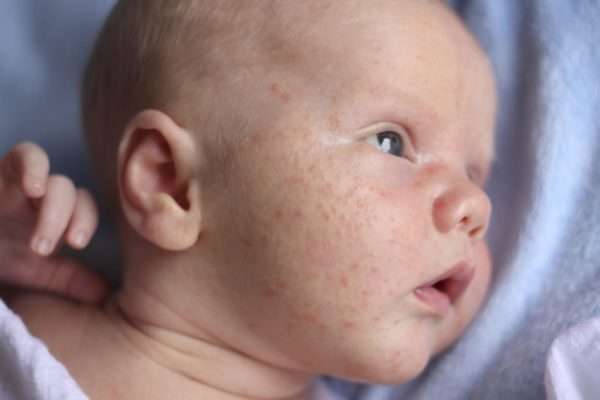
Неонатальный герпес
Неонатальный герпес – это заболевание, которое передается от матери к ребенку еще в период внутриутробного развития, если вирус преодолел барьер плаценты. Также заражение может произойти во время родового процесса или даже в первые дни после родов.
При инфицировании во время родов у ребенка может развиться:
- пневмония,
- гепатит,
- патологии в работе сердца и ЦНС,
- поражение органов слуха.
Неонатальный герпес опасен возникновением неврологических осложнений. Ими могут быть:
Эти заболевания вызывают поражение мозга у ребенка. Протекание их проходит в тяжелой форме, иногда заканчивается летальным исходом.
Наибольшую опасность представляет недавно возникшее или первичное заражение женщины. Отсутствие в ее организме анитител к вирусу делает плод или новорожденного ребенка полностью беззащитным перед болезнью. Риск его инфицирования в этой ситуации достаточно велик: он составляет 30% от числа выявленных заболеваний.
В случае диагностирования уже присутствующего вируса герпеса (вторичного) риск заражения ребенка составляет 1%. Иммунитет матери помогает малышу бороться с болезнью еще в утробе.
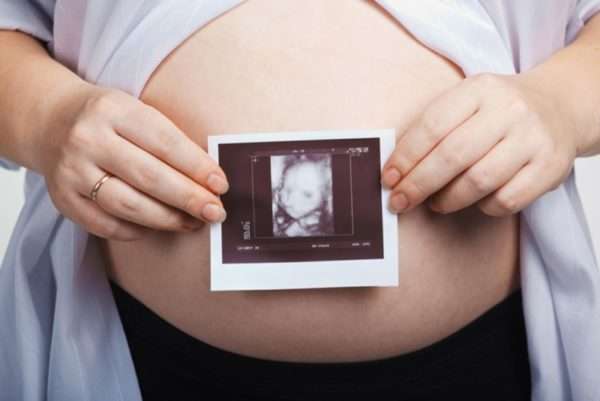
Группы риска при герпесе
Заболеть вирусом может практически любой человек: и взрослый, и ребенок. Этому способствуют многочисленные пути заражения, устойчивость и высокая способность вируса проникать в организм человека. Часть людей к нему особенно восприимчива.
К категории риска относятся:
- онкобольные,
- лица, имеющие ВИЧ и СПИД,
- беременные женщины,
- плод в чреве матери и новорожденные дети,
- люди, прошедшие полноценный курс лечения антибиотиками,
- пациенты, страдающие сахарным диабетом.
Меры профилактики осложнений при герпесе
Пока не найдена форма профилактики, которая полностью исключила бы инфицирование герпесом. Но уменьшить такую вероятность помогут:
- Поддержание гигиены: личной и членов семьи. Обязательна обработка рук с помощью антибактериальных препаратов, если рядом находится инфицированный человек. Не допускается пользование предметами, принадлежащими больному.
- Защищенный секс. Беспорядочные половые контакты без мер предохранения увеличивают риск заражения.
- Крепкий иммунитет. Правильный режим питания, полноценные отдых и сон, отсутствие стрессов и переохлаждения, нормализация работы ЖКТ укрепят иммунную систему.
- Противовирусные препараты. Их прием поможет создать барьер для проникновения вируса.
- Использование вакцины. Для проведения вакцинации рекомендуется использовать период ремиссии.
Выполнение этих правил может стать надежной защитой в борьбе с вирусом герпеса.
Помогите своему организму, и он ответит вам крепким здоровьем.
Инфекции остаются важнейшей причиной заболеваемости и смертности у больных с пересаженными почками.
1. Бактериальные инфекции после трансплантации почки. Чаще всего встречаются пневмония и инфекции мочевых путей. Последние могут быстро переходить в уросепсис и иногда бывают ошибочно приняты за острое отторжение трансплантата.
2. Вирусные инфекции после трансплантации почки. Особую опасность представляют герпесвирусы (цитомегаловирус, вирус простого герпеса, вирус varicella-zoster и вирус Эпштейна—Барр). У детей младшего возраста первый контакт с этими вирусами часто бывает уже после трансплантации почки, и тогда первичная инфекция на фоне иммунодепрессантов может протекать у них очень тяжело.
Частота этих заболеваний существенно возрастает после лечения антилимфоцитарными препаратами или пульс-терапии большими дозами глюкокортикоидов. В таких случаях показана профилактика герпесвирусных инфекций.
а) Цитомегаловирус. Цитомегаловирусная инфекция может протекать в виде носительства (вирус персистирует в лимфоидной ткани). Серологические пробы на цитомегаловирус положительны приблизительно у 30% детей старше 5 лет и у 60% подростков. Следовательно, чем младше ребенок, тем выше риск первичной цитомегаловирусной инфекции при трансплантации почки от инфицированного донора.
Она может проявляться лихорадкой, лейкопенией, тромбоцитопенией, пневмонией, язвами ЖКТ, гепатитом, гломерулопатией и почечной недостаточностью, острым отторжением трансплантата и подавлением иммунитета. Установлена связь между цитомегаловирусной инфекцией и хроническим отторжением при трансплантации любых органов. Для лечения и профилактики применяют иммуноглобулин против цитомегаловируса, нормальный иммуноглобулин для в/в введения в высоких дозах и противовирусные препараты — ацикловир, валацикловир, ганцикловир и валганцикловир.
Профилактическое лечение ганцикловиром показано серонегативным реципиентам почки от серопозитивного донора.
б) Вирус varicella-zoster. У детей старшего возраста, перенесших трансплантацию почки, вирус varicella-zoster чаще всего вызывает опоясывающий лишай — локальные пузырьковые высыпания в пределах одного дерматома. У детей младшего возраста возможна быстропрогрессирующая тяжелейшая инфекция с энцефалитом, пневмонией, печеночной недостаточностью, панкреатитом и ДВС-синдромом.
Серонегативным детям в течение 72 ч с момента случайного контакта с больным необходимо ввести иммуноглобулин против вируса varicella-zoster, в 75% случаев это существенно облегчает протекание инфекции. До трансплантации ребенка следует вакцинировать против вируса varicella-zoster. При появлении ветряночной сыпи у ребенка с пересаженной почкой необходимо немедленно ввести ацикловир парентерально. Опоясывающий лишай менее склонен к диссеминации, но ацикловир все же показан.
в) Вирус Эпштейна—Барр. Примерно 50% детей серонегативны в отношении вируса Эпштейна— Барр, и приблизительно 75% из них после трансплантации почки инфицируются. Инфекция вирусом Эпштейна—Барр даже на фоне иммунодепрессантов в большинстве случаев протекает бессимптомно. В то же время у 0,5—2% детей после трансплантации почки возникает лимфопролиферативный синдром, часто обусловленный инфекцией вирусом Эпштейна—Барр на фоне интенсивной иммуносупрессивной терапии.
Он может проявляться лихорадкой, потерей веса, гепатоспленомегалией, поносом, увеличением лимфоузлов, а при поражении ЦНС — неврологической симптоматикой. Лечение включает резкое снижение доз иммунодепрессантов, а при наличии очагов высокой степени злокачественности — химиотерапию и антилимфоцитарные средства.
г) Вирус простого герпеса. Типичные герпетические изъязвления около рта при применении иммунодепрессантов встречаются часто и обычно излечиваются при приеме ацикловира внутрь.
3. Пневмоцистная пневмония после трансплантации почки. Для профилактики пневмоцистной пневмонии после трансплантации показан 3—6-месячный курс триметоприма/сульфаметоксазола.
Все авторы участвовали в рассмотрении и обсуждении предмета. Главным автором был Азеведо Л.С. Pierrotti LC и Yasuda MAS рассмотрели рукопись.
Цитомегаловирусная инфекция является частым осложнением после трансплантации. Эта инфекция возникает из-за передачи из трансплантированного органа из-за реактивации скрытой инфекции или после первичной инфекции у серонегативных пациентов и может быть определена следующим образом: латентная инфекция, активная инфекция, вирусный синдром или инвазивное заболевание. Это состояние происходит в основном между 30 и 90 днями после трансплантации. При трансплантации гемопоэтических стволовых клеток, в частности, инфекция обычно возникает в течение первых 30 дней после трансплантации и в присутствии заболевания трансплантата против хозяина. Основными факторами риска являются то, что реципиент является серонегативным цитомегаловирусом, а донор является серопозитивным, а также когда используются истощающие лимфоциты антитела.
Существует два метода диагностики цитомегаловирусной инфекции: анализ антигеномии рр65 и полимеразная цепная реакция. Серология не имеет значения для диагностики активной болезни, тогда как гистология пораженной ткани и анализ бронхоальвеолярного лаважа полезны при диагностике инвазивного заболевания.
Цитомегаловирусную болезнь можно предотвратить профилактикой (введение противовирусных препаратов всем или в подгруппу пациентов с повышенным риском репликации вируса) или путем превентивной терапии (ранняя диагностика вирусной репликации до развития заболевания и назначение противовирусных препаратов лечение, чтобы предотвратить появление клинического заболевания). Используемый препарат является внутривенным или оральным ганцикловиром; оральный валганцикловир; или, реже, валацикловир. Профилактика должна продолжаться от 90 до 180 дней. Лечение всегда указывается при цитомегаловирусной болезни, а стандартом на основе золота является внутривенный ганцикловир. Лечение следует назначать на 2 — 3 недели и его следует продолжать в течение еще 7 дней после первого отрицательного результата для виремии.
Цитомегаловирус (ЦМВ) является вездесущим вирусом герпеса, который поражает до 60-100% людей в зрелом возрасте и является одним из основных агентов, участвующих в инфекционных осложнениях после трансплантации. CMV, подобно другим вирусам герпеса, создает скрытую инфекцию после первичной инфекции. В иммунокомпетентном хозяине начальная инфекция обычно протекает бессимптомно, но может присутствовать как неопределенный фебрильный, гриппоподобный или мононуклеоз-подобный синдром. В редких случаях инфекция представляет собой системный синдром, затрагивающий многие органы. Кроме того, иммунокомпетентные взрослые могут позднее проявить клинический синдром в результате реактивации скрытого вируса или из-за новой инфекции другим вирусным штаммом. Заболевание, вызванное посттрансплантационной ЦМВ (ПТ-ЦМВ), происходит из-за передачи из трансплантированного органа из-за реактивации скрытой инфекции или после первичной инфекции у пациентов с серонегативными трансплантатами 1-5.
ЦМВ-инфекцию и болезнь можно определить следующим образом:
латентная инфекция — после первоначального иммунного ответа вирус сохраняется в скрытом состоянии, главным образом в клетках миелоидной линии, и использует различные механизмы для уклонения от иммунной системы и для выживания.
активная инфекция — наличие вирусной репликации, диагностированной путем выращивания вируса in vitro; путем обнаружения внутрицитоплазматических и внутриядерных включений, которые являются характеристиками вируса; путем идентификации вируса посредством окрашивания тканей биопсийным материалом; или путем обнаружения доказательств вирусной репликации, обнаруженной антигенетическим анализом или молекулярными методами.
болезнь — свидетельство заражения симптомами, приписываемыми ей.
вирусный синдром — наличие признаков и симптомов заболевания и подтверждение репликации вируса в периферической крови (обнаружено с помощью антигенетического анализа или молекулярных методов).
инвазивное заболевание — наличие специфических симптомов в органе-мишени и гистологические данные, демонстрирующие цитопатический эффект вируса в ткани. В этих случаях могут быть или не быть свидетельства вирусной репликации в периферической крови.
Наиболее распространенной клинической картиной в пересаженном хозяине является вирусный синдром, характеризующийся лихорадкой и недомоганием, а также лейкопенией, тромбоцитопенией и повышенными ферментами печени. Эти знаки появляются с 3 по 4 неделю, с пиком с 6 по 16 неделю, и становятся редкими после 6-го месяца. Симптомы верхнего пищеварительного тракта и, главным образом, боль, являются общими. Диарея, иногда содержащая кровь, является более необычной и указывает на участие толстой кишки. Дыхательные симптомы указывают на более тяжелое заболевание и могут потребовать приема в отделение интенсивной терапии. Кроме того, клинический гепатит, менингоэнцефалит, панкреатит и миокардит встречаются редко. В отличие от того, что обнаружено у ВИЧ-инфицированных пациентов, хориоретинит очень редок у пересаженных пациентов.
Возникновение заболевания, вызванного ЦМВ у трансплантированных пациентов без профилактики, варьируется в зависимости от типа трансплантации, серологического соответствия между донором и реципиентом, используемых иммунодепрессантов (у пациентов с ингибиторами mTOR наблюдается очень низкая частота ЦМВ) и интерференция дополнительных факторы риска болезни. Заболеваемость выше у пациентов, перенесших трансплантацию легкого или сердца и легких (частота 50-75%), и у пациентов, перенесших трансплантацию поджелудочной железы или почек поджелудочной железы (около 50%). Заболеваемость ЦМВ составляет от 9 до 23% после трансплантации сердца, от 22 до 29% после трансплантации печени и от 8 до 32% после трансплантации почки 7. Более того, 30% пациентов, подвергшихся аллогенной трансплантации гемопоэтических стволовых клеток (HSCT), и приблизительно 5% пациентов, подвергшихся аутологичному HSCT, развивают заболевание ЦМВ.
При трансплантации твердых органов (SOT) наибольший фактор риска заболевания ЦМВ представляет собой серологическое рассогласование между донором и реципиентом (получатель серонегативный ЦМВ и донор серопозитивный) (ЦМВ D + / R-). Кроме того, трансплантация CMV D + / R + и трансплантация CMV D- / R + считаются промежуточным риском развития болезни, а трансплантация CMV D- / R-трансплантата считается низким риском ( 2000 копии / мл цельной крови 35,36. Эволюция вирусной нагрузки во времени может быть более важной для прогнозирования развития болезни, чем любые абсолютные значения вирусной нагрузки. Предел обнаружения варьируется в зависимости от различных тестов на вирусную нагрузку, и более низкий предел обнаружения более 1000 копий / мл (с использованием цельной крови или плазмы) может быть недостаточным для выявления заболевания, поскольку некоторые тяжелобольные пациенты могут проявлять очень низкие вирусные нагрузки. Однако очень чувствительный тест (ограничение обнаружения 100 дней после трансплантации) произошло у 24% пациентов, проходящих профилактику, по сравнению с 0% пациентов, подвергающихся превентивному лечению. В другом исследовании Kliem et al. 66 обнаружили значительное снижение заболеваемости ЦМВ за 12 месяцев (17% в группе профилактики и 50% в группе с преимущественным лечением). Пациенты по профилактике развивали инвазивные инфекции позже (135 против 39 дней после трансплантации). В краткосрочной перспективе не было существенной разницы в почечной функции. Тем не менее, частота потери трансплантата на 4-й год после трансплантации была выше у пациентов с упреждающим лечением (78% против 92%). Witzke et al. 68 выявили соответствующие показатели виремии 38,7% против 11% и инвазивные показатели ЦМВ-заболеваний 19,2% против 4,4% в группах превентивного и профилактического лечения. Spinner et al. 69 не обнаружили долгосрочных (4 лет) различий в отношении острого отторжения, потери почек или смерти у пациентов при профилактике или при упреждающем лечении. Reischig et al. 36 была обнаружена сходная частота заболевания ЦМВ с преимущественным лечением и профилактикой (6% против 9%), а появление виремии произошло при 37 по сравнению с 187 днями после трансплантации. Острый отказ был более частым в группе упреждающих (36% против 15%). В двух исследованиях сравнительные затраты были оценены и были одинаковыми в двух схемах, учитывая стоимость противовирусных препаратов и мониторинг с помощью ПЦР 35,58. Примечательно, что затраты на антигенетическое тестирование ниже, чем у RT-PCR.
Существует также гибридная стратегия, используемая некоторыми центрами трансплантации в случаях D + / R: профилактика с последующим превентивным лечением, чтобы предотвратить появление позднего инвазивного заболевания 28.
Использование противовирусных препаратов должно основываться на стандартизированных дозах с соответствующими алгоритмами коррекции уровня почечной функции (таблицы 2 и 3).
Согласно действующим правилам 28,70, варианты профилактики включают внутривенный ганцикловир, оральный валганцикловир и высокие дозы орального валацикловира у реципиентов почечной трансплантации. Был использован оральный ганцикловир, хотя в нескольких исследованиях были получены менее оптимальные результаты.
Хотя валганцикловир является лучшим препаратом для профилактики, потому что он эффективен и доступен в устной форме, его высокая стоимость ограничивает его использование, и он часто недоступен. Таким образом, внутривенный ганцикловир можно рассматривать, поскольку он дешевле и широко доступен, несмотря на необходимость внутривенного использования. Этот препарат использовался даже в виде трехкратного еженедельного приема 71. Валацикловир, хотя и менее эффективен, также доступен в устной форме и может быть альтернативой никакому лекарству вообще 72, 73.
Что касается профилактики заболевания ЦМВ, лечение пероральным CMX001 в дозе 100 мг два раза в неделю уменьшало частоту случаев ЦМВ у реципиентов HSCT, а диарея была распространенным побочным эффектом в дозе 200 мг, назначаемой дважды в неделю 74.
Лечение всегда проявляется при вирусном синдроме, в присутствии заболевания ЦМВ (свидетельство ЦМВ-инфекции с признаками и симптомами заболевания), а также при повреждении тканей и органов при гистологических и иммуногистохимических изменениях. Во время эпиднадзора за превентивным лечением антивирусные препараты следует начинать, как только наличие реплицирующего вируса обнаруживается либо антигенетией, либо RT-PCR-тестированием.
Стандартным лекарственным средством для лечения является внутривенный ганцикловир. Существует ограниченное доказательство того, что оральный валганцикловир также эффективен 75. Поэтому внутривенный ганцикловир является выбором для тяжелой инфекции, но для легкой и умеренной инфекции можно использовать лечение валганцикловиром. Ацикловир и валацикловир не указаны для лечения. Сопутствующее применение микофенолята, азатиоприна, ингибиторов mTOR или сульфаметоксазол-триметоприма может способствовать лейкопении. Следует также избегать модификаций установленных терапевтических режимов, за исключением случаев отмеченной лейкопении. В таких случаях указывается filgrastim.
Рекомендуемая продолжительность лечения определяется недельным мониторингом вирусных нагрузок ЦМВ; лечение должно быть непрерывным до тех пор, пока вирусная эрадикация не будет достигнута в течение одного или двух анализов через минимум две недели. Использование иммунных анализов может иметь потенциальную клиническую полезность для определения длины лечения и выявления пациентов с отрицательными результатами анализа в конце лечения, которые могут воспользоваться вторичной профилактикой 24,28,59.
Факторы риска, которые указывают на необходимость длительного лечения, включают высокую виремию в начале лечения и рецидив ЦМВ. Факторы риска для резистентности включают длительное противовирусное лекарственное воздействие при продолжающейся активной репликации вируса, высокий уровень иммуносупрессивной терапии и неадекватные противовирусные дозы 28. Сопротивление лекарственным средствам следует подозревать в сохранении или увеличении вирусной нагрузки в присутствии профилактики ЦМВ как постоянная репликация вируса и / или клиническая прогрессия после двух-трех недель лечения 28,73.
Фоскарнет является альтернативным вариантом для резистентных к ганцикловиру ЦМВ, хотя частые побочные эффекты и главным образом нефротоксичность ограничивают его использование 44,76.
По завершении лечения острой инфекции консенсус не был достигнут в отношении использования вторичной профилактики. Однако некоторые авторы рекомендуют этот подход для пациентов с высоким риском 28.
Реактивация ЦМВ может возникать у 30% пациентов с ГСКТ и у 70% пациентов с высоким риском, таких как у пациентов с положительной серологией, которые получали трансплантат от отрицательного донора 77. В общей сложности 30% пациентов, подвергающихся аллогенной трансплантации, и приблизительно У 5% пациентов, перенесших аутологичную трансплантацию, развивается заболевание ЦМВ. В HSCT реактивация обычно происходит в течение первых 30 дней после трансплантации и у тех, кто развивает РТПХ. ЦМВ можно реактивировать на протяжении всего периода применения иммуносупрессивного препарата 78,79. Смертность у пациентов с пневмонией или распространенным заболеванием может достигать 90%. Реактивация ЦМВ может также представлять собой задержку приживления. Превентивное лечение уменьшает заболеваемость и смертность этого агента в этой популяции пациентов. Ljungman et al. 79 показали, что заболеваемость ЦМВ-болезнью у пациентов, получавших преимущественное лечение, составила 1,8% через 100 дней после трансплантации и 6,3% через год после трансплантации.
ЦМВ-отрицательные пациенты с ЦМВ-негативными донорами должны получать только продукты с обедненной лейкоцитами крови или переливания от ЦМВ-негативных доноров. Превентивное лечение показано как при аутологичной, так и при аллогенной трансплантации. Лечение начинается при кондиционировании и сдаётся на 100-й день после трансплантации. Также проводятся два недельных обследования (антигенэмия или RT-ПЦР-тестирование). У педиатрических пациентов с аутологичной трансплантацией лечение начинается после приживления и назначается до 60-го дня после трансплантации, с недельными обследованиями (антигенэмия или RT-ПЦР-тестирование). При аллогенных трансплантациях лечение начинается на 10-й день после трансплантации и продолжается до 100-го дня. Лечение также предоставляется пациентам, которые развивают РТПХ. Сравнение между испытанием на вирусную нагрузку и тестом на антигенэмиссию для рекомендации по упреждающему лечению у получавших ХСКТ показало, что использование тестирования на вирусную нагрузку значительно сократило число пациентов, которым требуется преимущественное лечение, без увеличения ЦМВ-заболевания. Сопоставимые данные недоступны для SOT.
Заболеваемость ЦМВ-инфекцией и заболеванием выше у реципиентов трансплантации легких, чем у других реципиентов SOT с частотой от 54% до 92% у пациентов без профилактики ЦМВ 80. В дополнение к прямой заболеваемости и смертности ЦМВ-инфекция ассоциируется с эпизодами острого клеточного отторжения, а также с хронической дисфункцией аллотрансплантата, которая является основным ограничивающим фактором для долгосрочного успеха трансплантации легкого 81. Хотя ни одно исследование не сравнило профилактику и превентивную терапию при трансплантации легких, высокая частота этих осложнений после операции, трансплантация делает использование профилактики ЦМВ существенным в реципиентах трансплантации легких.
В 2005 году консультативный комитет экспертов ЦМВ учредил следующие рекомендации для центров трансплантации легких 82:
Все получатели трансплантации легких должны пройти профилактику ЦМВ, как показано ниже:
1-Профилактику следует проводить с помощью валганцикловира 900 мг / сут (доза, скорректированная на скорость клубочковой фильтрации) в течение не менее 100 дней;
2-Длительная профилактика (более 180 дней) может быть рассмотрена всеми центрами с учетом снижения заболеваемости / заболевания и косвенных последствий ЦМВ;
3-Профилактика должна сочетать противовирусные препараты и CMV-иммуноглобулин, который эффективен для профилактики ЦМВ-инфекции / заболевания и должен рассматриваться для групп высокого риска (D + / R-пациентов и пациентов, использующих ATG);
4 — В течение первых 6 месяцев после трансплантации, включая период профилактики, мониторинг виремии ЦМВ должен проводиться каждые 2 недели (путем тестирования антигенетий RT-PCR или pp65) в соответствии с местными протоколами, и через 6 месяцев мониторинг должен выполняются ежемесячно до конца первого года после трансплантации.
Не сообщалось о потенциальном конфликте интересов.
Определения: синдром ЦМВ и болезнь, поражающая различные органы 19-22.
Доказательства активного ЦМВ в крови: положительность антигенэмии или ОТ-ПЦР-тестирование.
Противовирусные лекарственные дозы, рекомендованные для профилактики в соответствии со скоростью клубочковой фильтрации, которая оценивается на основе клиренса креатинина.
1 таблетка = 500 мг
1 таблетка = 450 мг
некоторые авторы рекомендуют 450 мг / день 2
рекомендуется использовать внутривенный ганцикловир
Примечание: валацикловир и валганцикловир следует давать во время еды
Противовирусные лекарственные дозы, рекомендованные для лечения в соответствии со скоростью клубочковой фильтрации, которая оценивается на основе клиренса креатинина.
1 таблетка = 450 мг
рекомендуется использовать внутривенный ганцикловир
Примечание: валацикловир и валганцикловир следует давать во время еды
Читайте также:


