Модель кори полинга колтуна
- 6814
- 5,9
- 2
- 3
Введение
В 40-х годах прошлого века началось бурное развитие структурной химии и рентгеновской кристаллографии, что привело к определению первых пространственных структур органических молекул. Возможности структурных формул оказались исчерпаны, так как с их помощью (хоть они и называются структурными) крайне затруднительно передать трехмерное строение сложной молекулы. Вскоре последовавшие открытия структур белковых молекул и ДНК создали дополнительную потребность в способах наглядного изображения пространственной структуры биомакромолекул.
Середина XX века была ознаменована двумя крупнейшими открытиями, положившими начало структурной биологии и невероятно продвинувшими вперед все биологические науки. Эти открытия связаны с установлением принципов пространственной организации двух классов биологически важных макромолекул: белков и дезоксирибонуклеиновой кислоты (ДНК).

Лайнус Полинг рассказывает о том, как он открыл α-спираль.
Однажды, когда я работал в Оксфорде (дело было в апреле 1948 года), я заболел, и после двух дней в постели, проведенных за чтением фантастики и детективов, я подумал: „А не открыть ли мне α-спираль?“, или что-то вроде этого. Чтобы понять, как устроена полипептидная цепь с учётом всех требований структурной химии и как водородные связи поддерживают структуру белка, я взял лист бумаги навроде этого [берет лист бумаги] и нарисовал на нем полипептидную цепь в распрямлённой конформации (кстати, этот лист остался у меня до сих пор). Я стал складывать лист бумаги так, чтобы угол между Cα-атомами соседних остатков составлял около 110° [складывает листок], и после нескольких попыток сложил его таким образом, чтобы каждая NH и CO группа участвовала в образовании связи N-H···O=C. Я понял, что эта структура, присутствующая в белках, выделенных из волос, рога, ногтей и мышечных волокон, называемая α-спиралью, содержит 3,6 аминокислотных остатка на один виток спирали.
Немного сокращённый перевод речи Полинга
Уотсон, видимо, был настолько поражён элегантным открытием Полинга и его моделями, что в своей работе делал ставку главным образом на молекулярные модели как инструмент, с помощью которого можно было объяснить дифракционные данные, полученные Фрэнклин:
Однако в ближайшие несколько дней ни одной серьезной модели мы не построили. Нам не только не хватало моделей пуриновых и пиримидиновых оснований, но мастерская так и не изготовила для нас ни одной модели атома фосфора. Для того чтобы сделать даже самые простые атомы фосфора, нашему механику требовалось не менее трех дней, а потому после обеда я пошел к себе в Клэр-колледж привести в порядок статью по генетике.
Фрэнсис все больше тревожился из-за того, что я перестал работать над молекулярными моделями. … Чуть ли не каждый день после обеденного перерыва он то и дело раздраженно косился на заброшенный полинуклеотидный остов, зная, что я тем временем играю где-нибудь в теннис. … Брюзжание Фрэнсиса меня не беспокоило — усовершенствовать дальше наш последний остов не имело смысла, пока не будет решена проблема оснований.

архив лаборатории Колд Спринг Харбор

Френсис Крик рассказывает об открытии структуры ДНК в виде двух антипараллельных комплементарных друг другу цепей, образующих двойную спираль, и демонстрирует молекулярную модель ДНК.
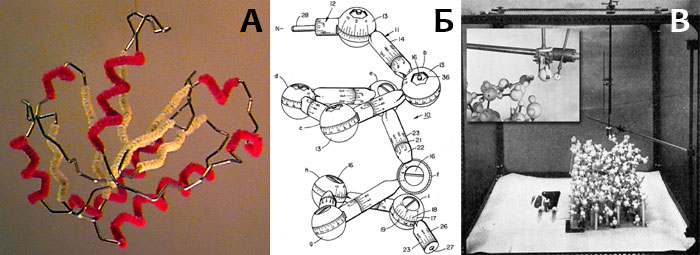
Модель Полинга оказалась очень удачной, и на её основе был разработан промышленный стандарт и выпущены многочисленные наборы для построения моделей молекул.

Рисунок 3. Слева: Фрагмент рисунка из патента, выданного Колтуну на его изобретение (1962). Рисунок объясняет устройство соединительных элементов, используемых для сборки моделей. Модели атомов и соединительные элементы были спроектированы с учётом требований, выдвинутых комитетом разработчику (см. ниже). Справа: Модель молекулы дипептида ГЛУ–ТРП, собранная из CPK-конструктора, найденного в лаборатории моделирования биомолекулярных систем Института биоорганической химии РАН (краешек пальца на фотографии мой. — А. Ч.).
Характеристики молекулярных моделей C-P-K [6]:
- Размеры. Углы и длины связей, а также ван-дер-ваальсовы радиусы атомов должны соответствовать наиболее актуальным научным данным. Валентные углы должны воспроизводиться с допуском ±0°30’, длины связей — ±0,01 Å, а радиусы атомов — ±0,03 Å;
- Масштаб должен составлять 1,25 см/Å. Этого достаточно для построения точных моделей при невысокой стоимости изготовления. Так, молекула с размерами 20×40×100 Å будет изображена моделью 25×50×125 см;
- Вес моделей атомов должен быть настолько мал, насколько это возможно (без нарушения остальных требований);
- Ограничение на вращение. Связи, не способные к вращению, должны быть зафиксированы. В остальных случаях вращение должно быть ограничено в соответствии с торсионным потенциалом;
- Водородные связи. В моделях должна присутствовать возможность образования водородных связей, столь существенных для функций макромолекул;
- Типы атомов. Разнообразие типов атомов в наборе должно позволять конструкцию всех практически важных типов биологических молекул;
- Спецатомы. Должна быть предусмотрена возможность изготовления спецатомов, важных в ряде случаев (хоть и не выпускаемых массово из-за редкого использования). Эти атомы должны быть совместимы с другими атомами в наборе;
- Соединительные элементы должны (а) надёжно фиксировать атомы; (б) позволять варьирование валентных углов в диапазоне ±8° без существенных усилий; (в) предотвращать самопроизвольное проворачивание групп атомов (до 50) под действием их собственного веса и не прогибаться более чем на 3° под этим весом и (г) позволять варьирование длин связей (в разумных пределах);
- Материалы и стоимость. Модели должны быть изготовлены из пластмассы со средней стоимостью около 15 центов за атом. Эта цена учитывает массовое производство и возможность государственной субсидии на изготовление сложных форм для отливки.
Первая пространственная структура белка, полученная Джоном Кендрю (John Kendrew) в 1958 году [7] с помощью анализа дифракции рентгеновских лучей на белковом кристалле, поразила учёных в первую очередь тем, что в ней не наблюдалось никакой симметрии. Многочисленные α-спиральные элементы в структуре миоглобина (именно этот белок исследовал Кендрю) располагались в пространстве прихотливым образом, подтверждая открытие Полинга о том, что α-спираль — один из основных типов укладки полипептидной цепи.
2500 вертикальными металлическими палочками, затруднявшими её построение, восприятие и переноску (рис. 4В).
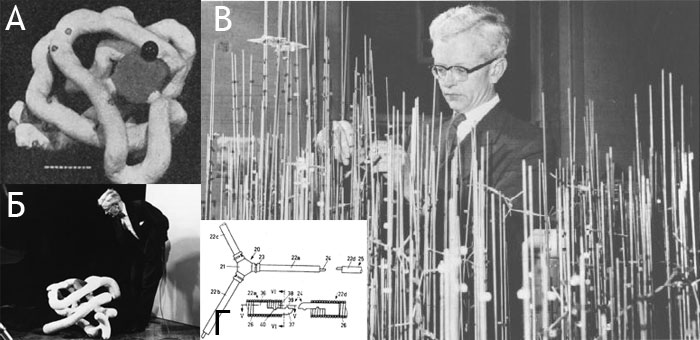
Модель, построенная Кендрю, была очень сложна в обращении и почти не поддавалась модификации, и, когда потребовалось построить несколько копий этой модели по запросу других университетов и лабораторий, возникла проблема создания более надёжной и удобной конструкции. В решении этой задачи помог Баркер (A.A. Barker), сотрудник инженерной лаборатории в Кембридже. Начиная с 1965 года, он конструировал молекулярные модели различных биомолекул, включая ДНК, витамин B12, инсулин, α-спираль и др. Кендрю предложил Баркеру использовать компоненты, изготовленные Биверсом (C.A. Beevers), профессором химии из Эдинбургского университета, — небольшие пластиковые шарики диаметром 6.9 мм с просверленными в них с помощью специального устройства отверстиями, в которые вставлялись лёгкие металлические трубочки. В первые же годы (с 1966 по 1968) Кендрю поступило около 30 заказов на молекулярные модели миоглобина и других белков, изготавливаемые в масштабе 1 см/Å примерно за месяц на одну модель (рис. 5). Цена моделей была около 600$, что являлось весьма существенной суммой в те времена.

Хотя первая пространственная структура белка была получена Джоном Кендрю, истинным первооткрывателем в данной области является другой человек — Макс Перутц (Max Perutz). Именно ему принадлежит идея изоморфного замещения, когда в определённые позиции белковой молекулы вводится атом тяжёлого металла, и на основании получаемых при этом искажений дифракционной картины появляется возможность установить структуру молекулы. В 1960 году Перутцем и его коллегами была получена пространственная структура гемоглобина [8] — белка существенно более сложного, нежели миоглобин.
Для визуализации пространственных карт электронной плотности Перутц использовал более количественный метод, чем Кендрю в своей первой структуре. Изопотенциальные области электронной плотности выпиливались из толстого куска пластмассы и скреплялись стопками, что позволило изобразить пространственную структуру молекулы (рис. 6).

Макс Перутц рассказывает историю открытия структуры гемоглобина. Интервью было записано в 2001 году, незадолго до его смерти (Макс Перутц умер 6 февраля 2002 года).


Начало компьютерной эры в визуализации молекул
Уже в 1964 году Сайрус Левинталь (Cyrus Levinthal) и его коллеги в Массачусетском Технологическом Институте (МТИ) разработали электронную систему, изображавшую основную цепь белка на экране осциллографа с возможностью вращения этой модели с помощью специального трекбола. Расчёты, необходимые для вывода картинки на экран осциллографа (рис. 10), производились на одном из первых мейнфреймов (проект “Multi-Access Computer”).
Пока еще невозможно оценить все преимущества, которые может дать компьютер при решении современных проблем молекулярной биологии. Однако, очевидно, что комбинация человек-машина может быть чрезвычайно эффективной. Уже показано, что компьютер может использоваться для построения и визуализации крупных молекул, и это его применение весьма полезно для понимания механизмов функционирования молекул. В то же время, не один год пройдёт, прежде чем полностью будет осознано, насколько важно интерактивное общение с компьютером в процессе построения модели белка.

Немного позже был разработан компьютерный алгоритм построения закрашенных поверхностей с учётом теней [21]. Это произвело целую революцию в компьютерной графике, поскольку позволяло показывать молекулы с совершенно новым уровнем наглядности, хоть в то время эта возможность была доступна лишь на самых мощных машинах.
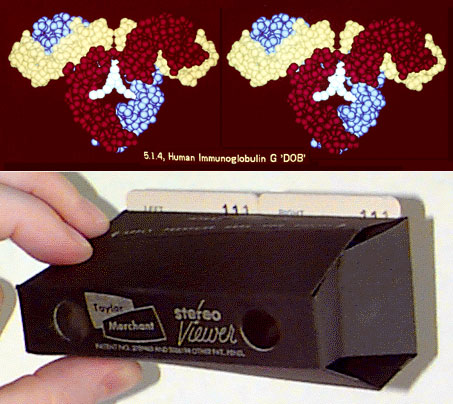
Рисунок 11. Стереослайды для образовательных целей (TAMS). Сверху: Иммуноглобулин “DOB” человека (только Cα-атомы). Лёгкая цепь показана жёлтым цветом, тяжёлые — красным и голубым. Молекула углевода окрашена в бирюзовый цвет. Снизу: Устройство для просмотра слайдов на просвет (“Tailor Merchant 101”).

Заключение
Последнее, что хотелось бы отметить, — чрезвычайная простота визуализации молекул, достигнутая в наше время (не нужно ничего, кроме самого простого компьютера и интернета), стала скорее затмевать механизмы работы молекул для рядовых пользователей программ визуализации, нежели прояснять их. Если раньше модель структуры молекулы становилась вершиной работы мысли учёного, то теперь, благодаря успехам структурной геномики и развитию компьютерных технологий, вывести на экран и покрутить молекулу белка не представляет ни малейшей сложности.
Вторичная структура представляет собой способ укладки полипептидной цепи в упорядоченную структуру благодаря образованию водородных связей между пептидными группами одной цепи или смежными полипептидными цепями. По конфигурации вторичные структуры делятся на спиральные (α-спираль) и слоисто-складчатые (β-структура и кросс-β-форма).
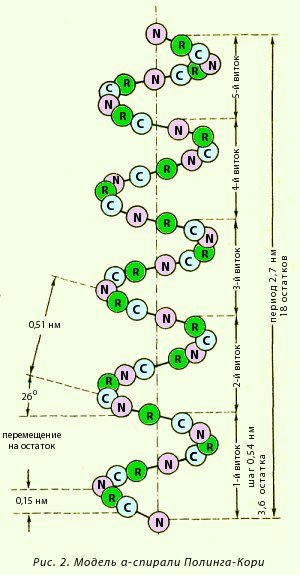
α-Спираль. Это разновидность вторичной структуры белка, имеющая вид регулярной спирали, образующейся благодаря межпептидным водородным связям в пределах одной полипептидной цепи. Модель строения α-спирали (рис. 2), учитывающая все свойства пептидной связи, была предложена Полингом и Кори. Основные особенности α-спирали:
· спиральная конфигурация полипептидной цепи, имеющая винтовую симметрию;
· образование водородных связей между пептидными группами каждого первого и четвертого аминокислотных остатков;
· регулярность витков спирали;
· равнозначность всех аминокислотных остатков в α-спирали независимо от строения их боковых радикалов;
· боковые радикалы аминокислот не участвуют в образовании α-спирали.
Внешне α-спираль похожа на слегка растянутую спираль электрической плитки. Регулярность водородных связей между первой и четвертой пептидными группами определяет и регулярность витков полипептидной цепи. Высота одного витка, или шаг α-спирали, равна 0,54 нм; в него входит 3,6 аминокислотных остатка, т. е. каждый аминокислотный остаток перемещается вдоль оси (высота одного аминокислотного остатка) на 0,15 нм (0,54:3,6 = 0,15 нм), что и позволяет говорить о равнозначности всех аминокислотных остатков в α-спирали. Период регулярности α-спирали равен 5 виткам или 18 аминокислотным остаткам; длина одного периода составляет 2,7 нм. Рис. 3. Модель а-спирали Полинга—Кори
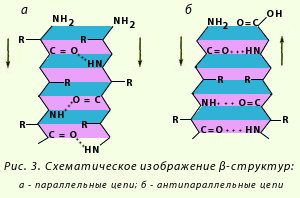
β-Структура. Это разновидность вторичной структуры, которая имеет слабо изогнутую конфигурацию полипептидной цепи и формируется с помощью межпептидных водородных связей в пределах отдельных участков одной полипептидной цепи или смежных полипептидных цепей. Ее называют также слоисто-складчатой структурой. Имеются разновидности β-структур. Ограниченные слоистые участки, образуемые одной полипептидной цепью белка, называют кросс-β-формой (короткая β-структура). Водородные связи в кросс-β-форме образуются между пептидными группами петель полипептидной цепи. Другой тип — полная β-структура — характерен для всей полипептидной цепочки, которая имеет вытянутую форму и удерживается межпептидными водородными связями между смежными параллельными полипептидными цепями (рис. 3). Эта структура напоминает меха аккордеона. Причем возможны варианты β-структур: они могут быть образованы параллельными цепями (N-концы полипептидных цепей направлены в одну и ту же сторону) и антипараллельными (N-концы направлены в разные стороны). Боковые радикалы одного слоя помещаются между боковыми радикалами другого слоя.
В белках возможны переходы от α-структур к β-структурам и обратно вследствие перестройки водородных связей. Вместо регулярных межпептидных водородных связей вдоль цепи (благодаря им полипептидная цепь скручивается в спираль) происходит раскручивание спирализованных участков и замыкание водородных связей между вытянутыми фрагментами полипептидных цепей. Такой переход обнаружен в кератине — белке волос. При мытье волос щелочными моющими средствами легко разрушается спиральная структура β-кератина и он переходит в α-кератин (вьющиеся волосы распрямляются).
Разрушение регулярных вторичных структур белков (α-спирали и β-структур) по аналогии с плавлением кристалла называют "плавлением" полипептидов. При этом водородные связи рвутся, и полипептидные цепи принимают форму беспорядочного клубка. Следовательно, стабильность вторичных структур определяется межпептидными водородными связями. Остальные типы связей почти не принимают в этом участия, за исключением дисульфидных связей вдоль полипептидной цепи в местах расположения остатков цистеина. Короткие пептиды благодаря дисульфидным связям замыкаются в циклы. Во многих белках одновременно имеются α-спиральные участки и β-структуры. Природных белков, состоящих на 100% из α-спирали, почти не бывает (исключение составляет парамиозин — мышечный белок, на 96-100% представляющий собой α-спираль), тогда как у синтетических полипептидов 100%-ная спирализация.
Другие белки имеют неодинаковую степень спирализации. Высокая частота α-спиральных структур наблюдается у парамиозина, миоглобина, гемоглобина. Напротив, у трипсина, рибонуклеазы значительная часть полипептидной цепи укладывается в слоистые β-структуры. Белки опорных тканей: кератин (белок волос, шерсти), коллаген (белок сухожилий, кожи), фиброин (белок натурального шелка) имеют β-конфигурацию полипептидных цепей. Разная степень спирализации полипептидных цепей белков говорит о том, что, очевидно, имеются силы, частично нарушающие спирализацию или "ломающие" регулярную укладку полипептидной цепи. Причиной этого является более компактная укладка полипептидной цепи белка в определенном объеме, т. е. в третичную структуру.
Не нашли то, что искали? Воспользуйтесь поиском:
В химии, раскраска по CPK (англ. Corey-Pauling-Koltun , рус. Кори-Полинг-Колтун ) — популярная схема цветового обозначения атомов различных химических элементов в молекулярных моделях. Данная схема названа в честь молекулярной модели CPK, созданной Робертом Кори и Лайнусом Полингом и усовершенствованной Уолтером Колтуном.
Содержание
История
В 1952 году, Кори и Полинг опубликовали описание объёмной модели белков и других биомолекул, которую они создали в Калифорнийском технологическом институте. [1] Их модель представляла атомы деревянными шариками, раскрашенными в яркие цвета, соответствующие химическим элементам. Их цветовая модель включала:
Они также построили уменьшенные модели, используя пластиковые шарики такой же цветовой схемы.
В 1965 году Колтун запатентовал улучшенную версию модели Кори-Полинга. [2] В своём патенте он упоминает следующие цвета:
- белый для водорода
- чёрный для углерода
- голубой для азота
- красный для кислорода
- тёмно-жёлтый для серы
- пурпурный для фосфора
- оттенки от светло- до тёмно-зелёного соответственно для галогенов (F, Cl, Br, I)
- серебряный для металлов (Co, Fe, Ni, Cu)
Типичные цветовые обозначения
Типичные цветовые обозначения в CPK включают:
| водород (H) | белый |
| углерод (C) | чёрный |
| азот (N) | синий |
| кислород (O) | красный |
| фтор (F), хлор (Cl) | зелёный |
| бром (Br) | коричневый |
| иод (I) | тёмно-фиолетовый |
| благородные газы (He, Ne, Ar, Xe, Kr) | голубой |
| фосфор (P) | светло-оранжевый |
| сера (S) | жёлтый |
| бор (B), большинство переходных металлов | бежевый |
| щелочные металлы (Li, Na, K, Rb, Cs) | фиолетовый |
| щелочноземельные металлы (Be, Mg, Ca, Sr, Ba, Ra) | тёмно-зелёный |
| титан (Ti) | серый |
| железо (Fe) | темно-оранжевый |
| другие элементы | розовый |
Некоторые из цветов CPK мнемонически связаны с цветами чистых элементов или их соединений. Например, водород — бесцветный газ, углерод в виде угля или графита чёрный, многие формы серы имеют жёлтый цвет, хлор — зеленоватый газ, бром — тёмно-красная жидкость, иод в эфире фиолетовый, одна из аллотропных модификаций фосфора имеет красный цвет, железная ржавчина имеет тёмно-оранжевый оттенок, и т. д. В случае других элементов, таких как кислород и азот, выбор цвета менее понятен. Вероятно, красный цвет для кислорода был выбран потому что он часто ассоциируется с горением, а голубой цвет для азота обусловлен тем, что это главный компонент земной атмосферы, имеющей голубой оттенок.
Современные варианты
Следующая таблица представляет собой цвета, назначаемые каждому элементу в популярных компьютерных программах. Колонка C содержит изначальные цвета Кори и Полинга, [1] колонка K содержит цвета из патента Колтуна. [2] Колонка J описывает цветовую схему, используемую молекулярным визуализатором Jmol. [3] Колонка R описывает цветовую схему, используемую программой Rasmol; в случае если указаны два цвета, второй актуален для версий 2.7.3 и выше. [3] [4] Все цвета даны приблизительно и могут зависеть от дисплея и настроек видео.
| Атомный номер | Символ | Название | Цвета | |||
|---|---|---|---|---|---|---|
| С | K | J | R | |||
| 1 | H | водород | ||||
| 1 | 2 H (D) | дейтерий | ||||
| 1 | 3 H (T) | тритий | ||||
| 2 | He | гелий | ||||
| 3 | Li | литий | ||||
| 4 | Be | бериллий | ||||
| 5 | B | бор | ||||
| 6 | C | углерод | ||||
| 6 | 13 C | углерод-13 | ||||
| 6 | 14 C | углерод-14 | ||||
| 7 | N | азот | ||||
| 7 | 15 N | азот-15 | ||||
| 8 | O | кислород | ||||
| 9 | F | фтор | ||||
| 10 | Ne | неон | ||||
| 11 | Na | натрий | ||||
| 12 | Mg | магний | ||||
| 13 | Al | алюминий | ||||
| 14 | Si | кремний | ||||
| 15 | P | фосфор | ||||
| 16 | S | сера | ||||
| 17 | Cl | хлор | ||||
| 18 | Ar | аргон | ||||
| 19 | K | калий | ||||
| 20 | Ca | кальций | ||||
| 21 | Sc | скандий | ||||
| 22 | Ti | титан | ||||
| 23 | V | ванадий | ||||
| 24 | Cr | хром | ||||
| 25 | Mn | марганец | ||||
| 26 | Fe | железо | ||||
| 27 | Co | кобальт | ||||
| 28 | Ni | никель | ||||
| 29 | Cu | медь | ||||
| 30 | Zn | цинк | ||||
| 31 | Ga | галлий | ||||
| 32 | Ge | германий | ||||
| 33 | As | мышьяк | ||||
| 34 | Se | селен | ||||
| 35 | Br | бром | ||||
| 36 | Kr | криптон | ||||
| 37 | Rb | рубидий | ||||
| 38 | Sr | стронций | ||||
| 39 | Y | иттрий | ||||
| 40 | Zr | цирконий | ||||
| 41 | Nb | ниобий | ||||
| 42 | Mo | молибден | ||||
| 43 | Tc | технеций | ||||
| 44 | Ru | рутений | ||||
| 45 | Rh | родий | ||||
| 46 | Pd | палладий | ||||
| 47 | Ag | серебро | ||||
| 48 | Cd | кадмий | ||||
| 49 | In | индий | ||||
| 50 | Sn | олово | ||||
| 51 | Sb | сурьма | ||||
| 52 | Te | теллур | ||||
| 53 | I | иод | ||||
| 54 | Xe | ксенон | ||||
| 55 | Cs | цезий | ||||
| 56 | Ba | барий | ||||
| 57 | La | лантан | ||||
| 58 | Ce | церий | ||||
| 59 | Pr | празеодим | ||||
| 60 | Nd | неодим | ||||
| 61 | Pm | прометий | ||||
| 62 | Sm | самарий | ||||
| 63 | Eu | европий | ||||
| 64 | Gd | гадолиний | ||||
| 65 | Tb | тербий | ||||
| 66 | Dy | диспрозий | ||||
| 67 | Ho | гольмий | ||||
| 68 | Er | эрбий | ||||
| 69 | Tm | тулий | ||||
| 70 | Yb | иттербий | ||||
| 71 | Lu | лютеций | ||||
| 72 | Hf | гафний | ||||
| 73 | Ta | тантал | ||||
| 74 | W | вольфрам | ||||
| 75 | Re | рений | ||||
| 76 | Os | осмий | ||||
| 77 | Ir | иридий | ||||
| 78 | Pt | платина | ||||
| 79 | Au | золото | ||||
| 80 | Hg | ртуть | ||||
| 81 | Tl | таллий | ||||
| 82 | Pb | свинец | ||||
| 83 | Bi | висмут | ||||
| 84 | Po | полоний | ||||
| 85 | At | астат | ||||
| 86 | Rn | радон | ||||
| 87 | Fr | франций | ||||
| 88 | Ra | радий | ||||
| 89 | Ac | актиний | ||||
| 90 | Th | торий | ||||
| 91 | Pa | протактиний | ||||
| 92 | U | уран | ||||
| 93 | Np | нептуний | ||||
| 94 | Pu | плутоний | ||||
| 95 | Am | америций | ||||
| 96 | Cm | кюрий | ||||
| 97 | Bk | берклий | ||||
| 98 | Cf | калифорний | ||||
| 99 | Es | эйнштейний | ||||
| 100 | Fm | фермий | ||||
| 101 | Md | менделевий | ||||
| 102 | No | нобелий | ||||
| 103 | Lr | лоуренсий | ||||
| 104 | Rf | резерфордий | ||||
| 105 | Db | дубний | ||||
| 106 | Sg | сиборгий | ||||
| 107 | Bh | борий | ||||
| 108 | Hs | хассий | ||||
| 109 | Mt | мейтнерий | ||||
| 110 | Ds | дармштадтий | ||||
| 111 | Rg | рентгений | ||||
Напишите отзыв о статье "Цветовая схема моделей Кори — Полинга — Колтуна"
Примечания
- ↑ 12 Robert B. Corey and Linus Pauling (1953): Molecular Models of Amino Acids, Peptides, and Proteins. Review of Scientific Instruments, Volume 24, Issue 8, pp. 621—627. DOI:[//dx.doi.org/10.1063%2F1.1770803 10.1063/1.1770803]
- ↑ 12 Walter L. Koltun (9165), Space filling atomic units and connectors for molecular models. U. S. Patent 3170246.
- ↑ 12 [http://jmol.sourceforge.net/jscolors/ Jmol color table] на sourceforge.net.
- ↑ [http://www.bio.cmu.edu/Courses/BiochemMols/RasFrames/CPKCLRS.HTM Rasmol color table] на bio.cmu.edu.
Ссылки
Отрывок, характеризующий Цветовая схема моделей Кори — Полинга — Колтуна
На этом витраже Магдалина изобра-
жена в виде Учителя, стоящего над
королями, аристократами, филосо-
фами и учёными.
Но как я уже говорил тебе, Изидора, этого придётся ещё очень долго ждать, ибо пока что человек думает только о своём личном благополучии, даже не задумываясь, для чего он пришёл на Землю, для чего был на ней рождён. Ибо каждая ЖИЗНЬ, какой бы незначительной она ни казалась, приходит на Землю с какой-то определённой целью. В большинстве своём – чтобы сделать лучше и радостнее, могущественнее и мудрее наш общий ДОМ.
– Ты думаешь, обычного человека когда-нибудь заинтересует общее благо? Ведь у многих людей это понятие совершенно отсутствует. Как же их научить, Север.
– Этому нельзя научить, Изидора. У людей должна появиться потребность к Свету, потребность к Добру. Они должны сами желать изменения. Ибо то, что даётся насильно, человек инстинктивно старается побыстрее отвергнуть, даже не пытаясь что-либо понять. Но мы отвлеклись, Изидора. Желаешь ли, чтобы я продолжил историю Радомира и Магдалины?
Я утвердительно кивнула, в душе сильно сожалея, что не могу вот так просто и спокойно вести с ним беседу, не волнуясь об отпущенных мне судьбой последних минутах моей искалеченной жизни и не думая с ужасом о нависшей над Анной беде.
– В библии очень много пишется об Иоанне Крестителе. Был ли он по-настоящему с Радомиром и рыцарями Храма? Его образ так удивительно хорош, что иногда заставлял сомневаться, являлся ли Иоанн настоящей фигурой? Можешь ли ты ответить, Север?
Север тепло улыбнулся, видимо вспоминая что-то, очень для него приятное и дорогое.
– Иоанн был мудрым и добрым, как большое тёплое солнце. Он был отцом для всех идущих с ним, их учителем и другом. Его ценили, слушались и любили. Но он никогда не был тем молодым и удивительно красивым юношей, каким его обычно рисовали художники. Иоанн в то время был уже пожилым волхвом, но всё ещё очень сильным и стойким. Седой и высокий, он был скорее похож на могучего былинного воина, чем на удивительно красивого и нежного юношу. Он носил очень длинные волосы, как впрочем, и все остальные, находящиеся с Радомиром.
Это был Радан, он был и правда необычайно красивым. Он, как и Радомир, с малых лет жил в Мэтэоре, рядом со своей матерью, Ведуньей Марией. Вспомни, Изидора, как много картин существует, в которых Мария написана с двумя, почти одного возраста, младенцами. Их почему-то рисовали все знаменитые художники, возможно, даже не понимая, КОГО по-настоящему изображала их кисть. И что самое интересное – это то, что именно на Радана Мария смотрит на всех этих картинах. Видимо уже тогда, будучи ещё младенцем, Радан уже был таким же весёлым и притягивающим, каким он оставался всю свою короткую жизнь.
И ещё. если бы и рисовали художники именно Иоанна на этих картинах, то как же тогда тот же самый Иоанн сумел бы так чудовищно постареть ко времени своей казни, свершённой по желанию капризницы Саломеи. Ведь по Библии это случилось ещё до распятия Христа, значит, Иоанну должно было быть в то время никак не более тридцати четырёх лет! Каким же образом из по-девичьи красивого, златокудрого юноши он превратился в старого и совсем уж несимпатичного еврея?!
Читайте также:


