Генитальный герпес современная концепция терапии

В своей практической деятельности врачи многих специальностей встречаются с заболеваниями, вызванными вирусами семейства Herpesviridae, которые широко распространены в человеческой популяции. Они способны поражать практически все органы и системы организма хозяина, вызывая латентную, острую и хроническую формы инфекции при этом, спектр клинических проявлений, развитие которых они обусловливают, чрезвычайно широк [7]. Особого внимания заслуживает рецидивирующая форма герпетической инфекции (ГИ), относящаяся к числу наиболее распространенных психосоматических кожных заболеваний. Хроническое течение, зуд, частая локализация и характер высыпаний на лице или интимно значимых участках кожного покрова сопровождаются изменениями эмоциональной сферы. В свою очередь, состояния стресса, восприятие самим пациентом проявлений болезни оказывает влияние на интенсивность и частоту рецидивов простого герпеса (ПГ) [24].
Многочисленные исследования в области проблемы ГИ, особенно вызванные вирусами простого герпеса (ВПГ) 1 и 2 типов, не теряют своей актуальности в настоящее время [21, 16].
Серьёзной проблемой является высокая инфицированность здорового населения, преимущественно молодого, трудоспособного возраста. В мире ежегодно заражаются от 16 до 800, а в России – от 40 до 80 человек на 100 тыс. населения. В настоящее время заболеваемость ПГ крайне высока, по статистике ВОЗ, она занимает второе место среди вирусных поражений, уступая лишь гриппу. ВПГ-1 инфицировано около 90 % взрослого населения планеты, распространенность ВПГ-2 колеблется от 7 до 40 %. В США ежегодно регистрируется до 98 млн случаев лабиального герпеса и 20 млн случаев рецидивирующего герпеса гениталий, 500 тыс. случаев офтальмогерпеса и более 5 тыс. случаев герпетического энцефалита, около 1 тыс. случаев герпеса новорожденных. По мнению ведущих специалистов, в нашей стране ежегодная заболеваемость герпесом губ составляет 10 млн, герпесом кожи – 1 млн, офтальмогерпесом – 250 тыс. случаев. Рецидивирующими формами герпеса страдают от 10 до 20 % населения, а ежегодный прирост увеличивается на 15–17 % [3, 13, 23].
Литературные данные свидетельствуют, что большинство населения Земли инфицировано ВПГ-1, ВПГ-2 или тем и другим вирусом одновременно. Первичная инфекция, ассоциированная с ВПГ-1 или ВПГ-2, может протекать в клинически выраженной форме в очаге инфицирования (например, в орофациальной или генитальной области) либо как бессимптомная или нераспознанная инфекция. Генитальная форма простого герпеса может быть связана с ВПГ-1, так же как и лабиальная форма – с ВПГ-2. После первичного инфицирования у 50–75 % больных отмечается рецидивирующее течение простого герпеса. В течение первых 12 месяцев после инфицирования ВПГ-2 рецидив возникает у 80 % пациентов, ВПГ-1 – у 55 % [15, 26].
Современная медицина не располагает методами лечения, позволяющими элиминировать ВПГ из организма человека. Целью лечения герпеса является: 1) подавление репродукции ВПГ в период обострения (купирование рецидива); 2) снижение частоты и длительности рецидивов заболевания, тяжести их течения; 3) формирование адекватного иммунного ответа и его длительное сохранение с целью блокирования реактивации ВПГ в очагах персистенции.
Всё разнообразие методов терапии и профилактики обострения герпесвирусных инфекций можно сгруппировать в направления этиотропного, патогенетического и симптоматического лечения с применением химиотерапии, иммунотерапии и комплексного лечения [1, 7, 11].
Большое внимание уделяется антигерпетическим соединениям растительного происхождения, природным антиоксидантам, адаптогенам из лекарственного растительного сырья и витаминно-минеральным комплексам, ввиду изменения иммунного статуса пациентов [14, 19].
Патогенетическая терапия направлена на нормализацию функции иммунной системы организма, в том числе на активацию системы интерфероновой защиты, как правило, связанная с применением интерферонов (ИФН), индукторов ИФН и иммуномодуляторов. Специфическая иммунотерапия состоит в применении герпетической вакцины, хотя ряд исследователей считает, что надежды, возлагаемые на специфическую вакцинопрофилактику, не оправдали себя [11, 19]. Иммунотропные препараты, обладающие активностью против вируса герпеса, разнообразны и представлены в таблице.
Иммунотропные препараты, обладающие активностью против вируса герпеса
Использование противовирусной химиотерапии велико при лечении рецидивирующих форм простого герпеса с поражением кожи и слизистых оболочек. В лечении простого герпеса с применением противогерпетических химиопрепаратов можно выделить два принципиально отличающихся друг от друга подхода: 1) эпизодическое лечение – прием ациклических нуклеозидов (АН) в момент рецидива в терапевтических дозах при соблюдении кратности и длительности лечения; 2) супрессивная терапия – длительный, иногда многолетний, постоянный прием препаратов АН вне рецидива в более низких дозах [9, 25].
Согласно проведенным исследованиям, биодоступность (per os) противогерпетических препаратов из группы ациклических нуклеозидов возрастает следующим образом: ацикловир – 20 %, валацикловир – 54 % и фамцикловир – 77 % [24]. Тем не менее применение ацикловира по-прежнему остаётся востребованным среди врачей и пациентов в настоящее время, и одновременно ведутся исследования по увеличению растворимости ацикловира [5] и синтезу его производных [8].
В разные годы предпринимались многочисленные попытки повысить эффективность лечения ПГ путем комбинированной терапии. С этой целью использовались различные сочетания средств иммунного влияния, а также препаратов, отличающихся по этиопатогенетическому механизму действия [20].
Возможно сочетанное использование противовирусной терапии и глюкокортикостероидов. Выявлено, что такая комбинация эффективнее монотерапии противовирусными препаратами, особенно для лечения острой боли и коррекции различных аспектов качества жизни пациентов. Комбинация ацикловир + преднизолон значительно быстрее купирует острую боль и возвращает пациента к обычной жизнедеятельности в случае постгерпетической невралгии [2].
Наружные средства дополняют системную противовирусную терапию. Многочисленные наблюдения подтверждают, что в случае назначения таблетированных форм ациклических нуклеозидов на стадии предвестников в сочетании с наружной противовирусной терапией значительно чаще удается полностью прервать дальнейшее развитие рецидива или наблюдать его абортивное течение [20].
Местная терапия противовирусных лекарственных средств при герпесе кожи и слизистых оболочек требуется для уменьшения отёка, экссудации, боли и зуда, ускорения заживления язвочек и эрозий и сокращения длительности выделения вируса на участках поражения [22]. Применение данных лекарственных форм начинают при появлении первых признаков активации инфекции (чувство жжения, зуд и т.д.) и продолжают вплоть до эпителизации эрозий. Рано начатое местное лечение может предотвратить развитие везикул.
В комплексную терапию пациентов с простым герпесом необходимо включать местные противовирусные средства, способствующие стабилизации и разрешению процесса [12].
При анализе ассортимента противовирусных средств на российском рынке установлено, что большинство противовирусных препаратов выпускается в виде твёрдых лекарственных форм – 66 %, в виде мягких лекарственных форм – 22 %, а в форме жидких – 12 % [22], лидером же является ацикловир [6].
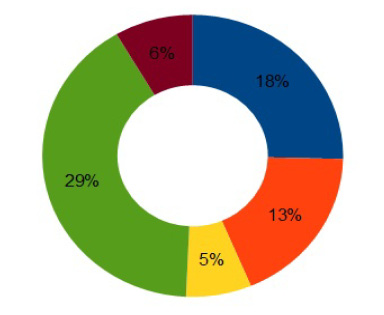

Ассортимент лекарственных форм, содержащих ацикловир
Следует отметить, что современная фармакотерапия герпеса эффективно уменьшает его клинические проявления, положительно влияет на психическое состояние пациентов и приобретает комплексный подход. Несмотря на различные достижения в лечении герпеса, ацикловир по-прежнему играет значительную роль в данном направлении и привлекает внимание исследователей по созданию комбинированных препаратов. В связи с чем актуальными являются исследования по разработке лекарственной формы комбинированного состава, обладающей противогерпесным эффектом – медицинские карандаши.
Рецензенты:
Степанова Э.Ф., д.фарм.н., профессор, профессор кафедры технологии лекарств ПМФИ – филиала ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск;
Хаджиева З.Д., д.фарм.н., профессор, профессор кафедры технологии лекарств ПМФИ – филиала ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск.
[youtube.player]*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
Статья посвящена вопросам современного лечения генитального герпеса
Для цитирования. Летяева О.И., Зиганшин О.Р., Кудревич Ю.В., Гизингер О.А. Генитальный герпес: современная концепция терапии // РМЖ. 2015. № 28. С. 1701–1704.
Впервые вирус герпеса был выделен W. Gruter в 1912 г. Сегодня известно более 80 представителей human herpes virus-HHV, 8 из которых наиболее патогенны для человека. С точки зрения вирусологии это филогенетически древнее семейство крупных ДНК-вирусов, подразделяющихся на 3 подсемейства – α, β, γ, однако наиболее быстрой репликацией и цитопатическим действием на культуры инфицированных клеток обладают α-герпес-вирусы, включающие HSV-1, HSV-2 и VZV. Уникальность герпес-вирусов заключается в их способности поражать различные органы и системы (кожа, слизистые оболочки, ЦНС, периферическая нервная система, эндотелий сосудов, Т-лимфоциты, эритроциты, тромбоциты; интеграция в геном клеток хозяина), вызывая самые разнообразные клинические проявления [1–4]. Несколько лет назад экспертами ВОЗ была представлена общая эпидемиологическая картина, свидетельствующая о практически 100% инфицировании населения планеты вирусом простого герпеса (ВПГ) типа 1 и 2, при этом у 10–20% инфицированных имеются различные клинические проявления герпетической инфекции [5–8]. Европейское региональное бюро ВОЗ относит герпес-вирусные инфекции к группе болезней, которые определяют будущее инфекционной патологии. Масштабы заболеваемости в сочетании с наносимым ими уроном – психологическим и физиологическим – определяют важное медицинское и социальное значение этих инфекций [9–11].
И проблема заключается не только в том, что вирус характеризуется быстрой репликацией, но и в распространении бессимптомной и недиагностированной форм болезни, что способствует формированию вторичного иммуносупрессивного состояния. Рецидивирующие формы герпеса оказывают негативное воздействие на иммунную систему больного, приводя к астении, нервно-психическим расстройствам, вызывая в 30% случаев спонтанные аборты на ранних сроках беременности, свыше 50% поздних выкидышей, и занимают второе место после вируса краснухи по тератогенности [11–17]. Доказана роль герпетической инфекции в ускорении интеграции вируса папилломы человека (ВПЧ) в геном клетки хозяина, что повышает риск онкопатологии полости рта, шейки матки, влагалища и прямой кишки. При этом коинфекция ВПГ и ВПЧ при дисплазии в 34 раза повышает риск малигнизации и в 61 раз – вероятность трансформации в плоскоклеточный рак [9, 16, 18].
В значительной мере осложняют постановку диагноза такие факторы, как изменение цикла развития герпетических элементов в очаге поражения, необычная локализация очага и анатомические особенности подлежащих тканей; преобладание субъективных ощущений в очаге. При этом все чаще практикующие врачи сталкиваются с атипичными формами, встречающимися, как правило, при рецидивах генитального герпеса и сопровождающимися неспецифическими симптомами, такими как: раздражение области вульвы; локализованная эритема; слизисто-гнойный цервицит; геморрагический цистит; рецидивирующий уретрит; боль в нижних отделах спины; вульварные спайки, рецидивирующая трещина ануса, зудящая форма герпеса ануса и герпетическое поражение геморроидальных узлов [2, 11, 18, 19].
Формирование единого подхода к вопросам диагностики и тактики ведения больных является важной задачей современного здравоохранения.
В 1974 г. Гертрудой Элион был синтезирован ацикловир, за создание которого в 1988 г. ей была присуждена Нобелевская премия по медицине. Механизм действия ациклических нуклеозидов связан с избирательным фосфорилированием в инфицированных ВПГ клетках и конкурентным субстратным ингибированием полимеразы дезоксирибонуклеиновой кислоты, ведущей к окончанию считывания цепи ДНК вируса. Однако они отличаются специфичностью и сродством к своим ферментам вируса-мишени [1, 2, 5, 19, 20]. Ацикловир является первым препаратом, использованным для терапии герпетических поражений, и избирательным аналогом нуклеозида с профилем приемлемой безопасности для широкого применения. Этот препарат, вызывающий минимальные побочные реакции, применяли у больных для купирования генитального герпеса до 10 лет [2, 6, 21, 22]. Однако появляется все больше сообщений о развитии резистентности вируса к ацикловиру. Так, по данным Patrick D., у 57% пациентов, страдающих рецидивирующим генитальным герпесом, развивается резистентность к ацикловиру или он изначально оказывается не эффективен [20]. Кроме того, наличие у герпес-вирусов молекулярной мимикрии, нюансы индивидуальных провоцирующих факторов и множество других причин зачастую становятся на пути полноценного контроля над этой инфекцией [16, 20].
Валацикловир (L-валил-эфир ацикловира) обеспечивает в 3–5 раз более эффективную биодоступность ацикловира. Обширная программа клинических исследований по оценке положительного действия валацикловира при генитальном герпесе показала, что он не менее эффективен, чем ацикловир. Так, при пероральном приеме биодоступность составляет 57%, и его применение в дозе 500 мг 2 р./сут эквивалентно приему ацикловира 5 р./сут в дозе 200 мг, а прием валацикловира в дозе 1000 мг 3 р./сут обеспечивает концентрацию, которая приближается к таковой при в/в введении ацикловира в дозе 15 мг/кг/сут, что позволяет заменить в/в введение ацикловира пероральным приемом валацикловира в высоких дозах [2, 12, 14, 15, 20, 21]. Кроме того, использование более простой схемы, при которой валацикловир рекомендован 2 р./сут по сравнению с ацикловиром (5 р./сут) для лечения эпизода, и прием валацикловира 1 р./сут по сравнению с ацикловиром 2–3 р./сут для длительной супрессивной терапии однозначно имеют превосходство в плане приверженности к терапии. На фоне лечения валацикловиром предотвращаются рецидивы инфекции, вызываемой ВПГ, или задерживается их возникновение на 71–85% (анализ соотношения опасностей) по сравнению с плацебо [1, 2, 20, 21]. Супрессивная терапия при генитальном герпесе оказывает положительное психосоциальное действие, а также уменьшает степень риска его передачи. По клинической эффективности на 25–40% превосходит ацикловир.
Проведенные ранее исследования свидетельствуют о том, что валацикловир является особенно эффективным препаратом при лечении привычного невынашивания беременности, ассоциированного с генитальным герпесом, а также в случае профилактики генитального герпеса и цитомегаловирусной (ЦМВ) инфекции одновременно [23].
На фармацевтическом рынке существует значительное количество препаратов, где действующим началом является валацикловир. Одно из таких лекарственных средств – препарат Валогард, показанием к назначению которого является в т. ч. и генитальный герпес.
Цель исследования: провести сравнительный клинико-иммунологический анализ эффективности и безопасности длительной супрессивной терапии препаратами ацикловир и валацикловир у пациенток с атипичными формами рецидивирующего генитального герпеса.
Материалы и методы: на кафедре дерматовенерологии ГБОУ ВПО ЮУГМУ было проведено простое открытое рандомизированное исследование, в которое вошли 35 женщин репродуктивного возраста. Средний возраст составил 27,2±0,3 года. Материалом для выделения и последующей амплификации ДНК ВПГ послужили соскобы эпителия цервикального канала, уретры, анальной области, взятые одноразовыми цитощетками и /или плейферами. План исследования соответствовал положениям Хельсинкской декларации Всемирной медицинской ассоциации последнего пересмотра (г. Эдинбург, Шотландия, 2000 г.), с учетом разъясняющего примечания п. 29, одобренного Генеральной ассамблеей ВМА (Сеул, 2008), и был одобрен этическим комитетом ГБОУ ВПО ЮУГМУ Минздрава РФ. Всем пациенткам было проведено комплексное исследование, включавшее: осмотр врача, микроскопическое исследование отделяемого цервикального канала, цитологическое исследование мазков-отпечатков, исследование показателей местного иммунитета. Материалом для исследования местного иммунитета репродуктивного тракта служила цервикальная слизь. Всем женщинам проводили исследование фагоцитарной активности нейтрофилов цервикальной слизи. Исследование внутриклеточного кислородзависимого метаболизма проводили с использованием НСТ-теста. Также рассчитывали функциональный резерв нейтрофилов (ФРН), лизосомальную активность. Определение концентрации IgМ, IgG, уровня цитокинов проводилось с использованием соответствующих тест-систем для иммуноферментного анализа.
Критериями включения в дальнейшее исследование были: наличие клинических проявлений герпетической инфекции, частота рецидивов от 4 до 6 в год, выявление ДНК ВПГ, репродуктивный возраст, согласие пациенток на участие в исследовании. Критериями исключения являлись: наличие тяжелой соматической патологии, гормональные нарушения, беременность, лактация, наличие других инфекций, передаваемых половым путем (ИППП), ВИЧ, несогласие пациенток на участие в исследовании.
В соответствии с МКБ-Х и клиническими рекомендациями РОДВК по ведению больных ИППП и урогенитальными инфекциями, был выставлен диагноз: А.60.0 Герпетическая инфекция половых органов и мочеполового тракта, рецидивирующее течение, средняя степень тяжести.
Частота рецидивов составляла 4–6 раз в год, межрецидивный период – не более 2–3 мес. Были сформированы следующие группы: №1 – здоровые (n=15), состояла из женщин, не имеющих клинических проявлений герпетической инфекции, группа №2 (n=18) – получали терапию валацикловиром по 500 мг 1 р./сут на протяжении 6 мес., группа №3 (n=17) – принимали ацикловир по 400 мг 2 р./сут в течение 6 мес. Группы были стратифицированы между собой на начальном этапе (до назначения лечения) по всем признакам, характеризующим заболевание: жалобы, клинические проявления, лабораторные показатели.
Результаты и обсуждение: пациенток с герпетической инфекцией урогенитального тракта беспокоили зуд, жжение в области гениталий различной интенсивности, у 22 (62,8%) женщин отмечались дискомфорт в области уретры, болезненность при мочеиспускании. При осмотре наблюдались гиперемия наружного отверстия уретры, наличие скудных слизистых выделений. У 10 (28,5%) женщин при уретроскопии в передней части уретры выявлены мелкие поверхностные эрозии, отечность слизистой оболочки. В 25,7% (9 женщин) случаев пациентки предъявляли жалобы на слизистые выделения и дискомфорт в области наружных половых органов, при объективном осмотре были выявлены: отечность слизистой оболочки шейки матки, поверхностные эрозии, слизистые выделения из цервикального канала. Клинически у всех женщин, страдающих генитальной герпетической инфекцией, на момент осмотра выявлены эрозивные поражения гениталий. У 12 (34,2%) пациенток эрозии имелись в области малых половых губ, у 15 (42,8%) – на задней спайке, у 4 (11,4%) пациенток отмечались утолщение складки анального отверстия, интенсивный зуд, жжение в периоды обострения герпетической инфекции (рис. 1).
В 100% случаев пациентки были тревожны, отмечали снижение качества жизни из-за страха возникновения рецидива, боязни инфицировать полового партнера, 5 (10,4%) женщин отметили, что во время рецидива избегают даже дополнительных бытовых контактов с близкими. Все пациентки обратились за медицинской помощью во время очередного рецидива, из анамнеза удалось установить, что средняя продолжительность болезни составляла 3,8±0,4 года.
Лабораторное исследование выявило повышение числа лейкоцитов в цервикальном канале – 47,6±2,9 в поле зрения, пласты эпителиальных клеток, количество лейкоцитов в уретре составляло 18,3±1,2. Оценка локального иммунологического статуса показала достоверное увеличение общего числа лейкоцитов, жизнеспособных клеток, снижение показателей спонтанного и индуцированного НСТ-теста, функционального резерва нейтрофилов. Фагоцитарная активность нейтрофилов у больных с герпетической инфекцией была значительно ниже, чем у здоровых женщин, что свидетельствует о дисфункциях в противовирусной защите макроорганизма (р Литература












Современная противовирусная терапия генитального герпеса у женщин вне беременности и во время нее
Определены современные особенности противовирусной терапии генитального герпеса (ГГ) у женщин вне и в период беременности и дано их клиническое обоснование. В настоящее время рекомендовано увеличить продолжительность терапии первого эпизода ГГ ациклическими нуклеозидами до 10 дней, сократив при этом кратность ежедневного приема, выбирая препарат с улучшенными фармакологическими характеристиками (валацикловир). Лечение рецидивов валацикловиром проводится в течение 3 дней, супрессивная терапия – 1 раз в день. Такие стратегии более удобны и экономически эффективны и должны рассматриваться как опции первой линии. Продолжительность антивирусной терапии во время беременности зависит от срока гестации. Обновление рекомендаций по противовирусной терапии ГГ направлено на повышение комплаентности и клинической эффективности лечения генитального герпеса.
Генитальный герпес (ГГ) – инфекция, передаваемая половым путем (ИППП), может быть вызвана вирусами простого герпеса (ВПГ) 1-го и 2-го типов. ВПГ-2 является наиболее распространенной причиной генитальных язв во многих странах. 19,2 миллиона новых инфекций, вызванных ВПГ-2, произошло среди взрослых и подростков в возрасте 15–49 лет в мире в 2012 году, причем самые высокие показатели наблюдались среди младших возрастных групп [1]. Глобальная распространенность ГГ, вызванного ВПГ-2, составляет 11,3% (417 млн человек) [2]. ВПГ-1 обычно передается без половых контактов (оральная инфекция). Однако этот тип вируса может также передаваться половым органам через оральный секс и все чаще отмечается как причина ГГ, особенно в развитых странах [3]. 140 млн людей имели генитальную инфекцию, вызванную ВПГ-1, в 2012 году [4].
В Российской Федерации, по данным официальной статистики, показатель заболеваемости ГГ в 2014 году составил 14,2 случая на 100 000 населения, у лиц в возрасте старше 18 лет – 17,2 случая [5].
У женщин ВПГ-2 встречается чаще, чем у мужчин: по данным ВОЗ в 2012 году носителями инфекции являлись 267 млн женщин и 150 млн мужчин. Это объясняется тем, что половым путем ВПГ передается легче от мужчины к женщине, чем от женщины к мужчине [6].
ВПГ-инфекция вызывает особую озабоченность в связи с ее эпидемиологической синергией с ВИЧ-инфекцией [7]. Люди, инфицированные ВПГ-2, примерно в 3–5 раз чаще инфицированы ВИЧ, и генитальный герпес встречается у 80% лиц с ВИЧ-инфекцией [8]. Поэтому лица с ВПГ, должны быть тестированы на ВИЧ. Ко-инфекция ВПГ-2 с ВИЧ часто протекает в более тяжелой форме и с более частыми рецидивами [9].
ГГ является пожизненным состоянием, при котором вирус персистирует в нервных ганглиях и характеризуется периодическими симптоматическими рецидивами после первого эпизода, иногда – частыми. Первичная инфекция в большинстве случаев является бессимптомной или нетипичной, поэтому не диагностируется. Классическая клиническая картина при первом эпизоде заболевания встречается только в 10–25% случаев [10].
Инфекция сопровождается периодическим выделением вируса со слизистой оболочки половых органов, даже при отсутствии симптомов. В результате ВПГ-2 часто передается во время полового контакта партнерам от пациентов, которые не знают о ее наличии [9].
Тактика лечения ГГ должна рассматриваться для следующих клинических условий: первый клинический эпизод ГГ; рецидивирующий ГГ (эпизодическая терапия); рецидивирующий ГГ с частыми обострениями и/или тяжелым течением или сопровождающийся осложнениями (супрессивная терапия) [9].
Противовирусная химиотерапия ациклическими нуклеозидами, блокирующими репликацию вируса (ацикловир, валацикловир и фамцикловир) является основным методом лечения пациентов с клиническими проявлениями [9–11]. Указанные средства помогают снизить тяжесть, продолжительность и частоту симптомов, однако не уничтожают вирус, не влияют на риск, частоту или тяжесть последующих рецидивов после прекращения приема препарата.
Частота и выраженность клинических проявлений заболевания связана с состоянием иммунной системы организма [12, 13]. При этом клеточные интерферон-γ-зависимые механизмы играют доминирующую роль в контроле распространения инфекции [13].
Предупреждение инфицирования ВПГ среди беременных женщин особенно важно на поздних сроках беременности, поскольку в этот период риск развития неонатального герпеса является максимальным [11].
На протяжении последних 3 лет ведущими медицинскими сообществами были пересмотрены рекомендации по лечению многих ИППП, в том числе и ГГ. Это связано с достижениями медицины в области профилактики, диагностики и лечения ИППП. Так, выявлены новые данные в эпидемиологии ИППП (вирусные патогены приобрели бóльшую распространенность, чем бактериальные) и определены изменения устойчивости к противомикробным препаратам. В связи с этим возникла необходимость в увеличении продолжительности лечения для первого эпизода ВПГ-инфекции и в проведении супрессивной терапии среди пациентов с ВПГ-инфекцией в районах с высоким уровнем ВИЧ [9].
Целью лечения клинических эпизодов ГГ является уменьшение продолжительности и тяжести генитальных поражений.
Лечение первого эпизода генитальной инфекции проводится по стандартным схемам: ацикловир 200 мг 5 раз в день или 400 мг 3 раза или валацикловир 500 мг 2 раза или фамвир 250 мг 3 раза (уровень доказательности – А). Продолжительность терапии клиническими рекомендациями 2014 года (RCOG) [14] определена.
1. Bernstein D.I., Bellamy A.R., Hook E.W., Levin M.J., Wald A., Ewell M.G. et al. Epidemiology, clinical presentation, and antibody response to primary infection with herpes simplex virus type 1 and type 2 in young women. Clin. Infect. Dis. 2013; 56(3): 344-51.
2. Looker K.J., Magaret A., Turner K.M.E., Vickerman P., Gottlieb S.L., Newman L.M. Global estimates of prevalent and incident herpes simplex virus type 2 infections in 2012. PloS One. 2015; 10(1): e114989.
3. Ryder N., Jin F., McNulty A.M., Grulich A.E., Donovan B. Increasing role of herpes simplex virus type 1 in first-episode anogenital herpes in heterosexual women and younger men who have sex with men, 1992-2006. Sex. Transm. Infect. 2009; 85(6): 416-9.
4. Looker K.J., Magaret A., May M.T., Turner K.M., Vickerman P., Gottlieb S.L. et al. Global and regional estimates of prevalent and incident herpes simplex virus type 1 infections in 2012. PloS One. 2015; 10(10): e0140765.
5. Летяева О.И., Зиганшин О.Р., Кудревич Ю.В., Гизингер О.А. Генитальный герпес: современная концепция терапии. РМЖ. 2015; 23(28): 1701-4.
7. Thurman A.R., Doncel G.F. Herpes simplex virus and HIV: genital infection synergy and novel approaches to dual prevention. Int. J. STD AIDS. 2012; 23(9): 613-9.
8. Barnabas R.V., Celum C. Infectious co-factors in HIV-1 transmission herpes simplex virus type-2 and HIV-1: new insights and interventions. Curr. HIV Res. 2012; 10(3): 228-37.
10. Tronstein E., Johnston C., Huang M.L., Selke S., Magaret A., Warren T. et al. Genital shedding of herpes simplex virus among symptomatic and asymptomatic persons with HSV-2 infection. JAMA. 2011; 305(14): 1441-9.
12. Chan T., Barra N.G., Lee A.J., Ashkar A.A. Innate and adaptive immunity against herpes simplex virus type 2 in the genital mucosa. J. Reprod. Immunol. 2011; 88(2): 210-8.
13. Chew T., Taylor K.E., Mossman K.L. Innate and adaptive immune responses to herpes simplex virus. Viruses. 2009; 1(3): 979-1002.
14. Patel R., Green J., Clarke E., Seneviratne K., Abbt N., Evans C. et al. 2014 UK national guideline for the management of anogenital herpes. Int. J. STD AIDS. 2015; 26(11): 763-76.
15. Федеральные клинические рекомендации по ведению больных генитальным герпесом. М.: Российское общество дерматовенерологов и косметологов; 2015. 13с.
16. Sawleshwarkar S., Dwyer D.E. Antivirals for herpes simplex viruses. BMJ. 2015; 351: h3350.
17. Heslop R., Roberts H., Flower D., Jordan V. Interventions for men and women with their first episode of genital herpes. Cochrane Database Syst. Rev. 2016; (8): CD010684.
20. Hayden F.G. Antiviral agents (Non-Retroviral). In: Bruton L.L., Lazo J.S., Parker K.L., eds. Goodman and Gilmans - the pharmacological basis of therapeutics.11th ed. New York: McGraw-Hill; 2006: 1243-71.
22. Wald A., Selke S., Warren T., Aoki F.Y., Sacks S., Diaz-Mitoma F., Corey L. Comparative efficacy of famciclovir and valacyclovir for suppression of recurrent genital herpes and viral shedding. Sex. Transm. Dis. 2006; 33(9): 529-33.
23. Rajalakshmi R., Kumari R., Thappa D.M. Acyclovir versus valacyclovir. Indian J. Dermatol. Venereol. Leprol. 2010; 76(4): 439-44.
24. Johnston C., Saracino M., Kuntz S., Magaret A., Selke S., Huang M. et al. Ineffectiveness of daily standard and high-dose antiviral therapy in preventing short episodes of genital HSV-2 reactivation: three randomized, open-label cross-over trials. Lancet. 2012; 379(9816): 641-7.
25. Bartlett B.L., Tyring S.K., Fife K., Gnann J.W. Jr., Hadala J.T., Kianifard F. et al. Famciclovir treatment options for patients with frequent outbreaks of recurrent genital herpes: the RELIEF trial. J. Clin. Virol. 2008; 43(2): 190-5.
26. Reitano M., Tyring S., Lang W., Thoming C., Worm A.M., Borelli S. et al. Valaciclovir for the suppression of recurrent genital herpes simplex virus infection: a large-scale dose range-finding study. International Valaciclovir HSV Study Group. J. Infect. Dis. 1998; 178(3): 603-10.
27. Corey L., Wald A., Patel R., Sacks S.L., Tyring S.K., Warren T. et al. Once-daily valacyclovir to reduce the risk of transmission of genital herpes. N. Engl. J. Med. 2004; 350(1): 11-20.
29. Международная ассоциация специалистов в области инфекций (МАСОИ). Простой герпес у взрослых. Клинические рекомендации. М.; 2016. 44с.
30. Хрянин А.А., Решетников О.В. Индукторы интерферона в терапии генитального герпеса у женщин. Акушерство и гинекология. 2015; 7: 88-93.
31. ACOG Committee on Practice Bulletins. ACOG Practice Bulletin. Clinical management guidelines for obstetrician-gynecologists. No. 82 June 2007. Management of herpes in pregnancy. Obstet. Gynecol. 2007; 109(6): 1489-98.
32. Palasanthiran P., Starr M., Jones C., Giles M. Management of perinatal infections. Australasian Society for Infectious Diseases. Inc. Sydney; 2014. 88р.
[youtube.player]Читайте также:


