Эмбрион вакцина против оспы птиц из штамма кэм
Общие положения
Биологические свойства вакцины
Порядок применения вакцины
- Эмбрион-вакцина предназначена для специфической профилактики ИЛТ/кур.
- Вакцина может быть применена двумя способами: окулярным (нанесение на конъюнктиву глаза) или оральным (выпаивание).
- Окулярный способ. Вакцину применяют в виде суспензии, приготовленной на разбавителе. В соответствии с объемом разбавителя (концентрата), указанным на флаконе образуют его рабочее разведение предназначенное для суспендирования вакцины. Используя чистую кипяченую или дистиллированную воду, содержимое одного флакона разбавителя доводят до рабочего разведения, соблюдая следующее соотношение: 7см 3 концентрата доводят до 50 см 3 , 14см 3 — до 100 см 3 , 21см 3 — до 150 см 3 .
Окулярная форма вакцины должна содержать одну прививную дозу в 0,05 см 3 суспензии, что соответствует объему одной капли при истечении из носика стандартной глазной пипетки. Объем рабочего разведения разбавителя (см 3 ), необходимый для суспендирования одного флакона вакцины определяют по формуле (число прививных доз во флаконе)/20.
Требуемый «объем суспендированной вакцины (см 3 ) рассчитывают по формуле: (численность поголовья)/20.
Пример. Окулярным способом необходимо вакцинировать 8720 голов птицы. Один флакон вакцины данной серии содержит 2000 окулярных доз. На основании этих условий определяют:
- объем рабочего разведения разбавителя для суспендирования одного флакона вакцины, 2000/20=100(см 3 );
- требуемый объем суспендированной вакцины, 8720/20=436(см 3 ).
Окулярную прививку проводят следующим образом: одну каплю суспензии наносят на конъюнктиву под нижнее веко глаза и ожидают ее равномерного распределения. В случае истечения из-под века большей части дозы допускается однократное повторение операции в другой глаз.
Вакцина в виде суспензии должна быть использована в течение 2 часов.
- Оральный способ. До вакцинации, соответственно породе и возрасту птицы, определяют величину прививного объема — среднего объема жидкости (см 3 ) выпиваемого одной птицей в течение 30 мин. Вакцину применяют в виде суспензии, приготовленной на каком-либо из следующих разбавителей: пастеризованное обезжиренное молоко (10%); сухое обезжиренное молоко (1%); пептон (0,5%). Основой перечисленных разбавителей служит чистая кипяченая вода.
Оральная форма вакцины в прививном объеме должна содержать 4 окулярные дозы. Объем разбавителя (см 3 ), необходимый для суспендирования одного флакона вакцины рассчитывают по формуле: (число прививных доз во флаконе х прививной объем)/4 .Требуемый объем суспендированной вакцины (см 3 ) рассчитывают по формуле: численность поголовья х прививной объем.
Пример. Оральным способом необходимо вакцинировать 8720 голов птицы. Один флакон вакцины данной серии содержит 2000 окулярных доз. Прививной объем составил 6,7 см 3 . На основании этих условий определяют:
- объем разбавителя для суспендирования одного флакона вакцины, 2000х6,7/4 = 3350 (см 3 );
- требуемый объем суспендированной вакцины 8720х6,7=58424(см 3 ).
Вакцину выпаивают один раз в сутки. 11еред вакцинацией птицу мясных пород выдерживают без воды в течение 2-3 часов, птицу яичных пород — в течение 4-8 часов. Вакцину распределяют через поилки, которые должны быть промыты и не содержать на внутренней поверхности дезсредств. Продолжительность присутствия вакцины в системе поилок не более 2 час.
- Вакцинации подлежит клинически здоровая птица в возрасте старше 15 сут. Птица в возрасте до 60 сут. вакцинируется дважды с интервалом 14 сут. Птица в возрасте старше 60 сут. возраста вакцинируется однократно.
- Мясо и яйца вакцинированных птиц могут быть использованы без ограничений.
Изобретение относится к области ветеринарной вирусологии и биотехнологии, в частности, к получению нового штамма вируса оспы кур, который пригоден для изготовления средств диагностики и специфической профилактики оспы птиц.
Оспа птиц - контагиозная, медленно распространяющаяся вирусная болезнь птиц, которая характеризуется образованием локализованных пролиферативно-некротических поражений на коже и дифтеритического воспаления слизистой оболочки ротовой полости, верхних дыхательных путей и конъюнктивы глаз [1, 2]. Болезнь распространена по всему миру, в том числе и в РФ, и наносит существенный экономический ущерб птицеводческим хозяйствам в связи со снижением яйценоскости, замедлением роста птиц, повышением смертности и вынужденным убоем [3, 4, 5, 6, 7, 8].
В соответствии с классификацией, установленной Международной комиссией по таксономии вирусов (International Committee on Taxonomy of Viruses - ICTV), вирус оспы птиц относится к роду Avipoxvirus, семейства Poxviridae.
Основным способом борьбы с этим заболеванием является специфическая профилактика. С этой целью применяют живые вакцины на основе аттенуированных штаммов вируса.
Недостатком штамма-прототипа также является необходимость использования для его культивирования клеточных культур [12, 13], что в свою очередь существенно усложняет технологический процесс изготовления на его основе вирус-вакцин.
В задачу создания настоящего изобретения входило получение нового штамма вируса оспы кур, обладающего аттенуированным фенотипом и высокой иммуногенной активностью, способного к культивированию на эмбрионах кур как на более технологически простой системе и обеспечивающего изготовление высокоиммуногенных и безвредных биопрепаратов для профилактики и диагностики оспы птиц.
Технический результат от использования предлагаемого изобретения заключается в расширении арсенала вакцинных штаммов вируса оспы кур, генетически аутентичных, безвредных, обладающих аттенуированным фенотипом и высокой иммуногенностью, способных к культивированию на эмбрионах кур как на более технологически простой системе, и пригодных для изготовления биопрепаратов специфической профилактики оспы птиц, тем самым, усиливая в данном аспекте биологическую безопасность государства.
Генетическая аутентичность штамма.
Условия проведения ПЦР. В пробирку емкостью 0,5 мл вносили следующие компоненты: деионизованная вода (9 мкл), растворы праймеров (по 1,0 мкл), дНТФ (0,5 мкл), 25 мМ р-р хлорида магния (3,5 мкл), 5х буфер для ПЦР (5,0 мкл), Taq ДНК-полимераза (1-2 ед.), ДНК (исследуемый образец, 5 мкл).
Смесь переносили в амплификатор и проводили ПЦР при следующих режимах: 95°С - 5 мин, 30 циклов с параметрами: 95°С - 20 с, 58°С - 30 с, 72°С - 120 с, финальный прогрев 72°С - 5 мин. Далее проводили электрофорез ПЦР-фрагментов в геле 2% агарозы с последующей очисткой для определения нуклеотидной последовательности. Секвенирование очищенной кДНК осуществляли на автоматическом секвенаторе ABI Prism 3100 (Applied Biosystems, США).
Культуральные свойства штамма.
Использовали развивающиеся эмбрионы кур международной категории SPF (Specific Pathogen Free). Эмбрионы заражали осветленной фильтрованием вируссодержащей суспензией ткани хориоаллантоисной оболочки (ХАО) в дозе 3 Ig ЭИД50/0,2 см 3 . Определяли параметры культивирования: возраст эмбрионов, способ заражения, место локализации вируса. Критерием оценки являлась величина инфекционного титра в экстраэмбриональной жидкости (ЭЭЖ), в суспензии ткани тела эмбриона и ткани ХАО. Результаты представлены в таблице 1.
Характеристика вирусного материала.
В таблице 2 приведена характеристика необходимой дисперсности тканевой взвеси, получаемой после осветления гомогената ткани вируссодержащих ХАО.
Сущность предлагаемого изобретения поясняется следующими графическими материалами:
Фиг.2 - Диаграмма значений долей защищенных птиц (с) соответственно испытанным прививным дозам вируса (IgD) через 21÷28 суток после вакцинации; пунктиром показан график зависимости исследуемых параметров, построенный по регрессионному уравнению вида "c=f["y=1,21(IgD)-0,25];
Фиг.3 - Диаграмма распределения долей защищенных птиц (с) в подопытных группах соответственно времени после вакцинации.
Сущность предлагаемого изобретения пояснена примерами его использования, которые не ограничивают объем изобретения.
В параллельных экспериментах определяли соотношение инфекционных титров вируса, установленных для 25-45-суточных цыплят методом интрадермальной прививки в перепонку крыла (Ig ИД50/см 3 ) и для СПФ-эмбрионов путем введения инфицирующей жидкости на ХАО (Ig ЭИД50/см 3 ). В экспериментах были использованы вируссодержащие материалы различной биологической активности. Соответствующие результаты приведены в таблице 3.
Безвредность вируса для птиц.
Проводили оценку воздействия различных доз вируса на физиологическое состояние птиц. Цыплятам в возрасте старше 25 суток инъецировали интрадермально вирусный материал в дозах 0÷3,7 Ig ИД50. Результаты клинических наблюдений представлены в таблице 4.
Иммунизирующая доза вируса, обеспечивающая защиту 95% привитых птиц (ИмД95).
Для заданных прививных доз (D) определяли долю защищенных птиц в группе (с). Полученные величины с преобразовывали в табличные пробит-эквиваленты (y=f(c)) для построения линейной модели вида "y=y0+k(IgD), где "y - прогнозируемый пробит-эквивалент с для заданной величины IgD. На основании построенной модели определяли прогнозируемую величину прививной дозы, гарантирующую защиту 95% иммунизированных птиц. Далее по таблице производили обратное преобразование по типу "c=f("y). Полученные результаты в графическом виде представлены виде диаграммы (Фиг.2).
Динамика напряженности иммунитета у цыплят, вакцинированных штаммом.
Устойчивость аттенуированного фенотипа вируса при пассажах в системе культивирования.
Устойчивость аттенуированного фенотипа штамма при пассажах на птице.
Препарат применяли однократно методом внутрикожной инъекции в перепонку крыла с помощью двухигольного инъектора в соответствии с прилагаемой инструкцией. На протяжении 21 суток после прививки за птицей вели клиническое наблюдение.
Препарат оценивали по следующим показателям:
1. Оценка эффективности вакцинации. Показателем результативности прививки (приживления вируса) являлась воспалительная реакция на месте инъекции. Определяли представительство (процент) птицы с поствакцинальной реакцией. Соответствующие результаты представлены в таблице 8. Критерием эффективности вакцинации (наличие поствакцинального иммунитета) считали отсутствие местной воспалительной реакции у птиц после вторичной прививки препарата, проведенной в противоположное крыло через 21-67 суток после первой вакцинации. С этой целью в каждом цехе выделяли группу вакцинированных птиц в количестве 40-70 голов, которым производили повторную прививку и в течение 10 суток вели клиническое наблюдение. Определяли процент иммунных птиц. Полученные результаты по оценке эффективности вакцинации представлены в таблице 8.
В вакцинированном поголовье иммунная птица составила 100%. Эмбрион-вакцина является иммуногенной.
2. Оценка сохранности и продуктивности птицепоголовья. Сопоставили показатели продуктивности птиц и сохранности (яйценоскость и среднесуточный падеж за 7 суток) до и после проведения вакцинации. Полученные результаты представлены в таблице 9.
Данные, представленные в таблице 9, демонстрируют, что применение эмбрион-вакцины не оказывает выраженного влияния на показатели сохранности и продуктивности иммунизированного птицепоголовья.
[youtube.player]Описание патента на изобретение RU2493253C1
Изобретение относится к области ветеринарной вирусологии и биотехнологии, в частности, к получению нового штамма вируса оспы кур, который пригоден для изготовления средств диагностики и специфической профилактики оспы птиц.
Оспа птиц - контагиозная, медленно распространяющаяся вирусная болезнь птиц, которая характеризуется образованием локализованных пролиферативно-некротических поражений на коже и дифтеритического воспаления слизистой оболочки ротовой полости, верхних дыхательных путей и конъюнктивы глаз [1, 2]. Болезнь распространена по всему миру, в том числе и в РФ, и наносит существенный экономический ущерб птицеводческим хозяйствам в связи со снижением яйценоскости, замедлением роста птиц, повышением смертности и вынужденным убоем [3, 4, 5, 6, 7, 8].
В соответствии с классификацией, установленной Международной комиссией по таксономии вирусов (International Committee on Taxonomy of Viruses - ICTV), вирус оспы птиц относится к роду Avipoxvirus, семейства Poxviridae.
Основным способом борьбы с этим заболеванием является специфическая профилактика. С этой целью применяют живые вакцины на основе аттенуированных штаммов вируса.
Недостатком штамма-прототипа также является необходимость использования для его культивирования клеточных культур [12, 13], что в свою очередь существенно усложняет технологический процесс изготовления на его основе вирус-вакцин.
В задачу создания настоящего изобретения входило получение нового штамма вируса оспы кур, обладающего аттенуированным фенотипом и высокой иммуногенной активностью, способного к культивированию на эмбрионах кур как на более технологически простой системе и обеспечивающего изготовление высокоиммуногенных и безвредных биопрепаратов для профилактики и диагностики оспы птиц.
Технический результат от использования предлагаемого изобретения заключается в расширении арсенала вакцинных штаммов вируса оспы кур, генетически аутентичных, безвредных, обладающих аттенуированным фенотипом и высокой иммуногенностью, способных к культивированию на эмбрионах кур как на более технологически простой системе, и пригодных для изготовления биопрепаратов специфической профилактики оспы птиц, тем самым, усиливая в данном аспекте биологическую безопасность государства.
Генетическая аутентичность штамма.
Условия проведения ПЦР. В пробирку емкостью 0,5 мл вносили следующие компоненты: деионизованная вода (9 мкл), растворы праймеров (по 1,0 мкл), дНТФ (0,5 мкл), 25 мМ р-р хлорида магния (3,5 мкл), 5х буфер для ПЦР (5,0 мкл), Taq ДНК-полимераза (1-2 ед.), ДНК (исследуемый образец, 5 мкл).
Смесь переносили в амплификатор и проводили ПЦР при следующих режимах: 95°С - 5 мин, 30 циклов с параметрами: 95°С - 20 с, 58°С - 30 с, 72°С - 120 с, финальный прогрев 72°С - 5 мин. Далее проводили электрофорез ПЦР-фрагментов в геле 2% агарозы с последующей очисткой для определения нуклеотидной последовательности. Секвенирование очищенной кДНК осуществляли на автоматическом секвенаторе ABI Prism 3100 (Applied Biosystems, США).
Культуральные свойства штамма.
Использовали развивающиеся эмбрионы кур международной категории SPF (Specific Pathogen Free). Эмбрионы заражали осветленной фильтрованием вируссодержащей суспензией ткани хориоаллантоисной оболочки (ХАО) в дозе 3 Ig ЭИД50/0,2 см 3 . Определяли параметры культивирования: возраст эмбрионов, способ заражения, место локализации вируса. Критерием оценки являлась величина инфекционного титра в экстраэмбриональной жидкости (ЭЭЖ), в суспензии ткани тела эмбриона и ткани ХАО. Результаты представлены в таблице 1.
Характеристика вирусного материала.
В таблице 2 приведена характеристика необходимой дисперсности тканевой взвеси, получаемой после осветления гомогената ткани вируссодержащих ХАО.
Сущность предлагаемого изобретения поясняется следующими графическими материалами:
Фиг.2 - Диаграмма значений долей защищенных птиц (с) соответственно испытанным прививным дозам вируса (IgD) через 21÷28 суток после вакцинации; пунктиром показан график зависимости исследуемых параметров, построенный по регрессионному уравнению вида "c=f["y=1,21(IgD)-0,25];
Фиг.3 - Диаграмма распределения долей защищенных птиц (с) в подопытных группах соответственно времени после вакцинации.
Сущность предлагаемого изобретения пояснена примерами его использования, которые не ограничивают объем изобретения.
В параллельных экспериментах определяли соотношение инфекционных титров вируса, установленных для 25-45-суточных цыплят методом интрадермальной прививки в перепонку крыла (Ig ИД50/см 3 ) и для СПФ-эмбрионов путем введения инфицирующей жидкости на ХАО (Ig ЭИД50/см 3 ). В экспериментах были использованы вируссодержащие материалы различной биологической активности. Соответствующие результаты приведены в таблице 3.
Безвредность вируса для птиц.
Проводили оценку воздействия различных доз вируса на физиологическое состояние птиц. Цыплятам в возрасте старше 25 суток инъецировали интрадермально вирусный материал в дозах 0÷3,7 Ig ИД50. Результаты клинических наблюдений представлены в таблице 4.
Иммунизирующая доза вируса, обеспечивающая защиту 95% привитых птиц (ИмД95).
Для заданных прививных доз (D) определяли долю защищенных птиц в группе (с). Полученные величины с преобразовывали в табличные пробит-эквиваленты (y=f(c)) для построения линейной модели вида "y=y0+k(IgD), где "y - прогнозируемый пробит-эквивалент с для заданной величины IgD. На основании построенной модели определяли прогнозируемую величину прививной дозы, гарантирующую защиту 95% иммунизированных птиц. Далее по таблице производили обратное преобразование по типу "c=f("y). Полученные результаты в графическом виде представлены виде диаграммы (Фиг.2).
Динамика напряженности иммунитета у цыплят, вакцинированных штаммом.
Устойчивость аттенуированного фенотипа вируса при пассажах в системе культивирования.
Устойчивость аттенуированного фенотипа штамма при пассажах на птице.
Препарат применяли однократно методом внутрикожной инъекции в перепонку крыла с помощью двухигольного инъектора в соответствии с прилагаемой инструкцией. На протяжении 21 суток после прививки за птицей вели клиническое наблюдение.
Препарат оценивали по следующим показателям:
1. Оценка эффективности вакцинации. Показателем результативности прививки (приживления вируса) являлась воспалительная реакция на месте инъекции. Определяли представительство (процент) птицы с поствакцинальной реакцией. Соответствующие результаты представлены в таблице 8. Критерием эффективности вакцинации (наличие поствакцинального иммунитета) считали отсутствие местной воспалительной реакции у птиц после вторичной прививки препарата, проведенной в противоположное крыло через 21-67 суток после первой вакцинации. С этой целью в каждом цехе выделяли группу вакцинированных птиц в количестве 40-70 голов, которым производили повторную прививку и в течение 10 суток вели клиническое наблюдение. Определяли процент иммунных птиц. Полученные результаты по оценке эффективности вакцинации представлены в таблице 8.
В вакцинированном поголовье иммунная птица составила 100%. Эмбрион-вакцина является иммуногенной.
2. Оценка сохранности и продуктивности птицепоголовья. Сопоставили показатели продуктивности птиц и сохранности (яйценоскость и среднесуточный падеж за 7 суток) до и после проведения вакцинации. Полученные результаты представлены в таблице 9.
Данные, представленные в таблице 9, демонстрируют, что применение эмбрион-вакцины не оказывает выраженного влияния на показатели сохранности и продуктивности иммунизированного птицепоголовья.

Похожие патенты RU2493253C1
| название | год | авторы | номер документа |
|---|---|---|---|
| ВАКЦИНА ПРОТИВ ИНФЕКЦИОННОЙ БУРСАЛЬНОЙ БОЛЕЗНИ ПТИЦ | 2001 |
| RU2205021C2 |
| ВИРУСВАКЦИНА ПРОТИВ ИНФЕКЦИОННОГО ЛАРИНГОТРАХЕИТА ПТИЦ | 2002 |
| RU2214277C1 |
| ШТАММ "БГ" ВИРУСА ИНФЕКЦИОННОЙ БУРСАЛЬНОЙ БОЛЕЗНИ ПТИЦ И ВАКЦИНА ПРОТИВ ИНФЕКЦИОННОЙ БУРСАЛЬНОЙ БОЛЕЗНИ ПТИЦ | 1997 |
| RU2127602C1 |
| ИНАКТИВИРОВАННАЯ ЭМУЛЬСИОННАЯ ВАКЦИНА ПРОТИВ ИНФЕКЦИОННОГО ЛАРИНГОТРАХЕИТА ПТИЦ | 2003 |
| RU2257225C1 |
| ВАКЦИНА ПРОТИВ ИНФЕКЦИОННОЙ БУРСАЛЬНОЙ БОЛЕЗНИ ПТИЦ | 1998 |
| RU2127604C1 |
| ШТАММ "О" ВИРУСА ИНФЕКЦИОННОГО ЛАРИНГОТРАХЕИТА ПТИЦ ДЛЯ ИЗГОТОВЛЕНИЯ ДИАГНОСТИЧЕСКИХ И ВАКЦИННЫХ ПРЕПАРАТОВ | 2002 |
| RU2207372C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ВИРУС-ВАКЦИНЫ ПРОТИВ ИНФЕКЦИОННОГО ЛАРИНГОТРАХЕИТА ПТИЦ | 2003 |
| RU2246317C1 |
| ВИРУСВАКЦИНА ПРОТИВ ИНФЕКЦИОННОЙ БУРСАЛЬНОЙ БОЛЕЗНИ ПТИЦ | 2004 |
| RU2272649C1 |
| ВАКЦИНА АССОЦИИРОВАННАЯ ПРОТИВ НЬЮКАСЛСКОЙ БОЛЕЗНИ, РЕОВИРУСНОГО ТЕНОСИНОВИТА И МЕТАПНЕВМОВИРУСНОЙ ИНФЕКЦИИ ПТИЦ ИНАКТИВИРОВАННАЯ ЭМУЛЬСИОННАЯ | 2011 |
| RU2480238C1 |
| СПОСОБ ПРОФИЛАКТИКИ ИНФЕКЦИОННОЙ БУРСАЛЬНОЙ БОЛЕЗНИ КУР | 2004 |
| RU2276995C2 |
Иллюстрации к изобретению RU 2 493 253 C1




Реферат патента 2013 года АТТЕНУИРОВАННЫЙ ШТАММ "КЭМ-7" ВИРУСА ОСПЫ КУР Fowlpox virus ДЛЯ ИЗГОТОВЛЕНИЯ ПРЕПАРАТОВ СПЕЦИФИЧЕСКОЙ ПРОФИЛАКТИКИ И ДИАГНОСТИКИ ОСПЫ ПТИЦ
Формула изобретения RU 2 493 253 C1
2. Штамм по п.1, характеризующийся тем, что он адаптирован к организму развивающихся эмбрионов кур, где способен накапливаться в ткани ХАО в среднем титре (6,3±0,18) Ig ЭИД50/см 3 .
3. Штамм по п.1, характеризующийся тем, что он является умеренно реактогенным и безвредным для птицы при интрадермальной инъекции в дозах до 3,7 IgИД50/0,004 см 3 .
4. Штамм по п.1, характеризующийся тем, что он является иммуногенным с иммунизирующей дозой 3 Ig ЭИД50/0,004 см 3 , обеспечивающей защиту 95% привитых птиц при контрольном заражении вирулентным вирусом оспы кур.
5. Штамм по п.4, характеризующийся тем, что он индуцирует поствакцинальный иммунитет (не менее 80% защищенности поголовья) продолжительностью 360 суток после прививки.
6. Штамм по п.1, характеризующийся тем, что он сохраняет аттенуированный фенотип при пассажах как в системе культивирования, так и на естественно восприимчивой птице.
[youtube.player]You are leaving the country website to access another site in the group.
Regulatory constraints and medical practices vary from country to country. Consequently, the information provided on the site in which you enter may not be suitable for use in your country.

You are leaving the country website to access another site in the group.
Regulatory constraints and medical practices vary from country to country. Consequently, the information provided on the site in which you enter may not be suitable for use in your country.

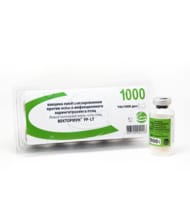
Живая рекомбинантная вакцина против оспы и инфекционного ларинготрахеита птиц, с разбавителем
Вакцина вызывает формирование иммунного ответа к вирусам оспы и инфекционного ларинготрахеита птиц через 7-14 дней после однократного применения, который сохраняется не менее 54 недель.
Одна иммунизирующая доза вакцины содержит не менее 10 2,7 TCID50 рекомбинантного вируса FP-LT.
Вакцина безвредна, лечебными свойствами не обладает.
Вакцину применяют для иммунизации куриных эмбрионов 18-суточного срока инкубации, а также цыплят в возрасте 7 суток и старше в племенных и товарных хозяйствах различного направления выращивания против оспы и инфекционного ларинготрахеита птиц. Вакцинируют только здоровую птицу.
СПОСОБ ПРИМЕНЕНИЯ И ДОЗИРОВКА
Эмбрионам вакцину вводят методом in ovo с последующей ревакцинацией цыплят в возрасте 7 суток методом прокола перепонки крыла. Цыплят, начиная с недельного возраста и старше, вакцинируют методом прокола перепонки крыла.
Перед применением вакцину ресуспендируют прилагаемыми разбавителями из расчета:
- метод in ovo: 1000 доз на 100 см 3 или 50 см 3 разбавителя;
- метод прокола перепонки крыла: 1000 доз на 10 см 3 разбавителя.
Метод иммунизации in ovo.
Куриные эмбрионы располагают воздушной камерой вверх и при помощи специального автоматического устройства, предназначенного для вакцинации in ovo или шприца-автомата, через воздушную камеру вводят в аллантоисную полость 0,05-0,1 см 3 подготовленной вакцины. После проведения вакцинации, для предотвращения охлаждения эмбрионов, их следует незамедлительно поместить в инкубатор.
Метод прокола перепонки крыла.
Для введения вакцины используют специальный двухигольный аппликатор. Иглы аппликатора погружают в суспензию вакцины таким образом, чтобы заполнились оба желобка (0,01 см 3 ) и прокалывают перепонку крыла, избегая касания перьев. Иглы аппликатора смачивают в суспензии вакцины перед каждой перфорацией подкрыльевой перепонки.
Не допускается вакцинация птиц ранее привитых вакциной против оспы птиц.
Не рекомендуется применять вакцину во время яйцекладки из-за возможного временного снижения яичной продуктивности.
СРОК ГОДНОСТИ И УСЛОВИЯ ХРАНЕНИЯ
Срок годности вакцины - 21 месяцев с даты изготовления при условии хранения и транспортирования в сухом, темном месте при температуре от 2 о С до 8 о С, а разбавителей - 5 лет при условии хранения 2 о С-25 о С. По истечении срока годности вакцина и разбавитель к применению не пригодны.
Вакцина расфасована по 500, 1000, 2000 и 4000 доз в стеклянные флаконы соответствующей вместимости, герметично укупоренные резиновыми пробками, укрепленными алюминиевыми колпачками.
Флаконы с вакциной упаковывают в картонные коробки по 10 или 20 штук.
Разбавитель для вакцинации методом in ovo расфасован по 200, 400, 800, 1000, 1200, 1600, 1800 и 2400 см3 в полимерные пакеты соответствующей вместимости, герметично укупоренные резиновыми пробками, укрепленными алюминиевыми колпачками.
Разбавитель для вакцинации методом прокола перепонки крыла расфасован по 5 см 3 в стеклянные флаконы или по 10 и 20 см 3 в пластиковые флаконы соответствующей вместимости, герметично укупоренные резиновыми пробками, укрепленными алюминиевыми колпачками.
Флаконы с разбавителем для вакцинации методом прокола перепонки крыла дополнительно снабжают двухигольными аппликторами для введения вакцины в перепонку крыла.
[youtube.player]1.1. Вирусвакцина сухая изготовлена из вируссодержащей экстраэмбриональной жидкости куриных эмбрионов с защитной средой на основе пептона или с обезжиренным молоком.
Вирусвакцина представляет собой массу или таблетку сухого вещества с однородной мелкозернистой структурой светло-коричневого или розовато-кремового цвета, имеющую иногда в осадке эритроциты, окрашивающие сухую массу в нижней части таблетки в красный цвет. При добавлении воды таблетка легко растворяется.
1.2. Вакцина расфасована в ампулы или во флаконы.
В каждой ампуле содержится 500 назальных доз (2 мл вируса и 2 мл наполнителя - обезжиренного молока), а во флаконах - с защитной средой на основе пептона 750 назальных доз (3 мл вируса и 1 мл наполнителя) или 1500 назальных доз (6 мл вируса и 2 мл наполнителя), с обезжиренным молоком 750 назальных доз (3 мл вируса и 3 мл наполнителя) или 1500 назальных доз (6 мл вируса и 6 мл наполнителя).
1.3. Ампулы (флаконы) с вакциной упакованы в коробки.
На каждой ампуле (флаконе) должна быть надпись с указанием наименования
биопрепарата, номера серии и даты изготовления, а на коробке с ампулами
(флаконами) - этикетка с указанием биопредприятия, изготовившего вакцину,
наименования биопрепарата, количества ампул (флаконов) в коробке, объема
вакцины в ампуле (флаконе), дозы вируса в 1 мл (ЭИД ), номера серии и
госконтроля, даты изготовления, срока годности и условий хранения.
В каждую коробку с вакциной должно быть вложено наставление по применению биопрепарата.
1.4. Срок годности вакцины 12 мес. со дня ее изготовления при условии хранения (транспортировки) в темном месте, при температуре не выше 4 - 6 °C. При нарушении целости ампулы (флакона), изменении цвета вакцины, консистенции, а также в случае неиспользования в течение 4 ч разведенной вакцины, препарат выбраковывают и инактивируют 30 мин. кипячением.
1.5. Для вакцинации птиц применяют вакцину с биологической активностью
2.1. Вакцину применяют с профилактической целью в благополучных и неблагополучных по ньюкаслской болезни хозяйствах. Иммунизации подлежит клинически здоровая птица, независимо от ее породы, продуктивности (яйценоскости) и периода линьки.
2.2. За 3 - 4 дня до вакцинации и в течение 5 дней после нее исключают дачу птице антибиотиков, сульфаниламидных и нитрофурановых препаратов.
2.3. Птицу вакцинируют:
в благополучных хозяйствах в возрасте - 15 - 20, 45 - 60, 140 - 150 дней и далее через каждые 6 мес.;
в неблагополучных хозяйствах в возрасте - 10 - 15, 35 - 40, 120 - 140 дней и далее через каждые 6 мес. Конкретные сроки вакцинации и ревакцинации птицы в благополучных и неблагополучных хозяйствах определяют по состоянию напряженности иммунитета. Результаты каждой иммунизации контролируют через 14 - 16 дней серологическим исследованием сыворотки крови в РЗГА. При этом исследуют не менее 25 - 30 проб крови от птиц, находящихся в птичнике (зале).
2.3.1. В благополучных хозяйствах птиц вакцинируют и ревакцинируют, если у 20%, а в неблагополучных - у 10 - 12% и более проб крови титры антител ниже 1:8.
2.3.2. Если иммунизация в благополучных по ньюкаслской болезни хозяйствах проводится впервые, то одновременно вакцинируют всю птицу начиная с 15-дневного возраста. Если в неблагополучных хозяйствах цыплята были получены от кур, ранее не вакцинированных против ньюкаслской болезни, первую вакцинацию таких цыплят проводят в возрасте 5 - 6 дней.
2.4. В благополучных хозяйствах вакцину применяют с питьевой водой, аэрозольно или интраназально.
В неблагополучных хозяйствах птицу прививают аэрозольным или интраназальным методами.
2.4.1. После снятия карантина и оздоровления хозяйства от ньюкаслской болезни дальнейшую иммунизацию птиц в течение 12 мес. проводят по схеме, предусмотренной для неблагополучного хозяйства.
2.5. Для интраназального введения содержимое ампулы (флакона) вакцины (500, 750 или 1500 назальных доз) разводят соответственно в 50, 75, 150 мл дистиллированной или кипяченой воды.
Разведенную вакцину закапывают глазной пипеткой в ноздрю птицы всех возрастов в объеме 2 капель, при этом другую ноздрю закрывают пальцем, чем достигается более глубокое введение вакцины в носовую полость.
Перед вакцинацией у птицы убирают воду. Поить птицу разрешается через 1,5 ч после введения вакцины.
2.6. При вакцинации птицы путем выпаивания содержимое одной ампулы (500 назальных доз) разводят в 1 л, а содержимое каждого флакона (750 и 1500 назальных доз) разводят соответственно в 1,5 или 3,0 л чистой кипяченой воды с содержанием в ней 25% свежего пастеризованного обезжиренного молока. Допустимо проводить разведение вакцины только в кипяченой воде.
2.6.1. Разведенную вакцину выпаивают птице из чистых поилок, утром в течение 2 дней подряд каждый раз из расчета по 5 мл на одного цыпленка до 25-дневного возраста, по 7,5 мл - до 45-дневного возраста, по 10 мл - старше 45-дневного возраста и по 15 мл взрослой птице.
Поилки, в которые наливают разведенную вакцину, должны быть вечером тщательно вымыты водой без применения дезсредств.
2.6.2. Разведенную вакцину птице выпаивают после предварительной выдержки ее без корма и воды в течение 6 - 10 ч. Дача корма и воды после выпаивания вакцины разрешается через 1,5 ч.
2.7. При аэрозольном методе иммунизации птицы вакциной из штамма "Ла-Сота" рабочее разведение ее готовят исходя из биологической активности вируса, концентрации вируса в птичнике, экспозиции иммунизации, легочного объема у птицы и оптимальной иммунизирующей дозы вируса.
При аэрозольном методе вакцинации рабочее разведение вакцинного вируса определяют по формуле:
Р.р - рабочее разведение вируса;
C - концентрация аэрозоля вируса в помещении (мг/л);
V - легочный объем у птиц (л/мин.);
t - экспозиция иммунизации (мин.);
A - биологическая активность вируса (ЭИД );
Д - оптимальная иммунизирующая доза вируса (ЭИД ).
Пример. Биологическая активность вируса 10 ЭИД или 10
ЭИД ; концентрация аэрозоля вируса в птичнике - 0,1 мг/л; экспозиция
иммунизации - 20 мин.; легочный объем у птицы - 0,2 л/мин.; доза вируса,
которую должны получить цыплята, 1000 ЭИД .
0,1 мг/л x 0,2 л/мин. x 20 мин. x 1000000 ЭИД
0,1 x 0,2 x 20 x 1000000
т.е. 1 мл вируса разводят в 400 мл разбавителя.
2.7.1. Общий объем лиофилизированного вируса, который необходимо взять для приготовления рабочего разведения в конкретном птичнике определяют исходя из объема птичника (куб. м) и рабочего разведения вируса.
Пример. Объем птичника 5000 куб. м, рабочее разведение вируса 1:400.
Расход рабочего разведения вируса составляет 1 мл на 1 куб. м птичника. Таким образом, для этого конкретного птичника потребуется 5250 мл рабочего разведения вируса (5000 + 5% на остаток в генераторах аэрозолей). Количество лиофилизированного вируса составит для данного птичника 13,1 мл (5250:400).
2.7.2. Для приготовления рабочего разведения берут вирус не меньше чем из 3 ампул (флаконов), взятых из разных коробок (даже если по расчету требуется одна ампула), но используют то количество вируса, которое требуется для распыления в птичнике данного объема.
2.8. Рабочее разведение вируса готовят, исходя из:
биологической активности вакцины (ЭИД ), которая должна быть
определена предварительно перед проведением иммунизации;
оптимальной иммунизирующей дозы вируса, которая должна составить для
цыплят в возрасте до одного месяца 600 ЭИД , а для птиц старше месячного
возраста - 1000 - 1200 ЭИД ;
концентрация аэрозоля вируса в мг на 1 л воздуха (мг/л), величина которой в течение 10 - 15 мин. после распыления составит условно: 0,1 мг/л (0,1 г/куб. м) - в недостаточно герметизированных птичниках (щели в окнах и дверях, небольшая тяга через приточную вентиляцию); 0,2 мг/л (0,2 г/куб. м) - в удовлетворительно герметизированных помещениях (тщательно подогнанные окна, двери, люки вентиляционных шахт, отсутствие щелей);
продолжительности воздействия аэрозоля на птиц, которая не должна превышать 20 мин. Экспозиция иммунизации отсчитывается с начала работы генераторов аэрозолей. В жаркие летние дни иммунизацию птиц проводят в ранние утренние часы и экспозицию сокращают до 15 мин.;
объема дыхания птиц в литрах в минуту (л/мин.), определяемого умножением средней массы птицы (г) на объем дыхания, приходящийся на 1 г массы птиц, равной 0,78 куб. см в минуту, и последующего вычитания из полученного произведения постоянной величины равной 16. Затем объем дыхания птиц в куб. см/мин. переводят в л/мин. Среднюю массу определяют взвешиванием 30 птиц, взятых из 3 различных точек птичника.
Пример. Средняя масса одного цыпленка 300 г. Объем дыхания таких цыплят составит:
0,78 куб. см/мин. x г x 300 г - 16 = 218 куб. см/мин.
2.9. Рабочее разведение вируса готовят на дистиллированной воде (предварительно охлажденной до 4°) и добавляют к нему 5% (по массе) пастеризованного сухого обезжиренного молока или 10% (по объему) химически чистого глицерина и тщательно перемешивают.
2.10. Аэрозольную вакцинацию проводят с помощью генераторов аэрозолей САГ-1, стаканы которых заправляют приготовленным рабочим разведением вируса посредством мерного цилиндра. Генераторы размещают в птичнике в шахматном порядке, подвешивая их на высоте 120 - 130 см от пола при четырехъярусных клеточных батареях: 80 см - при двухъярусных и 60 см при напольном содержании птицы из расчета один генератор на 150 - 200 куб. м площади пола при высоте птичника до 4 м; при высоте птичника до 6 м - площадь, приходящуюся на каждый генератор, уменьшают в 1,5 раза.
До подключения генератора аэрозолей к источнику сжатого воздуха поднимают брудеры, закрывают окна, двери и вентиляционные люки, продувают шланги, выключают приточно-вытяжную вентиляцию.
Время с момента выключения приточной и вытяжной вентиляции до начала работы генераторов не должно превышать 5 мин.
2.11. Рабочий раствор вакцинного вируса распыляют путем подачи на генераторы аэрозолей сжатого воздуха под давлением 3,5 - 4,0 атм. Источник сжатого воздуха отключают через 3 мин. после распыления рабочего раствора.
2.12. По истечении времени вакцинации генераторы аэрозолей выключают, а птичники проветривают (открывают люки вентиляционных систем, а в теплое время года - также окна и двери и включают приточно-вытяжную вентиляцию). Через 10 мин. от начала проветривания снимают генераторы аэрозолей.
2.13. Аэрозольную вакцинацию проводят под руководством ветеринарного врача, освоившего этот метод. Лица, участвующие в проведении аэрозольной вакцинации, должны надевать халаты, колпаки, сапоги, защитные очки с бесцветными стеклами, противогазы или респираторы.
2.14. За привитым поголовьем ведут ежедневное наблюдение в течение 14 сут. На 4 - 5-й день после вакцинации у молодняка птиц может наблюдаться недомогание, снижение аппетита, одышка, несколько увеличивается падеж. Эти явления исчезают к 10 - 12-му дню после вакцинации. У взрослых птиц поствакцинальной реакции, как правило, не наблюдается.
2.15. Иммунитет у птиц после аэрозольной вакцинации наступает через 7 - 8 дней, выпаивания и интраназальной прививки - на 8 - 10-й день.
2.16. Наряду с проведением профилактической вакцинации птицы обязательно выполнение комплекса ветеринарно-санитарных мероприятий, предусмотренных "Инструкцией по борьбе с ньюкаслской болезнью".
2.17. В случае появления у птицы осложнений или отсутствия иммунитета после прививок вакциной из штамма "Ла-Сота" дальнейшее применение вакцины данной серии необходимо прекратить и об этом сообщить Всесоюзному государственному научно-контрольному институту ветеринарных препаратов (123022, Москва, Д-22, Звенигородское шоссе, 5) и биопредприятию, изготовившему вакцину. Одновременно в институт высылают по 3 ампулы (флакона) вирусвакцины от каждой из примененных серий с указанием биопредприятия, изготовившего вакцину, номера серии и срока ее годности.
С утверждением настоящего Наставления отменяются "Наставление по
применению сухой вирусвакцины против болезни Ньюкасла птиц из штамма
"Ла-Сота", утвержденное Главным управлением ветеринарии Минсельхоза СССР
9 июня 1978 г., и "Наставление по аэрозольной вакцинации птиц против
болезни Ньюкасла (псевдочумы) вирусвакцинами из штаммов B и "Ла-Сота",
утвержденное Главным управлением ветеринарии Минсельхоза СССР 19 ноября
1975 г., с уточнениями и дополнениями от 28 августа 1978 г. (в части
применения настоящей вакцины).
Ассоциация содействует в оказании услуги в продаже лесоматериалов: оцилиндрованное бревно куплю по выгодным ценам на постоянной основе. Лесопродукция отличного качества.
[youtube.player]Читайте также:


