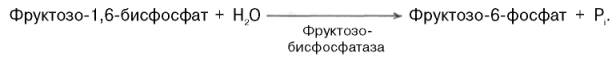Читайте также:
- Вирус кори. Таксономия. Характеристика. Лабораторная диагностика. Специфическая профилактика.
- Скважинные пакеры и якори.
|
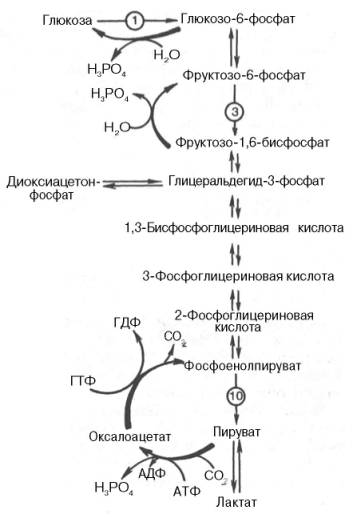
Некот. ткани, напр. мозг, нуждаются в постоянном поступлении глюкозы. Когда поступ. углеводов в составе пищи недост., сод-е глюкозы в крови некоторое время поддерж. в пределах нормы за счёт расщепления гликогена в печени. Однако запасы гликогена в печени невелики. Они значительно уменьшаются к 6-10 ч голодания и практич. полностью исчерп. после суточ. голодания. В этом случае в печени начинается синтез глюкозы de novo - глюконеогенез - процесс синтеза глюкозы из веществ неуглеводной природы. Его основной функцией является поддержание уровня глюкозы в крови в период длит. голодания и интенс. физич. нагрузок. Протекает в основном в печени и менее интенс. в корковом в-ве почек, в слиз. об-ке кишеч.
Первич. субстраты глюконеогенеза - лактат, ам-ты и глицерол. Лактат - продукт анаэр. гликолиза. Он обр-ся при любых состояниях организма в эритроцитах и работающих мышцах. Ииспользуется в глюконеогенезе постоянно. Глицерол высвоб. при гидролизе жиров в жир. тк. в период голодания или при длит. физич. нагрузке. Ами-ты обр-ся в рез-те распада мыш. белков и включ. в глюконеогенез при длит. голодании или продолжит. мыш. работе.
Большинство р-ций глюконеогенеза протекает за счёт обратимых р-ций гликолиза и катализируется теми же ферментами. Однако 3 реакции необратимы. На этих стадиях р-ции глюконеогенеза протекают другими путями. Часть реакций глюконеогенеза происходит в митохондриях.
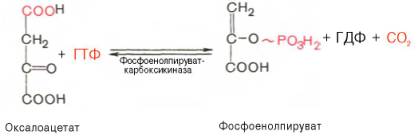
ПВК --> оксалоацетат(пируваткарбоксилаза) Оксалоацетат --> фосфоенолпируват (фосфоенолпируваткарбоксикиназа — ГТФ-зависимый фермент). Далее все р-ции до фруктозо-1,6-фосфата проходят под дейст. Гликолитич. Ферм. Фруктозо-1,6-бисфосфатаза и глюкозо-6-фосфатаза катал. отщепление фосфатной гр. от фруктозо-1,6-бисфосфата и глюкозо-6-фосфата. После чего свободная глюкоза выходит из клетки в кровь.
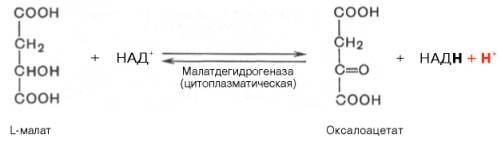
Лактат, обр-ся в интенс. раб. м-цах или в кл. с преобл. анаэр. спос. катаб. глюкозы, поступает в кровь, а затем в печень. В печени отношение NADH/NAD+ ниже, чем в сокращ. м-це, поэтому ЛДГ р-ция протекает в обратном направлении, т.е. в сторону образования ПВК из лактата. ПВК включ. в глюконеогенез, а образ-я глюкоза поступает в кровь и поглощ. скелет. м-цами - "глюкозо-лактатным циклом", или "циклом Кори", обесп. утилизацию лактата; предотвращает его накопление опасное снижение рН (лактоацидоз). Часть ПВК, обр. из лактата, ок. печенью. Энергия ок. может исп. для синтеза АТФ, необхо.о для р-ций глюконеогенеза.
Из всех аминокислот, поступающих в печень, примерно 30% приходится на долю аланина. Аланин из мышц переносится кровью в печень, где преобразуется в ПВК, который частич. окисляется и частично включ. в глюкозонеогенез. Следовательно, сущ. следующая последовательность событий (глюкозо-аланиновый цикл): глюкоза в мышцах → пируват в мышцах → аланин в мышцах → аланин в печени → глюкоза в печени → глюкоза в мышцах. Весь цикл не приводит к увеличению количества глюкозы в мышцах, но он решает проблемы транспорта аминного азота из мышц в печень и предотвращает лактоацидоз.
Аллостерическая регуляция скорости гликолиза, зависимая от изменения соотношения АТФ/АДФ, направлена на изменение скорости исп. глюкозы непосредственно кл. печени. Глюкоза в кл. печени исп. не только для синтеза гликогена и жиров, но также и как источник энергии для синтеза АТФ. Осн. потребителями АТФ в гепатоцитах явл. пр-сы трансмембранного переноса в-в, синтез белков, гликогена, жиров, глюконеогенез. От скорости утилизации АТФ в этих пр-сах зав. скорость его синтеза. АТФ, АДФ и АМФ, а также НАД и НАДН служат аллостерическими эффекторами некот. гликолитических ферментов и ферментов глюконеогенеза. В частности, АМФ активирует фосфофруктокиназу и ингибирует фруктозо-1,6-бисфосфатазу. АТФ и НАДН ингиб. пируваткиназу, а АДФ активирует пируваткарбоксилазу. Следовательно, при усил. расход. АТФ и снижении его конц-ции с одновременным увелич. конц-ции АМФ, активируется гликолиз и обр-е АТФ, а глюконеогенез при этом замедляется.
Глюкокортикостероиды обесп. пр-сс глюконеогенеза субстратами.
Дата добавления: 2015-04-18 ; просмотров: 8 ; Нарушение авторских прав
Глюконеогенез – синтез глюкозы из неуглеводных продуктов de novo. Его основной функцией является поддержание уровня глюкозы в крови в период длительного голодания и интенсивных физических нагрузок. Протекает в основном в печени и менее интенс. в корковом в-ве почек, в слиз. об-ке кишеч.Большинство р-ций глюконеогенеза протекает за счёт обратимых р-ций гликолиза и катализируется теми же ферментами. Однако 3 реакции необратимы. На этих стадиях р-ции глюконеогенеза протекают другими путями.
![]()
ПВК включ. в глюконеогенез, а образ-я глюкоза поступает в кровь и поглощ. скелет. м-цами - "глюкозо-лактатным циклом", или "циклом Кори", -обесп. утилизацию лактата; предотвращает его накопление- опасное снижение рН (лактоацидоз). Часть ПВК, обр. из лактата, окисляется печенью. Энергия ок. может исп. для синтеза АТФ, необхо. для р-ций глюконеогенеза. Из всех аминокислот, поступающих в печень, примерно 30% приходится на долю аланина. Аланин из мышц переносится кровью в печень, где преобразуется в ПВК, который частич. окисляется и частично включ. в глюкозонеогенез.
99.Глюконеогенез.см.выше и в метаболизме*
100-102. Аэробное окисление глюкозы(см.85).
103-104. Челночные механизмы транспорта. ![]()
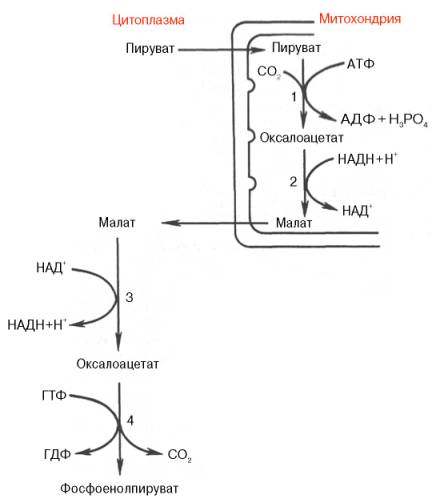
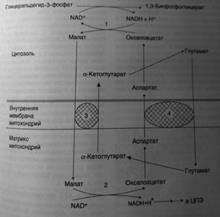
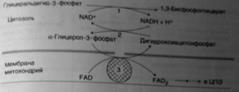
*малат-аспартатный челнок. Перенос водорода из цитозоля НАДН в митохондрии происходит при участии специальных механизмов, называющихся челночными. Суть этих механизмов сводится к тому, что НАДН в цитозоле восстанавливает некоторое соединение, способное проникать в митохондрию; в митохондрии это соединение окисляется, восстанавливая внутримитохондриальный НАД+, и вновь переходит в цитозоль. Самая активная малат-аспартатная система, действующая в митохондриях печени, почек и сердца. На каждую пару электронов цитозольной НАДН, переданную на кислород по этой системе, образуется 3 молекулы АТФ.
В скелетных мышцах и мозге перенос восстановительных эквивалентов от цитозольной НАДН осуществляет глицеролфосфатная система. При этом восстановительные эквиваленты передаются в цепь переноса электронов через комплекс II, и поэтому синтезируется только 2 молекулы АТФ.
Глицеро-фосфатный челнок: ![]()
105. Роль инсулина и глюкагона в регуляции энергетического метаболизма при нормальном питании и при голодании.Инсулин и глюкагон играют главную роль в регуляции метаболизма при смене абсорбтивного и постабсорбтивного периодов и при голодании.Абсорбтивный период: Увеличение отношения инсулин/глюкагон вызывает ускорение использования метаболитов для запасания энергоносителей: происходит синтез гликогена, жиров и белков. Режим запасания включается после приёма пищи и сменяется режимом мобилизации запасов после завершения пищеварения.
Голодание: В отсутствие пищи в крови снижается уровень глюкозы, ам-к и ТАГ. инсулинглюкагоновый индекс снижается, и повышается концентрация контринсулярных гормонов, в первую очередь кортизола. Сущ.2 наиболее встречающиеся формы нарушения переваривания дисахари-дов в кишечнике – дефект лактазы(β-гликози-дазного комплекса) и сахаразы (сахаразо-изомальтазного комплекса непереноси-мостьлактозы и сахарозы. Отсутствие гидролиза соответствующих дисахаридов приводит к осмотическому эффекту и задержке воды в просвете кишечника.
Кроме этого, сахара активно потребляются микрофлорой толстого кишечника и метаболизируют с образованием органических кислот (масляная, молочная) и газов. Из-за этого симптомами лактазной или сахаразной недостаточности являются диарея, срыгивания, метеоризм, вспучивание живота, его спазмы и боли, атопический дерматит.
Сахарный диабет - заболевание, возникающее вследствие абсолютного или относительного дефицита инсулина. При сахарном диабете, как правило, соотношение инсулин/глюкагон снижено. При этом ослабевает стимуляция процессов депонирования гликогена и жиров, и усиливается мобилизация запасов энергоносителей. Печень, мышцы и жировая ткань даже после приёма пищи функционируют в режиме постабсорбтивного состояния.
Организм может синтезировать глюкозу из соединений, способных предварительно превратиться в пируват, т. е. из большинства аминокислот и лактата, поступающего в кровь из работающих мышц. Совокупность таких превращений называют глюконеогенезом. Глюкоза не может быть синтезирована из ацетил-СоА и жирных кислот. Глюконеогенез позволяет как бы сохранить энергию превращений в виде гликогена. Однако помимо этого глюконеогенез в ряде случаев спасает организм от гибели.
Мозг требует непрерывного обеспечения глюкозой. Это означает, что во избежание комы или смерти уровень глюкозы в крови должен поддерживаться в пределах нормы. Между тем запасы гликогена в печени невелики и полностью исчерпываются после суточного голодания.
Люди, однако, остаются живы и при более продолжительном отсутствии пищи. В этом случае поступление глюкозы в кровь обеспечивается печенью. Ни один другой орган (кроме почек, вклад которых невелик) не способен выполнить эту задачу. После суточного голодания печень должна удовлетворить потребность человека в глюкозе (около 100 г в день).
На удовлетворение основных энергетических потребностей организма запаса жиров хватает на недели, но жирные кислоты не проникают через гематоэнцефалический барьер и потому не могут использоваться мозгом. Мобилизация жиров приводит к образованию кетоновых тел, чье присутствие в крови в какой-то мере уменьшает потребность в глюкозе (см. с. 84), однако необходимость ее синтеза при этом не исчезает. Потребность мозга в глюкозе при голодании остается прежней. К тому же мозг лишь один из основных ее потребителей. В глюкозе нуждаются клетки сетчатки, мозгового слоя почек, эритроциты, т. е. все ткани и клетки, жизнедеятельность которых в значительной мере или полностью (эритроциты вообще лишены митохондрий!) поддерживается анаэробным метаболизмом.
Глюконеогенез в печени начинается с пирувата, который служит исходным соединением и при синтезе жирных кислот. Казалось бы, он может связать две ветви метаболизма. Однако превращение пирувата в ацетил-СоА у животных необратимо, поэтому они не могут переработать жирные кислоты в глюкозу.
Механизм синтеза глюкозы из пирувата
Среди реакций гликолиза три термодинамически необратимы (см. рис. 8.7):
1) АТР-зависимое фосфорилирование глюкозы гексокиназой (или глюкокиназой);
2) фосфорилирование фруктозо-6-фосфата фосфофруктокиназой;
3) превращение фосфоенолпирувата в пируват. Глюкоза синтезируется из пирувата с образованием тех же промежуточных соединений, что и при гликолизе, но для того, чтобы обойти необратимые реакции, приходится избирать иные пути.
Первый термодинамический барьер нужно преодолеть в ходе превращения пирувата в фосфоенолпируват. Поскольку спонтанное превращение енольной формы пирувата в кетоформу сильно экзоэргонично (большая отрицательная величина ∆G°′), реакция Фосфоенолпируват —> Пируват необратима. Поэтому у животных превращение пирувата в фосфоенолпируват происходит обходным путем, в две стадии с использованием двух макроэргических фосфатов, делающих это превращение термодинамически выгодным:
![]()
Схема этих превращений представлена на рис. 11.1.
Рис. 11.1. Глюконеогенез в печени: образование фосфоенолпирувата из пирувата (ФЕП - фосфоенолпируват). Обратите внимание, что эти реакции образуют холостой цикл, если не блокировать обратное превращение ФЕП в пируват. О том, как это достигается, см. в главе 12
![]()
Почему на второй стадии используется GTP , а не АТР, непонятно. Энергетически оба эти вещества совершенно эквивалентны. Заметим, что реакция (1) - синтез оксалоацетата, катализируемый пируваткарбоксилазой, играет важную роль в регуляции цикла лимонной кислоты. Однако это не имеет отношения к глюконеогенезу.
Вторая реакция осуществляется фосфоенолпируват-карбоксикиназой. Такое название фермента объясняется тем, что обратную реакцию можно рассматривать как карбоксилирование фосфоенолпирувата, сопряженное с переносом фосфатной группы.
После образования фосфоенолпирувата все гликолитические реакции обратимы вплоть до реакции образования фруктозо-1,6-дифосфата, превращение которого из фруктозо-6-фосфата в ходе гликолиза необратимо. Это препятствие легко преодолевается, поскольку удаление фосфатной группы путем обычного гидролиза не требует затрат энергии.
Аналогичная реакция гидролиза в процессе глюконеогенеза имеет место при превращении глюкозо-6-фосфата в глюкозу (при гликолизе образование глюкозо-6-фосфата, катализируемое гексокиназой или глюкокиназой, необратимо).
В печени присутствует глюкозо-6-фосфатаза, которая гидролизует глюкозо-6-фосфат, после чего свободная глюкоза выходит из клетки. Совокупность реакций глюконеогенеза представлена на рис. 11.2. О том, как регулируется уровень глюкозы крови, рассказано в главе 12.
Итак, существуют четыре фермента, ответственные за глюконеогенез и не принимающие участия в гликолизе: пируваткарбоксилаза, фосфоенолпируваткарбоксикиназа, фруктозо-1,6-дифосфатаза и глюкозо-6-фосфатаза. Естественно, они сосредоточены преимущественно в печени. У крыс концентрация этих ферментов в печени в 20-50 раз больше, чем в скелетных мышцах.
![]()
Откуда печень получает пируват для глюконеогенеза?
Когда при голодании истощается запас гликогена, главным источником пирувата становится гидролитическое расщепление мышечных белков, в ходе которого образуются все 20 аминокислот. Хотя аланин - всего лишь одна из них, более 30% всех аминокислот, поступающих в печень, приходится на него. Аланин - одна из глюкогенных аминокислот; его углеводородный скелет используется печенью для строительства молекулы глюкозы (метаболизм аминокислот будет рассмотрен в главе 15).
Почему при расщеплении мышечных белков образуется так много аланина? В результате метаболизма многих аминокислот и цикла лимонной кислоты накапливается оксалоацетат, который превращается в пируват (см. рис. 11.1). Последний преобразуется в аланин; аминогруппа достается ему от других аминокислот.
Заметим, что при голодании для производства энергии мышцы используют в основном жирные кислоты и кетоновые тела; поэтому они располагают достаточным количеством ацетил-СоА, и для его получения им не нужно окисление пирувата. Как будет показано в главе 12, высокое соотношение концентраций ацетил-СоА/ СоА приводит к инактивации пируватдегидрогеназы. Благодаря этому пируват, образующийся из аминокислот, используется для синтеза аланина. При расщеплении мышечных белков образуются различные аминокислоты, многие из которых превращаются в аланин; он переносится кровью в печень. (Кроме аланина в мышцах синтезируется и доставляется в печень для синтеза глюкозы также и глутамин; принцип его превращения тот же.) В печени аланин преобразуется снова в пируват, а затем - в глюкозу. Схема участия аланина в глюконеогенезе представлена на рис. 11.3.
Рис. 11.2. Глюконеогенез в печени: синтез глюкозы из пирувата. Реакции, отличающиеся от соответствующих гликолитических превращений, выделены цветом
![]()
Рис. 11.3. Механизм, посредством которого при голодании мышечные белки обеспечивают печень пируватом для глюконеогенеза. Схема предполагает, что пируват не превращается в ацетил-СоА в ходе пируватдегидрогеназной реакции. Наряду с аланином из мышц поступает другой субстрат глюконеогенеза - глутамин
![]()
По мере того как при голодании в крови увеличивается содержание кетоновых тел, мозг более активно начинает использовать их вместо глюкозы для производства энергии. Это снижает (хотя и не устраняет) потребность в глюконеогенезе. Поскольку на производство 1 г глюкозы расходуется 2 г мышечных белков, замедление процесса их расщепления благотворно отражается на выживании голодающего организма.
В главе 15 подробно обсуждается схема глюкозо-аланинового цикла (см. рис. 15.9). На ней показано, как аланин, синтезированный в мышцах и доставленный в печень, перерабатывается там в глюкозу. Однако в рамках этой схемы пируват, необходимый для синтеза аланина, образуется в результате гликолиза. При этом имеет место следующая последовательность событий: глюкоза в печени —> глюкоза в мышцах —> аланин в мышцах —> аланин в печени —> глюкоза в печени.
Понятно, что такой цикл не приводит к увеличению количества глюкозы и не решает проблемы снабжения ею тканей, а является лишь формой транспорта аминного азота из мышц в печень.
Другой источник пирувата для глюконеогенеза важен не столько при голодании, сколько при нормальной жизнедеятельности организма. Речь идет о лактате, образующемся при анаэробном гликолитическом расщеплении глюкозы или гликогена (см. с. 101). Некоторые клетки, в частности мозгового вещества почек и сетчатки, фактически анаэробы, а в зрелых эритроцитах вообще нет митохондрий, и они не способны, следовательно, к окислительному фосфорилированию. При нормальном поступлении пищи главным источником лактата является гликолиз в интенсивно работающих мышцах. В таких условиях митохондрии не успевают реокислять накапливающийся NА D Н. В результате восстановительные эквиваленты переносятся на пируват, который превращается в лактат. Последний переносится кровью в печень, а там перерабатывается снова в пируват, а затем в глюкозу и гликоген. Этот физиологический цикл по имени его первооткрывателя называют циклом Кори (рис. 11.4).
Рис. 11.4. Цикл Кори - физиологический цикл, который протекает в мышцах и печени. В мышцах очень невелико содержание трех ферментов, необходимых для глюконеогенеза, поэтому для переработки в глюкозу накопленный в мышцах лактат должен быть перенесен в печень. Избыток лактата образуется в мышцах при их активном сокращении в процессе анаэробного гликолиза
![]()
У цикла Кори есть две важнейшие функции: сберечь лактат для последующего использования и предотвратить так называемый лактат-ацидоз. При поступлении больших количеств молочной кислоты в кровь ее буферная емкость может быть исчерпана, что приведет к опасному снижению pH. Этому препятствует превращение лактата в глюкозу, которое сопровождается поглощением двух протонов (на восстановление 1,3-дифосфоглицерата расходуется 1 протон (Н + ) и 1 молекула NА D Н).
Синтез глюкозы из глицерина
Еще одним источником углеродных соединений для глюконеогенеза служит глицерин, образующийся при гидролизе триглицеридов главным образом в жировой ткани. Он поглощается печенью и превращается там в глюкозу в соответствии со схемой, представленной на рис. 11.5. Первый этап - фосфорилирование глицерина осуществляется глицеринкиназой, которой в жировой ткани гораздо меньше, чем в печени. Все последующие превращения также сосредоточены в печени. Это вполне логично, поскольку в ситуации, когда образование глюкозы становится жизненно необходимым, эту задачу решает печень. Поэтому жировые клетки сами не используют глицерин.
Рис. 11.5. Превращение глицерина, высвобождающегося при гидролизе нейтральных жиров, в глюкозу. Основное количество глицерина образуется в жировых клетках, но поскольку в них нет глицеринкиназы, глюконеогенез из глицерина протекает в печени. Этот процесс обеспечивает образование глюкозы из глицерина при голодании
![]()
Синтез глюкозы посредством глиоксилатного цикла
Е. coli прекрасно существует, используя в качестве единственного источника углерода ацетат. В отличие от животных, бактерии способны превращать ацетил-СоА в С4-кислоты, задействованные в цикле лимонной кислоты, и использовать их для синтеза глюкозы и других необходимых компонентов клетки. В прорастающих семенах растений для синтеза глюкозы также используются запасенные триглицериды. Как же это удается бактериям и растениям?
Эти организмы обладают обычным циклом лимонной кислоты, но часть образующихся в нем соединений они могут использовать в других превращениях, не свойственных животным. Так, в цикле лимонной кислоты 2 углеродных атома ацетил-СоА вводятся сначала в молекулу оксалоацетата (С4) с образованием цитрата (С6), а затем 2 углеродных атома выводятся в виде 2 молекул С O 2 (переход от С6- к С4-кислотам) с образованием сукцината. Этой безвозвратной потери удается избежать благодаря так называемому глиоксилатному пути, который позволяет вывести из цикла лимонной кислоты 2 атома углерода не в виде С O 2, а в виде глиоксилата, который образуется непосредственно при расщеплении изоцитрата на сукцинат и глиоксилат:
![]()
Глиоксилат (С2) далее реагирует с ацетил-СоА, превращаясь в малат - обычный компонент цикла лимонной кислоты.
![]()
Общая схема, иллюстрирующая взаимосвязь всех рассмотренных процессов, представлена на рис. 11.6.
Рис. 11.6. Глиоксилатный цикл, с помощью которого растения и бактерии (у животных он отсутствует) осуществляют синтез углеводов из ацетил-СоА
Специфичные для этого цикла реакции выделены цветом. Штриховой линией отмечены реакции цикла лимонной кислоты, которые не задействованы в глиоксилатном цикле. Таким образом удается сохранить 2 молекулы С O 2, необходимые для превращения цитрата в 2 молекулы оксалоацетата, одна из которых опять используется для синтеза цитрата, а другая превращается в фосфоенолпируват
![]()
Их суммарный эффект сводится к тому, что ацетил- СоА плюс оксалоацетат превращаются в малат плюс сукцинат. И малат, и сукцинат могут быть преобразованы в оксалоацетат, одна молекула которого без ущерба для цикла может быть направлена на синтез глюкозы. В растениях эти реакции протекают в мембранах органелл, называемых глиоксисомами.
В заключение можно напомнить, что подавляющая доля углеводов на Земле образуется благодаря фотосинтезу, в ходе которого энергия солнечного света используется для фиксации С O 2 в виде дифосфоглицерата - соединения, знакомого нам по гликолизу. Механизмы этого процесса и дальнейшего превращения дифосфоглицерата в глюкозу будут рассмотрены в главе 14 как составные части фотосинтеза.
Итак, мы познакомились с использованием жиров и глюкозы в качестве источников энергии, а также с механизмами синтеза этих веществ. Следует напомнить, что эти метаболические процессы не существуют изолированно, а образуют интегрированную метаболическую систему, все части которой взаимозависимы и нуждаются в регуляции.
Вопросы к главе 11
1. После суточного голодания запасы гликогена в печени истощаются, но в организме имеются довольно большие запасы жиров. Зачем при голодании протекает процесс глюконеогенеза, когда в организме есть практически безграничные запасы ацетил-СоА (из жирных кислот), которых вполне хватает для производства энергии?
2. Почему фосфоенолпируват, необходимый для протекания глюконеогенеза, не может быть получен путем фосфорилирования пирувата с помощью пируват- киназы?
3. Начиная от фосфоенолпирувата, глюконеогенез в печени осуществляется путем обращения реакций гликолиза. Какие два гликолитических фермента катализируют необратимые реакции? Как существование этих реакций сказывается на механизме глюконеогенеза?
4. Есть ли в мышцах глюкозо-6-фосфатаза? Поясните ответ.
5. Что такое цикл Кори и какова его физиологическая роль?
6. В жировых клетках практически нет глицеринкиназы - фермента, катализирующего превращение глицерина в глицерин-3-фосфат, хотя там образуется глицерин (путем гидролиза триглицеридов). В печени же этот фермент есть. Логично ли это? А если да, то почему?
7. Как бактериям и растениям, в отличие от животных, удается превратить ацетил-СоА в углеводы?
Биологическая библиотека - материалы для студентов, учителей, учеников и их родителей.
Наш сайт не претендует на авторство размещенных материалов. Мы только конвертируем в удобный формат материалы, которые находятся в открытом доступе и присланные нашими посетителями.
Если вы являетесь обладателем авторского права на любой размещенный у нас материал и намерены удалить его или получить ссылки на место коммерческого размещения материалов, обратитесь для согласования к администратору сайта.
Разрешается копировать материалы с обязательной гипертекстовой ссылкой на сайт, будьте благодарными мы затратили много усилий чтобы привести информацию в удобный вид.
Читайте также:
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.