Цикл кори это гликолиз
ОБМЕН УГЛЕВОДОВ
Классификация:
1) Моносахариды – глюкоза, фруктоза, галактоза.
2) Олигосахариды – мальтоза, сахароза, лактоза.
3) Полисахариды – крахмал и гликоген.
Гликоген – полисахарид в котором молекулы глюкозы соединены 1,4-гликозидными связями, а в местах ветвления 1,6-гликозидными связями.
Крахмал – гетерополисахарид, состоящий из линейной амилозы и разветвленного амилопектина. Строительная единица крахмала – глюкоза соединенная 1,4- и 1,6-гликозидными связями.
Переваривание углеводов:
Начинается в ротовой полости, под действием амилазы слюны, которая является эндоамилазой, то есть разрывает внутренные 1,4-гликозидные связи. Действие про pH=6,8-7.0
Амилаза в активном центре содержит Ca, активатором амилазы является анион Cl - .
Глубокого переваривания в ротовой полости не происходит, так как пища там находится недолго. Образуются промежуточные продукты гидролиза крахмала – декстрины(амило-, эритро-, мальто-, ахродекстрины).
При попадании пищевого комка в желудок амилаза слюны инактивируется, так как pH желудочного сока 1,5-2,5
Переваривание углеводов внутри пищевого комка не происходит, так как соляная кислота не попадает внутрь пищевого комка. Основное переваривание углеводов происходит в кишке под действием панкреатической амилазы(диастаза), которая разрывает внутренние 1,4-гликозидные связи.
Панкреатический сок содержит еще 2 фермента – Амило- и олиго-1,6-гликозидазы, которые разрывают 1,6-гликозидные связи.Конечными продуктами переваривания крахмала являются мальтоза, мальтотриоза, глюкоза.
Кишечный сок содержит сахаразу, которая действует на сахарозу и расщепляет её на сахарозу и фруктозу. Так же в нем есть мальтаза, которая действует на мальтозу, расщепляя ее на 2 остатка глюкозы. Лактаза действует на лактозу и расщепляет ее на глюкозу и галактозу.
Конечные продукты переваривания полисахаридов являются моносахариды. Образовавшиеся моносахариды всасываются с различной скоростью, скорость всасывания глюкозы 100 процентов.
Использование глюкозы .
1) синтез гликогена в печени и скелетных мышцах. Наибольшее количество гликогена откладывается в мышцах, запас гликогена хватает на 24 часа. Гликоген откладывается в виде гранул или глыбок, где содержаться ферменты и синтеза и распада гликогена.
Глюкоза, попав в клетку активируется или фосфорилируется с образованием глюкозо-6-фосфата. Эту реакции катализирует ферменты – глюкокиназа или гексокиназа, которая обладает различным сродством к глюкозе. Реакция не обратимая и требует АТФ. Глюкозо-6-фосфат основной метаболит обмена углеводов.
2) Глюкозо-6-фосфат(фермент изомераза)→ глюкоза-1-фосфат.
3) Глюкоза-1-фосфат взаимодействует с УТФ в результате образуется транспортная форма глюкозы при синтезе гликогена УДФ-глюкоза. Фермент реакции трансфераза.
4) УДФ-глюкоза передает свой остаток глюкоза-1-фосфат на затравочное количество гликогена с образование 1,4-гликозидной связи. Фермент гликогенсинтетаза – главный фермент синтеза гликогена, может существовать в двух формах: фосфорилированная неактивная, дефосфорилированная активная. В образовании 1,6-гликозидных связей участвует фермент ветвления.
Распад Гликогена
Протекает при участии фермента гликоген-фосфарилазы, который может находится в 2 формах:
Активации гликоген-фосфорилазы осуществляют гормоны адреналин и глюкагон.
Адреналин действует при стрессах , активирует распад гликогенав печени и скелетных мышцах. Глюкагон действует в норме и в постабсортивный период, активируя распад гликогена только в печени.
Механизм действия глюкагона и адреналина
Так как для этих гормонов мембрана клетки не проницаема, рецепторы для них располагается на внешней поверхности клеточной мембраны. Происходит образование гормон-рецепторного комплекса, затем изменяется конформация G-белка за счет гидролиза ГТФ в ГДФ. G-белок расположен в самой мембране.
Активируется аденилатциклаза, расположенная на внутренней поверхности мембраны. Активированная аденилатциклаза в клетке катализирует реакцию образования цАМФ из АТФ.
цАМФ вторичный посредник или мессенджер в передаче гормонального сигнала внутрь клетки. На этом этапе происходит усиление гормонального сигнала цАМФ образуется много до 500 молекул, но время их жизни очень мало! так как они быстро гидролизируются ферментами. цАМФ активирует протеинкиназу, актиная протеинкиназа фосфорилирует белки-ферменты клетки. Активная гликоген-фосфорилаза отщепляет от гликогена глюкоза-1-фосфат→глюкозо-6-фосфат→глюкоза→в кровь.
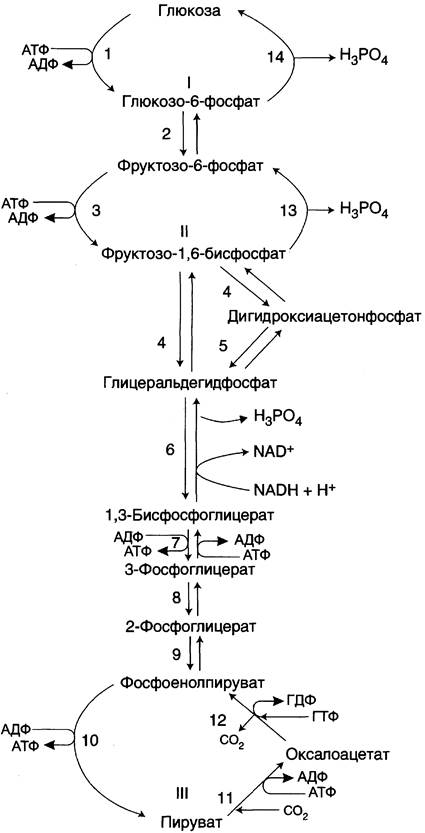
Гликолиз
Протекает в цитоплазме может быть аэробный и анаэробный.
Анаэробный гликолиз – это окисление глюкозы в отсутствии кислорода до двух молекул лактата и 2-х АТФ.
1) Образование глюкозо-6-фосфат. Реакция необратима, затрачивается 1 молекула АТФ.
3) Фруктозо-6-фосфат при участии АТФ и фермента фосфофруктокиназы фосфорилируется с образованием фруктоза-1,6—дифосфат. Реакция необратима, затрачивается АТФ. Эта реакция определяет скорость гликолиза в целом. Фосфофруктокиназа алостерический фермент его активность угнетается высоким содержанием АТФ и повышается при высоких концентрациях АМФ в клетке.
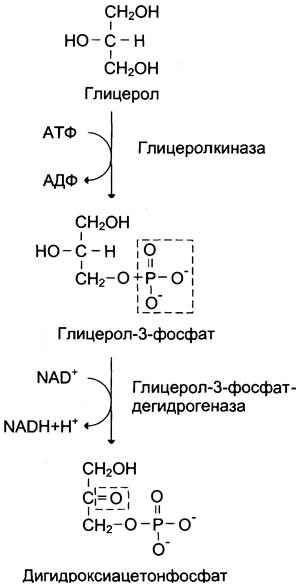
4) Фруктоза-1,6-фосфат при участии фермента альдолаза распадается на 2 фосфотриозы: диоксиацетонфосфат, глицероальдегидтрифосфат.
На этом заканчивается неокислительная стадия гликолиза и начинается стадия гликолитической оксиредукции, в которую вступают 2 молекулы глицероальдегиттрифосфат.
6) Реакция окислительного фосфорилирования протекает при участии неорганического фосфата. (H3PO4) НАД и фермента глицероальдегидфосфатдегидрогиназа. В результате образуется 1,3-дифосфоглицерат + 2НАДН2.
7) Субстратное фосфорилирование. 1,3-дифосфоглицерат передает свой остаток фосфата из первого положения на АДФ в результате образуется 2 молекулы АТФ и 2 молекул 3-фосфоглицерата. Фермент фосфоглицераткиназа.
9) 2-фосфоглицерат(енолаза)→фосфоенолпируват содержит макроэргическую связь, обозначаемую значком
10) Субстратное фосфорилирование. 2-фосфоенолпируват + 2АДФ→2пируват + 2АТФ. Фермент пируваткиназа, реакция необратима.
11) При участии НАДН2, которые образовались в 6-й реакции, восстанавливается в лактат. Фермент лактат дегидрогиназа.
Энергетический выход анаэробного гликолиза:
1-3-й реакции затрачивается 2 молекулы АТФ. 7,10-й реакции образуется 4 молекулы АТФ. И того 4-2=2 молекулы АТФ.
Биологическое значение анаэробного гликолиза.
Заключается в том что клетка получает 2 молекулы АТФ в отсутствии кислорода.
Аэробный гликолиз – это окисление глюкозы в присутствии кислорода с образованием 2 молекул пирувата и 7 молекул АТФ. Аэробный гликолиз состоит из 10 реакций. Энергетический выход аэробного гликолиза:
1-3-й реакции затрачивается 2 молекулы АТФ. 6-й реакции 2 молекулы НАДН2, которые поступают в дыхательную цепь и там дают 2.5 молекулы АТФ*2=5 молекул АТФ.(одна молекула НАДН2 дает 2.5 молекул АТФ, а одна молекула ФАДН2 дает 1.5 молекулы АТФ). 7,10-й реакции образуется 4 молекулы АТФ. Итого 5+4-2=7 молекул АТФ.
Анаэробный гликолиз отличается от аэробного гликолиза:
1) условие проведения
2) количество реакций анаэробный – 11, аэробный – 10.
3) Конечные продукты анаэробный – 2 молекулы лактата, аэробный – 2 молекулы пирувата.
4) Количество энергии анаэробный – 2 молекулы АТФ, аэробный – 7 молекул АТФ.
Глюконеогенез
Это синтез глюкозы из неуглеводных продуктов – пируват, лактат, гликогенные аминокислоты(белки), глицерин(жиры). Синтезировать глюкозу из пирувата и лактата по пути гликолиза невозможно, так как 3 реакции гликолиза являются необратимыми 1,3,10. Поэтому в глюконеогенезе обходные пути и специальные ферменты. Например, надо синтезировать глюкозу из 2-х молекул пирувата. Пируват не может превратится в фосфоенолпируват по пути гликолиза, так как 10-я реакция необратима.
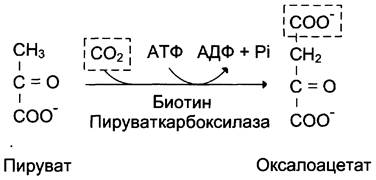
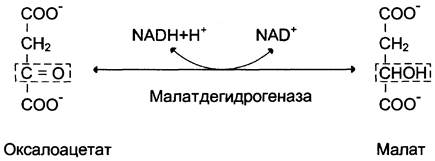
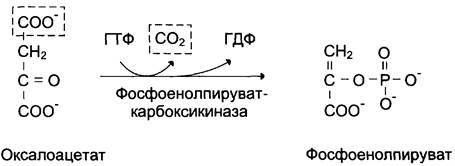
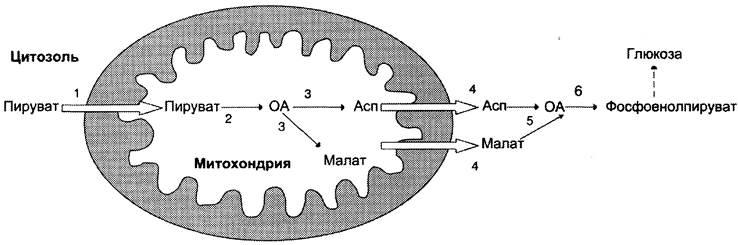
1-я обходная реакция пируват в митохондриях при участии 2-х молекул АТФ и CO2 карбоксилируется в оксалоацетат. Фермент этой реакции пируваткарбоксилаза, Кофермент витамин Н(биотин), при нехватки витамина активность фермента снижается. Оксалоацетат не может попасть в цитозоль, так как мембрана митохондрий для него не проницаема, сначала оксалоацетат превращается в малат, который переходит в цитозоль и вновь превращается в оксалоацетат. Оксалоацетат при участии 2-х молекул ГТФ и фермента фосфоенолпируваткарбоксикиназа превращается в фосфоенолпируват. Далее идут реакции гликолиза фосфоенолпируват→2-фосфоглицерат→3-фосфоглицерат(2АТФ) →1,3-дифосфоглицерат→2 молекулы глицероальдегидтрифосфат (1 молекула дает фрутозо-1,6-дифосфат) другая молекула дает диоксиацетонфосфат→фрутозо-1,6-дифосфат, который не может превратится во фрутоза-6-фосфат по пути гликолиза, так как 3-я реакция гликолиза необратима.
2-я обходная реакция ее катализирует фермент фруктозодифосфотаза при участии которого фрутозо-1,6-дифосфат превращается во фруктозо-6-фосфат→глюкозо-6-фосфат, который не может превратится в свободную глюкозу по пути гликолиза, так как 1-я реакция гликолиза необратима.
3-я обходная реакция катализирует фермент глюкозо-6-фосфатаза. На синтез 1 молекулы глюкозы из 2-х молекул пирувата тратится 6 молекул АТФ. Глюконеогенез контролтрует кортизол.
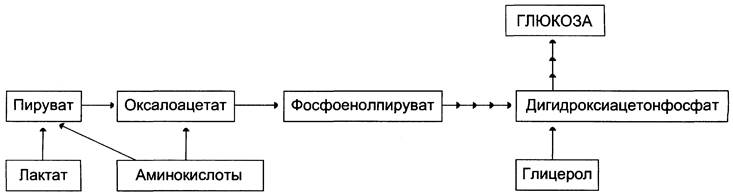
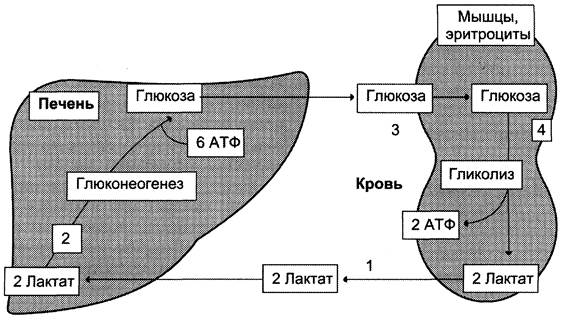
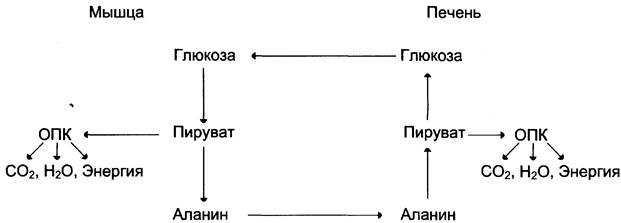
Глюкозолактатный цикл(цикл Кори).
Гликолиз, который протекает в скелетных мышцах связан с глюконеогенезом, который протекает в печени. При мышечной работе в них накапливается лактат, который выходит в кровь и попадает в печень, где из него синтезируется глюкоза путем глюконеогенеза. Эта глюкоза выходит в кровь, затем попадает в мышцы где используется в качестве энергетического материала.
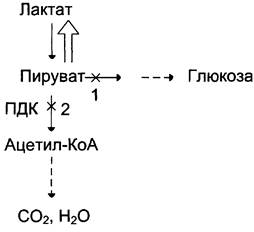
Пировиноградная кислота, которая образовалась в результате аэробного гликолиза, подвергается окислительному карбоксилированию с образованием ацетилКоА и НАДН2(2.5 АТФ). Эту реакцию катализирует пируватдегидрогиназный комплекс, который состоит из 3 ферментов и 5 коферментов.
5 коферментов: Тиаминпирофосфат, который связан с пируватдекарбоксилазой , липоат(липоевая кислота), Коэнзим А, ФАД, НАД.
В анаэробном гликолизе АТФ образуется только за счет субстратного фосфорилирования (2 моль АТФ на 1моль глюкозы).
Значение анаэробного гликолиза особенно велико для скелетных мышц. В интенсивно работающих скелетных мышцах мощность механизма транспорта кислорода оказывается недостаточной для обеспечения энергетической потребности, в этих условиях резко усиливается анаэробный гликолиз, и в мышцах накапливается молочная кислота. Особое значение анаэробный гликолиз имеет при кратковременной интенсивной работе. Так, бег в течение 30 с полностью обеспечивается анаэробным гликолизом. Однако уже через 4-5 мин бега энергия поставляется поровну анаэробным и аэробным процессами, а через 30 мин - почти целиком аэробным процессом. При длительной работе в аэробном процессе используется не глюкоза, а жирные кислоты.
Эритроциты вообще не имеют митохондрий, поэтому их потребность в АТФ удовлетворяется только за счет анаэробного гликолиза. Интенсивный гликолиз характерен также для злокачественных опухолей.
Цикл Кори (глюкозо-лактатный цикл) и глюкозо-аланиновый цикл.
Молочная кислота не является конечным продуктом обмена, но ее образование - тупиковый путь метаболизма: ее дальнейшее использование связано опять с превращением в пируват. Из клеток, в которых происходит гликолиз, образующаяся молочная кислота поступает в кровь и улавливается в основном печенью, где и превращается в пируват. Пируват в печени частично окисляется, а частично превращается в глюкозу. Часть пирувата в мышцах путем трансаминирования превращается в аланин, который транспортируется в печень, и здесь снова образует пируват.
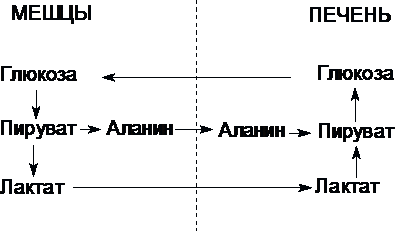
Рис. Цикл Кори и глюкозо-аланиновый цикл
Биосинтез глюкозы (глюконеогенез).
Глюконеогенез протекает в основном по тому же пути, что и гликолиз, но в обратном направлении. Однако три реакции гликолиза необратимы, и на этих стадиях реакции глюконеогенеза отличаются от реакций гликолиза.
Обходные пути глюконеогенеза.
I. Первый обходной путь - превращение пирувата в фосфоенолпируват.
Это превращение осуществляется под действием двух ферментов - пируваткарбоксилазы (Е1) и карбокикиназы фосфоенолпирувата (Е2).
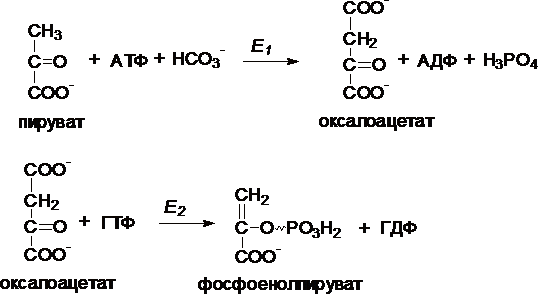
II. Превращение фруктозо-1,6-дифосфата во фруктозо-6-фосфат катализирует фермент фруктозо-1,6-дифосфатаза.
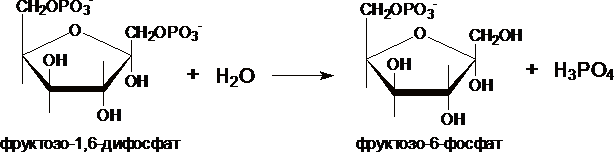
III. Образование глюкозы из глюкозо-6-фосфата катализирует фермент глюкозо-6-фосфотаза .
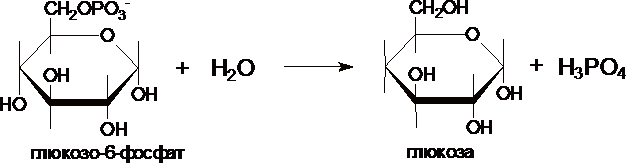
Этот фермент отсутствует в клетках мозга, скелетных мышц и др. тканях, поэтому глюконеогенез, протекающий в этих тканях не может поставлять глюкозу в кровь. Глюкозо-6-фосфатаза локализована в почках и, особенно, в печени, и глюкозо-6-фосфат может превращаться в глюкозу, если ее уровень в крови снижен.
Пентозофосфатный путь (пфп). Значение пфп.
Большая часть глюкозы расщепляется по гликолитическому пути. Наряду с гликолизом существуют второстепенные пути катаболизма глюкозы, одним из которых является пентозофосфатный путь (ПФП). Пентозофосфатный путь скорее даже - анаболический путь, который использует 6 атомов С глюкозы для синтеза пентоз и восстановительных эквивалентов в виде НАДФН, необходимых для образования липидов в организме. Однако, этот путь - окисление глюкозы, и при определенных условиях может завершиться полным окислением глюкозы до СО2 и Н2О. Главные функции этого цикла следующие:
Генерирование восстановительных эквивалентов в виде НАДФН для восстановительных реакций биосинтеза. Ферменты, которые катализируют реакции восстановления, часто используют в качестве кофактора НАДФ + /НАДФН, а окислительные ферменты - НАД + /НАДН. Восстановительные реакции биосинтеза жирных кислот и стероидных гормонов требуют НАДФН, поэтому клетки печени, жировой ткани и др., где протекает синтез липидов, имеют высокий уровень ферментов ПФП. В печени около 30% глюкозы подвергаются превращениям в ПФП.
НАДФН используется при обезвреживании лекарств и чужеродных веществ в монооксигеназной цепи окисления в печени.
НАДФН предохраняет ненасыщенные жирные кислоты эритроцитарной мембраны от аномальных взаимодействий с активным кислородом. Кроме того, эритроциты используют реакции ПФП для генерирования больших количеств НАДФН, который необходим для восстановления глутатиона, участвующего в системе обезвреживания активного кислорода, что позволяет поддерживать нормальную степень окисления Fe 2+ в гемоглобине.
Снабжение клеток рибозо-5-фосфатом для синтеза нуклеотидов, нуклеотидных коферментов и нуклеиновых кислот. Превращение рибонуклеотидов в дезоксирибонуклеотиды также требует НАДФН, поэтому многие быстро пролиферирующие клетки требуют больших количеств НАДФН.
Хотя это не значительная функция ПФП, он принимает участие в метаболизме пищевых пентоз, входящих в состав нуклеиновых кислот пищи и может превращать их углеродный скелет в интермедиаты гликолиза и глюконеогенеза.
Читайте также:
|