Материал для бактериологической диагностики брюшного тифа
Используют бактериологический и серологические методы, которые проводят с учетом периода инфекционного процесса.
Материалом для выделения являются кровь (гемокультура), испражнения (копрокультура), моча (уринокультура), дуоденальное содержимое, желчь (биликультура), соскоб розеол, костный мозг.
В бактериологическом исследовании ранним методом является выделение возбудителя из крови (гемокультура) в период бактериемии (первая неделя заболевания).
Кровь засевают в желчный бульон или среду Рапопорт в соотношении 1:10 (чтобы уменьшить бактерицидные свойства белков крови). На 2-й день проводят пересев на среду Эндо или Левина, или висмут-сульфит агар. Подозрительные (прозрачные или черные в зависимости от сред) колонии пересевают на скошенный агар или одну из комбинированных сред (Олькеницкого, Ресселя, Клиглера). На этих средах для первичной идентификации определяют ферментацию глюкозы, способность к газообразованию, выделение сероводорода, отсутствие уреазы.
Одновременно изучают морфологию и тинкториальные свойства.
Определяют биохимические свойства. Бактерии тифо-паратифозной группы не разлагают сахарозу, лактозу, не образуют индол.
При выделении культур, имеющих характерные для сальмонелл ферментативные свойства, изучают их антигенную структуру в реакции агглютинации на стекле с О- и Н-диагностическими антисыворотками, определяют чувствительность к антибиотикам, проводят фаготипирование.
Для серологической диагностики брюшного тифа и паратифов с 5-7 дня заболевания в основном используется РПГА с О- и Н-эритроцитарными диагностикумами. Положительной считается реакция в титре 1:160 и выше. При исследовании в РПГА титр антител в динамике заболевания нарастает.
Возможно применение реакции агглютинации Видаля с О- и Н-монодиагностикумами к конкретным возбудителям (положительный титр реакции – 1:200 и выше). Серологический диагноз имеет ретроспективный характер.
Для выявления бактерионосителей используют РПГА с эритроцитарным Vi-диагностикумом (титр реакции – 1:40). Исследуют били- и копрокультуру. Проводят фаготипирование с Vi-1 антигеном.
При эпидемических вспышках брюшного тифа для экспресс-диагностики с целью выявления АГ в крови, костном мозге и другом материале применяют РИФ и ИФА.
Лечение брюшного тифа
Этиотропную терапию проводят сразу после установления клинического диагноза. Для лечения используют фторхинолоны. При устойчивости к ним применяют цефалоспорины III поколения, азитромицин.
Левомицетин и ко-тримоксазол в настоящее время используют реже из-за распространения полирезистентных штаммов. Патогенетическое лечение включает инфузионно-дезинтоксикационную терапию.
Профилактика
Проводятся санитарно-гигиенические и противоэпидемические мероприятия, направленные на обезвреживание источников инфекции, пресечение путей передачи, повышение невосприимчивости организма.
Для специфической иммунопрофилактики брюшного тифа разработано 3 типа вакцин. Применяют инактивированные вакцины (эффективность 50-70%), разработана живая аттенуированная вакцина из штамма Ту21а (оказывает большее протективное действие, находится на стадии клинических испытаний). Эффективной является полисахаридная вакцина из Vi-антигена S. typhi(например, Вианвак пр-ва Российской Федерации), применяется по эпидпоказаниям, протективный эффект сохраняется до 2-х лет.
Сальмонеллезы
Сальмонеллезы – группа полиэтиологичных острых инфекционных болезней человека, животных и птиц, характеризующаяся преимущественным поражением желудочно-кишечного тракта, диареей и бактериемией.
Наиболее частой клинической формой сальмонеллезной инфекции является сальмонеллезный гастроэнтерит. Основные возбудители гастроэнтерита: S. Enteritidis, S .Choleraesuis, S .Anatum, S .Derby, хотя заболевания могут вызываться и многими другими вариантами бактерий.
Значительно более тяжелой формой является генерализованная сальмонеллезная инфекция – септицемия. Ее ведущим возбудителем является S. Typhimurium.
Большинство возбудителей выделяют у различных животных (основной резервуар) и человека.
Источником заражения человека чаще всего являются домашние птицы (50%), особенно куры и утки, а также их яйца (сальмонеллы могут проникать через скорлупу внутрь). Носительство сальмонелл выявлено у домашнего скота, собак, кошек, грызунов, у многих диких животных и птиц. Инфицированные животные выделяют бактерии с мочой и калом, молоком, слюной, загрязняя окружающую среду.
Основной путь передачи сальмонелл – пищевой. Заболевания возникают у человека в связи с употреблением мясных продуктов (говядина, свинина – до 20% случаев, мясо птицы), яиц, реже – рыбы, овощей, фруктов, моллюсков, раков, крабов.
Мясо может инфицироваться эндогенно при жизни животного во время его болезни, а также экзогенно в процессе транспортировки, переработки, хранения. Иногда продукты питания инфицируются при неправильной их кулинарной обработке, приготовлении пищи.
При несоблюдении санитарно-гигиенических норм может возникнуть контактно-бытовой путь передачи, который характерен для внутрибольничных вспышек сальмонеллеза. Такие вспышки отмечены в родовспомогательных учреждениях, хирургических, детских и других стационарах. При госпитальных сальмонеллезах чаще выделяется S. typhimurium иS. Haifa. В Республике Беларусь сальмонеллезные инфекции составляют более 50% от всех случаев госпитальных инфекций
Возбудители госпитальных сальмонеллезов отличаются высокой полирезистентностью к химиотерапевтическим препаратам и антибиотикам.
Наиболее восприимчивы к сальмонеллезу дети в возрасте до 1 года и лица с различными иммунодефицитами.
Инкубационный период болезни – от 2-6 часов до 2-3 суток (в среднем составляет 7-24 часа).
Патогенез сальмонеллезов определяется факторами вирулентности возбудителей. Среди них наиболее важную роль играют инвазивные белки III типа секреции.
Некоторые из белков инвазии обеспечивают проникновение сальмонелл внутрь эпителиальных клеток кишечника, их выживание внутри вакуолей. Кроме того, они стимулируют выброс провоспалительных цитокинов и хемокинов из пораженных клеток, апоптоз макрофагов.
Внутри макрофагов бактерии не только размножаются, но и частично погибают с освобождением эндотоксина, поражающего нервно-сосудистый аппарат кишечника и повышающего проницаемость клеточных мембран.
В течение 1 часа от проникновения сальмонелл внутрь клеток развивается выраженная нейтрофильная инфильтрация стенки кишечника. Кишечное воспаление сопровождается выходом белка из пораженных энтероцитов, усилением секреции хлоридов с развитием профузной диареи.
Часть сальмонелл может продуцировать энтеротоксин, который через повышение содержания цАМФ в энтероцитах стимулирует экскрецию хлоридов, что усугубляет диарею.
В большинстве случаев на этой стадии инфекционный процесс может завершиться (гастроинтестинальная форма).
В тяжелых случаях возникает бактериемия и генерализация инфекции, что приводит к септицемии.
Эта форма сальмонеллеза наиболее характерна для S. Typhimurium и S. Enteritidis. Ее развитие обусловлено белками вирулентности, которые кодируются островом патогенности SPI-2. Данные белки подавляют фагоцитоз, что обеспечивает выживание и размножение бактерий внутри фагоцитов, их проникновение в кровь и паренхиматозные органы.
В результате сальмонеллы могут вызывать дистрофические изменения в пораженных органах (селезенка, печень) с формированием вторичных гнойных очагов.
Обычно болезнь заканчивается выздоровлением, однако септические формы инфекции могут приводить у летальным исходам.
Иммунитет
Постинфекционный иммунитет непродолжительный, нестойкий, типоспецифический. В сыворотке больных и реконвалесцентов обнаруживаются агглютинины, преципитины, бактериолизины и другие антитела. Заболевание, вызванное одним сероваром, не создает иммунитета к другим, а перенесенная инфекция не исключает реинфекцию.
Показания. Бактериологическое исследование проводится при подозрении на паратифозное заболевание (наличие лихорадки постоянного, ремиттирующего или неправильно ремиттирующего типа); нарастание симптомов интоксикации параллельно подъему температуры; наличии гипотонии; относительной брадикардии (у детей раннего возраста - тахикардия); дикротии пульса; симптомов поражения органов пищеварения (сухой язык, трещины, утолщения его, отпечатки зубов по его краю, грязно-бурый или коричневый налет); вздутия (метеоризм) живота; урчании и болезненности в правой подвздошной области; положительном симптоме Падалки; задержке стула; гепатолиенальном синдроме на первой неделе заболевания; розеолезной сыпи на 8-10 день болезни; лейкопении с относительным лимфоцитозом или слегка повышенной СОЭ; у всех лихорадящих больных с неустановленным диагнозом, если высокая температура сохраняется более 3 дней.
Посев крови (гемокультура) проводится при наличии подозрения на паратифозное заболевание в любой день болезни; повторно, и особенно в ранние сроки лихорадочного периода до назначения этиотропного лечения.
Розеолокультура (содержимое розеол) берется с 8-10 дня болезни, в периоде реконвалесценции; при стертых формах паратифозных заболеваний, когда возбудители находятся в крови в небольшом количестве.
Посев костного мозга (миелокультура) проводится в атипичных случаях тифопаратифозных заболеваний при отрицательных результатах других лабораторных исследований и посевах крови.
Посев кала (копрокультура) и мочи (уринокультура) проводятся со второй недели болезни.
Посев желчи (биликультура) может проводится в течение всего периода заболевания. Посев желчи противопоказан в лихорадочном периоде.
Для посева крови используют 10% желчный бульон и среду Раппопорта. Можно производить посев в мясопептонный бульон с добавлением 1% глюкозы. Стерильным шприцом из локтевой вены берут кровь на первой неделе заболевания в количестве 10 мл, а в более поздние сроки -15-20 мл крови и засевают во флаконы с теплым бульоном у постели больного в соотношении 1:10 (при меньшем объеме питательной среды кровь может оказать бактерицидное действие на возбудителя). Если посев у постели больного провести нельзя, то в лабораторию посылается цитратная кровь. Во флакончики с 1 мл 40% стерильного раствора вводят 9 мл крови путем прокола пробки предварительно обработанной спиртом.
Для получения содержимого из розеолы кожу над ней обрабатывают этиловым спиртом и скарифицируют. На место скарификации наносят каплю желчного или простого бульона, а затем с помощью пипетки ее переносят во флакон с 50 мл желчного бульона.
Костный мозг получают путем стернальной пункции. Посев проводят во флакон с 50 мл желчного бульона.
Для посева кала стерильной стеклянной палочкой или шпателем берут 2-3 грамма испражнений. Если своевременно провести посев кала нельзя, то можно использовать консервант (глицериновая смесь), составляющий 2/3 общего объема. Посев производят прямым способом на чашку Петри со средами Плоскирева, Левина, с висмут-агаром или на среды обогащения (селенитовая, среда Мюллера) с последующим пересевом на вышеперечисленные среды.
Посев мочи проводят в стерильную посуду (собирают 20-30 мл мочи с соблюдением условий, исключающих ее инфицирование). Затем проводят посев мочи прямым способом на чашки Петри со средой Плоскирева и др.
Посев желчи, полученной при дуоденальном зондировании (не ранее 8-10 дня нормальной температуры) с соблюдением стерильности засевают на чашки Петри по 0,5 мл или на среды обогащения по 1-2 мл или на простой бульон.
Ожидаемые результаты. Предварительные результаты посевов крови - выделение S. Typhi - получают через 2-3 дня, а окончательные - через 5-10 дней. Окончательные результаты бактериологического анализа кала и мочи получают на 4-5 день, а желчи - на 7 день.
Трактовка результатов. Выделение гемокультуры является главным подтверждением диагноза паратифозного заболевания. На ранних стадиях заболевания возбудители выявляются у 40% больных в крови. В некоторых случаях обнаружение паратифозных микроорганизмов в крови не является признаком заболевания. Речь идет о бактерионосителях, у которых любое заболевание может сочетаться с выделением возбудителей брюшного тифа. Выделение возбудителей из мочи обладает повышенной диагностической ценностью в связи с тем, что почечные носители встречаются редко. Копро- урино- биликультуры чаще всего используют для подтверждения бактериологического выздоровления от брюшного тифа и паратифа.
Метод выделения розеолокультуры применяется ограниченно, поскольку экзантема встречается не у всех больных.
Положительные результаты копрокультуры характерны для 2-3 недели болезни, в период вторичной бактериемии, что ограничивает возможности метода.
При отрицательных результатах бактериологического исследования диагноз паратифозного заболевания может основываться на клинико-эпидемиологических данных.
Перед выпиской больных из стационара проводятся трехкратные посевы кала и мочи после отмены антибиотиков с интервалами 1-2 дня и однократным посевом желчи на 10 день нормальной температуры.
Выбор материала и метода микробиологической диагностики брюшного тифа зависит от стадии патогенеза. На 1 неделе заболевания возбудитель выделяют из крови (гемокультура), с конца 2 недели и на 3 неделе- из мочи (уринокультура), испражнений (копрокультура), костного мозга, ликвора.
Основным методом диагностики является бактериологический, начиная со 2 недели проводят серологическое исследование.
Серологический метод исследования:
1.Для серологической диагностики брюшного тифа используют развернутую реакцию агглютинации (РА)- реакцию Видаля, основанную на обнаружении в сыворотке крови людей агглютининов (АТ), которые появляются в конце 1, начале 2 недели заболевания, и на изучении динамики нарастания и длительности сохранения антител. Реакция ставится с антигенами: О- и Н-брюшнотифозными. Боюшнотифозные монодиагностикумы применяются для установления стадии болезни: О-антитела накапливаются в разгар болезни, Н-антитела- появляются к концу заболевания и сохраняются у переболевших в течение длительного времени.
Для реакции Видаля берут 2-3 мл крови из вены.
Реакцию Видаля ставят в 4 рядах пробирок по 7 пробирок в каждом ряду ( 5 опытных и 2 контрольных- контроль сыворотки и контроль АГ). Сначала готовят основное разведение сыворотки. Титры: 1:50, 1:100, 1:200, 1:400, 1:800. Затем делают серию разведений сыворотки путем последовательного переноса 1 мл из предыдущей пробирки в следующую пробирку ряда. Из последней пробирки 1 мл удаляют для сохранения объема. В контроль АГ вносят 1 мл ИХН. В каждую пробирку с разведениями сыворотки и в контрольную пробирку сыворотки вносят по 2 капли взвеси бактерий(диагностикума). Пробирки встряхивают и помещают в термостат при 37 гр на 2ч. , затем сутки выдерживают при комнатной температуре. Учет РА проводят оценивая каждую пробирку, начиная с контрольных. В контрольной пробирке (без диагностикума) не должно быть хлопьев.
Контроль сыворотки- светло-желтая жидкость, контроль АГ- равномерно мутная жидкость.
Реакцию учитывают как положительную при наличии отчетливой агглютинации во 2 опытной пробирке, и её отсутствие в обеих контрольных пробирках.
Титр сыворотки- наименьшее разведение, где наблюдается положительный результат, т.е. титр реакции Видаля равен 1:200.
2.РНГА с эритроцитарными групповыми (A, B, C, D, E) и монорецепторными диагностикумами.
3.ИФА, которые ставят с парными сыворотками в динамике заболевания.
4.Реакция пассивной Vi-гемагглютинации , с помощью которой определяют Vi-антитела в сыворотки крови больного. В качестве АГ используют эритроцитарный Vi-диагностикум. Испытуемую сыворотку разводят от 1:10 до 1:1280. При положительном результате эритроциты покрывают дно пробирки в виде диска с зазубренными краями, а надосадочная жидкость остается прозрачной. При отрицательном- диск с ровными краями. Диагностический титр- 1:40 и выше.
Лактобактерин сухой. Холерная вакцина.
Лактобактерин сухой.
Содержание: Лактобактерин сухой представляет собой микробную массу живых, лиофилизированных в среде культивирования лактобактерий L. plantarum или L.fermentum.
Получение: клетки выращивают в достаточном объеме, отделяют от жидкой среды центрифугированием, суспендируют осадок в стерильном криопротекторе. Суспесию заливают в ампулы, замораживают в течение часа, затем подвергают лиофильной сушке.
Применение: предназначен для лечения детей и взрослых, страдающих:
•хроническими колитами различной этиологии, в том числе неспецифическими язвенными колитами;
•соматическими заболеваниями, осложненными дисбактериозами, возникшими в результате применения антибиотиков, сульфаниламидных препаратов и других причин;
•для лиц, перенесших острые кишечные инфекции, при наличии дисфункций кишечника или выделении патогенных и условно-патогенных бактерий;
•в акушерско-гинекологической практике для санации половых путей при неспецифических воспалительных заболеваниях гениталий и предродовой подготовке беременных группы "риска" с нарушениями чистоты вагинального секрета до III-IV степени.
Холерная вакцина.
Содержание: взвесь убитых холерных вибрионов
Получение: готовится из вибрионов Эль-Тори классических холерных вибрионов серотипов Инаба и Огава. Получают путем выращивания на искусственных питательных средах возбудителей холеры, которые затем подвергают инактивации, разрушению, выделению антигенных комплексов, очистке, конструированию в виде сухого или лиофильно высушенного препарата. В препарат обязательно добавляют консервант, иногда- адъюванты. Проводят контроль вакцины.
Применение: для активной иммунизации против холеры.
24.Возбудители дизентерии Зонне. Биологические свойства (морфологические, культуральные, ферментативные, антигенные, токсинообразование).
Дизентерия Зонне- анторпонозное инфекционное заболевание с преимущественным поражением толстой кишки и общей интоксикацией, вызываемое Shigella Sonnei. Вызывает шигеллез в легкой форме, часто в виде бактерионосительства.
Возбудитель: семейство : Enterobacteriaceae, род: Shigella, вид: S.Sonnei. (1 серовар).
Морфологические свойства: неподвижные (не имеют жгутиков) грамотрицательные палочки, размером 0.5-0.7*2-3 мкм. Спор и капсул не образуют. Многие имеют половые пили, а также снабжены фимбриями(для адгезии).
Культуральные свойства: хорошо растут на простых питательных средах. На плотных средах образуют мелкие гладкие блестящие полупрозрачные колонии, на жидких- диффузное помутнение. Образуют два типа колоний: S-формы (1 фаза) и R-формы (2 фаза).
Ферментативные (биохимические) свойства: S. Sonnei является наиболее биохимически активным видом, по биохимической активности подразделяется на хемовары. 1. Не образуют газ при ферментации глюкозы. 2. Способен ферментировать лактозу и сахарозу медленно, в течение 72 ч. 3. Не прдуцирует сероводород и индол 4. Ферментирует маннит.
Антигенные свойства: О-антиген, также обладает антгеном фазы 1, который является К-антигеном.
Токсинообразование: S. Sonnei продуцирует шигаподобные токсины- белковые токсины, состоящие из 1 субъединицы А- энзиматическая и 5 субъединиц В- рецепторные (имеют сродство к рецептору Gb3 на эндотелии капилляров). Субъединица А, проникнув в клетку, взаимодействует с субъединицей рибосом, необратимо блокируя синтез белка. Шигаподобные токсины накапливаются в периплазматическом пространстве и выделяются в окружающую среду после гибели шигелл. Эндотоксин защищает шигеллы от действия низких значений рН и желчи.

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.

Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
• Микробиологическая диагностика брюшного тифа и паратифов
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: исходя из особенностей патогенеза брюшного тифа, на 1-й неделе заболевания, в период бактериемии, возбудителей выделяют из крови (получение гемокультуры), со 2-й недели заболевания — из испражнений (получение копрокультуры), мочи или желчи.
Бактериологическое исследование(схема 13.2.1).
Получение гемокультуры. В 1-й день из локтевой вены больного берут 5—10 мл крови и засевают в колбу с 50—100 мл селективной среды Раппопорт, содержащей желчный бульон (для подавления роста других бактерий), глюкозу, индикатор Андреде и поплавок для обнаружения газа. Указанные соотношения крови и среды необходимы для подавления бактерицидного действия белков крови. Посевы инкубируют при 37 "С в течение 18—20 ч. На 2-й день при росте сальмонелл наблюдается помутнение и изменение цвета среды. При росте паратифозных бактерий (биовары paratyphi А, Си schottmuelleri) наряду с указанными изменениями появляются пузырьки газа в поплавке. Для ускорения ответа из среды Раппопорт делают мазки и препараты "висячая" капля. При наличии чистой культуры грамотрицательных подвижных палочек и изменении цвета среды (или наличии газа) дают первый предварительный ответ. Затем культуру из среды Раппопорт пересевают в пробирку со средой Ресселя, полагая при этом, что из крови выделена чистая культура и можно сразу приступить к ее идентификации. Одновременно со среды Раппопорт делают посевы на среду Эндо для получения изолированных колоний с целью проверки чистоты выделенной культуры.
На 3-й день отмечают ферментацию глюкозы на среде Ресселя и ставят ориентировочную реакцию агглютинации на стекле. На основании полученных данных дают второй предварительный ответ. Для дальнейшего исследования отбирают несколько бесцветных колоний со среды Эндо и пересевают их в среду Ресселя или скошенный питательный агар (для контроля полученных результатов). Чистую культуру пересевают на среды "пестрого" ряда и серотипируют в реакции агглютинации на стекле со смесью групповых сывороток, а затем с

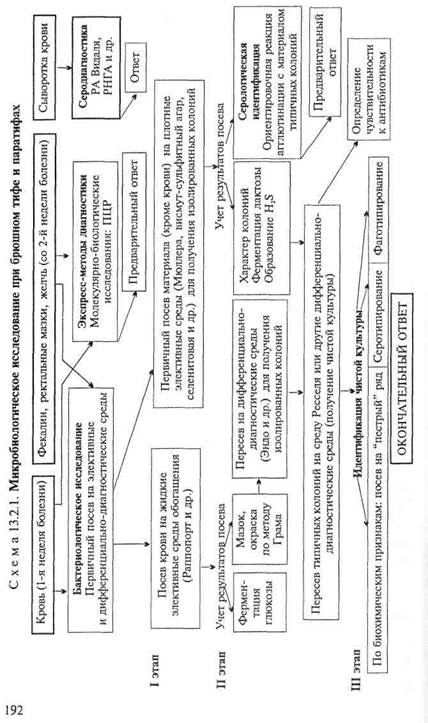 |
адсорбированными монорецепторными О- и Н-сальмонеллез-ными сыворотками. Окончательный диагноз устанавливают на основании биохимических (табл. 13.2.1) и антигенных свойств.
Таблица 13.2.1. Биохимические свойства сальмонелл — возбудителей брюшного тифа и паратифов
| Биовар S.enterica | Ферментация | Образование | |||||
| лактозы | глюкозы | мальтозы | сахарозы | ман-нита | H2S | NH3 | индола |
Paratyphi А - КГ КГ - КГ - -
Schottmuelleri — КГ КГ - КГ + +
Условные обозначения: К — образование кислоты; КГ — образование кислоты и газа; (+) — обнаружение признака; (—) — отсутствие признака.
Биохимические признаки (развернутый "пестрый" ряд) позволяют дифференцировать сальмонеллы от схожих сними энтеробактерий: Citrobacter, Hafnia (табл. 13.2.2).
Таблица 13.2.2. Дифференциация сальмонелл и других энтеробакте рий по биохимическим признакам
| Род | Лизин- декар- бокси- лаза | Ферментация углеводов | р- Галак-този-даза | ||
| дуль-цита | сорбита | ксилозы | рам-нозы | салицина | 4% лактозы |
Salmonella ± К(-) К К К - - -
Citrobacter - К(-) К К К К(±) К(±) К
Hafnia + - - К К К(+) - К
Условные обозначения: (+) — положительная реакция; (—) — отрицательная реакция; ± — вариабельная реакция; К — образование кислоты; К(—) — образование кислоты (редко); К(±) — образование кислоты (вариабельно).
Выделенную чистую культуру бактерий используют для определения чувствительности к антимикробным препаратам.
Фаготипирование. С помощью набора стандартных Vi-фагов определяют до 78 фаготипов S.enterica биовара typhi. При этом необходимым условием является наличие в культуре FZ-антигена. Культуры S.enterica биовара paratyphi В (schottmuelleri) дифференцируются на11 фаготипов и подтипов.
Получение копрокультуры. Испражнения засевают на одну из дифференциально-диагностических сред (Эндо или Левина) или элективные среды обогащения (Мюллера, селени-

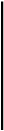
товая или висмут-сульфит агар). Для посева петлю фекалий вносят в пробирку с изотоническим раствором хлорида натрия и готовят суспензию. После оседания крупных комочков суспензию петлей наносят на поверхность агаровой среды — на одну половину чашки. Материал тщательно растирают шпателем по одной, а затем по другой половине чашки для получения изолированных колоний. Посевы инкубируют при 37 °С в течение 18—20 ч. На 2-й день изучают характер колоний, выросших на чашках (рис. 13.2.1; на вклейке), пересевают 2—3 бесцветные колонии (со среды Эндо или Левина) или колонии черного цвета (висмут-сульфит агар) на среду Ресселя и в пробирки со скошенным питательным агаром. При отсутствии подозрительных колоний на чашках делают высевы из среды Мюллера или селенитовой среды на чашки со средой Эндо для получения изолированных колоний. Для ускорения ответа ставят ориентировочную реакцию агглютинации на стекле с материалом, взятым из бесцветной колонии. Далее поступают так же, как и при идентификации гемокультуры.
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования.Молеку-лярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз.
Серодиагностика. Влабораторной практике широко применяют развернутую реакцию агглютинации Видаля, основанную на обнаружении в сыворотке крови людей антител — агглютининов, которые появляются в конце 1-й — начале 2-й недели заболевания. Реакцию ставят одновременно с четырьмя антигенами: О- и Н-брюшнотифозными, А- и В-паратифозными диагностикумами. Брюшнотифозные монодиагностикумы применяют для установления стадии болезни, так как содержание О- и Н-антител в разные ее периоды неодинаково. О-антитела появляются на 1-й неделе, накапливаются в разгар заболевания и исчезают к моменту выздоровления. Н-антитела появляются в разгар заболевания, накапливаются к концу заболевания и сохраняются у переболевших в течение длительного времени. У людей, вакцинированных против брюшного тифа и парати-фов, также наблюдается положительная реакция Видаля, причем в довольно высоком титре, поэтому "инфекционный Ви-даль" удается отличить от "прививочного" только по нарастанию титра агглютининов у больных в процессе заболевания. Реакцию Видаля ставят в четырех рядах пробирок по 7 пробирок в каждом ряду, из которых 5 опытных и 2 контрольные. Для контроля каждого диагностикума в пробирки вносят по 1 мл изотонического раствора хлорида натрия, в который добавляют 2 капли диагностикума. В контрольной пробирке с
1 мл сыворотки (без диагностикума) не должно быть хлопьев. При спонтанной агглютинации реакция не учитывается. Диагностический титр реакции Видаля равен 1:200. Для серологического исследования реконвалесцентов и выявления бактерионосителей широко используют реакцию непрямой И-гемаг-глютинации, с помощью которой в сыворотке крови людей определяют присутствие антител к К/-антигену. В качестве антигена используют эритроцитарный Р?-диагностикум, представляющий собой взвесь эритроцитов человека 1(0) группы, обработанных формалином и сенсибилизированных Fz'-антиге-ном S.enterica биовара typhi. Готовят разведения испытуемой сыворотки от 1:10 до 1:1280. При положительной реакции эритроциты покрывают дно пробирки в виде диска с зазубренными краями, а надосадочная жидкость остается прозрачной. При отрицательной реакции, так же как и в контроле, эритроциты осаждаются на дно пробирки и имеют виддиска с ровными краями ("пуговки"). Диагностическое значение имеет титр пассивной Й-гемагглютинации, начиная с 1:40 и выше. Всех лиц, сыворотка крови у которых дает положительный результат в РНГА с эритроцитарным F/f-диагностикумом, рассматривают как подозрительных на носительство S.enterica биовара typhi и подвергают многократному бактериологическому обследованию.
• Микробиологическая диагностика сальмонеллезов
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: испражнения, при генерализованной форме — кровь.
МЕТОДЫ ДИАГНОСТИКИ: микробиологическая диагностика сальмонеллезов принципиально не отличается от диагностики брюшного тифа и паратифов. Серодиагностика не применяется по причине большого числа сероваров возбудителей.
• Микробиологическая диагностика кишечного иерсиниоза
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: испражнения, при генерализованной форме — кровь, моча, спинномозговая жидкость.
МЕТОДЫДИАГНОСТИКИ:
Бактериологическое исследование.Посев материала на дифференциально-диагностические (среда Эндо, Мак-Конки, СБТС-агар с желчью и бромтимоловым синим) и селективные (CIN-arap с антибиотиками цефсулодином и новобиоцином) плотные среды или жидкие среды обогащения (буферно-казе-иново-дрожжевой бульон, 1 %, пептонная вода с рН 7,6—7,8). Посевы инкубируют при 25 "С в течение 24—48 ч. Идентификация чистой культуры осуществляется на основании морфологии, подвижности, тинкториальных свойств (грамотрица-

тельные палочки с закругленными концами и характерным биполярным окрашиванием, неспорообразующие, перитрихи), культуральных, биохимических признаков.
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования.Молеку-лярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР.В случае обнаружения соответствующих молекул можно поставить предварительный диагноз.
Серодиагностика.Диагностическое значение имеет обнаружение антител к поверхностным антигенам возбудителей наиболее распространенных серотипов (03, 04, 05, 06, 08, 09) в РА. Положительной считается РА в титре не менее 1:160. Разработаны также ИФА-тесты.
• Микробиологическая диагностика кишечного дисбактериоза
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: фекалии. МЕТОДЫ ДИАГНОСТИКИ:
Бактериоскопическое исследование.Имеет ориентировочное значение. При резко выраженном дисбактериозе в мазках преобладают микроорганизмы определенных видов (например, дрожжеподобные грибы, стафилококки и др.) на фоне существенного уменьшения грамотрицательной микрофлоры.
Бактериологическое исследование.Проводится количественное исследование состава микрофлоры кишечника. Для этого из исследуемого материала готовят разведения Ю -2 , 10 -4 , Ю -6 и т.д. Первичные посевы по 0,1 мл каждого разведения производят параллельно на несколько питательных сред (Эндо, кровяной агар, ЖСА, агар Сабуро и др.) и инкубируют при 37 °С. Подсчитывают число выросших колоний и определяют число КОЕ в 1 г материала. Проводят отсев 2—3 колоний каждого вида для выделения и идентификации чистых культур микроорганизмов.
Дляобнаружения анаэробных Bifidobacterium spp. делают мерные посевы материала в разведениях 10" 7 и выше в пробирки с 13—15 мл модифицированной среды Блаурокка, в состав которой входит печеночный бульон, пептон — 1 %, лактоза — 1 %, хлорид натрия — 0,5 %, цистин — 0,01 %, агар-агар — 0,75%, твин-80 — 0,1 %. При росте Bifidobacterium spp. через 24—48 ч происходит помутнение всей среды с образованием тяжей или отдельных колоний. Готовят мазки и окрашивают по методу Грама. Выделение чистых культур Bifidobacterium spp. является весьма трудоемким и практически необязательным. При необходимости идентификацию представителей рода осуществляют по биохимическим свойствам.
Для оценки результатов бактериологического исследования
сопоставляют полученные данные с количественным содержанием микроорганизмов в норме. Ориентировочные критерии нормальной микрофлоры толстой кишки представлены в табл. 13.2.3.
Таблица 13.2.3. Критерии нормы кишечной флоры
| Норма |
Патогенные микробы сем. Enterobacteriaceae О
Общее количество E.coli, млн/г 300—400
E.coli со слабовыраженными ферментативными
свойствами, % До 10
E.coli с гемолитическими свойствами, % Нет
Энтеробактерии (лактозоотрицательные и лактозополо
жительные): Hafnia, Aerobacter, Citrobacter, Klebsiella,
Serratia, % До 5
Кокковые формы, % До 25
Гемолитический стафилококк по отношению ко
всем кокковым формам, % Нет
Bifidobacterium spp. (рост при посеве разведения) 10 и выше
Бактерии рода Proteus Нет
Грибы рода Candida Нет
При кишечном дисбактериозе происходит значительное снижение облигатной анаэробной микрофлоры, и в первую очередь Bifidobacterium spp., а также увеличение аэробных видов, в частности E.coli, содержание которых может превышать 10 11 микробных клеток в 1 г испражнений. Увеличивается частота обнаружения штаммов E.coli со слабой ферментацией лактозы и имеющих гемолитические свойства (до 30—40 %), гемолитических и негемолитических стафилококков, бактерий рода Proteus, грибов рода Candida (до 15—16 %). У лиц с дис-бактериозами более часто обнаруживают лактозоотрицательные и лактозоположительные энтеробактерии, относящиеся к родам Hafnia, Aerobacter, Citrobacter. Для микроорганизмов, в норме отсутствующих в испражнениях или имеющихся в небольшом количестве, показателем дисбактериоза будет содержание их 10 5 —10 6 и выше КОЕ в 1 г материала (Proteus spp., Klebsiella pneumoniae, Pseudomonas aeruginosa, Staphylococcus aureus, Candida spp.). Для окончательного заключения о кишечном дисбактериозе важное значение имеет повторное его выявление в динамике обследования больного.
• Диагностические, профилактические и лечебные препараты
Не нашли то, что искали? Воспользуйтесь поиском:
Читайте также:


