Бактериофаг от золотистого стафилококка и клебсиеллы
Я в отчаянии.Моему ребенку нет и месяца — нашли золотистый стафилококк 10 в 5 и клебсиеллу пневмонию 10 в 7 степени, устойчивые к бактериофагам и чувствительные только к некоторым антибиотикам.Врач говорит, что надо выжидать.Прошу Вашей помощи!
Прежде чем ответить на этот вопрос, предлагаем вашему вниманию письмо от находящегося в отчаянном состоянии молодого мужчины после нескольких курсов лечения антибиотиками и бактериофагами:

Несмотря на кажущееся нам разнообразие антибиотиков, большинство из них попадает в три основные группы в зависимости от мишени: ингибиторы синтеза клеточной стенки бактерий (бета-лактамы), антибиотики, ингибирующие синтез белка (тетрациклины, аминогликозиды, макролиды), и фторхинолоны, ингибирующие синтез ДНК бактерий.
Первый антибиотик – пенициллин, когда-то спасший миллионы жизней во время Второй мировой войны, относится к группе бета-лактамов. Успех пенициллина был таким, что его не только продавали без рецепта, но и добавляли в зубные пасты для профилактики кариеса.
Эйфория ушла, когда в конце 1940-х годов многие штаммы золотистого стафилококка перестали реагировать на пенициллин, и потребовалось принятие срочных мер для создания новых химических производных пенициллина, таких как ампициллин или амоксициллин.
Основным источником резистентности стало распространение генов бета-лактамазы: фермента, расщепляющего ядро молекулы пенициллина. Эти гены не образовались заново, ведь плесневые грибки, производящие пенициллин, и бактерии сосуществовали друг с другом в природе миллионы лет.
Впрочем, полностью синтетические фторхинолоны, появившиеся в клинической практике в начале 1980-х, уже через десять лет повторили судьбу пенициллина. В частности, в докладе ВОЗ отмечается, что широко распространенная инфекция кишечной палочки, которая традиционно лечилась фторхинолонами, антибиотиками широкого спектра действия, уже выработала 100 процентую резистентность.
На протяжении последних десятилетий проходило соревнование химиков-синтетиков и бактерий: на рынок выходили новые и новые группы бета-лактамных антибиотиков (цефалоспорины нескольких поколений, монобактамы, карбапенемы), устойчивые к расщеплению, а бактерии обзаводились бета-лактамазами нового класса со все более широким спектром действия.
Но, если пока еще MRSA хоть иногда и поддается с большими побочными для организма излечению, то вот гонорея рискует превратиться в неизлечимую болезнь. Об этом предупреждает главный врач Англии Салли Дэвис. Совсем недавно она направила во все аптеки и всем врачам общей практики письма, где уточняется стратегия лечения этого венерического заболевания.
Дело в том, что начиная с сентября 2015 года на севере Англии наблюдалась вспышка гонореи с высокой степенью устойчивости к антибиотикам. Эта инфекция начала быстро приобретать иммунитет к новым антибактериальным препаратам, что сокращает возможности врачей. Им рекомендуют с максимальной тщательностью выбирать лекарства.
Исследование, опубликованное в журнале BMJ Open, показало, что врачи продолжают прописывать страдающим от гонореи антибиотики, которые уже перестали действовать против ее возбудителя, и тем самым повышают сопротивляемость микроорганизмов. Например, ципрофлоксацин власти не рекомендуют выписывать уже с 2005 года, но при этом в 2007 году его включали в 42 процента рецептов, в 2011 году — в 20 процентов.
Статистика наблюдений беспристрастно фиксирует, что в Австрии, Австралии, Канаде, Франции, Японии, Норвегии, Словении, Южной Африке, Швеции и Великобритании уже подтверждена неэффективность лечения гонореи третьим поколением фторхинолонов.

Откуда берется устойчивость.

MRSA. (Фото: NIAID)
MRSA - далеко не самый страшный больничный патоген. Он относится к группе грам-положительных бактерий, а значит имеет толстую клеточную стенку, в которую хорошо проникают молекулы разных веществ. Например, ванкомицин.
Настоящий ужас у врачей вызывают грам-отрицательные Escherichia coli, Pseudomonas aeruginosa и Acinetobacter baumannii. У этих бактерий клеточная стенка покрыта липидной мембраной, в которую вещества попадают через узкие каналы.
Escherichia coli (abbreviated as E. Coli)This giant inflatable E.coli sculpture was made for the KREBS Fest, presented at University of Sheffield. Эта бактерия вызывает настоящий ужас у врачей!
Когда бактерия чувствует присутствие антибиотика, она снижает количество таких каналов, что сразу же понижает эффективность лечения. К этому надо добавить переносимые на плазмидах транспортеры, которые откачивают наружу чудом попавшие внутрь клетки молекулы лекарства, и гены бета-лактамаз (гены устойчивости обычно переносятся комплексами, что дополнительно усложняет борьбу с бактериями).
Именно для борьбы с такими инфекциями антибиотик колистин до последнего времени оставался единственным доступным средством лечения.

Почему так мало новых антибактериальных препаратов.
Но дело не только в этом. Отсутствие новых антибиотиков - следствие нескольких фатально совпавших причин, прежде всего экономических.
Во-первых, новые антибиотики, в отличие от каких-нибудь иммуномодуляторов, нужны относительно небольшому числу пациентов, причем живут эти пациенты преимущественно в бедных странах. Во-вторых, курс лечения антибиотиком занимает несколько недель, а не годы, как, например, гипотензивными средствами. В-третьих, устойчивость может сделать дорогой препарат нерентабельным уже через несколько лет после начала применения. В общем, на них не заработаешь.

Бактериофаги
В микромире фаги играют роль естественных ограничителей численности бактерий, и количество фагов колеблется в зависимости от количества бактерий. Если число нужных фагу бактерий снижается, то и фагов становится меньше, иначе им негде будет размножаться. Поэтому фаги ограничивают, но не уничтожают полностью популяцию бактерий.
Ученые называют фаги по имени бактерий: стафилококковый фаг, клебсиельный фаг, то есть каждой бактерии соответсвует определенный фаг.Каждый бактериофаг способен заражать только определенные виды бактерий.
Хотя производители бактериофагов и рекламируют их применение для предупреждения и лечения многих инфекционных заболеваний чуть ли ни как панацею и замену антибиотикам, но, как показывает практика, в организме человека вирусы действуют на бактерии несколько иначе(не так активно), чем в пробирке.
Как оказалось, применение фагов по сути ничем не отличается от использования антибиотиков: единственной мутации в белке-рецепторе на поверхности бактерии достаточно, чтобы фаг перестал на нее садиться. Попросту говоря, бактерии быстро научились приспосабливаются не только к антибиотикам, но и к фагам,становясь устойчивыми к их действию.
Глава исследовательской группы геномной эпидемиологии Франк Ареструп из Датского технического университета зявляет:

Использование бактериофагов — вирусов осложняется тем, что бактерии способны передавать друг другу гены,обеспечивающие сопротивляемость вирусам.Кроме того, процедура сопряжена со множеством потенциальных побочных эффектов.
Когда действие фагов заканчивается, иммунная система входит в рабочий режим не сразу.
Фаги не сочетаются с рядом пробиотиков (бифидумбактерин, лактобактерин) и пребиотиков (нормазе, хилак-форте), так как кислая среда последних нейтрализует их.
Фаги блокируются бактериями в коллоидной среде( в коллоидном растворе). Например,снижение бактерицидности фагов при наличии большого количества слизи в толстой кишке. Бактерии выделяют большое количество полисахаридов и живут в этой массе, в которую фагам проникнуть очень сложно.
Все это, в итоге, не может представлять фаговую терапию как стандартный и повсеместный способ лечения, как об этом часто любят заявлять компании, производящие данную продукцию.
Многие ведущие ученые считают, что именно степень реакции иммунной системы на вирус или бактерию и определяет в конечном итоге исход течения болезни.
Ни антибиотики, ни бактериофаги не имеют такого потенциала,чтобы одновременно и патогенные бактерии уничтожать, и иммунную систему укреплять, и интоксикацию организма снимать.
Как проходило ваше лечение,сколько по времени?На какой день виден результат?Как малыш переносил само лечение?
![]()
Хотелось бы продолжить тему, ибо она все ещё актуальна. У моего сына, ему1.2, постоянные проблемы с животом, вздутие вообще не проходит. ( только с утра он как балерина) а потом живот надувается, жалко его🥺 Какашки ужасные, горчичного цвета, со слизью и зловонные. Какает 5-6 раз, даже по ночам( В анализах золотистый и клебсиелла. До шести месяцев ждали, давали Прибалтики. В 8 месяцев пролечили макмирором. Нужен грамотный специалист, посоветуйте. Или же лечение которое сработало.
![]()
У нас клабсиелла вылезла и др. бяки, назначили энтерофурил 2-3 р в день 7дней лечть, хилак форте 3 р в день на 7-10 дней, креон 4 р в день по 1/4 2-3 недели, и регидрон если кал жидкий. Потом 1,5 месяца нормофлорин л и б у
![]()
Полякова -это врач в Киеве? Мы боремся с зоотистым стафилоккоком и все безрезультатно, пили курсы бактериофагов и ничего.
Подскажите, как попасть к доктору Поляковой? Буду благодарна за ответ
![]()
Уже почти две недели лечимся у Поляковой, ее методами. Стул нормализовался, высыпания проходят, ребенок стал значительно поспокойнее. Рекомендации людей, которых она вылечила, превосходят все мои ожидания. Никогда не думала, что стафилококк и клебсиеллу можно так успешно лечить у месячного ребенка фитотерапией.
![]()
У меня знакомые недавно лечили klebsiella. Сам процесс занял у них почти месяц. Ребенка практически истощили. Но результат был довольно эффективный. А какие вам помогли препараты? Или у них у всех почти курс месяц. Ну очень долго, особенно тяжело все это время диету соблюдать
![]()
Мы в 2 месяца лечили стафил., бактериофагами гнали. Результат был первую неделю, потом опять какахи зеленые. Дальше был энтерофурил и кип, тоже самое. Сейчас нам 6 мес, здали анализы, высеились золот. стаф. и клебсиелла. Я ничего делать не буду! Хватит мучать попу! Есть стафилококк, а есть стафилококковая инфекция. в этом и есть разница (это не я сказала, а доктор Комаровский) Ребенок обязательно перерастет эту гадость! Здоровья Вашим деткам.
![]()
Скажите пожалуйста как у вас дела?стафф оставил вас в покое?
![]()
Здравствуйте всем. Мы тоже столкнулись с этой проблемой. И честно говоря, я перепробовала все. Супер гастроэнтерологи типа Назаренко (3 больница), Журавлева ( Мать и Дитя) платный инфекционист на дом, туча педиаторов, притом современных!! (НСП и бла-бла) Короче это долго все. Сейчас как то полегче стало. Но все это сумма: время, терпения, ГВ(чудом удалось спасти и не жалею! ниодни пугалки типа "а так у вас вторичная лактазная недостаточность" не остановили. И слава БОГУ!), анализ на дисбак, отказ напроч от госпитализации (даже в самые критические моменты, а у нас была и кровь в стуле), и постоянные анализы на дисбак и копрограмма (контроль результата лечения регулярный). А еще куча новомодный лекарств. Креон 10000, Клебсиеллезный бактериофаг (который до сих пор дома в холодильнике стоит), Лактаза беби (по мне полная херня). Вообщем что я хотела сказать. Дорогие мамы, будте бдительны , доверяйте своему чутью и все получиться.Бог не дает более того, что мы можем пережить. все обязательно наладиться!! Здоровья ВАМ и ВАШИМ МАЛЫШАМ. Я до сих пор помню как со слезами на глазах читала подобные статьи и казалось, что мой случай самый сложный. Но все проходит.
Наталья. У меня остались еще препораты и если кому- то они понадобяться звоните 751-46-54 (мтс)
![]()
у моей малышки болит животик, иногда пукаем очень болезненно, пару раз кал был зеленый. нам 2 месяца. да еще нашли золотистый стафилакок. приписали антибиотики. а я боюсь довать, кроха ведь совсем. кормлю наном. давала и боботик и эспумезан и плантекс толку мало. помогите у кого такая беда. врачи не знают от чего животя болит толи от стафилакока толи от смеси.
![]()
![]()
Если у вас есть другие вопросы пишите в личные сообщения на Baby Blog или в контакте в группе Мелкозаврики. Или заказывайте полную консультацию(от 500руб).
С уважением Екатерина Балунова.

Дисбиотические нарушения в настоящее время широко распространены в России и за рубежом. Особенно часто встречается дисбиоз кишечника, от которого, по данным различных исследователей, в той или иной степени страдает до 90 % населения страны [1]. Самым многочисленным как по видовому разнообразию, так и в количественном отношении является ассоциативный симбиоз микробных сообществ толстого кишечника [3]. У детей первого года жизни с высокой частотой и в этиологически значимых количествах выделяются клебсиеллы и золотистый стафилококк, что делает этот возраст уязвимым для развития эндогенных гнойно-воспалительных процессов различной локализации [2]. Микробиоценоз кишечника характеризуется неустойчивостью, связанной с микробной сукцессией при формировании микробиоты, особенностями иммунной системы, неадекватным иммунным ответом организма на заселение кишечника УПМ [1; 3]. Однако мало изученными остаются вопросы, связанные с распространенностью и взаимодействием генетических маркеров патогенности среди клебсиелл и стафилококков, персистирующих совместно в кишечном биотопе. Низкая эффективность эмпирического использования антибиотиков в сочетании с их побочным иммуносупрессивным эффектом приводит к подавлению нормальной микрофлоры кишечника и последующим формированием дисбиозов. Среди альтернативных антимикробных препаратов особый интерес представляют бактериофаги. В то время как антибиотики воздействуют на широкий спектр бактерий, в том числе и на нормальную микрофлору, бактериофаги обладают выраженной специфичностью [6].
Цель исследования. Оценить патогенный потенциал аутоштаммов Klebsiella spp. в ассоциации со Staphylococcus aureus, изолированных от детей первого года жизни с дисбиозами кишечника посредством детекции генетических детерминант патогенности.
Материалы и методы исследования
Для ПЦР-амплификации использовали коммерческий набор AmpliSens-200-1 (ФГУН ЦНИИЭ Роспотребнадзора, Россия). ПЦР проводили с ДНК-матрицы (3 мкл), прямого и обратного праймеров (1 мкл). ДНК амплифицировали в соответствии с протоколом [2]. Электрофорез ПЦР-фрагментов ДНК клебсиелл проводили с использованием 1,0 %-го агарозного геля в 1 % трис-ацетатном буфере в течение 60 мин при 100 В, окрашивали бромистым этидием (1%) и просматривали с помощью УФ-просвечивания. Выделенные гены были идентифицированы и определены на основе размера фрагмента ДНК продукта [2] при его соответствии с длиной маркерного фрагмента. Исследования проводились в течение 2012–2014 гг. Для статистической обработки результатов использовали Excel из пакета MS Office 2003.
Результаты исследования
и их обсуждение
В обследованной группе детей первого года жизни Klebsiella spp. была выделена в 60 % случаев, в том числе в ассоциации с золотистым стафилококком – в 40 %. Также был выявлен микроэкологический дисбаланс, который характеризовался дефицитом бифидобактерий (63,1±4,8), лактобацилл (6,8±2,5), нормальной кишечной палочки (11,7±3,2) на фоне высокой плотности бактерий рода Klebsiella (>104 КОЕ/г). В мазках 60 % аутоштаммов клебсиелл имели плотную полисахаридную капсулу, которая способствовала усилению гидрофобности клеточной стенки и препятствует проникновению фагов и АБП в клетку. Клебсиеллы чаще встречались в ассоциациях с Enterococcus spp. (78,6±4,1), Staphylococcus aureus (40,8±4,9); реже – с E. coli со слабой ферментативной активностью (26,2±4,4), Clostridium spp. (25,2±4,3) и грибами рода Candida (15,5±3,6). Далее по частоте убывания регистрировались E.coli с гемолитической активностью (13,6±3,4), коагулазонегативные виды стафилококка (4,9±2,2), Proteus spp. (3,0±1,7), Enterobacter spp. (2,0±1,4), Citrobacter frendii (2,0±1,4).
Установлено, что исследуемые штаммы клебсиелл (n=100) были чувствительны практически ко всем тестируемым антибиотикам. Процент штаммов чувствительных к β-лактамным антибиотикам составлял 85±3,5 % (цефтазидим), 83±3,8 % (амоксициллин), 89±3,1 % (цефотаксим). Исключение составил ампициллин, к которому были резистентны 70±4,5 % штаммов. Полученные данные подтверждают факт природной устойчивости клебсиелл к ампициллину. Также был высок процент штаммов чувствительных к амикацину и норфлоксацину (по 92±2,7 % случаев соответственно).
Результаты чувствительности штаммов Klebsiella spp. (n=156) к коммерческим препаратам бактериофагов представлены в табл. 1.
Характеристика чувствительности аутоштаммов Klebsiella spp к бактериофагам, (%)

Согласно данным исторической статистики, детская смертность в Российской империи значительно превышала общеевропейские показатели. Причиной тому было отсутствие антибактериальных препаратов, пренебрежение элементарными санитарно-гигиеническими нормами по уходу за младенцами и их врожденная слабость, обусловленная плохим здоровьем, а иногда и истощением родителей. Наиболее часто детей поражали кишечные инфекции, возбуждаемые патогенными организмами вроде золотистого стафилококка. До годовалого возраста тогда доживали лишь около 75% малышей.
По причине скудного питания у рожениц возникали трудности с лактацией. Очевидно, что без материнского молока ситуация с детской смертностью усугублялась – ребенок не получал защитных веществ, а потому его иммунитет оставался уязвимым и не выполнял свои функции в полном объеме. В таких тяжелых условиях организм младенца был вынужден своими силами бороться с множественными возбудителями.
Широкое распространение антибактериальных препаратов и антисептических средств, призванных бороться с патогенными микроорганизмами, несколько улучшило положение дел. Однако, как оказалось, чаяния педиатров и врачей-инфекционистов на успешное решение проблемы оказались преждевременными.
Проблема заключалась в том, что бактерии рода стафилококков и энтерококков (золотистый стафилококк и клебсиелла) обладали огромной сопротивляемостью к медикаментам и не меньшей приспособляемостью к любым неблагоприятным условиям.
В последние 30-50 лет с массовым распространением антибиотиков пришла и сомнительная терапевтическая практика: по поводу и без врачи рекомендуют приём антибактериальных препаратов абсолютно всем, начиная с больных банальной простудой, заканчивая онкологическими пациентами. За короткий срок патогенные микроорганизмы изменились настолько, что сейчас стали огромной проблемой для роддомов и детских отделений больниц.
Доказательства мутации патогенной флоры, как говорится, налицо:
Золотистый стафилококк научился продуцировать новые ферменты, разрушающие антибактериальные вещества;
Кроме того, возбудитель перестроился и начал жить сложными колониями, нечувствительными к антибиотикам.
Исследования ученых показывают, что одиночные, разрозненные представители патогенной микрофлоры чувствительны практически ко всем антибиотикам, в том числе, к самому обыкновенному пенициллину. Тот же эффект достигался, когда стафилококки жили привычными небольшими колониями.
Никто не брал в расчет, что бактерии давно перестали существовать в виде однослойных поселений. Теперь они живут многослойными колониями. Антибактериальное средство уничтожает только верхний слой или нижний слой, а остальные бактерии благополучно продолжают свою жизнедеятельность.
Два этих свойства золотистого стафилококка превратили безобидную, на первый взгляд, бактерию в грозного противника. Стафилококк — настоящий бич стационаров. Бороться с ним крайне сложно, и здесь не помогут ни косметические ремонты, ни обработка ультрафиолетом.
Нередко случается и так, что носителями стафилококка становятся сами работники больниц.
Симптомы стафилококка у грудничка
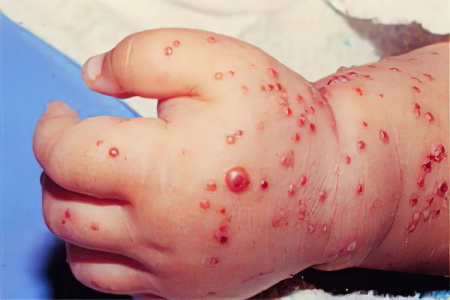
Инфицирование стафилококком проявляется довольно быстро. Золотистый стафилококк — крайне агрессивный и вирулентный патогенный микроорганизм, обнаруживающий свое присутствие практически сразу после заражения. Норма содержания золотистого стафилококка в организме — ноль. Если заражение произошло в условиях родильного дома, то ко 2-5 дню у младенца начинаются проблемы с желудочно-кишечным трактом.
Основной признак — частый стул. Однако и у здорового младенца, вскармливаемого грудным молоком, стул может быть регулярным и довольно частым.
В таком случае заболевание можно выявить, исходя из дополнительной симптоматики:
Кожные высыпания (гнойнички, фурункулы и др.);
Длительно незаживающий пуп;
Появление зелени, гноя, крови в кале;
Изменение цвета и структуры стула: кал желтый или зеленоватый, пенистый.
Дети старше одного месяца страдают от стафилококковой инфекции несколько реже, и симптоматика у них отличается. У таких детей заболевание проходит по типу гастроэнтероколита или токсикоинфекции.
Стафилококк часто образует колонии на поверхности продуктов питания. В ходе жизнедеятельности микроорганизм активно вырабатывает энтеротоксины. После употребления зараженных продуктов в организм ребенка проникают как сами бактерии, так и выработанные ими токсины.
Симптоматика включает в себя:
Признаки общей интоксикации организма (повышение температуры тела до 37.5-39.0, головная боль, слабость и вялость, сонливость, тошнота);
Бледность кожных покровов;
Частая рвота и понос.
Чаще всего детский организм подвергается атаке бактерии при употреблении следующих продуктов:
Кисломолочные продукты: молоко, творог, кефир и др.;
Фруктовые и овощные соки;
Детское питание из баночек.
Особенно рискуют родители, которые постоянно кормят своего ребенка магазинными продуктами питания. Как известно, такие продукты часто неправильно транспортируются и хранятся.
Любой врач из детской инфекционной больницы может рассказать о множестве пациентов до двух лет, накормленных просроченной "Агушей", "Фрутоняней" или "Растишкой" и попавших в стационар с тяжелым отравлением.
Дети, инфицированные стафилококком, переносят заболевание гораздо тяжелее взрослых:
Высокая степень интоксикации приводит к тому, что ребенок практически отказывается от еды;
Частые поносы и рвота приводят к обезвоживанию и выведению из организма солей-электролитов. В результате метаболизм существенно нарушается;
Если у ребенка наблюдаются частые проявления токсикоинфекции, при этом они тяжело проявляются (бледность после рвоты, проблемы со сном и пробуждением), следует немедленно транспортировать ребенка в стационар своими силами или вызвав скорую помощь.
Кислотность желудка ребенка не имеет той степени, которая наблюдается у взрослого человека. Стафилококк в ходе жизнедеятельности продуцирует массу ферментов и токсинов, разрушающих клеточные структуры слизистых оболочек. В результате происходит поражение слизистой желудка, тонкого и толстого кишечника. Развивается так называемый гастроэнтероколит.
Заболевание включает в себя два компонента:
Гастрит. У детей болезнь выражается в отказе от питания и частой рвоте. Не так просто без специальных знаний отличить рвоту от естественного срыгивания. Чтобы сделать верный вывод, нужно иметь в виду, что к рвоте у младенца специалисты относят объем рвотных масс, превышающий три столовых ложки. Срыгивание свыше трех раз в сутки также считается патологическим.
Гастрит у детей сопровождается симптомами интоксикации, а также дыхательными нарушениями (дыхание хриплое или более шумное);
Голос ребенка становится хриплым;
Ослабевает сосательный рефлекс;
Наблюдается сухость губ. Глазные яблоки визуально западают глубже;
Стенка брюшины утрачивает тонус. В результате функциональной пробы (щипок за кожу) складка расправляется медленно. Это свидетельствует об обезвоживании организма.
Справиться с заболеванием в домашних условиях невозможно, следует незамедлительно транспортировать ребенка в стационар и начать специфическую терапию.
Клиническая картина типична для тяжелого колита:
Частые поносы с примесями слизи, гноя, крови;
Светло-желтый кал, при контакте с атмосферным воздухом принимает зеленый оттенок;
Молоко в организме полностью не перерабатывается. В кале обнаруживаются комочки свернувшегося молока;
После нескольких дефекаций кал утрачивает структуру и принимает вид воды желтоватого или зелёного цвета;
Блуждающие боли в животе;
Ребенок становится беспокойным. Картина похожа на кишечные колики (подтягивает ноги к животу, кричит и т.д.);
Вздутие живота и повышенное продуцирование кишечных газов (бурление в животе), частое отхождение газов;
Постепенно развиваются признаки обезвоживания: сухость кожи, утрата эластичности кожных покровов, западение глазных яблок и др.
Определить патологию по количеству дефекаций в течение суток можно достаточно просто. Если ребенок на естественном вскармливании опорожняет кишечник 7-10 раз — это не норма. У детей на искусственном вскармливании нормальное количество дефекаций — 1-2 раза в сутки.
Наличие в структуре кала инородных примесей (кровь, слизь, гной) всегда говорит о патологическом процессе в области толстой или тонкой кишок.
Клебсиелла относится к условно-патогенным микроорганизмам, поскольку присутствует в организме человека постоянно. Эти бактерии — рекордсмены по частоте возбуждаемых ими кишечных инфекций. Чаще всего клебсиелла поражает кишечник, то есть относится к энтеробактериям. Однако проникнув на слизистую носа, она может вызвать озену (зловонный насморк).
Чаще всего клебсиелла попадает в организм ребенка именно в условиях стационара.
Причин инфицирования несколько:
Взрослые нередко пренебрегают правилами личной гигиены и санации предметов обихода. Клебсиелла обычно попадает в организм ребенка именно после контакта с руками взрослого носителя или грязными предметами;
Часто клебсиелла инфицирует грудничков в процессе взаимодействия с общественными игрушками в поликлиниках и больницах;
Контакт с грязной пустышкой. Если пустышка падает на пеленальный стол или на пол, родители часто обтирают (а иногда и обсасывают) предмет и помещают его обратно в рот ребенку. Это прямой путь к инфицированию.
Клебсиелла в целом характеризуется тем же симптоматическим комплексом. Однако в отличие от золотистого стафилококка бактерия менее агрессивна и поражает преимущественно детей с ослабленным иммунитетом, дисбактериозом или имеющейся стафилококковой инфекцией.
Главное клиническое отличие клебсиеллы от стафилококка — цвет кала. Если при стафилококковой инфекции кал светло-желтый, то при поражении клебсиеллой он темно-зеленый. Для клебсиеллы также характерно более активное газообразование.
Чем опасен стафилококк у грудничка?

В отсутствии адекватной антибактериальной терапии стафилококковое поражение влечет множество тяжелых и смертельно опасных осложнений:
Развитие обезвоживания. Длительный и мучительный понос, а также частая рвота приводят к тому, что из тела с огромной скоростью выводится вода вместе с солями-электролитами. Организм не способен привести все системы в состояние динамического равновесия (гомеостаза). В результате может развиться шок и наступить летальный исход. У детей обезвоживание начинается гораздо раньше по причине меньшего количества жидкости в организме;
Инфекционно-токсический шок. Золотистый стафилококк — один из лидеров по скорости размножения. Как было сказано, бактерия продуцирует множество токсических веществ. При чрезмерном размножении токсинов и ферментов становится так много, что организм утрачивает возможность поддерживать все необходимые жизненные функции: отказывают почки, сердце, печень и мозг;
Кишечные кровотечения. Длительный энтероколит приводит к разрушению эпителия кишечника, перфорации его стенок и массивному кровотечению;
Перитонит. С перфорацией стенок пищевые и каловые массы выходят за пределы кишечника, инфицируя брюшную полость;
Сепсис. Разрушая кишечные стенки, стафилококк может проникнуть в кровеносное русло. Это приведет к заражению крови, и риск летального исхода многократно повысится;
Развитие носительства золотистого стафилококка. Даже если лечение проведено своевременно и эффективно, есть риск развития носительства бактерии. Микроорганизм начинает существование в латентной форме. Клинически носительство напоминает вялотекущий дисбактериоз: пониженный аппетит, неустойчивость стула, поносы чередуются с запорами и периодами нормального функционирования кишечника, тяжесть в животе, вздутие, метеоризм (колики), частое срыгивание.
Лечение стафилококка у грудничка
Терапия инфекционного поражения стафилококком сводится к трем основным аспектам:
Установление контроля над интенсивностью размножения микроорганизма, уничтожение возбудителей методом санации и приемом бактериофагов;
Поддерживающее лечение (восстановление водного баланса в организме, назначение лечебного питания);
Лечить грудных детей антибиотиками абсолютно недопустимо. Проведение антибактериальной терапии с применением макролидов или цефалоспоринов целесообразно только у детей с подтвержденным сепсисом.
Во всех остальных случаях антибиотики уничтожают микрофлору кишечника, а стафилококк благополучно продолжает свое существование и энтероколит вспыхивает ещё сильнее, поскольку конкуренции со стороны бифидум- и лактобактерий патогенная флора больше не испытывает.
Пробиотики в этом случае не помогают, поскольку на фоне приема антибиотиков полезная флора не приживается, к тому же стафилококки или клебсиеллы быстро уничтожают поступающее ничтожное число полезных бактерий.
Разумнее всего проводить лечение специализированными бактериофагами — вирусами, пожирающими определенный вид бактерий:
Бактериофаг стафилококка применяется в чистом виде или в виде комплекса (смесь фагов стафилококка, сальмонелл, шигелл и др.);
Длительность приема бактериофага — 1-2 недели;
При отсутствии терапевтического эффекта проводится повторный курс лечения;
Препарат требует особых условий хранения. Температура — не выше 6 °C. Это означает, что хранить его можно только в холодильнике. Для непосредственного использования препарат следует довести до комнатной температуры. Нагревать его нельзя. В этом основная сложность использования.
Для борьбы с бактериями используются следующие медикаменты:
Нитрофураны . Стопдиар, Эрсефурил, Энтерофурил. Их применение допускается, начиная с месяца от рождения. Препараты эффективны как против стафилококков, так и против клебсиеллы. Длительность приема — 7 дней. Детям старше года рекомендуется приём фуразолидона;
Энтеросорбенты . Должны применяться с большой осторожностью, поскольку велик риск развития кишечной инвагинации. Рекомендуется приём Смекты;
Иммуностимуляторы . Для применения у грудничков рекомендуется Кипферон. Курс лечения составляет 5 дней;
Препараты-пробиотики . Используются для восстановления нормальной микрофлоры кишечника. Конкретные наименования должны подбираться исходя из общего состояния здоровья ребенка;
Для восстановления водно-солевого баланса применяется комплексная терапия. Самостоятельно восстановить баланс почти невозможно. Между кормлениями ребенка необходимо поить чистой водой из расчета 100 мл воды на каждый килограмм веса. После улучшения общего состояния переходят к поддерживающему допаиванию. Объем воды — 100 мл на каждый килограмм веса в сутки. Это означает, что ребенок весом 4 кг должен получать за сутки 400 мл воды.
Чтобы остановить рвоту внутримышечно вводится церукал. В комплексе с ним продолжают приём жидкости. Каждые 4-10 минут — по чайной ложке воды. Вводятся растворы гидралазина и регидрона, также 5% глюкозы в пропорции 1:4. Если такой способ восстановления водно-солевого баланса оказался неэффективным и наблюдаются симптомы обезвоживания, единственный способ — госпитализация и проведение внутривенных вливаний.
Профилактика стафилококка у грудничка

Золотистый стафилококк — везде. Защитить ребенка от этой бактерии невозможно. Однако при достаточном функционировании иммунной системы и своевременно лечении стафилококковой инфекции это не страшно. Согласно данным статистики, почти 100% населения земли являются носителями золотистого стафилококка в подавленном состоянии.
Однако следует минимизировать риск инфицирования в первые месяцы жизни ребенка.
Для этого рекомендуется:
Правильно дезинфицировать предметы обихода и кормления: бутылочки, соски должны обрабатываться в стерилизаторах, а при их отсутствии — кипятиться;
Исключить контакты с общественными игрушками. В поликлинике, больнице, игрушки должны быть своими;
Соски, упавшие на любую поверхность, должны отправляться на стерилизацию;
Помещение, в котором находится ребенок, регулярно нужно проветривать;
Следует как можно чаще проводить влажную уборку помещения. Стафилококк отлично себя чувствует на частицах пыли.
Таким образом, стафилококковая инфекция представляет собой одну из наиболее опасных и грозных. Стафилококк является возбудителем множества опасных воспалительных заболеваний. Тяжелее всего инфекцию переносят дети до года, особенно груднички, иммунитет которых ещё не обладает достаточной эффективностью.
Чаще всего золотистый стафилококк поражает слизистые оболочки кишечника и желудка, что становится причиной развития тяжелейшего гастроэнтероколита.
Диагностика заболеваний, вызываемых золотистым стафилококком, не представляет особых сложностей. Куда труднее подобрать оптимальное и безопасное для ребенка лечение. Антибактериальная терапия показана в строго ограниченном числе случаев, эффективнее и безопаснее применение бактериофагов. В целом же, терапия должна быть комплексной.
Клебсиелла менее агрессивна, и вызывает инфекционные поражения только у ослабленных детей. Нередко бактерия мирно сосуществует с золотистым стафилококком. И проявления, и методы лечения клебсиеллезных инфекций схожи с борьбой со стафилококком.
Желательно, чтобы ребенок в первые месяцы жизни не встречался со столь опасными возбудителями, поэтому нужно уделить особое внимание профилактическим мероприятиям.

Читайте также:


