Вич т-хелперы т киллеры
Мне кажется, я понял, что хочет узнать автор, но это лекция на 2 часа, не меньше. Неужели так трудно взять книжку и почитать!?
Коротко. Как вирус обманывает иммунную систему и прогрессирует:
1) Антитела, которые вырабатываются на начальных стадиях, подавляют активность свободно циркулирующих вирусов, но не действуют на вирусы, находящиеся в клетках в виде провирусов.
2) В первое время после инфицирования образующиеся вирионы практически идентичны между собой, однако благодаря ошибкам, допускаемым ферментом обратной траскриптозой, со временем образуется множество псевдовидов, что позволяет вирусу уклоняться от иммунного ответа и антитела к новым псевдовидам не успевают вырабатываться.
3) Аллоэпитопы вирусной оболочки позволяют вирусу уйти от иимунологического надзора.
4) Вирус может долгое время находиться в СД4 клетке в виде провируса в латентном состоянии до тех пор, пока не возникнет нужная для индукции вирусной репликации активация клетки.
5) вич обладает интерфероновой резистентностью, снижает способность интерферона защищать клетки и снижает его уровень.
6) Поскольку СД4 клетки перестают в полном объёме осуществлять свою иммунную функцию, В-клетки перестают синтезировать специфические антитела и начинают синтезировать неспецифические иммуноглобулины.
7) В организме человека есть целый ряд иммунных, соматических и других клеток, несущие на себе рецепторы СД4 для ВИЧ и являющиеся резервуаром.
По началу скорость утраты равна скорости обновления СД4 клеток, но потом скорость обновления уменьшается т.к.:
1) Нарушения функции красного костного мозга и возникает миелодисплазия (уменьшение числа стволовых клеток) по причине:
- Белки вич способны действовать как суперантигены, вызывая выраженное расширение пула СД4 Т-лимфоцитов, с последующим его истощением.
- Непосредственно поражаются клетки предшественники гемопоэза.
- Непосредственное вирусное поражение синусоидальных сосудов и изменение их функциональной способности.
- прямое воздействие вич на стромальные клетки, которое проводит к нарушению их морфофункциональной активности, снижается выработка ими колониестимулирующих факторов, влияющих на пролиферацию и дифференцировку клеток предшественников
- гиперпродукция провоспалительных цитокинов ФНО-а, ИЛ-1в, ИЛ-6, которая происходит при вич-инфекции, оказывают цитостатическое и цитолитическое действие на стромальные клетки, вызывают ингибирование стромальными клетками колониестимулирующих факторов, в связи с чем нарушается пролиферация и дифференцировка кроветворных клеток-предшественников, включая лимфоидные.
2) Истощение тимуса
3) Угнетение функции СД4 клеток и их реакции на антигены, нарушается хематтрактация, продукция цитокинов (особенно Т-клеточный ростовой фактор ИЛ-2), в результате чего утрачивается способность к вич-специфическому ответу и утрачиваются некоторые антигенпрезентирующие функции.
4) Синцитий образующий вирус формирует конгломераты вирусных частиц и СД4 лимфоцитов, которые забивают сосудистые капилляры и там погибают
5) Цитотоксическое действие ФНО на инфицированные СД4 клетки
6) Утрата разнообразия структуры Т-клеточного антигенного рецептора
7) Цитотоксические лимфоциты, естественные киллеры, антитела участвуют в гибели СД Т-лимфоцитов как прямым так и опосредованным путём
8) Переключение с Тх1 на Тх2 иммунный ответ.
Связь количества Т-хелперов и иммунитетом была известна ещё до появления вич, они выполняют важные эффекторные функции в иммунном ответе.
И вообще зачем плодить темы? пишите в "полигон для дискуссий.."
Слишком много аргументов. Такое впечатление, что за недостатком их качества ты хочешь взять на количестве?
Нас тут уверяли, будто Вич не может сразу атаковать все наличные лимфоциты по той причине, что в крови их около 2%, а остальные 98% в тканях. Это НЕ аргумент. Потому как в эти самые ткани лимфоциты попадают естественно ИЗ КРОВИ, и к тому же потом из тканей В ЛИМФУ, потом снова в ткани. И так или иначе речь не идёт только о циркуляции 2% их в крови, а о циркуляции между кровью, тканями и лимфой. То есть, по сути, все лимфоциты постоянно циркулируют из крови в ткани, затем из тканей в лимфу, и опять в ткани, - так не 2% подвергнуты непосредственному риску атаки вируса, а все 100%, как сразу в крови, так и далее в лимфе.
Так что передавай привет Гансу, и посоветуй ему более не врать столь нагло.
ВНИМАНИЕ! САЙТ ЛЕКЦИИ.ОРГ проводит недельный опрос. ПРИМИТЕ УЧАСТИЕ. ВСЕГО 1 МИНУТА.
СПИД – это синдром приобретенного иммунодефицита, который вызывается вирусом иммунодефицита человека (ВИЧ), поэтому заболевание имеет двоякое название: СПИД или ВИЧ-инфекция. Вирус иммунодефицита человека был выделен в 1983 г. французскими, а затем и американскими исследователями. Обнаружение вируса в тех или иных субстратах, связанных с заболевшими (крови, слюне, сперме), дало возможность уточнить пути передачи заболевания. В свою очередь установление этиологии позволило развернуть работы по серологической диагностике инфекции. Таким образом, СПИД был четко отдифференцирован от других приобретенных иммунодефицитов.
СПИД – тяжело протекающая болезнь, при далеко зашедшем заболевании гибель больного практически неизбежна
Проявления иммунодепрессииначинаются задолго до клинической манифестации индикаторных болезней. Механизмы иммунодепрессии.
◊ Прямое цитотоксическое действие ВИЧ на CD4 + T-лимфоциты (T-хелперы).
◊ Гибель вследствие образования синцитиев. На заражённой клетке экспонирован вирусный белок gp120, обладающий высоким сродством к CD4. В результате заражённые клетки сливаются с незаражёнными и образуется синцитий, который уже не функционирует и погибает. Т.е. уничтожается заражённая клетка и вместе с ней множество нормальных CD4 + T-лимфоцов. Образование синцития - один из механизмов гибели клеток при ВИЧ-инфекции. Этот эффект проявляется после того, как одна клетка поражается вирусом и начинает сама производить вирусные белки, в том числе и белок gp120, молекулы которого располагаются на поверхности поражённой клетки.
◊ Растворимый gp120, связываясь с неинфицированными Т-лимфоцитами, превращает их в мишень для ЦТЛ и антителозависимой клеточной цитотоксичности.
◊ Суперантигены ВИЧ индуцируют поликлональную активацию и апоптоз T-лимфоцитов.
◊ Характерный признак ВИЧ-инфекции - массовая гибель CD4 + Т-лимфоцитов в пищеварительном тракте. Сопровождающая заболевание энтеропатия и повышение проницаемости стенок кишечника приводят к проникновению в кровоток патогенных микроорганизмов и ЛПС, что также приводит к активации лимфоцитов.
При естественном течении ВИЧ-инфекции выделяют 3 основных стадии:
· стадия манифестных проявлений (пре-СПИД и СПИД).
Острая инфекция (первичная инфекция или острый ретровирусный синдром) — это результат начальной супрессии Т-клеток. Стадия развивается у большинства ВИЧ-инфицированных людей имеет клиническую картину инфекционного мононуклеоза или признаки, которые имеют сходство с гриппом. Чаще всего симптомы ВИЧ инфекции у мужчин и у женщин появляются через 1—3 недели после инфицирования (этот период может удлиняться до 10 месяцев) и сохраняются в пределах 1-6 недель (в среднем 14-21 день). Проявлениями острого ретровирусного синдрома являются лихорадка, боли в горле, головная боль, миалгии и артралгии, тошнота, рвота, диарея, лимфаденопатия.. В этот период можно обнаружить транзиторное снижение CD4+ лимфоцитов. Уровень CD4+ клеток в последующем повышается, но не нормализуется Уровень виремии в этот период очень высок. Выявление антител к ВИЧ в эту стадию не постоянно и часто совсем отсутствует. Более надежно определять р24 антиген ВИЧ.
Латентная инфекция (асимптомная инфекция) следует за острой фазой болезни, и при отсутствии симптомов заболевания в крови возможно выявление изолятов ВИЧ. Асимптомная инфекция (АИ) может длиться от 2 до 10 лет. В этот период, несмотря на инфицированность, человек остается клинически здоровым, у него отсутствуют признаки иммунодефицита. В этот период виремия ВИЧ минимальна, CD4+ остаются на уровне здорового человека.
Стадии манифестных проявлений ВИЧ-инфекции (пре-СПИД, СПИД) возникают на фоне роста виремии ВИЧ, снижения СД4+ и проявляются манифестацией оппортунистических инфекций и ВИЧ-ассоциированных опухолей.
На ранних симптомных стадиях (пре-СПИД) ВИЧ- инфекция проявляется поражением слизистых и кожи (себорейный дерматит, орофарингеальный кандидоз, онихомикозы, локализованные герпетические поражения, лейкоплакия языка), рецидивирующими простудными, кожными, урогенитальными заболеваниями с незначительно или умеренно выраженными общими симптомами (лихорадка >38,5°С, или диарея продолжительностью более 1месяца, снижение массы тела менее чем на 10%). У пациентов диагностируется клиническая категория В (классификация CDC) или 2, 3 клиническая категория (клиническая классификация ВОЗ,2006).
СПИД — терминальная стадия ВИЧ-инфекции, характеризуется выраженным иммунодефицитом и/или манифестацией тяжелых оппортунистических инфекций и опухолей. У пациента определяются тяжелые атипично протекающие инфекции (токсоплазмоз головного мозга, кандидозный эзофагит, кандидоз трахеи и бронхов, криптококкоз, криптоспоридиоз, туберкулез, атипичный микобактериоз, ВИЧ-деменция, ВИЧ-ассоциированные опухоли: саркома Капоши, лимфомы и др.). Развивается выраженное истощение. У пациентов диагностируется клиническая категория С (классификация CDC) или 4 клиническая категория (клиническая классификация ВОЗ,2006).
Необходимо помнить, что у многих пациентов стадия СПИД длительное время может протекать без типичных клинических проявлений, при отсутствии манифестации ОИ и опухолей. Диагностика стадии СПИД в таких случаях возможна лишь по иммунологическим критериям — определение уровня СБ4+лимфоцитов (классификация CDC). В таких случаях при снижении показателя ниже 200 кл/мкл диагностируется стадия СПИД, независимо от клинических проявлений заболевания. Все пациенты на стадии СПИД должны получать антиретровирусную терапию (APT) и профилактику ОИ и ОЗ.
Существует целый ряд дополняющих друг друга механизмов взаимодействия ВИЧ с клетками Т-хелперов. Последние стимулируют работу Т-киллеров и макрофагов, индуцируют продукцию антител В-лимфоцитами. Лимфоциты-носители молекул Т8 (CD8) могут быть либо киллерами, либо супрессорами. Некоторые из механизмов еще спорны, подвергаются изменениям; постоянно появляются новые детали и нюансы влияния ВИЧ на иммунную систему
При продуктивном процессе состоявшейся репродукции и массированном (несколько тысяч вирионов в генерации одной клетки) выходе из лимфоцитов ВИЧ интенсивно лизирует Т-хелперы. Но даже если вирусы спонтанно отпочковываются от Т-клетки-хелпера (без ее лизиса), клетка не успевает восстанавливать целостность мембран, молекулы цитоплазмы свободно элиминируют из клетки, и Т-хелпер гибнет. Поскольку Т-хелперы составляют порядка 60% циркулирующих Т-клеток, быстрая их гибель приводит к глубоким нарушениям иммунной системы инфицированного человека. СПИД развивается на фоне острой недостаточности CD4-лимфоцитов.
| Наименование услуги | Стоимость |
|---|---|
| Прием первичный врача-дерматовенеролога , лечебно-диагностический, амбулаторный | 1 800 руб. |
| Прием первичный врача-дерматовенеролога К.М.Н., лечебно-диагностический, амбулаторный | 2 100 руб. |
| Обобщение результатов обследования и составление индивидуальной программы лечения 2 степень сложности | 1 000 руб. |
| Дезинфекция кожи и обработка специфическими средствами /1 сеанс | 270 руб. |
| Удаление кондилом на слизистой / за одну зону 0,1см*0,1 см.или (1мм.х1мм.), за 1 поле. | 1 000 руб. |
| Дерматоскопия | 800 руб. |
| Смотреть весь прайс-лист | |
Частицы ВИЧ изменяют реактогенные зоны поверхности Т-хелперов, что приводит к образованию нежизнеспособных синцитиев. Компоненты вирусной оболочки, синтезируемые в процессе репродукции вируса, резко нарушают цитоплазматическую мембрану клетки-хозяина: в результате элиминации протоплазмы клетки сливаются, образуются нежизнеспособные многоядерные структуры
Исследования подтвердили, что вирус резко изменяет мембраны Т-лимфоцитов и приводит к их слиянию в нежизнеспособные многоядерные клетки-монстры. Образование синцитиев возможно по типу гемагглютинирующего эффекта, когда здоровые лимфоциты при соприкосновении с инфицированными в свою оболочку включают поверхностные белки вируса, и взаимодействие рецепторных зон приводит к образованию крупных нежизнеспособных конгломератов.
ВИЧ не разрушает CD4-лимфоциты, а изменяет и значительно замедляет их рост в периодической культуре, тогда как другие виды Т-клеток продолжают размножаться нормально. Отмечено, что скорость гибели зараженных клеток пропорциональна количеству CD4-рецепторов на их поверхности. Со временем число CD4-клеток становиться меньше, хотя некоторая их часть выживает и сохраняет вирус в латентном состоянии в виде провируса.
ВИЧ маскирует CD4-маркер. Было показано, что в выживших CD4-лимфоцитах вирус может маскировать CD4-маркер на поверхности клеток или предотвращать его появление там. В результате получается, что число CD4-клеток еще меньше, чем на самом деле. С исчезновением CD4-клеток падает уровень ИЛ-2 и в результате замедляется рост клонов зрелых Т-клеток, индуцируемых этим лимфокином. Из-за ослабления синтеза интерлейкина и интерферона падает активность К-клеток и макрофагов, которые в номе стимулируютя этими белками.
В инфицированных CD4-клетках ВИЧ вызывает секрецию растворимого фактора супрессии. Это вещество блокирует иммунные реакции, зависящие от Т-клеток как in vitro, так и in vivo. При этом угнетается образование специфических антител и пролиферация Т-клеток.
Считают, что геном вируса не кодирует последовательность растворимых факторов супрессии, а только индуцирует в CD4-клеткет его синтез. Такой же механизм, возможно, лежит в основе иммуносупрессии при других инфекциях. Интересно было бы сравнить этот супрессивный фактор с иммуносупрессивным фактором продуктов перекисного окисления липидов.
Вирус иммунодефицита человека вызывает изменения поверхности CD4-лимфоцитов, что провоцирует их уничтожение как чуждых иммунной системе. CD4-клетки, будучи инфицированными, погибают от того, что на них нападают Т-лимфоциты-киллеры. Таким путем идет непрерывное снижение количества Т-хелперов в крови, лимфоузлах, селезенке и других тканях. В то же время количество супрессорных CD8-лимфоцитов не уменьшается и даже несколько возрастает, что приводит к снижению показателя Тх/Тс.
Проникший в лимфоциты ВИЧ изменяет геном Т-хелперов, в результате чего они лишаются способности к трансформации и нормальному ответу на ИЛ-2.
Приезжая из отпуска, каждый мужчина привозит с собой яркие впечатления, множество фотографий и интересные истории. Еще долгое время воспоминания заставляют его улыбаться и вызывают желание повторить удавшийся отдых.
Я был в разных клиниках на приеме у дерматовенеролога. Но в Евромедпрестиже качество и результат лечения инфекций намного выше, чем у других. Спасибо. Вы мне очень помогли.
Уважаемое руководство клиники! Выражаю глубокую благодарность и признательность за чуткое и доброе отношение, высокий уровень обслуживания населения и лично меня и мою семью. Любые вопросы-без проблем, проволочек и очередей. Будьте все здоровы и большое спасибо за заботу о людях.
11 октября 2016
- 2468
- 2,1
- 2
- 11
Комплекс-белок Cas9/sgRNA/viral RNA (слева) и модель вируса иммунодефицита человека (справа), построенная коллективом Visual science.

Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
Спонсор публикации этой статьи — Виктор Татарский.
Врага нужно знать в лицо
Об иммунитете, апоптозе и вообще.
Иммунная система развивалась сотни миллионов лет. По типу реакции ее обычно делят на врожденный (неспецифичный) и приобретенный (специфичный) иммунитет [1], [2]. Считается, что специфичный (то есть вырабатываемый к конкретному патогену) иммунитет впервые появился у челюстноротых (рыб и всех вышестоящих по эволюционному древу таксонов) после отделения от бесчелюстных (миног и миксин), хотя у вторых имеется аналогичная система защиты [3]. К клеткам специфичного иммунитета относят В-лимфоциты, Т-лимфоциты и NK-клетки (естественные киллеры, natural killer cells). Помимо этого существуют моноциты, которые хоть и не являются истинными инструментами приобретенного иммунитета, однако выполняют некоторые функции по нейтрализации патогена: фагоцитоз, презентация антигена, выделение бактерицидных веществ и цитокинов.
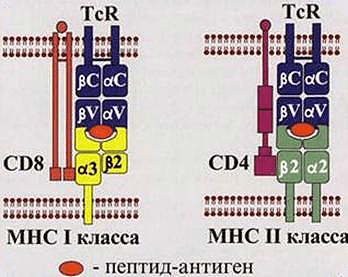
Рисунок 1. Взаимодействия Т-киллеров (слева) и Т-хелперов (справа) с зараженными клетками. Для передачи сигнала о заражении необходимо выполнение двух условий: контакт комплекса МНС-патоген с TcR (T-cell Receptor, рецептор Т-клеток) и CD. Двигаясь по организму, Т-лимфоциты проверяют каждую клетку на предмет наличия у нее антигена в комплексе с МНС. Их можно сравнить с подслеповатой глуховатой бабушкой, пришедшей забирать дитятко из детского сада. Для опознания ей надо подойти вплотную и по нескольким (в данном случае по двум) признакам определить, ее ли это чадо или нет.
Т-лимфоциты, в свою очередь, необходимы для уничтожения клеток, зараженных внутриклеточными паразитами, и опухолевых клеток. Они делятся на два основных типа в зависимости от класса рецепторов, находящихся на внешней стороне их мембраны.
Т-киллеры несут CD8 рецепторы и отвечают за:
Т-хелперы имеют CD4 рецепторы и ответственны за секрецию цитокинов, которые:
- активируют макрофаги для борьбы с внутриклеточными паразитами;
- способствуют продукции антител В-лимфоцитами.
Но не менее важна роль Т-хелперов в подготовке зрелых Т-киллеров из клеток-предшественниц, активации NK-клеток и моноцитов.
Как же происходит опознавание антигена на молекулярном уровне? Здесь надо упомянуть еще об одном очень важном классе рецепторов — МНС (Major Histocompability Complex или главном комплексе гистосовместимости). Они бывают двух классов: I и II. МНС I присутствует на поверхности всех ядерных клеток организма человека. Он необходим для опознавания клетки натуральным киллером и Т-киллером (рис. 1, 2). Если по какой-то причине МНС I изменен, несет на себе антиген или отсутствует, клетка будет подвергнута апоптозу. МНС II находится на поверхности В-лимфоцитов, макрофагов и дендритных клеток. Он необходим для презентации антигена Т-хелперам (рис. 1, 2). Жизнь пула Т-хелперов можно представить как прогулку с ребенком в зоопарке, только вместо животных — антигены, вместо ребенка — Т-хелпер, а вместо взрослых, объясняющих, кто есть кто, — три перечисленных типа клеток.
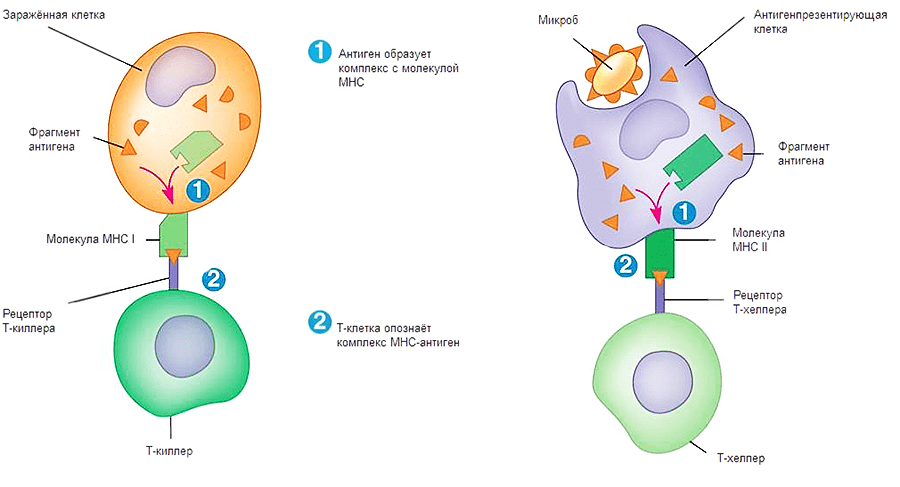
Рисунок 2. Процесс передачи сигнала Т-киллеру и Т-хелперу. Первый этап — сборка комплекса МНС-антиген, второй этап — презентация комплекса на поверхности клетки.
Первый этап проникновения вируса в клетку — взаимодействие вирусного белка gp120 (рис. 3) с рецептором CD4. Отсюда понятно, почему ВИЧ размножается именно в Т-хелперах. Взаимодействию способствуют корецепторы CCR5 и CXCR4 [8]. В норме они являются рецепторами цитокинов, а при взаимодействии ВИЧ с клеткой их связь является необходимым условием проникновения вируса внутрь. Мутации в генах этих рецепторов обеспечивают частичную устойчивость носителей таких мутаций (таких людей около 2%, причем некоторые штаммы вируса все равно могут их поражать) [9]. Затем в мембрану клетки погружается белок gp41, после чего мембрана вируса сливается с клеточной, и происходит распаковка генетического материала. По принципу обратной транскрипции с РНК-матрицы вируса с помощью фермента ревертазы (обратной транскриптазы) синтезируются молекулы кДНК (комплементарной ДНК). Синтезированная кДНК вставляется вирусной интегразой в геном клетки хозяина. После попадания в геном хозяина вирус может никак себя не проявлять до нескольких лет — протекает так называемый инкубационный период. Только когда клетки активно пролиферируют, а значит, синтезируют белки на матрице ДНК, начинается сборка вирусных частиц , выход их из клеток и гибель последних (так как каждая частица забирает с собой часть клеточной мембраны клетки, вирусы попросту разрывают клетку).
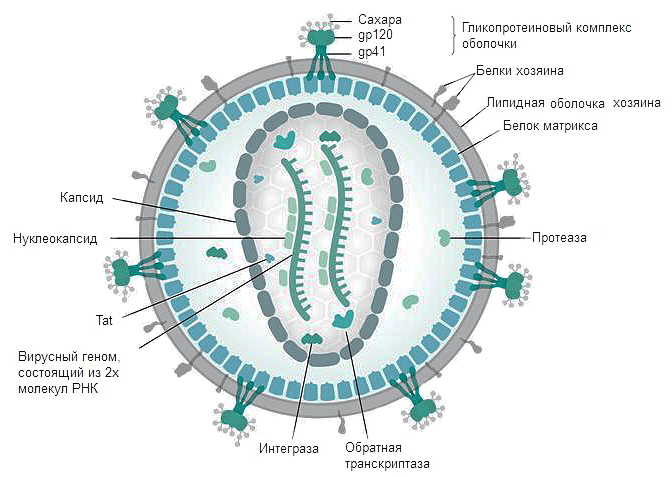
Рисунок 3. Строение ВИЧ. Белки gp120 и gp41 участвуют в рецепции вируса клеткой и проникновении вирусной частицы внутрь. Липидная оболочка захватывается от клетки хозяина вместе с частью мембранных белков. Белки матрикса синтезируются в клетке после встраивания кДНК в геном в момент наработки клеточных белков для деления. Протеаза, возможно, необходима для разрезания противоапоптотического фактора Bcl-2 [9]. Ферменты обратная транскриптаза и интеграза создают кДНК на матрице РНК и встраивают кДНК в геном Т-хелпера соответственно. Tat — белок, вовлеченный в индукцию апоптоза. Нуклеокапсид — комплекс из РНК и белков вируса, представляющий собой компактную упакованную форму генома. Капсид — белковая оболочка, защищающая содержимое от воздействия внешних условий.
Как иммунитет бактерий правит геномы
Система редактирования геномов CRISPR/Cas известна уже довольно давно (впервые локус описал в 1987 году Есизуми Исино из университета Осаки), но только недавно (в 2005 году) ученые поняли ее истинное предназначение [11], [12].
Как вы уже поняли, система состоит из двух компонентов: CRISPR-локуса (Clustered Regularly Interspaced Short Palindromic Repeats или сгруппированные и регулярно разделенные короткие палиндромные повторы) и белков Cas, которые, являются нуклеотид-специфичными эндонуклеазами (а название получили за работу в команде с CRISPR — Crispr associated).
Помимо CRISPR-локуса и блока генов Cas в ДНК бактерии (не обязательно в нуклеоиде [12]) находится ген tracrРНК (transactivated crispr RNA), частично комплементарной палиндромам.
Для формирования специфичной устойчивости к вирусу бактерия, как и человек, должна встретиться с ним дважды.
Первый раз после внедрения вирусной ДНК в клетку происходит разрезание ДНК белками Cas1 и Cas2 на протоспейсеры и встраивание их в начало CRISPR-локуса. Cas1 и Cas2 формируют при этом комплекс, причем Cas2 играет только структурную роль, удерживая ДНК, тогда как Cas1 встраивает ее. Каждый протоспейсер вставляется в CRISPR-локус так, чтобы от другого (уже имеющегося) спейсера его отделял палиндром.
Соответственно, после транскрипции ДНК всего комплекса образуются три продукта (рис. 4):
- tracrРНК;
- РНК белка Cas (наиболее изученным является Cas9, поэтому далее повествование пойдет о нем), далее транслирующаяся;
- pre-crРНК (poly-spacer precursor crRNA или многоспейсерный предшественник crРНК), которая представляет собой транскрипт спейсеров, разделенных образовавшимися из палиндромов шпильками или петлями.
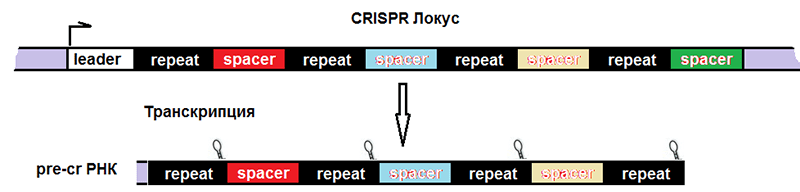
Рисунок 4. Строение CRISPR-локуса и результат транскрипции. leader — лидерная последовательность, отвечающая за начало транскрипции, со стороны которой вставляется новый спейсер. repeat — палиндромный повтор, который после транскрипции превращается в шпильку или петлю.
Второй этап — образование комплекса pre-crРНК/Cas9/РНКаза III. Очевидно, что вся длинная pre-crРНК не может участвовать в опознавании инвазивной ДНК, так как, во-первых, очень длинна, что конформационно неудобно, а во-вторых, при сравнении спейсеров РНК с протоспейсерами инвазивной ДНК длинный транскрипт начнет путаться и в итоге образует клубок, непригодный для дальнейшей работы. Самое логичное — разделить длинную последовательность на короткие участки, которые могли бы проверятся на соответствие инвазивной ДНК белком Cas9. И тащить за собой не надо, и не запутается.
С помощью фермента РНКазы III и при участии tracrРНК pre-crРНК разделяется по границам повторов так, что в белково-нуклеиновый комплекс входят один спейсер и один повтор, комплементарно связанный с tracrРНК (рис. 5) [13]. Повтор полностью теряет свою вторичную структуру, tracrРНК же оставляет несколько шпилек (обычно три).
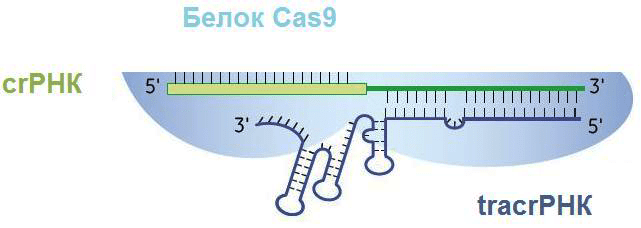
Рисунок 5. Белково-нуклеиновый комплекс после созревания транскрипта. crРНК состоит из спейсера (слева) и повтора, соединенного с частью tracrРНК (справа). Три петли на tracrРНК нужны для удержания ее эндонуклеазой Cas9.
- комплементарность спейсера комплекса Cas9/crРНК/tracrРНК протоспейсеру инвазивной (например, вирусной) ДНК;
- наличие в геноме вируса около протоспейсера последовательности из трех нуклеотидов — РАМ (Protospacer Adjacent Motif, прилежащий к протоспейсеру мотив).
Таким образом клетка страхуется от уничтожения своей ДНК. Но даже просто разрезанная в одном месте вирусная ДНК может представлять опасность, поэтому завершает инактивацию негомологическое сращивание концов (non-homologous end joining, NHEJ). При этом происходит инсерция/делеция одного или нескольких нуклеотидов, что приводит к потере инфекционности.
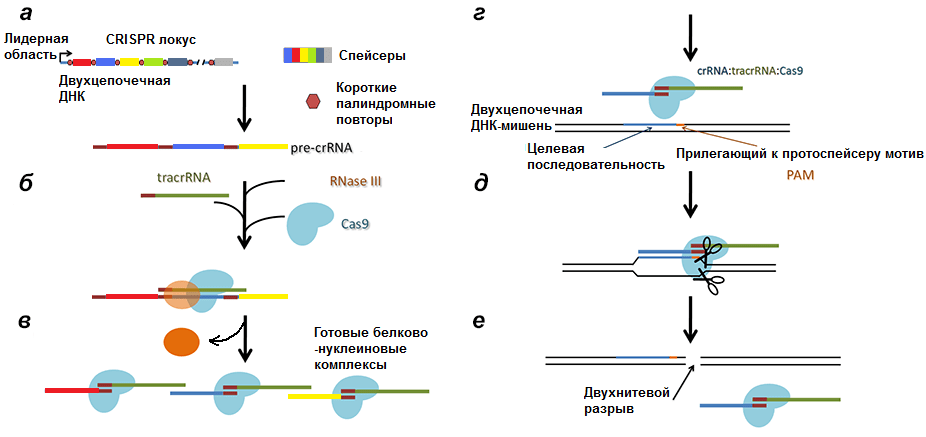
Рисунок 6. Полная схема механизма работы CRISPR/Cas9 системы. а — Транскрипция CRISPR локуса с образованием pre-crРНК. б, в — Разрезание РНК РНКазой III и образование комплексов Cas9/tracrРНК/crРНК. г — Вторичное проникновение в клетку чужеродной ДНК. д — Соединение комплекса с инвазивной ДНК. е — Образование двухнитевого разрыва в протоспейсере.
А где же тут редактирование геномов? А вот где:
- во-первых, таким образом можно просто нокаутировать целевой ген и добиться прекращения экспрессии того или иного белка;
- во-вторых, после создания двухцепочечного разрыва в образовавшуюся брешь можно вставить нужный нам ген и заставить организм синтезировать нужный нам белок.
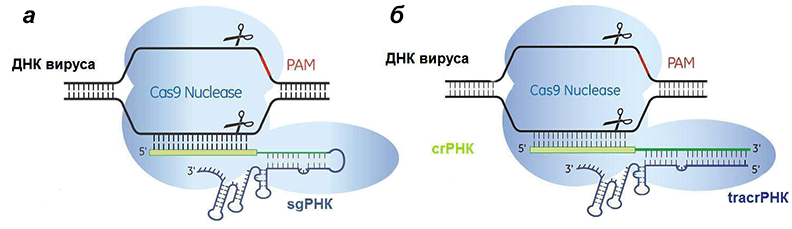
Рисунок 7. Сравнение искусственной (а) и естественной (б) систем CRISPR/Cas9. Отличие состоит лишь в том, что искусственная РНК едина, а природная — состоит из двух частей, гены которых разделены.
Битва века
Однако вернемся к теме этой статьи.
Так как система редактирования геномов может помочь в избавлении от ВИЧ? Очень просто: вирус можно вырезать! Нацелив Cas9, путем создания sgРНК с последовательностью, комплементарной вирусной кДНК.
Некоторое время назад группа ученых из немецкого Института экспериментальной вирусологии и иммунологии уже пыталась использовать инструмент редактирования геномов для удаления ВИЧ из культуры HeLa [15]. Они модифицировали Cre-рекомбиназу методом направленной эволюции и один из полученных вариантов использовали для удаления вируса путем контролируемой рекомбинации [16]. Однако надо учитывать, что между Т-хелперами и опухолевой HeLa есть немало различий, к тому же, авторы не предлагают вариантов доставки или экспрессии гена Tre-рекомбиназы (усовершенствованный вариант фермента Cre).
С другой стороны, группа американских исследователей опубликовала в марте этого года статью [17], где подробно описывались метод доставки и механизм удаления вируса. Ученые ставили перед собой задачу не только полностью избавить клеточную культуру Т-хелперов от вируса, но и проверить отсутствие цитотоксического действия самой CRISPR/Cas9 системы. Единственный недостаток этого геномного инструмента в том, что из-за сравнительно небольшой длины спейсера, даже при наличии страхующего элемента PAM, в больших геномах могут быть найдены нецелевые сайты, подверженные разрезанию (off-target sites). Именно поэтому исследователи уделяли данной проблеме немало внимания.
Работа проводилась с использованием штамма ВИЧ-1 и клеточной линии Т-хелперов 2D10, зараженной вирусом в покоящейся стадии. Доставка и экспрессия sgРНК/Cas9 осуществлялась с помощью лентивирусного вектора.
Для оценки того, вырезался ли вирус из двух мест встраивания (1-я и 16-я хромосомы), было проведено полногеномное секвенирование. Оно показало, что в клетках, где экспрессировались и гены Cas9, и sgРНК, провирусная ДНК отсутствует.
Был проведен анализ того, могут ли гены, куда встроился провирус (RSBN1 и MSRB1), и близлежащие гены нормально транскрибироваться после его вырезания. Ученые показали, что как RSBN1, так и MSRB1 нормально экспрессируются. Соседние гены также не претерпели изменений.
С помощью биоинформатических методов и анализа баз данных было показано, что sgРНК/Cas9 не проявляет активности по отношению к нецелевым сайтам.
Таким образом, можно с уверенностью сказать, что группа Камински впервые успешно удалила ВИЧ из культуры зараженных Т-хелперов. Данное достижение приблизило человечество к победе на ВИЧ. Да, это только культура клеток. Да, до внедрения данной техники в медицину пройдут годы, а может и десятки лет, но данная работа является уникальной в своем роде, ибо ученые не только бросили вызов одному из страшнейших заболеваний на планете, но и смогли победить его — пусть даже масштаб сражения пока невелик.
Перспективы применения данной технологии очевидны: введя пациенту вектор, содержащий гены Cas9 и sgРНК, мы добьемся их экспрессии и полного удаления вируса из клеток. Современная терапия, направленная против ретровирусов, являющаяся основным средством борьбы с ВИЧ, не удаляет вирус из клеток, так как провирус остается встроенным в ДНК хозяина. В свою очередь, данный подход не оставляет вирусу шансов укрыться.
Читайте также:


