Вич с резусом положительным
В случае с ВИЧем возможность передачи данной болезни при переливании крови однозначно позволила классифицировать такое состояние как заражение инфекционной природы.
Однако антигены резус-фактора и групп крови А, В, и АВ также имеют аналогичную природу переноса в организм человека – путём переливания крови другого резуса или другой группы. Причём антигены систем Rh, АВ0 относятся к тем же веществам, что и вирус СПИДа.
Однако в этих случаях заражения организма ВИЧем, болезнь развивается в общепринятых временных рамках, в то время как, если рассматривать систему АВ0, как заболевание вирусной природы, сроки развития заболевания практически совпадают со временем жизни здорового человека, а проявления предполагаемой болезни списываются на нарушения работы других систем организма, не связанных с нахождением антигенов А и В на эритроцитах крови.
Главную роль в постановке диагноза на наличие вируса ВИЧ играет лабораторное исследование крови. В анализе крови выявляется наличие антител к вирусу ВИЧ. Положительный результат анализа на антитела к ВИЧ свидетельствует о заражении ВИЧ-инфекцией (но не о заболевании СПИДом) [2210].
Аналогичный метод применяется и при определении групп крови. На предметном стекле производится смешивание стандартных сывороток с кровью, подлежащей исследованию. Испытуемая кровь относится к той группе, с сывороткой которой не произошла агглютинация. Если агглютинация произошла во всех четырёх каплях, то испытуемая кровь четвёртой группы (АВ).
ВИЧ инфицирует главным образом Т-хелперные клетки, что в итоге может привести к выходу из строя иммунной системы.
Вирус иммунодефицита человека (ВИЧ) в структурном отношении подобен вирусу гриппа (А). Геном ВИЧ состоит из двух молекул однонитевой РНК [онРНК (ssRNA)], каждая молекула содержит 9200 н.о.). Вирус имеет двухслойный капсид и окружен белоксодержащей мембраной. При инфекции мембрана вируса сливается с плазматической мембраной клетки-мишени, и ядро нуклеокапсида попадает в цитоплазму. Там вирусная РНК (RNA) вначале образует гибрид РНК/ДНК, а затем транскрибируется с образованием днДНК. Обе реакции катализируются обратной транскриптазой вируса. После этого днДНК интегрируется в геном клетки, где может оставаться в неактивном состоянии. При её активации вначале с помощью ферментов клетки-хозяина транскрибируется фрагмент ДНК, соответствующий вирусному геному. При этом идет репликация как вирусной онРНК, так и мРНК (mRNA), кодирующей предшественники вирусных белков. Затем белки встраиваются в плазматическую мембрану клетки и там подвергаются протеолитической модификации. Цикл заканчивается почкованием вновь образованных вирусных частиц.
Группа PHК-содержащих вирусов, к которым принадлежит и ВИЧ, носит название ретровирусы, поскольку их жизненный цикл начинается с синтеза ДНК на РНК-матрице, т.е. с процесса, обратного обычной транскрипции, когда матрицей служит ДНК.
СПИД относится к той же природе вирусных заболеваний, что бешенство, полиомиелит, корь, краснуха, оспа, гепатит, грипп и другие инфекции верхних дыхательных путей (о действии которых см. выше).
При этом вирусы – это паразитические нуклеопротеидные комплексы, в которых не идут процессы обмена веществ и которые размножаются только в клетке-хозяине. Поэтому вирусы не относят к живым организмам. Наиболее простые вирусы имеют в своем составе только одну молекулу нуклеиновой кислоты (ДНК или РНК, никогда вместе) и оболочку из молекул белка. Вирусы, которые при своем размножении повреждают клетку-хозяина, являются возбудителями заболеваний и считаются патогенными.
Эритроциты являются клетками крови. Присоединение к мембране эритроцита антигена А, антигена В или обоих антигенов сразу (А и В) имеет тот же механизм, что и при заражении вирусом ВИЧа.
Отличия заключены в следующем:
- Вирус ВИЧ поражает Т-хелперные клетки, антиген А (В) – эритроциты;
- Механизм редубликации вируса ВИЧ использует внутренние механизмы заражённых клеток, антиген А (В) – внутренний механизм одного из локусов 9-ой хромосомы;
- Вирус ВИЧ препятствует развитию иммунитета всего организма, антиген А (В) – только иммунитета, направленного против себя (образованию антител а (b) соответственно).
Различными по происхождению являются и антитела. За клеточный иммунитет ответственны Т-лимфоциты. Их активность направлена против зараженной вирусом клетки организма, а также на защиту от грибов и паразитов. Т-лимфоциты принимают активное участие в процессе отторжения чужеродной ткани и помогают в формировании гуморального иммунного ответа. В свою очередь, гуморальный иммунный ответ направлен на активацию В-лимфоцитов, которые созревают в костном мозге в отличие от Т-лимфоцитов тимуса. В-лимфоциты несут на своей поверхности антитела и выделяют их в плазму. Антитела обладают способностью специфически связывать соответствующие антигены. Связывание антител с антигенами – решающее звено в системе защиты организма от внеклеточных вирусов и бактерий. В результате такого связывания последние опознаются как инородные тела и в дальнейшем уничтожаются.
При лечении связанных с вирусными поражения заболеваний, в том числе и СПИДом, как исходные вещества в искусственном синтезе фрагментов ДНК (РНК) и синтезе нуклеотидов, используютсянуклеозиды – природные гликозиды [2211].
Как мы показали выше, воздействие на организм человека антигенов А и В (а также и антигена Rh) хотя и растянуто во времени на всю жизнь человека, несёт реальные патологии этому организму в виде наследственных заболеваний и заболеваний, связанных с преимущественным распространением среди лиц той или иной группы крови (А, В или АВ).
По технике поражения организма воздействие антигенов А и В следует поставить в один ряд с врождёнными иммунодефицитами. При этом гомеологическо-хромосомный иммунодефицит (так названо в 2008 г. А.А. Тюняевым заболевание вирусами групп крови и резус-фактора) обусловлен двойственным дефектом – дефектом 9-ой хромосомы и дефектом эритроцита.
Кандидат биологических наук А. ЛУШНИКОВА. По материалам "Scientific American".
Иголка в стоге сена
Генетикам давно известны гены устойчивости к некоторым вирусам у мышей, например к вирусу лейкоза. Но существуют ли подобные гены у человека, и если да, то какова их роль в защите против СПИДа?
Стивен О'Брайн и Михаэль Дин со своими коллегами из Национального института рака США много лет вели поиск таких генов у человека.
В начале 80-х годов американские ученые исследовали множество людей, которые по тем или иным причинам могли заразиться вирусом иммунодефицита. Они проанализировали тысячи образцов крови и обнаружили, казалось бы, необъяснимое явление: у 10-25% обследованных вирус вообще не выявляется, а около 1% носителей ВИЧ - относительно здоровы, признаки СПИДа у них либо отсутствуют, либо выражены очень слабо, а иммунная система в полном порядке. Неужели существует какая-то устойчивость к вирусу у некоторых людей? И если да, то с чем она связана?
Опыты на лабораторных мышах, крысах, морских свинках и кроликах показали, что устойчивость к различным вирусным инфекциям часто определяется целым набором генов. Оказалось, что сходный механизм определяет и устойчивость к вирусу иммунодефицита человека.
Известно, что многие гены ответственны за выработку определенных белков. Часто бывает, что один и тот же ген существует в нескольких измененных вариантах. Такие "многоликие" гены называются полиморфными, а их варианты могут отвечать за выработку различных белков, которые по-разному ведут себя в клетке.
Сравнив восприимчивость к вирусам у мышей, несущих множество разнообразных наборов генов, и у мышей с небольшим числом генных вариантов, ученые пришли к выводу, что чем разнороднее генетически были животные, тем реже они заражались вирусом. В таком случае можно предположить, что в генетически разнообразных человеческих популяциях генные варианты, определяющие устойчивость к ВИЧ, должны встречаться достаточно часто. Анализ заболеваемости СПИДом среди американцев различных национальностей выявил еще одну особенность: более устойчивы американцы европейского происхождения, у африканцев и азиатов устойчивость близка к нулю. Чем объяснить такие различия?
Ответ на этот вопрос предложил в середине 80-х годов американский вирусолог Джей Леви из Калифорнийского университета в Сан-Франциско. Леви и его коллеги пытались выяснить, какие именно клетки в организме поражает вирус. Они обнаружили, что после того, как вирус заражает иммунные клетки, они легко узнаются иммунными клетками другого типа, так называемыми Т-киллерами (убийцами). Киллеры разрушают зараженные вирусом клетки, препятствуя дальнейшему размножению вируса. Клетки-убийцы несут на своей поверхности особую молекулу - рецептор CD8. Она, как принимающая антенна, "узнает" сигналы от клеток, зараженных вирусом, и клетки-убийцы уничтожают их. Если из крови удалить все клетки, несущие молекулу CD8, то вскоре в организме обнаруживаются многочисленные вирусные частицы, происходит быстрое размножение вируса и разрушение лимфоцитов. Не в этом ли ключ к разгадке?
В 1995 году группа американских ученых под руководством Р. Галло обнаружила вещества, которые вырабатываются в клетках-киллерах, несущих молекулы CD8, и подавляют размножение ВИЧ. Защитные вещества оказались гормоноподобными молекулами, называемыми хемокинами. Это небольшие белки, которые прикрепляются к молекулам-рецепторам на поверхности иммунных клеток, когда клетки направляются к месту воспаления или заражения. Оставалось найти "ворота", сквозь которые проникают в иммунные клетки вирусные частицы, то есть понять, с какими именно рецепторами взаимодействуют хемокины.
Ахиллесова пята иммунных клеток
Вскоре после открытия хемокинов Эдвард Бергер, биохимик из Национального института аллергических и инфекционных болезней в Бетезде, США, обнаружил в иммунных клетках, в первую очередь поражаемых вирусом (их называют клетки-мишени), сложный по строению белок. Этот белок как бы пронизывает мембраны клеток и содействует "посадке" и слиянию вирусных частиц с оболочкой иммунных клеток. Бергер назвал этот белок "фузин", от английского слова fusion - слияние. Оказалось, что фузин родствен белкам-рецепторам хемокинов. Не служит ли этот белок "входными воротами" иммунных клеток, через которые вирус проникает внутрь? В таком случае взаимодействие с фузином какого-нибудь другого вещества закроет доступ вирусным частицам в клетку: представьте, что в скважину замка вставляется ключ, и вирусная "лазейка" исчезает. Казалось бы, все встало на свои места, и взаимосвязь хемокины - фузин - ВИЧ уже не вызывала сомнений. Но верна ли эта схема для всех типов клеток, зараженных вирусом?
Пока молекулярные биологи распутывали сложный клубок событий, происходящих на поверхности клеток, генетики продолжали поиск генов устойчивости к вирусу иммунодефицита у людей. Американские исследователи из Национального института рака получили культуры клеток крови и различных тканей от сотен пациентов, зараженных ВИЧ. Из этих клеток выделили ДНК для поиска генов устойчивости.
Чтобы понять, насколько сложна эта задача, достаточно вспомнить, что в хромосомах человека содержится около 100 тысяч различных генов. Проверка хотя бы сотой доли этих генов потребовала бы нескольких лет напряженной работы. Круг генов-кандидатов заметно сузился, когда ученые сосредоточили свое внимание на клетках, которые прежде всего поражает вирус, - так называемых клетках-мишенях.
Уравнение со многими неизвестными
Одна из особенностей вируса иммунодефицита заключается в том, что его гены внедряются в наследственное вещество зараженной клетки и "затаиваются" там на время. Пока эта клетка растет и размножается, вирусные гены воспроизводятся вместе с собственными генами клетки. Затем они попадают в дочерние клетки и заражают их.
Из множества людей с высоким риском заражения ВИЧ отобрали зараженных вирусом и тех, кто не стал носителем ВИЧ, несмотря на постоянные контакты с больными. Среди зараженных выделили группы относительно здоровых и людей с быстро развивающимися признаками СПИДа, которые страдали сопутствующими заболеваниями: пневмонией, раком кожи и другими. Ученые изучили разные варианты взаимодействия вируса с организмом человека. Различный исход этого взаимодействия, по-видимому, зависел от набора генов у обследованных людей.
Выяснилось, что люди, устойчивые к СПИДу, имеют мутантные, измененные гены рецептора хемокинов - молекулы, к которой прикрепляется вирус, чтобы проникнуть в иммунную клетку. У них контакт иммунной клетки с вирусом невозможен, поскольку нет "принимающего устройства".
В это же время бельгийские ученые Михаэль Симпсон и Марк Парментье выделили ген другого рецептора. Им оказался белок, который также служит рецептором для связывания ВИЧ на поверхности иммунных клеток. Только взаимодействие этих двух молекул-рецепторов на поверхности иммунной клетки создает "посадочную площадку" для вируса.
Итак, основными "виновниками" заражения клеток вирусом иммунодефицита служат молекулы-рецепторы, названные CCR5 и CD4. Возник вопрос: что происходит с этими рецепторами при устойчивости к ВИЧ?
В июле 1996 года американская исследовательница Мэри Керингтон из Института рака сообщила, что нормальный ген рецептора ССR5 обнаруживается лишь у 1/5 обследованных ею пациентов. Дальнейший поиск вариантов этого гена среди двух тысяч больных дал удивительные результаты. Оказалось, что у 3% людей, не заразившихся вирусом, несмотря на контакты с больными, ген рецептора ССR5 измененный, мутантный. Например, при обследовании двух нью-йоркских гомосексуалистов - здоровых, несмотря на контакты с зараженными, выяснилось, что в их клетках образуется мутантный белок CCR5, не способный взаимодействовать с вирусными частицами. Подобные генетические варианты были найдены лишь у американцев европейского происхождения или у выходцев из западной Азии, у американцев же африканского и восточноазиатского происхождения не нашли "защитных" генов.
Оказалось также, что устойчивость некоторых пациентов к инфекции лишь временная, если они получили "спасительную" мутацию только от одного из своих родителей. Через несколько лет после заражения количество иммунных клеток в крови таких пациентов снижалось в 5 раз, и на этом фоне развивались сопутствующие СПИДу осложнения. Таким образом, неуязвимыми для ВИЧ были только носители сразу двух мутантных генов.
Но у обладателей одного мутантного гена признаки СПИДа все же развивались медленнее, чем у носителей двух нормальных генов, и такие больные лучше поддавались лечению.
Не так давно исследователи обнаружили разновидности чрезвычайно агрессивных вирусов. Людей, зараженных такими вирусами, не спасает даже присутствие двух мутантных генов, обеспечивающих устойчивость к ВИЧ.
Это заставляет продолжать поиск генов устойчивости к ВИЧ. Недавно американские исследователи О'Брайн и М. Дин с коллегами обнаружили ген, который, присутствуя у людей лишь в одной копии, задерживает развитие СПИДа на 2-3 года и более. Значит ли это, что появилось новое оружие в борьбе с вирусом, вызывающим СПИД? Скорее всего, ученые приоткрыли еще одну завесу над загадками ВИЧ, и это поможет медикам в поисках средств лечения "чумы ХХ века". В многочисленных популяциях американцев афро-азиатского происхождения мутантные гены так и не найдены, но тем не менее есть небольшие группы здоровых людей, контактировавших с зараженными. Это говорит о существовании других генов защиты иммунной системы от страшной инфекции. Пока можно лишь предполагать, что в различных популяциях человека сложились свои системы генетической защиты. По-видимому, и для других инфекционных заболеваний, включая вирусный гепатит, также имеются гены устойчивости к вирусам-возбудителям. Теперь уже никто из генетиков не сомневается в существовании таких генов для вируса иммунодефицита. Исследования последних лет дали надежду найти решение такой, казалось бы, неразрешимой проблемы, как борьба со СПИДом. Кто станет победителем в противоборстве ВИЧ - человек, покажет будущее.
КАК ЛЕЧИТЬ СПИД. ПОИСК СТРАТЕГИИ
Результаты исследований последних лет заставили задуматься не только ученых и практических врачей, занимающихся проблемами СПИДа, но и фармацевтов. Раньше основное внимание уделялось комбинированному лечению инфекции, направленному против вируса. Применялись препараты, препятствующие размножению вируса в клетке: невипарин и атевирдин. Это так называемая группа ингибиторов обратной транскриптазы ВИЧ, которые не дают наследственному материалу вируса внедряться в ДНК иммунных клеток. Их сочетают с аналогами нуклеозидов типа зидовудина, диданозина и ставудина, которые облегчают течение болезни. Однако эти средства токсичны и обладают побочными действиями на организм, поэтому их нельзя считать оптимальными. Им на смену все чаще приходят более совершенные средства воздействия на ВИЧ.
В последнее время появилась возможность препятствовать "посадке" вирусных частиц на поверхность клеток. Известно, что этот процесс происходит за счет связывания вирусного белка gр120 с клеточными рецепторами. Искусственное блокирование мест связывания ВИЧ с помощью хемокинов должно защищать клетки от вторжения ВИЧ. Для этого нужно разработать специальные препараты-блокаторы.
Другой путь - получение антител, которые будут связываться с рецепторами ССR5, создающими "посадочную площадку". Такие антитела будут препятствовать взаимодействию этих рецепторов с вирусом, не давая доступа ВИЧ в клетки. Кроме того, можно вводить в организм фрагменты молекул ССR5. В ответ на это иммунная система начнет вырабатывать антитела к данному белку, которые также перекроют доступ к нему вирусных частиц.
Наиболее дорогостоящий способ обезопасить вирусные частицы - ввести в иммунные клетки новые мутантные гены. В результате сборка рецептора для "посадки" вируса на поверхности "оперированных" клеток прекратится, и вирусные частицы не смогут заразить такие клетки. Подобная защищающая терапия, по-видимому, наиболее перспективна при лечении больных СПИДом, хотя и весьма дорого стоит.
При лечении сопровождающих СПИД раковых заболеваний врачи чаще всего прибегают к высоким дозам химических препаратов и к облучению опухолей, что нарушает кроветворение и требует пересадки больным здорового костного мозга. А что, если в качестве донорских кроветворных клеток пересадить больному костный мозг, взятый от людей, генетически устойчивых к инфекции ВИЧ? Можно предположить, что после такой пересадки распространение вируса в организме пациента будет остановлено: ведь донорские клетки устойчивы к инфекции, поскольку не имеют рецепторов, позволяющих вирусу проникнуть через клеточную мембрану. Однако эту привлекательную идею вряд ли удастся воплотить в практику полностью. Дело в том, что иммунологические различия между пациентом и донором, как правило, приводят к отторжению пересаженной ткани, а иногда и к более серьезным последствиям, когда донорские клетки атакуют чужеродные для них клетки реципиента, вызывая их массовую гибель.
Т-киллеры - иммунные клетки, которые уничтожают зараженные вирусом клетки.
Рецепторы клеток - особые молекулы на поверхности, которые служат "опознавательным знаком" для вирусных частиц и других клеток.
Ген рецептора - ген, ответственный за выработку соответствующего белка.
Хемокины - гормоноподобные вещества на поверхности иммунных клеток, которые подавляют размножение вируса в организме.
Культура клеток - клетки, развивающиеся вне организма, в питательной среде пробирки.
Мутантные гены - измененные гены, не способные контролировать выработку нужного белка.
Клетки-мишени - иммунные клетки, которые в первую очередь поражает вирус.
- Сегодня в мире 29 миллионов зараженных вирусом иммунодефицита. 1,5 миллиона человек уже умерли от вызванного этим заражением СПИДа.
- Самый неблагополучный по СПИДу регион - Африка. В Европе лидируют Испания, Италия, Франция, Германия. С 1997 года к этим странам присоединилась Россия. На территории бывшего СССР зараженность ВИЧ распределяется так: 70% - Украина, 18,2% - Россия, 5,4% - Беларусь, 1,9% - Молдова, 1,3% - Казахстан, остальные - менее 0,5%.
- К 1 декабря 1997 года в России официально зарегистрировано около 7000 зараженных вирусом иммунодефицита, в основном при передаче инфекции половым путем.
- В России и странах ближнего зарубежья существует более 80 центров по профилактике и борьбе со СПИДом.
В соответствии с определением, резус иммунизацией (Rh сенсибилизация/Rh конфликт) называется появление у беременной резус антител в ответ на попадание в кровоток фетальных эритроцитарных антигенов, т.е, перефразируя проще – это несовместимость матери с резус-отрицательной группой крови с ребенком, имеющим резус положительную группу крови (а не с мужем, как многие думают).
Резус антиген – это белок, находящийся в мембране эритроцитов/красных кровяных телец большинства людей. Кровь таких людей является положительной по системе резус, а кровь тех лиц, у кого нет этого белка, соответственно, называется резус отрицательной. Около 1/3 популяции являются резус-отрицательными.
При наличии у матери и отца ребенка резус отрицательной группы крови, у ребенка также отрицательный резус-фактор.
А вот при наличии у матери резус-отрицательной крови, а у отца положительной, резус-положительный плод встречается у 60% беременных, однако только в 1,5% этих беременностей развивается несовместимость.
Как правило, при повторной беременности вероятность несовместимости выше, чем при первой.
Механизм развития резус-конфликта
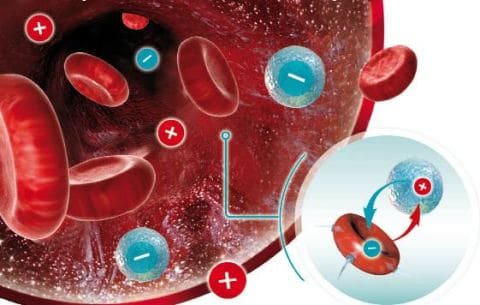
Если резус-положительные эритроциты встречаются с резус-отрицательными, то происходит их слипание — агглютинация. Чтобы этого не произошло, иммунная система резус-отрицательной матери вырабатывает специальные белки – антитела, которые соединяются с Rhбелком в мембране эритроцитов плода (антигенами), препятствуя слипанию их с собственными эритроцитами матери. Антитела называются иммуноглобулинами и бывают двух видов: IgM иIgG.
Контакт эритроцитов плода с антителами происходит в пространстве между стенкой матки и плацентой. При первой встрече плодовых резус-положительных эритроцитов с иммунной системой резус-отрицательной матери происходит выработка IgM, размер которых слишком велик, чтобы проникнуть через плацентарный барьер. Именно поэтому, как правило, во время первой беременности резус-отрицательной матери резус-положительным плодом конфликт возникает сравнительно редко. Несовместимость развивается при повторном попадании антигенов плода (Rh положительных эритроцитов) в кровоток резус-отрицательной матери, иммунная система которой в таком случае массивно вырабатывает IgG, которые, имея меньшие размеры, проникают через плаценту и вызывают гемолиз, т.е. разрушение эритроцитов плода. Так развивается гемолитическая болезнь плода/новорожденного.
Осложнения резус-конфликта
Факторы риска резус-конфликта
Делятся на:
1. Связанные с беременностью:
— любой вид прерывания беременности: выкидыш, инструментальный и медикаментозный аборты;
— внематочная беременность;
— роды, а именно, в третий период, когда происходит отделение плаценты от стенки матки;
— осложнение беременности или родов — преждевременная отслойка плаценты, которая сопровождается кровотечением из сосудов плаценты;
— любые инвазивные методы исследования: (амниоцентез, кордоцентез – пункция плодного пузыря или пуповины).
2. Несвязанные с беременностью:
— иммунизация при переливании крови;
— использование одной иглы при внутривенном употреблении наркотиков.
Симптомы резус-конфликта
Клинические проявления у пациентки отсутствуют, её состояние не страдает.
Диагностика резус-конфликта и тактика ведения беременности
Целью наблюдения беременных при резус-иммунизации является: обследование для выявления сенсибилизации, проведение профилактики резус иммунизации, ранняя диагностика гемолитической болезни плода и её коррекция, а также определение наиболее оптимальных сроков для родоразрешения. При постановке на учет по беременности показано определение группы крови, как самой беременной, так и отца ребенка в плановом порядке. При наличии резус-отрицательной крови у матери и резус-положительной крови у отца, беременным проводят анализ крови на антитела 1 один раз в месяц, отслеживая динамику титра антител. При наличии любого титра антител беременность считается резус сенсибилизированной. Если антитела обнаружены впервые, то определяют их класс (IgM или IgG). Далее анализ крови на антитела проводят ежемесячно, наблюдая пациентку до 20 недель в женской консультации, а после 20 недель – направляют в специализированные центры для определения дальнейшей тактики ведения, возможно, проведения лечения и решения вопроса о методе и сроках родоразрешения.
Начиная с 18 недель проводят оценку состояния плода при помощи УЗИ.
Методы оценки состояния плода делятся на:
1. Не инвазивные методы.
— УЗИ, при котором оценивают: размеры органов плода, наличие свободной жидкости в полостях, наличие отечности, толщину плаценты и диаметр вены пуповины. Первое УЗИ проводят в сроке 18-20 недель, повторяют в 24-26 недель, 30-32 недели, 34-36 и непосредственно перед родоразрешением. В зависимости от тяжести состояния плода возможно более частое проведение этого исследования, вплоть до ежедневного (как, например, после проведения переливания крови плоду).
— допплерометрия, которая оценивает функциональные показатели сердца, скорость кровотока в крупных сосудах плода и пуповине и т.д.
— кардиотокография оценивает реактивность сердечно-сосудистой системы плода, выявляет наличие или отсутствия гипоксии (недостатка кислорода).
2. Инвазивные:
— амниоцентез – пункция плодного пузыря с целью забора околоплодных вод для оценки тяжести гемолиза по содержанию билирубина (продукта распада гемоглобина), что является одним из самых точных методов оценки тяжести состояния плода. К сожалению, данный метод чреват многими осложнениями: инфицирование, дородовое излитие околоплодных вод, преждевременные роды, кровотечение, преждевременная отслойка плаценты.Показания к проведению амниоцентеза: титр антител 1:16 и более, наличие у пациентки детей, перенесших тяжелую форму гемолитической болезни новорожденных.
— кордоцентез — пункция пуповины с целью забора крови. Метод позволяет точно оценить тяжесть гемолиза, одномоментно провести внутриматочное переливание крови плоду. Кроме тех осложнений, которые характерны для амниоцентеза, при кордоцентезе так же возможно развитие гематомы пуповины и кровотечения из места пункции.Показаниями для кордоцентеза является определение признаков гемолитической болезни плода при УЗИ, титр антител 1:32 и выше, наличие у пациентки детей, перенесших тяжелые форму ГБП в прошлом или погибших от нее, высокий уровень билирубина в околоплодных водах, полученных при амниоцентезе.
В связи с возможным риском, перед проведением и той и другой процедуры пациентка должна быть проинформирована врачом о возможности неблагоприятных последствий процедуры и дать свое письменное согласие на её проведение.
Лечение резус-конфликта
В современном акушерстве единственным методом лечения с доказанной эффективностью является внутриутробное переливание крови, которое проводится при выраженной анемии (малокровии) у плода. Такого рода лечение проводится только в стационаре и позволяет добиться значительного улучшения состояния плода и снизить риск преждевременных родов и развития тяжелой формы болезни после рождения.
Пациенток высокой группы риска (у которых титра антител обнаружен на ранних сроках, тех, у кого титр антител 1:16 и выше, тех у кого прошлая беременность протекала с резус конфликтом) наблюдают в условиях женской консультации до 20 недель, а затем направляют в специализированные стационары для проведения вышеуказанного лечения.
Различные методики очищения крови матери от антител (плазмаферез, гемосорбция), способы, влияющие на активность иммунной системы (десенсибилизирующая терапия, терапия иммуноглобулинами, пересадка пациентке кожного лоскута отца ребенка) в настоящее время считаются малоэффективными или даже неэффективными.
Но, к сожалению, несмотря на значительные успехи в области коррекции состояния плода, самым эффективным способом является прекращение поступления к нему материнских антител, чего можно достигнуть только родоразрешением.
Родоразрешение при резус-конфликте
К сожалению, при резус-сенсибилизации часто приходится проводить родоразрешение досрочно, т.к. на поздних сроках беременности происходит увеличение количества антител, которые поступают к плоду.
В зависимости от состояния плода и срока беременности, метод родоразрешения индивидуален в каждом отдельном случае. Считается, что кесарево сечение является более щадящим для плода, в связи с чем в тяжелых случаях прибегают именно к нему. При удовлетворительном состоянии плода, сроках беременности свыше 36 недель, у повторнородящей возможно ведение родов через естественные родовые пути с тщательным мониторным контролем состояния плода, профилактикой внутриутробной гипоксии. При ухудшении его состояния в родах, план ведения может быть пересмотрен в пользу кесарева сечения.
Прогноз при резус-конфликте
Прогноз зависит от того, насколько рано была диагностирована резус иммунизация, от величины титра антител и скорости его нарастания, а также от формы гемолитической болезни плода. Чем раньше обнаружены антитела в крови матери, например, на сроке 8-10 недель, тем более прогностически неблагоприятным это является. Быстрое нарастание титра антител, титр выше 1:16, раннее обнаружение его (на сроках менее 20 недель) является основанием для неблагоприятного прогноза. В таких случаях возрастает не только риск гемолитической болезни плода, но и риск невынашивания беременности.
Наиболее прогностически неблагоприятной формой гемолитической болезни плода является отечная. Такие дети часто требуют лечения в условиях отделения детской реанимации и интенсивной терапии, заменного переливания крови. Наиболее прогностически благоприятной формой является анемическая форма, (в зависимости от выраженности анемии). При желтушной форме определяющим критерием является уровень билирубина. Чем он выше, тем более высока возможность поражения центральной нервной системы плода, которое проявляется в дальнейшем слабоумием, тугоухостью.
Профилактика резус-конфликта
Профилактику следует проводить во время беременности в сроке 28 недель при отсутствии антител в крови матери, так как именно в этом сроке резко возрастает риск контакта антител матери с эритроцитами плода, в связи с чем увеличивается и риск гемолитической болезни плода. Вследствие введения препарата в крови может появиться титр антител, поэтому после введения препарата определение антител более не проводится.Далее, следует повторить профилактику в течение 72 часов после родов в том случае, если пациентка планирует следующую беременность. При возникновении кровотечений во время беременности, а также при проведении кордо- или амниоцентеза, а также в послеродовом периоде следует повторить введение иммуноглобулина, т.к. резус сенсибилизация может возникнуть при следующей беременности в ответ на попадание крови плода (при кровотечении из сосудов плаценты) в кровоток матери.
Также, следует проводить профилактику инъекцией препарата при любом исходе беременности: выкидыш, медикаментозный или инструментальный аборт, внематочная беременность, пузырный занос в течение 72 часов после прерывания. Особое внимание уделяют кровопотере, при появлении которой дозу препарата следует увеличить.
Читайте также:


