Вич и рак печени
Терапевтический архив, 2002. Т. 74, №11.
В. И. Шахгильдян, А. В. Кравченко, Ю. Г. Пархоменко, О. А. Тишкевич, В. В. Серова, Б. М. Груздев.
Центральный научно-исследовательский институт эпидемиологии МЗ РФ (директор — акад. РАМН В. И. Покровский),
Инфекционная клиническая больница №2 (главный врач В. А. Мясников), Москва.
В настоящее время исследования по проблеме патологии печени у больных в абсолютном большинстве случаев посвящены изучению вирусных гепатитов В, С, D в данной группе лиц [1, 2, 3]. Вместе с тем, учитывая все возрастающее количество больных имеющих глубокую иммуносупрессию и страдающих различными оппортунистическими заболеваниями, особый интерес представляют поражения печени у этих пациентов, не связанные с вирусами гепатитов.
служило определение спектра и частоты поражения печени, а также клинических, лабораторных, инструментальных и морфологических особенностей печеночной патологии при вторичных заболеваниях у больных
В период с января 1991 г. по март 2002 г. под нашим наблюдением находились 59 больных на стадии вторичных заболеваний, 3В (СПИД), у которых имело место поражение печени, обусловленное оппортунистическими инфекциями и опухолями. При неоднократном исследовании сыворотки крови данных пациентов иммуноферментным методом и методом ПЦР маркеры вирусных гепатитов В, С, D обнаружены не были. Во всех случаях инфицирование ВИЧ произошло при сексуальных контактах. Возраст пациентов колебался от 21 до 54 лет (средний возраст составил 35,8 + 1,5 лет), мужчин было 57, женщин — 2.
В 57 случаях заболевание закончилось летальным исходом, и характер поражения печени был подтвержден гистологическими исследованиями с окраской препаратов гематоксилином и эозином,
Наибольшую группу больных имевших поражение печени, составили пациенты, страдавшие генерализованным туберкулезом (25 человек, 42.4% от общего количества больных с печеночной патологией). Среди всех умерших больных туберкулезом поражение печени имело место в 26.3% случаев, в том числе, при генерализованной форме заболевания — 80.6% случаев. У большинства больных имели место милиарные поражения печени, с наличием мелких просовидных бугорков (гранулем). В двух случаях туберкулеза при наличии глубокой иммуносупрессии, были выявлены крупноочаговые изменения в органе, причем не в виде гранулем, а в форме обширных очагов казеозного некроза со скоплением большого количества возбудителя в них. В семи случаях мы наблюдали острейший туберкулезный сепсис, который был представлен многочисленными мелкими очагами некроза в печени с большим количеством микобактерий в них.
Туберкулез печени морфологически характеризовался значительным объемом поражения паренхимы, выраженной эксудативно-альтеративной реакцией, слабой пролиферативной реакцией и казеозом регионарных лимфатических узлов в области ворот печени. Масса печени была в пределах от 1450 до 1600 г.
Клинические проявления, обусловленные собственно поражением печени, при туберкулезе были скудны. Наряду с характерными для туберкулезной инфекции симптомами интоксикации (повышение температуры до 39.0 — 39.5, потливость, ознобы) имело место увеличение печени в пределах 2 — 6 см ниже края правой реберной дуги, у ряда пациентов — увеличение селезенки. Желтуха была лишь у двух больных.
При проведении УЗИ органов брюшной полости у всех больных отмечали увеличение печени с диффузными изменениями в паренхиме различной степени. В двух случаях на этом фоне определяли очаговые изменения: у одного пациента — единичный очаг повышенной эхогенности с ровным контуром, у второго — множественные очаги пониженной эхогенности размерами от 6 до 9 мм в диаметре. Селезенка у большинства больных была увеличена с диффузными изменениями в паренхиме. У двух пациентов имели место множественные, мелкие очаги пониженной эхогенности, у одного — множественные кальцинаты до 3 — 4 мм в диаметре.
Средние уровни активности АсАТ и АлАТ у больных туберкулезом составили соответственно (у здоровых лиц до 40 МЕ/л), уровни ЩФ и ГГТ — соответственно (контроль ЩФ 76.5 и ГГТ — 9.8). Максимальные цифры билирубина составили 72 мкмоль/л — связанная фракция и 48 мкмоль/л — свободная. В ряде случаев выявляли гиперглобулинемию, отражающей наличие хронической инфекции и печеночных гранулем [4].
Среднее количество в данной группе больных было 117+38 кл/мм 3 (у здоровых лиц —
Цитомегаловирусное поражение печени имело место у 10 пациентов (16.9%). Среди умерших больных, страдавших манифестной поражение печени было установлено в 10.8% случаев. При морфологическом исследовании печени выявляли гигантоклеточный метаморфоз гепатоцитов, купферовских клеток, синусоидальных клеток эндотелия артериол и эпителиоцитов желчных протоков, а также — распространенные очаги некрозов и разрастания соединительной ткани. В ряде случаев отмечали лимфогистиоцитарную инфильтрацию портальных трактов, формирование гранулем вокруг погибших гигантских клеток, наличие цитомегалоклеток в эндотелии развлетвлений воротной вены и развитие гранулематозного гепатита. Масса печени не была существенно увеличена и составляла от 1500 до 1600 г.
У больных СПИДом достаточно часто осложняется склерозирующим холангитом, папиллярным стенозом, стриктурой общего желчного протока и некалькулезным холециститом [5, 6]. В нашем исследовании в двух случаях цитомегаловирусного гепатита мы диагностировали поражение желчевыводящих путей.
Печеночная патология у наблюдаемых нами больных всегда была лишь одной из форм генерализованной Факт поражения печени в большинстве случаев устанавливали лишь при посмертном исследовании. Клинические проявления собственно гепатита у большинства больных были неяркими. Желтуху отмечали лишь в двух случаях. При пальпации живота выявляли умеренное увеличение печени, в 2/3 случаях — увеличение селезенки. У трех человек имели место носовые кровотечения.
По данным УЗИ у всех пациентов отмечали увеличение печени с диффузными изменениями в паренхиме, у трети из них в области ворот печени по ходу сосудов и желчного протока имели место крупные одиночные очаги повышенной эхогенности с неровным контуром, размерами в диаметре (рис. 1). В одном случае были выявлены многочисленные очаги пониженной эхогенности с зоной повышения эхогенности в центре, с неровными, но четкими контурами, размерами в диаметре. У половины пациентов зафиксировано увеличение селезенки, причем, в двух случаях имела место выраженная спленомегалия с диффузными изменениями в паренхиме.
Средние уровни активности АсАТ и АлАТ у больных ЦМВИ были равны соответственно, а уровни ЩФ и ГГТ — Максимальные цифры билирубина составили 139.2 мкмоль/л — связанная фракция и 62.4 мкмоль/л — свободная.
При сочетанном поражении цитомегаловирусом паренхимы печени и желчевыводящих путей, имела место стойкая умеренно выраженная желтуха, приступообразные боли в верхней части живота, тошнота, диарея. Печень была значительно увеличена (до + 7 см от правого края реберной дуги), уплотнена, чувствительная при пальпации. В этих случаях уровни активности ЩФ и ГГТ достигали максимальных значений: 2160 МЕ/л и 1827 МЕ/л, соответственно.
Количество у больных ЦМВИ было крайне низким и в среднем составило
У четырех пациентов (6.8%) поражение печени имело токсоплазменную этиологию. Среди больных токсоплазмозом патология печени была выявлена в 17.4% случаев. При морфологических исследованиях обращало на себя внимание большое количество токсоплазменных цист в синусоидах и паренхиме печени среди фокусов коагуляционных некрозов (рис. 2). При токсоплазменном гепатите могли формироваться гранулемы. Все случаи поражения печени нами установлены посмертно. При жизни больных лишь у одного отмечали иктеричность склер, увеличение печени было небольшим, нарушения функции органа отсутствовали или оставались не резко выраженными. Максимальные цифры активности АсАТ — 320 МЕ/л, АлАТ — 230 МЕ/л, ЩФ — 540 МЕ/л, ГГТ — 230 МЕ/л. Повышения уровня билирубина в крови не отмечали. У больных при УЗИ выявляли увеличение печени с диффузными изменениями в паренхиме. В одном случае имели место множественные очаги повышенной эхогеннности с ровными четкими контурами, размерами от 1.5 до 5.5 см в диаметре (рис. 3).
Количество в крови пациентов находилось в пределах от 10 до 50 кл/мм 3.
Поражение печени грибами представляет собой одно из проявлений генерализованного микоза. У двух наблюдаемых нами пациентов (3.4%) патология печени была связана с криптококкозом и характеризовалась большой площадью поражения органа, наличием множества молодых форм криптококка и слабо выраженной воспалительной реакцией. В одном наблюдении (1.7%) имела место генерализованная кандидозная инфекция с гранулематозом и микроабсцессами печени.
Количество у пациентов грибковым поражением печени колебалось в пределах Уровни АсАТ и АлАТ у пациентов были повышены умеренно Уровень билирубина в крови находился в пределах нормы.
Патология печени, обусловленная атипичным микобактериозом, была выявлена у двух больных (3.4%). При гистологических исследованиях в портальных трактах печени выявляли скопления гистиоцитов, в цитоплазме которых при окраске по методу определяли большое количество микобактерий. Количество у больных было менее 50 кл/мм 3 .
Кроме того, у четырех пациентов (6.8%) нами зарегистрирован гранулематозный гепатит не установленной этиологии.
Среди патологий, приводящих к поражению печени, нередко встречаются онкологические заболевания [7]. Данную группу составили 11 пациентов (18.6%). У четырех из них была диагностирована висцеральная форма саркомы Капоши с поражением обеих долей печени. Кроме того, имели место холангиоцеллюлярный рак печени с прорастанием стенки желчного пузыря и метастазами в лимфоузлы ворот печени (1 случай), гепатоцеллюлярная карцинома (1), недифференцированный рак печени (1), рак желудка с метастазами в печень (1), рак легкого с метастазами в печень (1), лимфоцитарная лимфосаркома с метастазами в печень (1), лимфогранулематоз с очаговыми и диффузными поражениями печени (1). У одного пациента наблюдали одновременное метастатическое и цитомегаловирусное поражение органа. На аутопсии при раке печени обращало на себя внимание резкое увеличение ее массы, которая находилась в пределах от 2 до 3.5 кг. Клиническая картина, обусловленная поражением печени, у больных онкологическими заболеваниями была более яркой, по сравнению с пациентами иных групп. Имели место желтуха, значительное увеличение и уплотнение печени, болезненность ее при пальпации, носовые кровотечения. Данные симптомы сочетались с лабораторными признаками нарушения печеночных функций (синтеза белков, факторов свертывания крови). У двух больных с раком печени развилась печеночная недостаточность. В тоже время, средние уровни АсАТ и АлАТ у онкологических больных были ниже, чем у пациентов с вторичными инфекциями соответственно, среди патологий, приводящих к поражению печени, нередко встречаются онкологические заболевания [7]. Данную группу составили 11 пациентов (18.6%). У четырех из них была диагностирована висцеральная форма саркомы Капоши с поражением обеих долей печени. Кроме того, имели место холангиоцеллюлярный рак печени с прорастанием стенки желчного пузыря и метастазами в лимфоузлы ворот печени (1 случай), гепатоцеллюлярная карцинома (1), недифференцированный рак печени (1), рак желудка с метастазами в печень (1), рак легкого с метастазами в печень (1), лимфоцитарная лимфосаркома с метастазами в печень (1), лимфогранулематоз с очаговыми и диффузными поражениями печени (1). У одного пациента наблюдали одновременное метастатическое и цитомегаловирусное поражение органа. На аутопсии при раке печени обращало на себя внимание резкое увеличение ее массы, которая находилась в пределах от 2 до 3.5 кг. Клиническая картина, обусловленная поражением печени, у больных онкологическими заболеваниями была более яркой, по сравнению с пациентами иных групп. Имели место желтуха, значительное увеличение и уплотнение печени, болезненность ее при пальпации, носовые кровотечения. Данные симптомы сочетались с лабораторными признаками нарушения печеночных функций (синтеза белков, факторов свертывания крови). У двух больных с раком печени развилась печеночная недостаточность. В тоже время, средние уровни АсАТ и АлАТ у онкологических больных были ниже, чем у пациентов с вторичными инфекциями соответственно, p 3 .
1. Блохина Н. П. Клинические аспекты гепатита С Вирусные гепатиты, инф. бюллетень, 2001. №2 (12).
2. Канестри В. Г. Комбинированная противовирусная терапия хронического гепатита С у больных Дис. …канд. мед. наук. М.: 2001.
3. Munoz S., Castilio J., Tellez M. et al. Mortality due to hepatopathy in HIV patients European Conference on clinical aspects and treatment of Athens 2001. Book of Abstracts, Abs. p. 275, page 175.
4. Шерлок Ш., Дули Дж. Заболевания печени и желчных путей: Практич. Рук.: Пер. с англ. / Под ред. З. Г. Апросиной, Н. А. Мухина. — М.: Гэотар Медицина, 1999.
5. Dieterich D., Poles M., Lew E. Ganciclovir treatment of gastrointestinal infection caused by CMV in patients with AIDS // Rev. Infect. Dis. 1996. V. 10.
6. Dieterich D., Poles M., Lew E. et al. Results of 452 liver biopsises in patients seropositive for HIV // Hepatology. 1992. V. 98.
7. Кравченко А. В., Рослый И. М., Сереброская Л. В. и др. Этиологическая структура и особенности поражений печени у больных Тер. архив, 1997. Т. 69, №11.
8. Шахгильдян В. И., Шипулина О. Ю., Каражас Н. В. и др. Лабораторная диагностика цитомегаловирусной инфекции пациентов // Эпид. и инф. болезни, 2001. №1.
Цель исследования. Определение спектра и частоты поражения печени, клинических, лабораторных и морфологических особенностей печеночной патологии при вторичных заболеваниях у больных
Материалы и методы. С 1991 по 2002 гг. наблюдали 59 больных имевших поражение печени, обусловленное оппортунистическими инфекциями и опухолями. Проводили биохимический анализ крови пациентов, определяли показатели системы иммунитета, исследовали кровь, биопсийные и аутопсийные материалы для выявления ДНК CMV, T. gondii, M. tuberculosis (ПЦР). Проводили пункционную биопсию печени, УЗИ органов брюшной полости. В 57 случаях заболевание закончилось летальным исходом, и характер поражения печени был подтвержден морфологическими исследованиями.
Результаты. Среди всех больных с поражением печени туберкулезная этиология процесса выявлена в 42.4%, ЦМВ — 16.9%, токсоплазменная — 6.8% случаев. У трех пациентов печеночная патология была связана с грибковой инфекцией. Злокачественные опухоли в печени имели место в 18.6% случаев. Клиническая картина, обусловленная патологией печени, у большинства пациентов была стертая и не соответствовала масштабу морфологических изменений в органе, часто обширных, с явлениями фиброза и некроза. Выявляемые при УЗИ очаги в печени наиболее часто имели место у больных ЦМВИ, токсоплазмозом и при наличии злокачественных опухолей в органе. Изменение уровней биохимических параметров крови пациентов было умеренным. У лиц с отмечено значительное повышение активности ГГТ и ЩФ.
Заключение. У больных помимо вирусных гепатитов В, С, D, наиболее часто поражение печени обусловлено туберкулезом, ЦМВИ, токсоплазмозом. Значительная доля в этиологической структуре поражения печени принадлежит онкологическим заболеваниям. Развитие у больного гепатита, не связанного с вирусами В, С, D или приемом лекарственных средств, является критерием генерализованного патологического процесса, свидетельствующего о наличии у пациента поздней стадии со снижением количества менее 100 кл/мм 3 .
Ключевые слова: оппортунистические заболевания, поражение печени.
ВИЧ-инфекция — один из факторов, который во много раз повышает вероятность развития рака. Выяснили, какие именно онкозаболевания чаще всего могут возникать при положительном ВИЧ-статусе, как их вовремя обнаружить, и на какие факторы риска еще нужно обратить внимание людям, живущим с ВИЧ.
Главная мишень вируса — CD4-Т-лимфоциты. Они передают сигнал другим клеткам, которые защищают организм от рака. В результате вмешательства вируса количество CD4-T-лимфоцитов постепенно уменьшается. Критически низкий уровень этих клеток - одна из причин отсутствия согласованной работы между звеньями иммунитета и главный механизм, приводящий к развитию СПИДа.
Иммунитет человека с ВИЧ-инфекцией перестает контролировать процессы избыточного клеточного деления и злокачественной трансформации клеток. Вместе с уменьшением количества CD4-T-лимфоцитов происходит накопление раковых клеток. В результате у человека развиваются несколько видов опухолей, которые называют СПИД-индикаторными: появление такого вида рака с очень большой вероятностью означает наличие у человека СПИДа.
Однако повышается риск появления не только СПИД-индикаторных опухолей, но и тех видов рака, которые развиваются из-за потери иммунного контроля над несколькими онкогенными инфекциями: вирусом герпеса человека 8 типа (ВГЧ-8), вирусом папилломы человека (ВПЧ), вирусами гепатита В и С (ВГВ, ВГС), вирусом Эпштейна-Барр (ВЭБ) и другими.
Все эти состояния развиваются у людей с ВИЧ-инфекцией преимущественно на фоне снижения количества CD4-T-лимфоцитов до уровня менее 200 клеток/мкл (при разбросе в норме от 500 до 1100 клеток), но также могут возникать при нормальном или близком к нормальному уровню CD4-T-лимфоцитов.
Саркома Капоши (СК) — СПИД-индикаторная опухоль, при которой происходит злокачественная трансформация клеток лимфатических и кровеносных сосудов. Риск развития СК у пациентов с ВИЧ-инфекцией увеличивается в несколько сотен раз. Различные белки ВИЧ-1 способны усиливать воспаление и нарушать регуляцию в эндотелиальных клетках. Это приводит к тому, что саркома Капоши может развиться до того, как уровень CD4-T-лимфоцитов упадет ниже 200 клеток/мкл. Еще одно обязательное условие для возникновения СК — наличие в организме вируса герпеса человека 8 типа.
Саркома Капоши развивается в виде папулы, пятна, узелка, бляшки коричневого, розового, красного или темно-красного цвета от нескольких миллиметров до нескольких сантиметров в диаметре. Обычно высыпания концентрируются на ногах, голове, шее, на слизистой оболочке — в области неба, десен, конъюнктивы.
До эры внедрения лекарств от ВИЧ — антиретровирусной терапии (АРТ) 5-летняя выживаемость (с момента диагностики опухоли) пациентов с саркомой Капоши составляла менее 10%. Применение АРТ значительно улучшило ситуацию — сейчас речь идет о 74%, — а также позволило снизить риск развития СК.
Более половины случаев СК (56%) диагностируются сейчас в локальной форме — до того, как опухоль распространится на лимфатические узлы, слизистую ЖКТ, печень, селезенку и другие органы. Прием антиретровирусной терапии помогает значительно замедлить прогрессию болезни и предотвратить распространение СК по всему организму.
К сожалению, обнаружить саркому Капоши до появления симптомов не получится
Однако, человеку с ВИЧ и его амбулаторному врачу-инфекционисту необходимо учитывать несколько факторов риска развития этой опухоли:
- Этническая принадлежность: люди еврейского или средиземноморского происхождения, а также экваториальные африканцы;
- Мужской пол;
- Иммунодефицит: Люди с уровнем CD4-клеток менее 200 кл/мкл, те, кто перенес трансплантацию органов или костного мозга или постоянно принимает глюкокортикостероиды;
- Сексуальная ориентация: мужчины, имеющие секс с мужчинами(МСМ), подвержены более высокому риску развития СК.
К онкологическим заболеваниям, ассоциированным с вирусом папилломы человека, относятся инвазивный рак шейки матки (ИРШМ), сквамозный (чешуйчатый) рак головы/шеи, рак анального канала, вульвы и влагалища. СПИД-индикаторной из них является только ИРШМ.
Распространенность генитальной онкогенной инфекции ВПЧ среди женщин, живущих с ВИЧ, в целом выше, чем у остального населения.
Вирус папилломы человека способен к самопроизвольной элиминации — исчезновению из организма. У ВИЧ-положительных женщин этот процесс занимает больше времени, что увеличивает вероятность появления патологических изменений в шейке матки.
Продолжительный прием АРТ приводит к более низкой распространенности ВПЧ высокого риска и поражений шейки матки и даже предотвращает новые случаи ИРШМ.
Раннее начало антиретровирусной терапии, приверженность лечению обеспечивают снижение вирусной нагрузки — количества вируса в крови. Эти меры очень эффективны в отношении местного иммунитета слизистой оболочки и профилактики ИРШМ.
Скрининг ИРШМ заключается в проведении ПАП-теста и ВПЧ-теста (ПЦР). Женщины с ВИЧ-инфекцией в возрасте от 21 до 29 лет должны пройти ПАП-тест во время первичной диагностики ВИЧ, затем — через 12 месяцев, если анализ не показал патологии. Некоторые эксперты рекомендуют делать следующий ПАП-тест через 6 месяцев после первого. Если результаты трех последовательных мазков без отклонений, повторные тесты следует проводить каждые 3 года. ВПЧ-тест не рекомендуется подключать к ПАП-тесту до 30 лет — высока вероятность положительного результата, при этом оснований для активных действий нет. Лечения ВПЧ не существует, а для развития РШМ требуется, как правило, от 10 лет.
После 30 лет ПАП-тест и ВПЧ-тест проводятся совместно
У пациентов с ВИЧ-инфекцией повышается риск развития:
- гепатоцеллюлярной карциномы (ГЦК), связанной с вирусами гепатита С и В (ВГВ и ВГС) — в три раза;
- рака желудка, ассоциированного с инфекцией H.pylori;
- лимфомы Ходжкина — 8-13 раз. Риск связан с сопутствующей Эпштейн-Барр-инфекцией. Важно, что повсеместное внедрение АРТ не повлияло на показатели заболеваемости лимфомой Ходжкина в популяции людей с ВИЧ.
К факторам риска развития ГЦК у пациентов с ВИЧ относятся: цирроз печени, ожирение, диабет, возраст старше 60 лет, мужской пол.
Скрининг ГЦК проводится с помощью анализа крови на альфа-фетопротеин (АФП), который может продуцироваться раковыми клетками, или инструментальных методик диагностики — УЗИ, КТ, МРТ.
В последние годы всё чаще используется фиброскан для оценки стадии фиброза и близости к циррозу, независимому фактору риска ГЦК.
Предотвратить появление гепатоцеллюлярной карциномы можно с помощью своевременной вакцинации и ревакцинации от вирусного гепатита В и контроля вирусной нагрузки.
Несмотря на появление АРТ, НХЛ остаются актуальной проблемой для людей, длительное время живущих с ВИЧ. Хотя в большом количестве случаев неходжкинские лимфомы являются СПИД-индикаторными, они способны развиваться при нормальном уровне CD4-клеток и являются одной из наиболее частых причин смерти среди ВИЧ-положительных.
Общая выживаемость у пациентов с этим диагнозом низкая: более половины умирают в течение пяти лет от момента постановки диагноза
Отсюда возникают факторы риска развития НХЛ при ВИЧ-инфекции:
- наличие ко-инфекции вирусными гепатитами В, C, H.pylori;
- наличие вирусной нагрузки вируса Эпштейна-Барр или цитомегаловируса;
- наличие аутоиммунных заболеваний до постановки диагноза ВИЧ-инфекция;
- наличие специфических изменений в протеинограмме до или во время ВИЧ-инфекции;
- наличие минимальной вирусной нагрузки ВИЧ, несмотря на АРТ;
- снижение CD4-Т-лимфоцитов.
К скринингу неходжкинских лимфом относятся мониторинг вирусной нагрузки ВЭБ, ВГС, ВГВ и проведение инструментальной диагностики (КТ, МРТ, УЗИ, ФГДС).
С помощью контроля факторов риска и своевременного скрининга можно не только найти опухоль на ранней стадии, но и предотвратить заболевание.
Если рак все же обнаружили, ни в коем случае нельзя прерывать антиретровирусную терапию — она проводится по жизненным показаниям, что означает высокую вероятность неблагоприятного исхода противоопухолевой терапии без сопутствующего противовирусного лечения.

ВИЧ-инфекция негативно влияет на риски возникновения онкологических заболеваний у человека, данные риски значительно увеличиваются при возникновении выраженного иммунодефицита – СПИД. Впрочем, и при достаточно высоком уровне функционирования иммунной системы при ВИЧ-инфекции риски все же выше – это очень важно знать, однако, не менее и даже более важно понимать, что практически всеми данными рисками можно и нужно управлять, снижая риски онкологии.
Онкологические заболевания при ВИЧ-инфекции исторически разделяют на СПИД-ассоциированные (САР) и не-СПИД-ассоциированные (не-САР) формы рака. Данное разделение именно историческое, так как многие формы рака нашли свое подтверждение связи с ВИЧ-инфекцией, однако, продолжают рассматриваться как не-САР. Онкозаболевания, риски которых возрастают именно у ВИЧ-инфицированных, обычно связаны с потенциально онкогенными вирусами: Вирус Эпштейна–Барр (ВЭБ), герпесвирус человека 8 типа (ГССК/KSHV), вирус папилломы человека (ВПЧ), вирусные гепатиты B и С… Кроме того, среди людей с ВИЧ-инфекцией более распространено курение, а также больше людей, злоупотребляющих алкоголем, что также является мощными факторами риска.
| Событие | Люди с ВИЧ | Не инфицированные ВИЧ |
| Саркома Капоши | 130,4 | 0,2 |
| Неходжкинская лимфома | 153,5 | 12,6 |
| Рак легких | 129,3 | 45,4 |
| Анальный рак | 60,1 | 1,2 |
| Колоректальный рак | 36,4 | 27,7 |
| Рак печени | 46,3 | 10,9 |
| Ходжкинская лимфома | 33,5 | 1,9 |
| Меланома | 16,4 | 14,5 |
| Рак ротовой полости/глотки | 34,3 | 18,4 |
Показатели заболеваемости и смертности от некоторых онкозаболеваний в зависимости от ВИЧ-статуса. Данные NA-ACCORD, 1996 –2009. Частота случаев на 100 000 лет наблюдений.
С наступлением эпохи антиретровирусной терапии стремительно снижается распространенность тех форм рака, которые часто наблюдается именно при возникновении СПИД. АРВ-терапия сохраняет иммунную систему, позволяя организму бороться с рисками онкологии. Оборотной стороной медали стало то, что продолжительность жизни людей с ВИЧ практически сравнялась с продолжительностью жизни без ВИЧ-инфекции, и стало очевидно, что старение с ВИЧ также сопряжено с ростом рисков возникновения онкозаболеваний. Важно понимать, что основные факторы риска рака при ВИЧ-инфекции являются управляемыми, их можно и нужно серьезно снизить или практически устранить.
Раннее начало терапии позволяет очень значительно снизить риски развития многих форм рака и увеличить общую выживаемость. В особенности это относится к рискам тех видов рака, которые обусловлены воздействием онкогенных вирусов, например, саркома Капоши и неходжкинская лимфома.
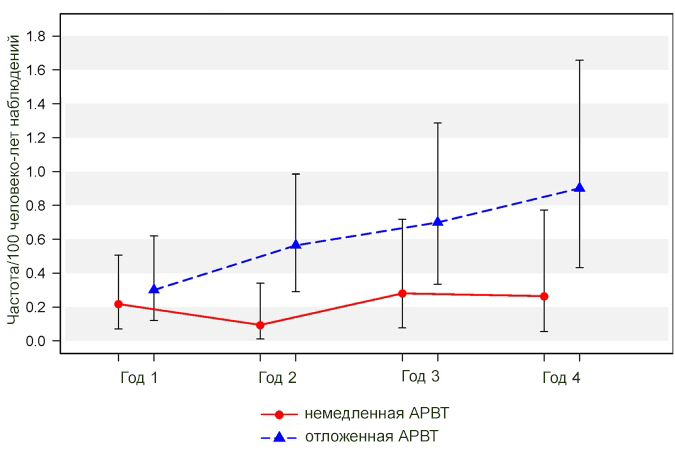
Темпы прироста заболеваемости всеми типами рака по частоте (на 100 человеко-лет наблюдений) и в зависимости от начала АРВ-терапии. Данные исследования START.
Отказ от курения очень значительно снижает не только риски рака легких, глотки или ротовой полости, но почти в два раза снижает все риски смерти, не связанные со СПИД при ВИЧ-инфекции.
Устранить вирусный гепатит С и подавить гепатит B. Риски онкозаболеваний печени при ко-инфекции практически в два раза выше. Современные безинтерфероновые режимы позволяют почти во всех случаях устранить гепатит С за непродолжительное время и с очень хорошей переносимостью лечения. Правильный подбор АРВ-терапии позволяет и подавить вирус гепатита В.
Профилактика ВПЧ и регулярный скрининг изменений эпителия шейки матки и прямой кишки, который включает тест Папаниколау и тест ДНК ВПЧ, позволяет своевременно принять меры, которые способны практически полностью устранить риски рака шейки матки, а также анального рака. Центр по контролю и профилактике заболеваний (CDC, США) рекомендует вакцинацию против вируса папилломы человека (ВПЧ) для женщин и мужчин с ВИЧ-инфекцией в возрасте до 26 лет, а в октябре 2018 года регулятор в США одобрил вакцину Gardasil-9 для людей в возрасте до 45 лет.
Герпесвирус 8 типа (ГССК/KSHV) выделяется со слюной, не следует использовать слюну в качестве лубриканта при сексуальных контактах. Использование лубрикантов, вместо слюны, позволяет снизить вероятность заражения ГССК и тем самым уменьшить риски саркомы Капоши.
Антиретровирусная терапия, устранение или минимизация управляемых факторов риска, в сочетании с формированием и выполнением рационального индивидуального плана обследований – позволяют сегодня достичь радикального снижения рисков возникновения онкологических заболеваний у людей с ВИЧ-инфекцией, а если таковые риски и реализуются, то своевременная диагностика дает крайне высокие шансы на излечение.

Люди, живущие с ВИЧ и на протяжении длительного времени имеющие определяемую вирусную нагрузку, а также те, в крови которых снижено содержание CD4+ Т-клеток, имеют более высокий риск развития рака печени при отсутствии выраженного фиброза, следует из данных исследования, представленного на Конференции по ретровирусам и оппортунистическим инфекциям (CROI-2019).
С момента появления эффективной антиретровирусной терапии (АРВТ) заболевания печени стали одной из основных причин смертности среди людей, живущих с ВИЧ. В течение многих лет хроническая инфекция вирусов гепатита В или С (ВГВ или ВГС), употребление алкоголя в больших количествах, гепатоз и ряд иных причин, связанных с поражением печени, приводили к развитию прогрессирующего фиброза, цирроза и гепатоцеллюлярной карциномы (ГЦК), наиболее распространенному типу рака печени.
С 1996 года заболеваемость раком печени среди людей с ВИЧ-инфекцией увеличилась в четыре раза, при этом вероятность развития ГЦК оказалась примерно в четыре раза выше, чем среди ВИЧ-отрицательных, отметила доктор Джесси Торгерсен из Медицинской школы Перельмана Университета Пенсильвании. Однако причины этого дисбаланса до сих пор оставались неизвестными.
Торгерсен и ее коллеги провели ретроспективное когортное исследование, направленное на изучение влияния уровня вирусной нагрузки ВИЧ, продолжительности виремии и количества клеток CD4+ на частоту возникновения рака печени и связь с риском развития цирроза.
Специалисты проанализировали электронные медицинские записи участников когортного исследования старения людей с ВИЧ в США, у которых были доступны показатели уровней вирусной нагрузки и количества CD4+ в течение как минимум полугода в период между 1999 и 2015 гг. В качестве меры фиброза печени учеными был использован индекс неинвазивного фиброза-4 (FIB-4), который включает возраст пациента, количество тромбоцитов и уровни аланинаминотрансферазы (ALT) и аспартатаминотрансферазы (AST). Баллы выше 3,25 указывали на прогрессирующий фиброз или цирроз печени.
В анализ были включены 2497 человек (8%) с прогрессирующим фиброзом или циррозом и 29 836 с отсутствующим, легким или умеренным фиброзом. Почти все участники исследования были мужчинами.
Люди с прогрессирующими заболеваниями печени, как правило, были старше среднего возраста группы (50 против 46 лет) и чаще имели диагнозы ВГВ (10% против 5%), ВГС (59% против 30%) и связанные с алкоголем заболевания (47% против 29%). У них также отмечалась более высокая вероятность наличия нагрузки ВИЧ от 500 копий/мл (63% против 56%) и сниженный уровень CD4+ (менее 200 клеток/мм3) (39% против 26%).
За все время наблюдения у 278 человек был диагностирован рак печени. В этой группе ГЦК был диагностирован у 43% ЛЖВ, не имеющих прогрессирующего фиброза или цирроза печени. Этот показатель оказался намного выше того, что был характерен для выборки из 13% людей без ВИЧ, у которых ГЦК развился при тех же условиях.
Как и ожидалось, коинфекция ВГВ или ВГС была связана с более высокой вероятностью развития рака печени при любом уровне фиброза. Люди с ВГС были более чем в шесть раз более склонны к развитию ГЦК независимо от статуса фиброза. Среди пациентов с прогрессирующим фиброзом или циррозом печени у людей с ВГВ вероятность развития ГЦК была более чем в два раза выше, в то время как среди лиц без прогрессирующего фиброза ВГВ был связан почти с пятикратным повышением риска.
У людей с прогрессирующим фиброзом или циррозом печени нагрузка ВИЧ и количество клеток CD4+ не оказали существенного влияния на риск развития рака печени. Но среди лиц без обширного фиброза более высокая вирусная нагрузка была связана с повышением риска ГЦК на 24%, а наличие РНК ВИЧ> 500 копий / мл в течение года или более было связано с ростом заболеваемости на 57%. Кроме того, у пациентов с количеством CD4+ менее 200 клеток / мм3 риск ГЦК повышался на 58% и 78% в двух разных моделях.
Полученные результаты, считают исследователи, показывают, что факторы риска развития ГЦК у ВИЧ-позитивных людей различаются в зависимости от исходного фиброза. В то время как ВГВ и ВГС повышали риск ГЦК в обеих группах FIB-4, в группах без прогрессирующего фиброза или цирроза печени также был важен уровень виремии ВИЧ и низкое количество CD4+.
Читайте также:


