Вич арвт литература передача

В этой статье мы рассмотрим эффекты антиретровирусной терапии, официальные рекомендации по ее применению и список препаратов для антиретровирусной терапии.
Специалисты ввели антиретровирусную терапию в 1996 году в связи с низким уровнем успеха среди тех, кто принимал только одно лекарство от ВИЧ за раз.
Начало антиретровирусного лечения тремя препаратами стало поворотным моментом в истории лечения ВИЧ. Новый дизайн лечения превратил то, что раньше было диагнозом с очень плохим прогнозом, в управляемое состояние.
Антиретровирусная терапия уменьшает количество вирусных клеток, присутствующих в организме и как следствие организм способен самостоятельно востановить должный уровень клеток иммунной системы.
Антиретровирусная терапия воздействует на ВИЧ следующим образом:
- останавливает его размножение в крови;
- снижает вирусную нагрузку, то есть количество копий ВИЧ в крови;
- увеличивает (в следствии подавления вируса) количество клеток CD4, которые являются иммунными клетками, на которые нацеливается ВИЧ, для улучшения функции иммунной системы;
- замедляет и предотвращает развитие поздней стадии ВИЧ или СПИД;
- предотвращает передачу ВИЧ другим;
- уменьшает тяжесть осложнений и увеличивает выживаемость при ВИЧ-инфекции;
- снижает количество вирусов в крови.
При назначении антиретровирусной терапии медработники обычно используют режим из трех или более препаратов для наилучших шансов снижения количества ВИЧ в организме.
Однако человек живущий с ВИЧ может обсудить со своим врачом возможность назначения комбинированных препаратов (в 1 таблетке, содержится несколько лекарств).
Согласно данным ВОЗ антиретровирусная терапия может снизить вирусную нагрузку до такой степени, что ее невозможно обнаружить. Это означает, что человек больше не может передавать вирус другому человеку даже через секс без презерватива.
Эта концепция называется неопределяемый = непередаваемый или Н = Н.
ВОЗ рекомендует людям, живущим с ВИЧ, начинать прием антиретровирусных препаратов независимо от состояния их здоровья или от того, как долго у них ВИЧ.
Когда человек с ВИЧ использует антиретровирусную терапию в соответствии с указаниями своего лечащего врача, он может обеспечить себе обычную полноценную, здоровую жизнь.
Существует семь классов лекарств от ВИЧ, которые включают в себя около 30 различных лекарств:
- ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ)
- нуклеозидные ингибиторы обратной транскриптазы (НИОТ)
- ингибиторы прикрепления
- ингибиторы протеазы (ИП)
- Антагонисты CCR5 (АР)
- ингибиторы интегразы (ИИ)
- ингибиторы слияния
Начальные схемы лечения обычно включают два НИОТ в сочетании с третьим активным антиретровирусным препаратом, который может относиться к классу ННИОТ, ИП или ИИ. Иногда они могут включать усилитель, например cobicistat или ритонавир.
Схема начала антиретровирусной терапии для взрослых и подростков с ВИЧ обычно одна из следующих:
- тенофовир / ламивудин / фосампренавир + ритонавир
- тенофовир / ламивудин / эфавиренз
- биктегравир / тенофовир алафенамид / эмтрицитабин или ламивудин
- долутегравир / тенофовир / эмтрицитабин или ламивудин
- ралтегравир / тенофовир / эмтрицитабин или ламивудин
- абакавир / долутегравир / ламивудин , не подходит для людей с генетической чувствительностью к абакавиру
Как только медицинский работник находит эффективный режим, проходит около 3–6 месяцев, прежде чем вирусная нагрузка достигает неопределяемого уровня. Однако ВИЧ полностью не исчезнет из организма, так вирус останется в определенных тканях организма. Однако уровни концентрации вируса будут существенно ниже чем до начала АРВТ.
Чтобы антиретровирусная терапия была эффективной, человек должен принимать лекарства именно так, как это предписывает врач. Избегайте пропущенных доз или прекращения приема лекарств в течение любого периода времени. Соблюдение режима предотвратит размножение ВИЧ в крови и негативное влияние на иммунную систему.
Обсуждая наиболее подходящий режим лечения, поговорите с врачом о любых возможных трудностях с приемом лекарств, таких как образ жизни, особенности графика работы, наличие хронических заболеваний.
При выборе режима антиретровирусной терапии медицинские работники примут во внимание следующее:
- другие состояния здоровья и наличие хронических заболеваний
- беременность
- возможные побочные эффекты лекарств от ВИЧ
- возможные взаимодействия между лекарствами от ВИЧ и другими лекарствами, которые принимает человек
- доступность и наличие лекарств
- способность человека соблюдать режим приема лекарств
Антиретровирусная терапия это метод лечения ВИЧ, при котором используется комбинация двух или более антиретровирусных препаратов. Антиретровирусная терапия произвела революцию в лечении ВИЧ после её введения в 1996 году.
Антиретровирусная терапия — это эффективное лечение ВИЧ. Это не излечивает ВИЧ полностью, но это может уменьшить вирусную нагрузку до неопределяемого уровня. Это означает, что вирус не передается половым путем, и иммунная система человека может восстановиться самостоятельно.
Обычно вирусная нагрузка достигает неопределяемых уровней примерно через 3–6 месяцев от начала лечения.
Важна строгая приверженность режиму антиретровирусной терапии, поскольку это предотвратит размножение ВИЧ в крови и тканях и повреждение иммунной системы.
Пожалуйста поддержите наш проект, чтобы мы могли публиковать еще больше интересных статей. Подпишитесь на ежемесячное пожертвование:
Публичная оферта о заключении договора пожертвования
Автономная некоммерческая организация "Социальный проект "Чтобы Жить", в лице #LEGAL_FACE_RP#,
предлагает гражданам сделать пожертвование на ниже приведенных условиях:
1. Общие положения
1.1. В соответствии с п. 2 ст. 437 Гражданского кодекса Российской Федерации данное предложение является публичной офертой (далее – Оферта).
1.4. Получатель пожертвования вправе отменить Оферту в любое время путем удаления ее со страницы своего сайта в Интернете.
1.5. Недействительность одного или нескольких условий Оферты не влечет недействительность всех остальных условий Оферты.
2. Существенные условия договора пожертвования:
2.1. Пожертвование используется на содержание и ведение уставной деятельности Получателя пожертвования.
2.2. Сумма пожертвования определяется Жертвователем.
3. Порядок заключения договора пожертвования:
3.1. В соответствии с п. 3 ст. 434 Гражданского кодекса Российской Федерации договор пожертвования заключается в письменной форме путем акцепта Оферты Жертвователем.
3.3. Совершение Жертвователем любого из действий, предусмотренных п. 3.2. Оферты, считается акцептом Оферты в соответствии с п. 3 ст. 438 Гражданского кодекса Российской Федерации.
3.4. Датой акцепта Оферты – датой заключения договора пожертвования является дата поступления пожертвования в виде денежных средств от Жертвователя на расчетный счет Получателя пожертвования.
4. Заключительные положения:
4.1. Совершая действия, предусмотренные настоящей Офертой, Жертвователь подтверждает, что ознакомлен с условиями Оферты, целями деятельности Получателя пожертвования, осознает значение своих действий и имеет полное право на их совершение, полностью и безоговорочно принимает условия настоящей Оферты.
4.2. Настоящая Оферта регулируется и толкуется в соответствии с действующим российском законодательством.
5. Подпись и реквизиты Получателя пожертвования
Автономная некоммерческая организация "Социальный проект "Чтобы Жить"
Адрес места нахождения: 620026, Свердловская область, г. Екатеринбург, ул. Сони Морозовой, 175а, 93
Номер банковского счёта: 40703810210050000615
Банк: Ф ТОЧКА БАНК КИВИ БАНК (АО)
БИК банка: 044525797
Номер корреспондентского счёта банка: 30101810445250000797
Дернова Надежда Владимировна
Согласие на обработку персональных данных
Пользователь дает согласие на обработку своих персональных данных, как без использования средств автоматизации, так и с их использованием.
Согласие дается на обработку следующих персональных данных (не являющимися специальными или биометрическими):
• фамилия, имя, отчество;
• адрес(а) электронной почты;
• иные данные, предоставляемые Пользователем.
Персональные данные пользователя не являются общедоступными.
3. В ходе обработки с персональными данными будут совершены следующие действия с персональными данными: сбор, запись, систематизация, накопление, хранение, уточнение (обновление, изменение), извлечение, использование, передача (распространение, предоставление, доступ), обезличивание, блокирование, удаление, уничтожение.
4. Передача персональных данных, скрытых для общего просмотра, третьим лицам не осуществляется, за исключением случаев, предусмотренных законодательством Российской Федерации.
5. Пользователь подтверждает, что указанные им персональные данные принадлежат лично ему.
9. Настоящее Согласие является бессрочным, и действует все время до момента прекращения обработки персональных данных, указанных в п.7 и п.8 данного Согласия.
Вирусы могут размножаться только внутри клетки-хозяина, перестраивая ее работу так, что клетка начинает производить новые вирусные частицы. Это серьезно нарушает работу самой клетки и в большинстве случаев ведет к ее гибели. Процесс проникновения и размножения вируса в ней сложный и содержит много стадий, а значит, специальные лекарства могут тормозить его на различных этапах.
В случае с ВИЧ это выглядит так.
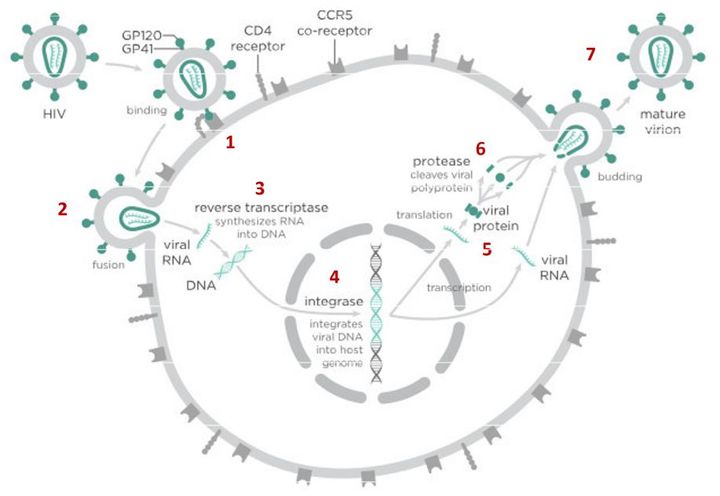

После того как вирусная частица приклеилась к рецепторам CD4 и CCR5/CXCR4 и закрепилась на поверхности клетки, другой специальный белок вируса gp41 соединяет оболочку вируса с мембраной клетки-мишени и помогает вирусу проникнуть внутрь клетки (цифра 2 на схеме). На этом этапе остановить вирус может другая группа препаратов — ингибиторы слияния, например, энфувиртид. Препарат связывается с вирусным белком gp41 и нарушает его работу.
На этом этапе размножение вируса блокирует очень большое количество препаратов из двух классов — нуклеозидные ингибиторы обратной транскриптазы (НИОТ — ламивудин, абакавир, тенофовир) и ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ — эфавиренз, рилпивирин). Принцип действия у веществ из обеих групп похожий: молекула лекарства связывается с обратной транскриптазой вируса, нарушает ее работу и так блокирует перенос генов вируса из РНК в ДНК. Это не позволяет генам вируса встроиться в ДНК клетки-хозяина и начать производство новых вирусных частиц.
На следующем этапе инфицирования (цифра 4 на схеме) готовая вирусная ДНК проникает в ядро и встраивается в ДНК клетки-хозяина с помощью специального вирусного фермента — интегразы. Работу этого фермента блокируют ингибиторы интегразы, например, долутегравир, не позволяя ДНК вируса встроиться в наши гены.
После того как вирусная ДНК встраивается в ДНК клетки-хозяина, клетка получает неправильную программу и начинает производить вирусные белки и РНК, необходимые для сборки новых частиц вируса (цифра 5 на схеме), используя для этого структуры, которые в норме производят собственные белки клетки. Такая перенастройка производства белка сильно нарушает работу клетки и через некоторое время вызывает ее гибель. Лекарств, которые бы влияли на этот этап размножения вируса, нет, так как здесь вирус использует собственные ферментные системы клетки-хозяина и блокирование их работы какими-то веществами навредит здоровым клеткам.

После синтеза вирусных белков клеткой-хозяином в работу вступает еще один фермент вируса — протеаза (цифра 6 на схеме). Дело в том, что белки ВИЧ синтезируются в виде длинных цепочек белков-предшественников, но они неактивные. Протеаза разрезает эти цепочки на более короткие фрагменты, которые становятся активными белками вируса: из одних собирается вирусная оболочка, другие выполняют функции ферментов (обратная транскриптаза, интеграза, протеаза, о которых мы говорили выше). Класс лекарств, нарушающих работу вирусной протеазы, включает большое количество препаратов от достаточно старого лопинавира до современного дарунавира. Основной недостаток препаратов этого класса — высокая степень перекрестной устойчивости: если вирус приобретает устойчивость к одному препарату, скорее всего, на него не подействует ни один другой препарат из этого класса.
На последнем этапе (цифра 7 на схеме) вирусные частицы собираются из готовых компонентов (синтезированных клеткой вирусных белков и РНК), как конструктор, и покидают клетку-хозяина. Лекарств, которые бы тормозили эти процессы, пока не существует.
ВИЧ имеет высокую склонность к мутациям, что позволяет ему быстро приобретать устойчивость к лекарствам. Мутации изменяют форму молекул ферментов вируса. Если при этом форма изменится существенно, то фермент не сможет нормально работать и такой вирус размножаться перестанет — это вредная для вируса мутация. Однако в некоторых случаях — при полезных мутациях — форма молекулы фермента меняется не сильно, а так, что сам фермент продолжает нормально работать, но молекула лекарства уже не может с ним связаться.
Поэтому для эффективного подавления размножения ВИЧ обычно назначают три разных препарата из разных групп, влияющих на разные ферменты вируса, блокируя его воспроизводство на разных этапах. Исключением является группа ингибиторов обратной транскриптазы (НИОТ и ННИОТ) — эти лекарства связываются с разными участками молекулы вирусного фермента, поэтому могут назначаться вместе, несмотря на то, что относятся к одной группе. В условиях такой терапии вирусу очень трудно выработать устойчивость, потому что одновременно должно произойти несколько полезных мутаций в разных генах вируса, а это бывает крайне редко.
Есть несколько перспективных технологий, например, CRISPR/Cas9, которые могут позволить полностью удалить вирусную ДНК из организма человека, но пока ни одна из них не прошла все необходимые исследования для подтверждения эффективности и безопасности. Исследования продолжаются.
Инфекц. бол.: новости, мнения, обучение. 2016. № 3. С. 113-117.
С появлением антиретровирусной терапии (АРВТ) ВИЧ – инфекция перешла в разряд терапевтически контролируемых заболеваний [1]. Несмотря на все успехи в данной области, в настоящий момент распространение ВИЧ – инфекции приобрело характер широкомасштабной эпидемии. Согласно данным UNAIDS , в мире зарегистрировано 36,9 (34,3 – 41,4) млн ВИЧ – инфицированных человек, из них 2 млн инфицировались в 2014 г. [2]. В настоящее время на территории России отмечается вторая волна подъема заболеваемости ВИЧ – инфекцией. Общее число россиян, инфицированных ВИЧ, на 31 декабря 2014 г., составило 907 607 человек. Из года в год регистрируется увеличение количества новых случаев ВИЧ – инфекции, из них около половины ассоциированы с половым путем передачи. Таким образом, наблюдается ухудшение эпидемической ситуации по ВИЧ – инфекции: сохраняется высокий уровень заболеваемости, увеличивается общее число и число смертей ВИЧ – инфицированных, активизируется выход эпидемии из уязвимых групп населения в общую популяцию [3].
Распространение ВИЧ – инфекции оказывает многофакторное деструктивное воздействие на все субъекты экономики: ухудшение демографических показателей, снижение трудоспособности, рост государственных расходов на здравоохранение и социальное обеспечение [4].
Основные цели АРВТ – увеличение продолжительности и сохранение качества жизни ВИЧ – инфицированных. Анти ретровирусные препараты подавляют вирусную репликацию, благодаря чему увеличивается количество лимфоцитов CD 4. Вследствие уменьшения РНК ВИЧ достигается еще одна цель терапии – снижение контагиозности пациента, что приводит к снижению риска передачи ВИЧ – инфекции. Известно, что на гетеросексуальные контакты как фактор риска заражения ВИЧ приходится около половины всех случаев заражения. Вероятно, раннее начало АРВТ может существенно повлиять на распространение эпидемии ВИЧ – инфекции.
Антиретровирусная терапия как профилактика заражения ВИ Ч
Термин “лечение как профилактика” подразумевает под собой назначение АРВТ вслед за постановкой диагноза “ВИЧ – инфекция” (“ test and treat “) независимо от количества CD4 – лимфоцитов. В 2000 г. Quinn и соавт. опубликовали данные о том, что вероятность заражения ВИЧ – отрицательных партнеров напрямую зависит от уровня вирусной нагрузки в крови ВИЧ – положительных партнеров [5]. Вероятность передачи ВИЧ также связана с уровнем вирусной нагрузки в секретах урогенитального тракта [6]. Антиретровирусные препараты подавляют репликацию РНК ВИЧ в крови и в генитальном секрете [7].
Исследование HPTN 052 продемонстрировало, что передача ВИЧ в дискордантных парах снижается на 96%, если ВИЧ – инфицированный партнер принимает АРВТ [8]. Кроме того, в этом исследовании было продемонстрировано значительное преимущество ранней АРВТ перед отсроченной. Из 28 случаев заражения ВИЧ – отрицательного партнера 27 случаев приходятся на группу, где АРВТ для ВИЧ – положительного партнера была отсрочена по сравнению с группой, где ВИЧ – положительный партнер получал раннюю АРВТ [9].
Метаанализ 9 обсервационных и одного рандомизированного исследований, проведенный в 2014 г., также подтвердил эффективность антиретровирусной терапии как метода профилактики заражения ВИЧ – инфекцией в дискордантных парах [10].
Ранняя антиретровирусная терапия как профилактика вторичных заболевани й
Ранняя АРВТ снижает частоту развития оппортунистических инфекций и смертность среди ВИЧ – инфицированных [11, 12]. В III фазе исследования HPTN 052, о котором упоминалось выше, сравнивали количество неблагоприятных исходов (развитие СПИДа, туберкулеза, не СПИД – индикаторных заболеваний) у пациентов с ранним назначением АРВТ (сразу после включения в исследование) и отсроченной АРВТ (при снижении CD4 – лимфоцитов – индикаторными заболеваниями [13].
Убедительные данные в пользу ранней АРВТ были получены в 2015 г. в рандомизированном исследовании START ( Strategic Timing of AntiRetroviral Treatment ) [14], в котором приняли участие 4685 пациентов с уровнем CD4 – лимфоцитов >500 кл/мкл. Они были разделены на 2 группы: группа с началом АРВТ сразу после включения в исследование и группа, где АРВТ была отложена до снижения количества СD4 – лимфоцитов до 350 кл/мкл. По итогам контролируемого исследования было установлено, что риск развития серьезных заболеваний (не связанных со СПИДом и, особенно, СПИД – ассоциированных) на 53% ниже в группе с ранней АРВТ, чем в группе, где терапия была отсрочена.
Результаты исследования TEMPRANO ANRS 12136, опубликованные в июле 2015 г. в “ The New England Journal of Medicine “, подтверждают преимущество ранней АРВТ в сочетании с изониазидом как метода профилактики туберкулеза и других серьезных заболеваний по сравнению с отсроченным лечением [15].
Ранняя антиретровирусная терапия как профилактика иммунологической неэффективности лечени я
Улучшение показателей выживаемости среди ВИЧ – инфицированных пациентов, получающих АРВТ, главным образом обусловлено снижением вирусной нагрузки РНК ВИЧ, что приводит к увеличению численности CD4 – лимфоцитов. Однако некоторые пациенты могут давать дискордантный ответ на терапию, когда на фоне исчезновения вируса из крови отсутствует подъем уровня CD4 – лимфоцитов. Несмотря на длительное лечение у пациентов сохраняется иммунодефицитное состояние. Стабильно низкие показатели количества CD4 – лимфоцитов связаны с повышенным риском наступления стадии СПИДа. Кроме того, в этой группе пациентов отмечали небольшое увеличение показателей смертности, не связанной со СПИД – индикаторными заболеваниями [16]. Низкий уровень CD4 – лимфоцитов до начала АРВТ является, пожалуй, самым неблагоприятным фактором недостаточного восстановления CD4 – лимфоцитов на фоне АРВТ [17]. Чем ниже показатели количества CD 4 – лимфоцитов перед началом терапии, тем меньше шансов, что они когда – нибудь вернутся к норме [18]. Раннее назначение АРВТ позволит сохранить восстановительный потенциал иммунной системы, снизить риск прогрессирования заболевания до стадии СПИД и связанную с ней смертность.
Социально – экономическая выгода от ранней антиретровирусной терапи и
Потери совокупного человеческого капитала в результате смерти от ВИЧ – инфекции выше, чем от любой другой причины, включая дорожно – транспортные происшествия, самоубийства, инсульт и инфаркт [4].
Национальный исследовательский университет “Высшая школа экономики” провел расчет социально – экономических потерь Российской Федерации в результате прямых и косвенных издержек, связанных с ВИЧ – инфекцией. Социально – экономические потери составили 92 328 млн руб.
Кроме того, НИУ ВШЭ оценивала общее число потенциально предотвращенных случаев заражения в результате применения ранней АРВТ. Согласно расчетной модели, если все ВИЧ – инфицированные взрослые, исключая больных в терминальной стадии, получат лечение сразу после установления диагноза ВИЧ – инфекции, независимо от уровня CD4 – лимфоцитов, в результате ранней АРВТ можно будет предотвратить 34 216 новых случаев заражения, преимущественно за счет профилактики в дискордантных парах [4].
Слабые стороны ранней антиретровирусной терапи и
Теоретическую пользу от ранней АРВТ необходимо соотносить с возможными рисками, возникающими на фоне длительного приема препаратов: отдаленные токсические эффекты и развитие резистентности ВИЧ к антиретровирусным препаратам. Кроме того, необходимость пожизненного приема препаратов и строжайшего соблюдения режима лечения (высокая приверженность терапии) – важные условия эффективной АРВТ. И наконец для реализации стратегии “ test and treat ” лечение должно быть доступным.
Для разрешения вышеперечисленных проблем необходимо создавать доступные препараты с высоким профилем резистентности, отвечающие критериям безопасности и удобства приема, что в свою очередь положительно скажется на приверженности пациентов к лечению.
Современные рекомендаци и
Большинство протоколов, посвященных лечению ВИЧ – инфекции, в качестве обоснования назначения АРВТ используют показатель количества CD4 – лимфоцитов. С учетом имеющихся данных необходимо сдвигать сроки начала лечения в сторону назначения АРВТ при более высоких цифрах CD4 – лимфоцитов. В таблице представлены современные рекомендации по началу АРВТ [19 – 22].
В условиях продолжающейся эпидемии ВИЧ – инфекции требуются эффективные меры, направленные на профилактику заражения ВИЧ. АРВТ приводит к значительному уменьшению риска передачи ВИЧ половым путем. Кроме того, концепция “лечение как профилактика” располагает убедительными доказательствами преимущества ранней АРВТ для сохранения здоровья и уменьшения смертности среди ВИЧ – инфицированных. Улучшение эпидемической обстановки по ВИЧ – инфекции снизит социально – экономический ущерб, наносимый этим заболеванием.
Сведения об авторах
Альфия Фаридовна Олейник
Должность: аспирант кафедры инфекционных болезней
Место работы: ФГБОУ ВО “Казанский государственный медицинский университет” Минздрава России ГАУЗ “Республиканский центр по профилактике и борьбе со СПИД и инфекционными заболеваниями” Минздрава Республики Татарстан, Казань
Вильдан Хайруллаевич Фазылов
C тепень/зв.: доктор медицинских наук, профессор
Должность: заведующий кафедрой инфекционных болезней
Место работы: ФГБОУ ВО “Казанский государственный медицинский университет” Минздрава России
Полный текст:
к.м.н, с.н.с. и главный ученый секретарь Научно-исследовательского института профилактической медицины Таджикистана
734025, Республика Таджикистан, Душанбе, ул. Шевченко, 61
111123, Москва, ул. Новогиреевская, 3А
119991, Москва, ул. Большая Пироговская, 2, стр. 4
4. Maheu-Giroux M., Vesga J.F., Diabaté S., Alary M., Baral S., Diouf D., Abo K., Boily M.C. Population-level impact of an accelerated HIV response plan to reach the UNAIDS 90–90–90 target in Côte d’Ivoire: Insights from mathematical modeling. PLoS Med., 2017, Vol. 14 (6), pp. e1002321. DOI: 10.1371/journal.pmed.1002321.
5. Mathers B.M., Cooper D.A. Integrating HIV prevention into practice. JAMA, 2014, Vol. 312 (4), pp. 349–350. DOI: 10.1001/jama.2014.8606.
6. Granich R., Gupta S., Hersh B., Williams B., Montaner J., Young B., Zuniga J.M. Trends in AIDS Deaths, New Infections and ART Coverage in the Top 30 Countries with the Highest AIDS Mortality Burden; 1990–2013. PLoS One, 2015, Vol. 10 (7), pp. e0131353. DOI: 10.1371/journal.pone.0131353.
7. Global update on the health sector response to HIV. Geneva: WHO, July 2014, рр. 16.
8. Global AIDS Update UNAIDS. New York: United Nations, 2016, 16 p.
9. Cohen M.S., Smith M.K., Muessig K.E., Hallett T.B., Powers K.A., Kashuba A.D. Antiretroviral treatment of HIV-1 prevents transmission of HIV-1: where do we go from here? Lancet, 2013, Vol. 382 (9903), pp. 1515–1524. DOI: 10.1016/S0140-6736(13)61998-4.
10. Wilson D.P. HIV treatment as prevention: natural experiments highlight limits of antiretroviral treatment as HIV prevention. PLoS Med., 2012, Vol. 9 (7), pp. e1001231. DOI: 10.1371/journal.pmed.1001231.
11. Plazy M., Farouki K.E., Iwuji C., Okesola N., Orne-Gliemann J., Larmarange J., Lert F., Newell M.L., Dabis F., Dray-Spira R.; Anrs 12249 Tasp Study Group. Access to HIV care in the context of universal test and treat: challenges within the ANRS 12249 TasP cluster- randomized trial in rural South Africa. J. Int. AIDS Soc., 2016, Vol. 19 (1), pp. 20 913. DOI: 10.7448/IAS.19.1.20913.
12. Wilton J. & Broeckaert L. Treatment as prevention: do the individual prevention benefits translate of the population level? Prevention in Focus. PLoS Med., 2012, Vol. 9 (7), pp. e1001231. DOI: 10.1371/journal.pmed.1001231.
13. Consolidated guidelines on the use of antiretroviral drugs for treating and preventing HIV infection. Recommendations for a public health approach ARV2013. World Health Organization, 30 June 2013, 272 р.
14. Severe P., Juste M.A., Ambroise A., Eliacin L., Marchand C., Apollon S., Edwards A., Bang H., Nicotera J., Godfrey C., Gulick R.M., Johnson W.D. Jr., Pape J.W., Fitzgerald D.W. Early versus standard antiretroviral therapy for HIV-infected adults in Haiti. N. Engl. J. Med., 2010, Vol. 363 (3), pp. 257–265. DOI: 10.1056/NEJMoa0910370.
15. Emery S., Neuhaus J.A., Phillips A.N., Babiker A., Cohen C.J., Gatell J.M., Girard P.M., Grund B., Law M., Losso M.H., Palfreeman A., Wood R. Strategies for Management of Antiretroviral Therapy (SMART) Study Group. Major clinical outcomes in antiretroviral therapy (ART)-naive participants and in those not receiving ART at baseline in the SMART study. J. Infect. Dis., 2008, Vol. 197 (8), pp. 1133–1144. DOI: 10.1086/586713.
16. Kitahata M.M., Gange S.J., Abraham A.G., Merriman B., Saag M.S., Justice A.C., Hogg R.S., Deeks S.G., Eron J.J., Brooks J.T., Rourke S.B., Gill M.J., Bosch R.J., Martin J.N., Klein M.B., Jacobson L.P., Rodriguez B., Sterling T.R., Kirk G.D., Napravnik S., Rachlis A.R., Calzavara L.M., Horberg M.A., Silverberg M.J., Gebo K.A., Goedert J.J., Benson C.A., Collier A.C., Van Rompaey S.E., Crane H.M., McKaig R.G., Lau B., Freeman A.M., Moore R.D.; NA-ACCORD Investigators. Effect of early versus deferred antiretroviral therapy for HIV on survival. N. Engl. J. Med., 2009, Vol. 360 (18), pp. 1815–1826. DOI: 10.1056/NEJMoa0807252.
17. Siedner M.J., Musinguzi N., Tsai A.C., Muzoora C., Kembabazi A., Weiser S.D., Bennett J., Hunt P.W., Martin J.N., Haberer J.E., Bangsberg D.R. Treatment as long-term prevention: sustained reduction in HIV sexual transmission risk with use of antiretroviral therapy in rural Uganda. AIDS, 2014, Vol. 28 (2), pp. 267–271. DOI: 10.1097/QAD.0000000000000136.
18. Melo M.G., Santos B.R., De Cassia Lira R., Varella I.S., Turella M.L., Rocha T.M., Nielsen-Saines K. Sexual transmission of HIV-1 among serodiscordant couples in Porto Alegre, southern Brazil. Sex. Transm. Dis., 2008, Vol. 35 (11), pp. 912–915. DOI: 10.1097/OLQ.0b013e31817e2491.
19. Loutfy M.R., Wu W., Letchumanan M., Bondy L., Antoniou T., Margolese S., Zhang Y., Rueda S., McGee F., Peck R., Binder L., Allard P., Rourke S.B., Rochon P.A. Systematic review of HIV transmission between heterosexual serodiscordant couples where the HIV-positive partner is fully suppressed on antiretroviral therapy. PLoS One, 2013, Vol. 8 (2), pp. e55747. DOI: 10.1371/journal.pone.0055747.
20. Castel A.D., Befus M., Willis S., Griffin A., West T., Hader S., Greenberg A.E. Use of the community viral load as a population-based biomarker of HIV burden. AIDS, 2012, Vol. 26 (3), pp. 345–353. DOI: 10.1097/QAD.0b013e32834de5fe.
21. Sorensen S.W., Sansom S.L., Brooks J.T., Marks G., Begier E.M., Buchacz K., Dinenno E.A., Mermin J.H., Kilmarx P.H. A mathematical model of comprehensive test-and-treat services and HIV incidence among men who have sex with men in the United States. PLoS One, 2012, Vol. 7 (2), pp. e29098. DOI: 10.1371/journal.pone.0029098.
22. Birrell P.J., Gill O.N., Delpech V.C., Brown A.E., Desai S., Chadborn T.R., Rice B.D., De Angelis D. HIV incidence in men who have sex with men in England and Wales 2001–2010: a nationwide population study. Lancet Infect. Dis., 2013, Vol. 13 (4), pp. 313–318. DOI: 10.1016/S1473-3099(12)70341-9.
23. Wilson D.P. HIV treatment as prevention: natural experiments highlight limits of antiretroviral treatment as HIV prevention. PLoS Med., 2012, Vol. 9 (7), pp. e1001231. DOI: 10.1371/journal.pmed.1001231.
24. Van Griensven F., Guadamuz T.E., de Lind van Wijngaarden J.W., Phanuphak N., Solomon S.S., Lo Y.R. Challenges and emerging opportunities for the HIV prevention, treatment and care cascade in men who have sex with men in Asia Pacific. Sex. Transm. Infect., 2017, Vol. 93 (5), pp. 356–362. DOI: 10.1136/sextrans-2016–052669.
25. Abu-Raddad L.J., Awad S.F. How does population viral load vary with the evolution of a large HIV epidemic in Sub-Saharan Africa? AIDS, 2014, Vol. 28 (6), pp. 927–929. DOI: 10.1097/QAD.0000000000000211.
26. Novitsky V., Essex M. Using HIV viral load to guide treatment-for-prevention interventions. Curr. Opin. HIV AIDS, 2012, Vol. 7 (2), pp. 117–124. DOI: 10.1097/COH.0b013e32834fe8ff.
27. Eyawo O., de Walque D., Ford N., Gakii G., Lester R.T., Mills E.J. HIV status in discordant couples in sub-Saharan Africa: a systematic review and meta-analysis. Lancet Infect. Dis., 2010, Vol. 10 (11), pp. 770–777. DOI: 10.1016/S1473-3099(10)70189-4.
28. Vernazza P., Bernard E.J. HIV is not transmitted under fully suppressive therapy: The Swiss Statement — eight years later. Swiss Med. Wkly, 2016, 146: w14246. DOI: 10.4414/smw.2016.14246.
29. Quinn T.C., Wawer M.J., Sewankambo N., Serwadda D., Li C., Wabwire-Mangen F., Meehan M.O., Lutalo T., Gray R.H. Viral load and heterosexual transmission of human immunodeficiency virus type 1. Rakai Project Study Group. N. Engl. J. Med., 2000, Vol. 342 (13), pp. 921–929.
30. Cohen M.S., Chen Y.Q., McCauley M., Gamble T., Hosseinipour M.C., Kumarasamy N., Hakim J.G., Kumwenda J., Grinsztejn B., Pilotto J.H., Godbole S.V., Mehendale S., Chariyalertsak S., Santos B.R., Mayer K.H., Hoffman I.F., Eshleman S.H., Piwowar-Manning E., Wang L., Makhema J., Mills L.A., de Bruyn G., Sanne I., Eron J., Gallant J., Havlir D., Swindells S., Ribaudo H., Elharrar V., Burns D., Taha T.E., Nielsen-Saines K., Celentano D., Essex M., Fleming T.R. HPTN 052 Study Team. Prevention of HIV-1 infection with early antiretroviral therapy. N. Engl. J. Med., 2011, Vol. 365 (6), pp. 493–505. DOI: 10.1056/NEJMoa1105243.
31. Dieffenbach C.W. Preventing HIV transmission through antiretroviral treatment-mediated virologic suppression: aspects of an emerging scientific agenda. Curr. Opin. HIV AIDS, 2012, Vol. 7 (2):106–110. DOI: 10.1097/COH.0b013e32834f3f13.
32. Donnell D., Baeten J.M., Kiarie J., Thomas K.K., Stevens W., Cohen C.R., McIntyre J., Lingappa J.R., Celum C. Partners in Prevention HSV/HIV Transmission Study Team Heterosexual HIV-1 transmission after initiation of antiretroviral therapy: a prospective cohort analysis. Lancet, 2010, Vol. 375 (9731), pp. 2092–2098. DOI: 10.1016/S0140-6736(10)60705-2.
33. Jia Z., Mao Y., Zhang F., Ruan Y., Ma Y., Li J., Guo W., Liu E., Dou Z., Zhao Y., Wang L., Li Q., Xie P., Tang H., Han J., Jin X., Xu J., Xiong R., Zhao D., Li P., Wang X., Wang L., Qing Q., Ding Z., Chen R.Y., Liu Z., Shao Y. Antiretroviral therapy to prevent HIV transmission in serodiscordant couples in China (2003-11): a national observational cohort study. Lancet, 2013, Vol. 382 (9899), pp. 1195–1203. DOI: 10.1016/S0140-6736(12)61898-4.
34. Anglemyer A., Rutherford G.W., Horvath T., Baggaley R.C., Egger M., Siegfried N. Antiretroviral therapy for prevention of HIV transmission in HIV-discordant couples. Cochrane Database Syst. Rev., 2013, Vol. (4), pp. CD009153. DOI: 10.1002/14651858.CD009153.pub3.
35. Das M., Chu P.L., Santos G.M., Scheer S., Vittinghoff E., McFarland W., Colfax G.N. Decreases in community viral load are accompanied by reductions in new HIV infections in San Francisco. PLoS One, 2010, Vol. 5 (6), pp. e11068. DOI: 10.1371/journal.pone.0011068.
36. Montaner J.S., Lima V.D., Barrios R., Yip B., Wood E., Kerr T., Shannon K., Harrigan P.R., Hogg R.S., Daly P., Kendall P. Association of highly active antiretroviral therapy coverage, population viral load, and yearly new HIV diagnoses in British Columbia, Canada: a population-based study. Lancet, 2010, Vol. 376 (9740), pp. 532–539. DOI: 10.1016/S0140-6736(10)60936-1.
37. Nosyk B., Zang X., Min J.E., Krebs E., Lima V.D., Milloy M.J., Shoveller J., Barrios R., Harrigan P.R., Kerr T., Wood E., Montaner J.S.G. Relative effects of antiretroviral therapy and harm reduction initiatives on HIV incidence in British Columbia, Canada, 1996–2013: a modelling study. Lancet HIV, 2017, Vol. 4 (7), pp. e303–e310. DOI: 10.1016/S2352-3018(17)30045-0.
38. Brown A.E., Kall M.M., Smith R.D., Yin Z., Hunter A., Hunter A., Delpech V.C. Auditing national HIV guidelines and policies: The United Kingdom CD4 Surveillance Scheme. Open AIDS J., 2012, Vol. 6, pp. 149–155. DOI: 10.2174/1874613601206010149.
39. Supervie V., Ndawinz J.D., Lodi S., Costagliola D. The undiagnosed HIV epidemic in France and its implications for HIV screening strategies. AIDS, 2014, Vol. 28 (12), pp. 1797–1804. DOI: 10.1097/QAD.0000000000000270.
40. Supervie V., Costagliola D. Time for a revolution in tracking the HIV epidemic. Lancet HIV, 2016, Vol. 3 (8), pp. e337–e339. DOI: 10.1016/S2352-3018(16)30089-3.
41. Law M.G., Woolley I., Templeton D.J., Roth N., Chuah J., Mulhall B., Canavan P., McManus H., Cooper D.A., Petoumenos K. Trends in detectable viral load by calendar year in the Australian HIV observational database; Australian HIV Observational Database (AHOD). J. Int. AIDS Soc., 2011, Vol. 14, pp. 10. DOI: 10.1186/1758-2652-14-10.
42. Phillips A.N., Cambiano V., Nakagawa F., Brown A.E., Lampe F., Rodger A., Miners A., Elford J., Hart G., Johnson A.M., Lundgren J., Delpech V.C. Increased HIV incidence in men who have sex with men despite high levels of ART-induced viral suppression: analysis of an extensively documented epidemic. PLoS One, 2013, Vol. 8 (2), pp. e55312. DOI: 10.1371/journal.pone.0055312.
43. Mooney A.C., Gottert A., Khoza N., Rebombo D., Hove J., Suárez A.J., Twine R., MacPhail C., Treves-Kagan S., Kahn K., Pettifor A. Men’s Perceptions of Treatment as Prevention in South Africa: Implications for Engagement in HIV Care and Treatment. AIDS Educ. Prev., 2017, Vol. 29 (3), pp. 274–287. DOI: 10.1521/aeap.2017.29.3.274.
44. Van Sighem A., Vidondo B., Glass T.R., Bucher H.C., Vernazza P., Gebhardt M., de Wolf F., Derendinger S., Jeannin A., Bezemer D., Fraser C., Low N. Swiss HIV Cohort Study. Resurgence of HIV infection among men who have sex with men in Switzerland: mathematical modelling study. PLoS One, 2012, Vol. 7 (9), pp. e44819.
45. Cowan S.A., Gerstoft J., Haff J., Christiansen A.H., Nielsen J., Obel N. Stable incidence of HIV diagnoses among Danish MSM despite increased engagement in unsafe sex. J. Acquir. Immune Defic. Syndr., 2012, Vol. 61 (1), pp. 106–111. DOI: 10.1097/QAI.0b013e31825af890.
46. Lou J., Blevins M., Ruan Y., Vermund S.H., Tang S., Webb G.F., Shepherd B.E., He X., Lu H., Shao Y., Qian H.Z. Modeling the impact on HIV incidence of combination prevention strategies among men who have sex with men in Beijing, China. PLoS One, 2014, Vol. 9 (3), pp. e90985. DOI: 10.1371/journal.pone.0090985.
47. Lou J., Hu P., Qian H.Z., Ruan Y., Jin Z., Xing H., Shao Y., Vermund S.H. Expanded antiretroviral treatment, sexual networks, and condom use: Treatment as prevention unlikely to succeed without partner reduction among men who have sex with men in China. PLoS One, 2017, Vol. 12 (4), pp. e0171295. DOI: 10.1371/journal.pone.0171295.
48. Hu X., Chen F., Ding F., Lin X., Wang X., He H., Huang W., Yang Q., Zhang H. Coverage of HIV related follow-up intervention and antiretroviral treatment and its correlation among HIV-positive men who have sex with men of 3 cities in China. Zhonghua Yu Fang Yi Xue Za Zhi (Chinese), 2015, Vol. 49 (11), pp. 945–949.
49. Su S., Chen X., Mao L., He J., Wei X., Jing J., Zhang L. Superior Effects of Antiretroviral Treatment among Men Who have Sex with Men Compared to Other HIV At-Risk Populations in a Large Cohort Study in Hunan, China. Int. J. Environ. Res. Public Health, 2016, Vol. 13 (3),
50. pii: E283. DOI: 10.3390/ijerph13030283.
51. Kroon E.D.M.B., Phanuphak N., Shattock A.J., Fletcher J.L.K., Pinyakorn S., Chomchey N., Akapirat S., de Souza M.S., Robb M.L., Kim J.H., van Griensven F., Ananworanich J., Wilson D.P. Acute HIV infection detection and immediate treatment estimated to reduce transmission by 89% among men who have sex with men in Bangkok. J. Int. AIDS Soc., 2017, Vol. 20 (1), pp. 1–9. DOI: 10.7448/IAS.20.1.21708.
52. Milloy M.J., King A., Kerr T., Adams E., Samji H., Guillemi S., Wood E., Montaner J. Improvements in HIV treatment outcomes among indigenous and non-indigenous people who use illicit drugs in a Canadian setting. J. Int. AIDS Soc., 2016, Vol. 19 (1), pp. 20 617. DOI: 10.7448/IAS.19.1.20617.
53. Lake S., Kerr T., Capler R., Shoveller J., Montaner J., Milloy M.J. High-intensity cannabis use and HIV clinical outcomes among HIV-positive people who use illicit drugs in Vancouver, Canada. Int. J. Drug Policy, 2017, Vol. 42, pp. 63–70. DOI: 10.1016/j.drugpo.2017.02.009.
54. Milloy M.J., Wood E., Kerr T., Hogg B., Guillemi S., Harrigan P.R., Montaner J. Increased Prevalence of Controlled Viremia and Decreased Rates of HIV Drug Resistance Among HIV- Positive People Who Use Illicit Drugs During a Community-wide Treatment-as-Prevention Initiative. Clin. Infect. Dis., 2016, Vol. 62 (5), pp. 640–647. DOI: 10.1093/cid/civ929.
55. Покровский В.В., Юрин О.Г., Кравченко А.В., Беляева В.В., Ермак Т.Н., Канестри В.Г., Шахгильдян В.И., Козырина Н.В., Воронин Е.Е., Афонина Л.Ю., Васильева И.А., Зимина В.Н. Национальные рекомендации по диспансерному наблюдению и лечению больных ВИЧ-инфекцией // Эпидемиология и инфекционные болезни. Актуальные вопросы. 2017. № 6, приложение. С. 1–80. [Pokrovskiy V.V., Yurin O.G., Kravchenko A.V., Belyaeva V.V., Ermak T.N., Kanestri V.G., Shahgildyan V.I., Kozyrina N.V., Voronin E.E., Afonina L.Yu., Vasil’eva I.A., Zimina V.N. National recommendations on dispensary surveillance and treatment of patients with HIV. Epidemiology and Infectious Diseases. Topical Issue, 2017, No. 6, Application, pp. 1–80 (In Russ.)].

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Читайте также:


