У кого рак кожи и вич
ВИЧ-инфекция — один из факторов, который во много раз повышает вероятность развития рака. Выяснили, какие именно онкозаболевания чаще всего могут возникать при положительном ВИЧ-статусе, как их вовремя обнаружить, и на какие факторы риска еще нужно обратить внимание людям, живущим с ВИЧ.
Главная мишень вируса — CD4-Т-лимфоциты. Они передают сигнал другим клеткам, которые защищают организм от рака. В результате вмешательства вируса количество CD4-T-лимфоцитов постепенно уменьшается. Критически низкий уровень этих клеток - одна из причин отсутствия согласованной работы между звеньями иммунитета и главный механизм, приводящий к развитию СПИДа.
Иммунитет человека с ВИЧ-инфекцией перестает контролировать процессы избыточного клеточного деления и злокачественной трансформации клеток. Вместе с уменьшением количества CD4-T-лимфоцитов происходит накопление раковых клеток. В результате у человека развиваются несколько видов опухолей, которые называют СПИД-индикаторными: появление такого вида рака с очень большой вероятностью означает наличие у человека СПИДа.
Однако повышается риск появления не только СПИД-индикаторных опухолей, но и тех видов рака, которые развиваются из-за потери иммунного контроля над несколькими онкогенными инфекциями: вирусом герпеса человека 8 типа (ВГЧ-8), вирусом папилломы человека (ВПЧ), вирусами гепатита В и С (ВГВ, ВГС), вирусом Эпштейна-Барр (ВЭБ) и другими.
Все эти состояния развиваются у людей с ВИЧ-инфекцией преимущественно на фоне снижения количества CD4-T-лимфоцитов до уровня менее 200 клеток/мкл (при разбросе в норме от 500 до 1100 клеток), но также могут возникать при нормальном или близком к нормальному уровню CD4-T-лимфоцитов.
Саркома Капоши (СК) — СПИД-индикаторная опухоль, при которой происходит злокачественная трансформация клеток лимфатических и кровеносных сосудов. Риск развития СК у пациентов с ВИЧ-инфекцией увеличивается в несколько сотен раз. Различные белки ВИЧ-1 способны усиливать воспаление и нарушать регуляцию в эндотелиальных клетках. Это приводит к тому, что саркома Капоши может развиться до того, как уровень CD4-T-лимфоцитов упадет ниже 200 клеток/мкл. Еще одно обязательное условие для возникновения СК — наличие в организме вируса герпеса человека 8 типа.
Саркома Капоши развивается в виде папулы, пятна, узелка, бляшки коричневого, розового, красного или темно-красного цвета от нескольких миллиметров до нескольких сантиметров в диаметре. Обычно высыпания концентрируются на ногах, голове, шее, на слизистой оболочке — в области неба, десен, конъюнктивы.
До эры внедрения лекарств от ВИЧ — антиретровирусной терапии (АРТ) 5-летняя выживаемость (с момента диагностики опухоли) пациентов с саркомой Капоши составляла менее 10%. Применение АРТ значительно улучшило ситуацию — сейчас речь идет о 74%, — а также позволило снизить риск развития СК.
Более половины случаев СК (56%) диагностируются сейчас в локальной форме — до того, как опухоль распространится на лимфатические узлы, слизистую ЖКТ, печень, селезенку и другие органы. Прием антиретровирусной терапии помогает значительно замедлить прогрессию болезни и предотвратить распространение СК по всему организму.
К сожалению, обнаружить саркому Капоши до появления симптомов не получится
Однако, человеку с ВИЧ и его амбулаторному врачу-инфекционисту необходимо учитывать несколько факторов риска развития этой опухоли:
- Этническая принадлежность: люди еврейского или средиземноморского происхождения, а также экваториальные африканцы;
- Мужской пол;
- Иммунодефицит: Люди с уровнем CD4-клеток менее 200 кл/мкл, те, кто перенес трансплантацию органов или костного мозга или постоянно принимает глюкокортикостероиды;
- Сексуальная ориентация: мужчины, имеющие секс с мужчинами(МСМ), подвержены более высокому риску развития СК.
К онкологическим заболеваниям, ассоциированным с вирусом папилломы человека, относятся инвазивный рак шейки матки (ИРШМ), сквамозный (чешуйчатый) рак головы/шеи, рак анального канала, вульвы и влагалища. СПИД-индикаторной из них является только ИРШМ.
Распространенность генитальной онкогенной инфекции ВПЧ среди женщин, живущих с ВИЧ, в целом выше, чем у остального населения.
Вирус папилломы человека способен к самопроизвольной элиминации — исчезновению из организма. У ВИЧ-положительных женщин этот процесс занимает больше времени, что увеличивает вероятность появления патологических изменений в шейке матки.
Продолжительный прием АРТ приводит к более низкой распространенности ВПЧ высокого риска и поражений шейки матки и даже предотвращает новые случаи ИРШМ.
Раннее начало антиретровирусной терапии, приверженность лечению обеспечивают снижение вирусной нагрузки — количества вируса в крови. Эти меры очень эффективны в отношении местного иммунитета слизистой оболочки и профилактики ИРШМ.
Скрининг ИРШМ заключается в проведении ПАП-теста и ВПЧ-теста (ПЦР). Женщины с ВИЧ-инфекцией в возрасте от 21 до 29 лет должны пройти ПАП-тест во время первичной диагностики ВИЧ, затем — через 12 месяцев, если анализ не показал патологии. Некоторые эксперты рекомендуют делать следующий ПАП-тест через 6 месяцев после первого. Если результаты трех последовательных мазков без отклонений, повторные тесты следует проводить каждые 3 года. ВПЧ-тест не рекомендуется подключать к ПАП-тесту до 30 лет — высока вероятность положительного результата, при этом оснований для активных действий нет. Лечения ВПЧ не существует, а для развития РШМ требуется, как правило, от 10 лет.
После 30 лет ПАП-тест и ВПЧ-тест проводятся совместно
У пациентов с ВИЧ-инфекцией повышается риск развития:
- гепатоцеллюлярной карциномы (ГЦК), связанной с вирусами гепатита С и В (ВГВ и ВГС) — в три раза;
- рака желудка, ассоциированного с инфекцией H.pylori;
- лимфомы Ходжкина — 8-13 раз. Риск связан с сопутствующей Эпштейн-Барр-инфекцией. Важно, что повсеместное внедрение АРТ не повлияло на показатели заболеваемости лимфомой Ходжкина в популяции людей с ВИЧ.
К факторам риска развития ГЦК у пациентов с ВИЧ относятся: цирроз печени, ожирение, диабет, возраст старше 60 лет, мужской пол.
Скрининг ГЦК проводится с помощью анализа крови на альфа-фетопротеин (АФП), который может продуцироваться раковыми клетками, или инструментальных методик диагностики — УЗИ, КТ, МРТ.
В последние годы всё чаще используется фиброскан для оценки стадии фиброза и близости к циррозу, независимому фактору риска ГЦК.
Предотвратить появление гепатоцеллюлярной карциномы можно с помощью своевременной вакцинации и ревакцинации от вирусного гепатита В и контроля вирусной нагрузки.
Несмотря на появление АРТ, НХЛ остаются актуальной проблемой для людей, длительное время живущих с ВИЧ. Хотя в большом количестве случаев неходжкинские лимфомы являются СПИД-индикаторными, они способны развиваться при нормальном уровне CD4-клеток и являются одной из наиболее частых причин смерти среди ВИЧ-положительных.
Общая выживаемость у пациентов с этим диагнозом низкая: более половины умирают в течение пяти лет от момента постановки диагноза
Отсюда возникают факторы риска развития НХЛ при ВИЧ-инфекции:
- наличие ко-инфекции вирусными гепатитами В, C, H.pylori;
- наличие вирусной нагрузки вируса Эпштейна-Барр или цитомегаловируса;
- наличие аутоиммунных заболеваний до постановки диагноза ВИЧ-инфекция;
- наличие специфических изменений в протеинограмме до или во время ВИЧ-инфекции;
- наличие минимальной вирусной нагрузки ВИЧ, несмотря на АРТ;
- снижение CD4-Т-лимфоцитов.
К скринингу неходжкинских лимфом относятся мониторинг вирусной нагрузки ВЭБ, ВГС, ВГВ и проведение инструментальной диагностики (КТ, МРТ, УЗИ, ФГДС).
С помощью контроля факторов риска и своевременного скрининга можно не только найти опухоль на ранней стадии, но и предотвратить заболевание.
Если рак все же обнаружили, ни в коем случае нельзя прерывать антиретровирусную терапию — она проводится по жизненным показаниям, что означает высокую вероятность неблагоприятного исхода противоопухолевой терапии без сопутствующего противовирусного лечения.
Поражения кожи при ВИЧ/СПИДе и основные диагностические методы.
Заболеваемость болезнями кожи различаются в разных регионах, что объясняется климатом, уровнем санитарно-гигиенических условий, доступностью медицинской помощи и культурными факторами. Наиболее часто встречающиеся в Европейском регионе поражения кожи (в порядке убывания частоты): кандидозный стоматит, себорейный дерматит, ксероз, дерматофития (руброфития, разноцветный лишай, паховая эпидермофития), фолликулит, сифилис (активный или наличие антител), саркома капоши, зуд, остроконечные кондиломы, кандидоз помимо кандидозного стоматита, лекарственная сыпь, герпес половых органов и перианальной области, опоясывающий лишай, гонорея (текущая или в анамнезе), бактериальные инфекции кожи, контагиозный моллюск, бородавки (вирус папилломы человека), герпес лица и полости рта, волосистая лейкоплакия рта, выпадение волос, псориаз, базальноклеточный рак, плоскоклеточный рак, меланома.
Как видно, весомую долю занимают банальные инфекции кожи. Но даже они часто протекают атипично и нередко представляют трудности для диагностики.
Показание
Метод
Интерпретация
Заболевания кожи, вызванные вирусами семейства герпеса.
Herpes simplex virus вызывает язвенно-некротические поражения кожи. Количество CD4 лимфоцитов, при котором развивается поражение, может быть любым, но по мере снижения CD4 частота возрастает. Частые ВПГ-инфекции кожи (в том числе кожи гениталий) могут быть первыми признаками прогрессирования иммунодефицита. Особенности клинического течения: На месте герпетических высыпаний образуются язвы, достигающие в диаметре 2 см и более, которые могут сливаться в обширные язвенные поверхности. Дно язв имеет признаки некроза. Обратное развитие происходит очень медленно. Склонность к рецидивированию. Диагностика: распознавание характерных элементов сыпи; выделение вируса в культуре клеток. Язвенно-некротические поражения кожи, сохраняющиеся более 3 месяцев, относятся к числу СПИД-индикаторных заболеваний. Лечение: ацикловир внутривенно 5 мг/кг х 3 раза в сутки в течение 7 дней, валацикловир внутрь 1 г 2 раза в сутки в течение 5–10 дней.
Varicella zoster virus вызывает рецидивирующий опоясывающий лишай. Количество CD4 лимфоцитов, при котором развивается поражение, может быть любым, но по мере снижения CD4 частота возрастает. Особенности клинического течения: Как и у ВИЧ-негативных лиц, но при переходе заболевания в последнюю фазу возможно появление гангренозных форм. Высыпания часто располагаются по ходу ЧМН и в области крестца. Диагностика: распознавание характерных элементов сыпи. Лечение: ацикловир менее эффективен, чем при лечении ВПГ-инфекций, его дозировка составляет 10 мг/кг внутривенно х 3 раза в сутки в течение 7-10 дней. Валацикловир внутрь 1 г 3 раза в сутки в течение 7–10 дней. Используются препараты, снижающие болевой синдром и местные антисептики для предупреждения бактериальных суперинфекций
Вирусные бородавки и кондиломы.
В настоящее время существует вакцина против вируса папилломы человека, традиционно использующаяся с целью профилактики развития рака шейки матки у женщин детородного возраста.
Лечение бородавок и кондилом заключается в их удалении (криодеструкция, химическое разрушение, хирургический метод)
Опухоли кожи у ВИЧ-инфицированных.
Особая роль в формировании клинических проявлений СПИД принадлежит саркоме Капоши. Саркома Капоши у молодых мужчин-гомосексуалистов была первым наглядным симптомом СПИДа. Это опухоль сосудистого происхождения, соответственно ее локализация может быть практически любой. Саркома Капоши имеет не только кожные проявления, но и вызывает поражения слизистых, дыхательных путей, нервной системы, желудочно-кишечного тракта и др. Развитие саркомы Капоши связано с вирусом герпеса человека 8 типа и не имеет четкой зависимости от уровня снижения CD4 клеток.
Клеточный иммунитет играет важную роль в защите от эпителиальных опухолей. Риск развития плоскоклеточного и базальноклеточного рака, лимфом и даже меланомы зависит от длительности иммунодефицита у ВИЧ-инфицированного. Сегодня благодаря АРТ ВИЧ-инфицированные живут дольше, чем раньше. Поэтому их нужно внимательно наблюдать на предмет первичных злокачественных новообразований кожи, таких как базальноклеточный рак, плоскоклеточный рак, меланома и лимфома кожи.
В лечении опухолей важным является не только удаление опухоли и уничтожение ее метастазов химио- или радиотерапией, но и старт проведения АРТ с восстановлением Т-клеточного иммунитета.

Сегодня мы знаем, что наличие ВИЧ-инфекции несет повышенные риски возникновения некоторых онкозаболеваний. Тут просто нужно сложить 2+2: некоторые виды рака связаны с вирусными поражениями, а ВИЧ-инфекция поражает наши системы защиты. Другие виды рака могут более или менее успешно контролироваться иммунной системой, а у нас именно там проблема. Все более чем очевидно. Но тут же возникает логичное предположение: а если мы начали лечение ВИЧ-инфекции очень рано, иммунная система существенно пострадать не успела, защита от вирусов не отличается от таковой у здорового человека, что же будет в таком случае?
Многие формы рака все же являются редким заболеванием, и качественное исследование в области онкологии требует длительного времени наблюдения, а также очень большого объема участников. В нашем случае - людей без ВИЧ, и это не проблема, и людей с ВИЧ, которые начали терапию рано или очень рано и многие годы поддерживали высокий уровень супрессии вируса. И вот со второй группой у нас большие проблемы. Таких людей недостаточно даже в масштабах планеты. Впрочем, некоторые ориентиры все же есть.
Департамент по делам ветеранов в США и большая группа исследователей изучили данные, полученные с 1999 по 2015 годы у 42441 человека с ВИЧ, и сравнили эти данные с показателями в группе 104712 ветеранов без ВИЧ-инфекции за тот же период. Набросок этой картины выглядит так: не подавленная вирусная нагрузка повышает риск онкозаболеваний в 2,35 раза по сравнению с людьми без ВИЧ. Своевременное начало эффективной терапии снижает риск, но он все равно почти в 2 раза выше. Более или менее своевременное начало терапии и длительное подавление еще больше снижают риски, но они все равно в 1,5 раза выше. Много? Как посмотреть… с одной стороны, в 1,5 раза выше, с другой, это то же самое, что 10 из 1000 против 15 из 1000 человек. Второе сравнение уже не выглядит столь трагичным.
Однако важно понимать, что это исследование проводилось не в России, и оно не отражает наших реалий. В реальной жизни мы крайне часто видим очень поздно выявленную ВИЧ-инфекцию, выраженный иммунодефицит, ситуации, когда саркома Капоши диагностируется в 500 раз чаще, чем без ВИЧ, неходжкинская Лимфома – более чем в 10 раз чаще, и даже рак шейки матки в 3 раза чаще. Другое ограничение этого и подобных исследований в том, что они не дают понимание потенциала и рисков тех случаев, где все сделано идеально и крайне своевременно. Есть огромные основания полагать, что в таких случаях разница рисков для людей с ВИЧ и без ВИЧ будет минимальна, а часто и вовсе будет отсутствовать.
Рассмотрим два сценария. Первый: ВИЧ-инфекция выявлена довольно рано, наблюдается высокий иммунный статус. Это грандиозный шанс снизить мешок рисков одним ударом. Начало терапии так быстро, как это возможно, без всяких остановок и перерывов позволит отодвинуть за горизонт широчайший спектр серьезных рисков, и риски онкозаболеваний тут даже не главные. Печально, но есть довольно высокая вероятность, что в СПИД Центре не оценят ваше рвение к раннему началу терапии, а то и будут откровенно не рады, учитывая большое число пациентов и весьма ограниченные возможности Центров СПИД. Не без исключений, иногда вы встретите понимание со стороны врача и даже получите более современный режим терапии, но так будет очень нечасто. Иногда разумным выбором будет самообеспечение препаратами и наблюдение в частном порядке как минимум в некотором периоде.
И в обоих сценариях есть общий знаменатель – устранить все факторы риска, которыми можно управлять. Курение – враг номер один. Устранить гепатит С, если есть. Избавиться от Helicobacter pylori, копнуть и иные потенциальные инфекционные проблемы в желудочно-кишечном тракте и также разобраться. Есть проблемы с вирусными кожными поражениями – тоже устранять, возможно, победа придет и не сразу, но руки не опускать. Для женщины очень важно наблюдаться у грамотного современного гинеколога, который позволит свести практически к нулю риски рака шейки матки. У мужчин свои проблемы, и они тоже не должны оставаться без решений, задвигаться в долгий ящик. И так далее, полный список составить невозможно, риски и решения нужно оценивать индивидуально. Но не забываем: чем дольше мы миримся и сосуществуем с фактором риска, тем вероятнее, что риск превратится в проблему.
Выглядит, на первый взгляд, все сложно и дорого, но лишь на первый взгляд. Под руководством грамотных врачей запутанный клубок проблем легко превращается в понятный алгоритм несложных действий. Для врачей H-Clinic это обычная каждодневная работа, как и для многих наших коллег по всей стране, коих не так много, но они есть, мы их знаем и гордимся ими.
- Park LS. и др. Association of Viral Suppression With Lower AIDS-Defining and Non-AIDS-Defining Cancer Incidence in HIV-Infected Veterans: A Prospective Cohort Study. Ann Intern Med. 2018 Jun 12. PMID: 29893768.
- Hernández-Ramírez RU и др. Cancer risk in HIV-infected people in the USA from 1996 to 2012: a population-based, registry-linkage study. Lancet HIV. 2017 Nov;4(11):e495-e504. PMID: 28803888.
а) Поражения кожи при остром ВИЧ-синдроме. У большинства ВИЧ-инфицированных с острым ретровирусным синдромом развиваются высыпания на коже и слизистых, обычно состоящие из характерных, четко очерченных, незудящих пятен и папул, в основном локализующихся на верхней части груди и спине (особенно в области ключиц), на лбу и волосистой части кожи головы.
Сообщалось также о диффузных уртикарных и пустулезных/везикулезных высыпаниях, хотя менее часто. Еще одним типичным признаком являются неинфекционные изъязвления на слизистой полости рта, гениталий и анальной области, о которых сообщается у 6-28% пациентов. Кожные симптомы часто сопровождаются лихорадкой, летаргией, лимфаденопатией и болью в суставах. Высыпания острого ретровирусного синдрома обычно появляются через 3-6 недель после первоначального инфицирования и персистируют около 5-8 дней.
Дифференциальный диагноз острого ретровирусного синдрома включает инфекцию вируса Эпштейна-Барр, цитомегаловирусную инфекцию, первичную инфекцию вируса простого герпеса, вторичный сифилис и системную лекарственную гиперчунствительность. Острая инфекция ВИЧ-1 ассоциируется с высокой степенью виремии в течение 2-6 недель инфекции, идентификация лиц с острым ретровирусным синдромом дает возможность предупредить вторичную передачу в период значительной виремии перед сероконверсией.
Острый ретровирусный синдром: экзантема.
Отдельные эритематозные макулы и папулы на туловище и руке;
сопутствующими симптомами были лихорадка, язвы мошонки, эритематозные макулы на небе и лимфаденопатия. 
б) Поражения кожи при иммунной супрессии. Начало APT обычно приводит к частичному восстановлению иммунной системы, что отражается в увеличении числа Т-клеток CD4+ и уменьшении ВИЧ-нагрузки в плазме. В целом, это приводит к клиническому улучшению; однако у небольшой группы пациентов происходит парадоксальное ухудшение состояния. Этот феномен, называемый болезнью восстановления иммунитета или воспалительным синдромом иммунной реконституции (ВСИР), типично проявляется в первые три месяца начала APT либо симптомами нового инфекционного или воспалительного поражения, либо клиническим ухудшением имеющегося инфекционного или воспалительного заболевания.
Считается, что ВСИР является результатом усиленного иммунного ответа на существующие микробные антигены, антигены организма-хозя-ина или другие антигены в гот момент, когда количество Т-клеток CD4+ быстро увеличивается. О ВСИР сообщалось у 15-25% пациентов, начинавших APT, и с частотой 15-45% у лиц с наличием документально подтвержденной оппортунистической инфекции. К факторам риска, связанным с развитием ВСИР относятся мужской пол, более короткий интервал между началом лечения оппортунистической инфекции и инициацией APT, быстрое падение вирусной нагрузки ВИЧ после инициации APT, более низкий исходный уровень Т-клеток CD4+ и более высокая вирусная нагрузка во время APT.
Сообщалось об ассоциации ВСИР с широким спектром инфекций, воспалительных заболеваний и неоплазий. Если у пациента наблюдается парадоксальное ухудшение имеющегося заболевания на фоне начала APT, важно, кроме факторов несоблюдения режима терапии, антимикробной устойчивости и тахифилаксии, помнить о возможности ВСИР. Хотя в большинстве случаев ВСИР разрешается самопроизвольно и обычно продолжается от нескольких недель до месяцев, синдром может ассоциироваться с тяжелым состоянием, а в редких случаях со смертельным исходом.
Терапия ВСИР заключается в продолжении приема антиретровирусных медикаментов и инициации соответствующей терапии имеющегося инфекционного или воспалительного заболевания. Кроме того, в некоторых случаях, сообщалось о благоприятном эффекте системных стероидов. В тяжелых случаях рекомендуется подумать о прекращении APT, сопоставив эту меру с риском развития вирусной резистентности или прогрессирования ВИЧ.

в) Кожные поражения при клинической латентной инфекции. Внедрение APT значительно изменило естественное течение ВИЧ-инфекции, создав возможность иммунной реконституции и существенного уменьшения частоты как оппортунистических инфекций, так и неоплазий. В результате многие из распространенных кожных проявлений клинически латентной стадии ВИЧ — это кожные заболевания, обычно наблюдаемые у иммунокомпетентных лиц, такие как себорейный дерматит, псориаз, реакции лекарственной гиперчувствительности, рак кожи и инфекции вируса папилломы человека. Кроме того, возрастающая доступность APT привела к увеличению частоты кожных побочных эффектов антиретровирусных препаратов.

г) Воспалительные дерматозы при ВИЧ:
1. Себорейный дерматит при ВИЧ. Себорейный дерматит — одно из самых распространенных дерматологических проявлений ВИЧ-инфекции, поражающее 83% ВИЧ-инфицированных лиц в течении ВИЧ-заболевания. Себорейный дерматит может развиться на всех стадиях ВИЧ-заболевания и часто наблюдается на ранних стадиях ВИЧ-инфекции (число Т-клеток CD4+ > 500/мкл). Как и у иммунокомпетентных взрослых, у ВИЧ-инфицированных лиц себорейный дерматит проявляется эритемой и жирными чешуйками на волосистой части кожи головы, бровях, носогубных складках и в заушных областях. Однако на поздних стадиях ВИЧ-заболевания часто наблюдаются более диссеминированные формы себорейного дерматита. Могут поражаться лоб и область скул, а также грудь, спина, подмышечная и паховые области. Фактически, эритродермия, развивающаяся на фоне себорейного дерматита, может быть первым признаком ВИЧ-инфекции в развивающихся странах. Терапия обычно включает местные стероиды слабой фармакологической активности и местные противогрибковые средства, хотя более распространенные формы хуже поддаются методам стандартного лечения.
2. Вульгарный псориаз при ВИЧ. Хотя псориаз может развиться на любой стадии ВИЧ-инфекции, тяжесть псориаза коррелирует с ухудшением иммунной функции. У некоторых лиц псориаз может быть первоначальным симптомом ВИЧ-инфекции, и впервые начавшийся псориаз у человека из группы риска ВИЧ-инфекции является показанием к обследованию на ВИЧ. У ВИЧ-инфицированных наблюдаются все клинические формы псориаза, хотя чаще всего встречаются каплевидный, инверсный и эритродермический псориаз.
Рандомизированные исследования терапии псориаза у ВИЧ-инфицированных пациентов отсутствуют. Однако на основании отдельных и серийных сообщений в качестве терапии первого выбора в случае псориаза легкой и умеренной степени рекомендуются препараты местной терапии (такие как кальципотриол, кортикостероиды и тазаротен). В случае псориаза умеренной и тяжелой степени в качестве терапии первого выбора применяется APT и фототерапия, системные ретиноиды, такие как ацитретин, предлагаются в качестве препаратов второго выбора.В случае тяжелого и устойчивого к терапии заболевания эффективны мототрека, этанерцепт и инфликсимаб, но они ассоциируются с повышенным риском оппортунистической инфекции.
д) Оппортунистические инфекции:
1. Инфекции вируса папилломы человека. Хотя с внедрением APT частота оппортунистических инфекций в целом значительно уменьшилась, частота инфекций вируса папилломы человека (ВПЧ) не сократилась столь же значительно, а фактически, возможно, и возросла. Инфекции ВПЧ типично наблюдаются на всех стадиях ВИЧ-заболевания, а в аногенитальной области и в полости рта инфекции ВПЧ, согласно сообщениям, наблюдаются у ВИЧ-инфицированных чаще, чем в общей популяции.
2. Обыкновенные бородавки. По мере прогрессирования иммунодефицита обыкновенные бородавки увеличиваются в размерах, сливаются, становятся более многочисленными и устойчивыми к терапии. ВПЧ-5 может вызывать необычную картину обширной плоской бородавки и очагов по типу разноцветного лишая, которая напоминает веррукозную эпидермодисплазию.
3. Аногенитальные бородавки. Клинически аногенитальные бородавки напоминают подобные бородавки у иммунокомпетентных индивидуумов; однако кондиломы могут быть более многочисленными и обширными и часто хуже поддаются терапии. Аногенитальные бородавки у ВИЧ-инфицированных, как и у иммунокомпетентных пациентов, чаще всего возникают в результате инфекции ВПЧ-6 и ВПЧ-11. Хотя аногенитальные бородавки обычно считаются доброкачественными очагами, у ВИЧ-инфицированных такие бородавки могут быть проявлением инфекции, вызванной многочисленными типами ВПЧ, в том числе типами высокого онкогеного риска -16, -18, -31, -51, -53, -56 и -58, а также типами низкого риска -6 и - II. В одном исследовании обнаружили, что большинство аногенитальных бородавок у ВИЧ-инфицированных представляют собой совместную инфекцию двух типов ВПЧ: низкого и высокого риска. В другой серии исследований гистологические признаки внутриэпителиальной неоплазии низкой степени злокачественности были обнаружены примерно в 50% внешне доброкачественных аногенитальных бородавок у ВИЧ-инфицированных индивидуумов.
4. Инфекции ВПЧ в полости рта. Вызванные ВПЧ очаги в ротоглотке типично проявляются в форме розовых или белых бородавчатых папул, напоминающих аногенитальные кондиломы. Если очаги обширные, они могут сливаться, образуя крупные бляшки, которые способны трансформироваться в веррукозную карциному (цветущий папилломатоз полости рта). Инфекции ВПЧ в полости рта ассоциировались также с подгруппой орофарингеальных ИКР, которые иногда развиваются у основания языка и в области миндалин. Интересно отметить, что маркеры прогрессирующего ВИЧ-заболевания, такие как низкий показатель количества Т-клеток CD4+ не являются прогностическими для развития инфекции ВПЧ в полости рта. Эффективной терапией очагов в полости рта, вызванных ВПЧ, является метод электрохирургии.
е) Вызванная ВПЧ дисплазия и инвазивный ИКР. Риск вызванной ВПЧ дисплазии и злокачественности у ВИЧ-инфицированных значительно выше, чем в общей популяции. По оценкам крупного проспективного когортного исследования Г1КК анальной области у ВИЧ-инфицированных наблюдалась в 42,9 раза чаще, чем в общей популяции, а частота рака шейки матки у ВИЧ-инфицированных женщин была в 12,2 раза выше, чем в общей популяции. Низкий показатель количества Т-клеток CD4+ ассоциировался со значительно повышенным риском анального ПКР у мужчин, но не риском ПКР шейки матки или вульвы у женщин. Воздействие APT на частоту индуцированных ВПЧ in situ и инвазивных ПКК вариабельное. Внедрение APT ассоциировалось с повышением частоты анального рака у ВИЧ-инфицированных лиц; однако APT ассоциировалась также с понижением частоты рака шейки матки.
Аногенитальную дисплазию успешно лечили методами аблятивной терапии, такими как хирургическое удаление, электрокаутеризация, лазер и инфракрасная коагуляция. Еще одним подходом является местная терапия, варианты которой включают имиквимод, подофиллотоксин, 80%-ную трихлоруксусную кислоту и жидкий азот. В одном небольшом исследовании ВИЧ-инфицированных мужчин с внутриэпителиальной анальной неоплазией пациенты получали крем имиквимод три раза в неделю в течение 16 недель. К окончанию терапии почти у 80% наблюдалось полное очищение очагов. Однако у 26% пациентов с полным разрешением очагов после терапии имиквимодом в период последующего наблюдения развился рецидив через, в среднем, 30 месяцев. В случае минимально инвазивного ПКР на дистальном участке анального отверстия (на границе некератинизированного и кератинизированного эпителия) или на наружных участках аногенитальной области (половом члене, вульве и промежности) рекомендуется хирургическая эксцизия с адекватными границами безопасности. В случае инвазивного ПКР ануса (зона трансформации) обычно применяется лучевая терапия и химиотерапия.
ж) Стафилококковые инфекции. Staphylococcus aureus является распространенным бактериальным патогеном, который вызывает кожные и системные инфекции на всех стадиях ВИЧ-заболевания. Уникальных стафилококковых инфекций при ВИЧ-заболевании не наблюдается. У ВИЧ-инфицированных развивается, скорее, широкий спектр первичных инфекций кожи и мягких тканей, которые обычно наблюдаются у иммунокомпетентных лиц. Вторичная инфекция основного дерматоза, в частности у лиц с колонизацией S. aureus, часто отмечается у больных атопическим дерматитом. Возможна вторичная инфекция в форме герпетических язв и контагиозного моллюска.
К факторам риска стафилококковой инфекции у ВИЧ-инфицированных относятся носительство S. aureus в полости носа, наличие постоянного сосудистого катетера и количество Т-клеток CD4+ 
Хронические герпетические поражения.
Хронические язвы и изъязвленная опухоль на половом члене, мошонке и лобковой области у пациента с ВИЧ-инфекцией.
Вирус простого герпеса оказался устойчивым к ацикловиру, и поражения разрешились после местного лечения цидофовиром.
з) Инфекции вируса простого герпеса типов 1 и 2. Инфекция вируса простого герпеса (ВПГ) часто ассоциируется с ВИЧ-заболеванием. Хронические герпетические язвы длительностью более 1 месяца являются состоянием, определяющим наличие СПИДа. Инфекция ВПГ при ВИЧ-заболевании может проявляться тяжелыми болезненными изъязвлениями в периоральной и аногенитальной областях, а также на пальцах. Атипичные морфологические элементы, такие как гиперкератотические бородавчатые папулы и узлы, иногда наблюдаются на поздней стадии ВИЧ-заболевания. На прогрессирующих стадиях ВИЧ-заболевания очаги обычно медленнее отвечают на системную противовирусную терапию и чаще рецидивируют.
Фоскарнет и цидофовир назначаются внутривенно в случае инфекций, вызванных резистентным к ацикловиру ВПГ. Гель цидофовир эффективен в качестве местной терапии резистентных к ацикловиру инфекций ВПГ. Крем имиквимод (5%) также является эффективной местной терапией в случае кожных герпетических инфекций, в том числе вызванных устойчивым к ацикловиру ВПГ.
и) Инфекции вируса Varicella Zoster. Инфекция вируса varicella zoster (VZV) у ВИЧ-инфицированных может проявляться в форме тяжелой ветряной оспы (первичной инфекции VZV), стойкой ветряной оспы, дерматомного опоясывающего герпеса, диссеминированного опоясывающего герпеса и хронического или рецидивирующего опоясывающего герпеса. На поздних стадиях ВИЧ-заболевания опоясывающий герпес может проявляться атипично. Диссеминированная инфекция опоясывающего герпеса может развиваться в форме рассеянных везикул в отсутствие дерматомных очагов. Описаны также персистирующие эктима-подобные изъязвления и веррукозные папулы при отсутствии везикулезной стадии.
Ведение ВИЧ-инфицированных пациентов с первичной инфекцией VZV должно включать оценку поражения внутренних органов. При наличии такого поражения следует начать внутривенную терапию ацикловиром (10 мг/кг каждые 8 часов, с учетом состояния почек). Терапия опоясывающего герпеса зависит от распространенности заболевания и степени ослабления иммунитета у пациента. Пациентам с ранней стадией ВИЧ-заболевания и локализованным поражением кожи можно назначить внутрь ацикловир, валацикловир или фамцикловир в течение 7-10 дней. В случае прогрессирующих поздних стадий ВИЧ-инфекции (количество Т-клеток 
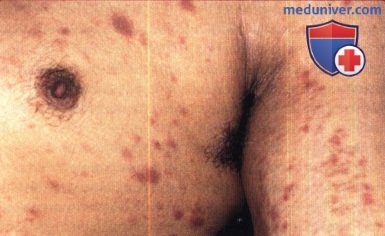
Инвазивная сквамозно-клеточная карцинома, вызванная ПВЧ, у 32-летнего мужчины с ВИЧ-инфекцией.
Перианальная опухоль присутствовала в течение нескольких месяцев, при гистологическом исследовании была выявлена инвазивная сквамозно-клеточная карцинома.
- Вернуться в оглавление раздела "дерматология"
Редактор: Искандер Милевски. Дата публикации: 17.5.2019
Читайте также:


