Шишки у вич инфицированного
Некоторые виды онкологических заболеваний так часто встречаются у больных СПИДом, что считаются СПИД-определяющими болезнями – это означает, что их присутствие у ВИЧ-инфицированного является признаком развития у такого больного СПИДа. Эти онкологические заболевания также называют СПИД-ассоциированными онкологическими заболеваниями, к которым относится:
- Саркома Капоши
- Лимфома (особенно неходжкинская лимфома и лимфома центральной нервной системы)
- Инвазивный рак шейки матки
К другим видам рака, которые с большей вероятностью могут развиться у ВИЧ-инфицированных, относятся: инвазивный рак анального канала, болезнь Ходжкина, рак лёгких, рак ротовой полости, рак яичек, рак кожи, включая базальный эпидермоцит и плоскоклеточную карциному, а также злокачественная меланома. Конечно, ВИЧ-отрицательные люди тоже могут болеть этими заболеваниями, даже теми, которые считаются СПИД-ассоциированными. Но таковыми они называются только тогда, когда возникают у ВИЧ-позитивных больных.
В развивающихся странах у 4 из 10 больных СПИДом в тот или иной момент болезни развивается рак. Тем не менее, общая картина раковых опухолей у ВИЧ-инфицированных изменяется. С распространением антиретровирусного лечения снизилось число случаев саркомы Капоши и неходжкинской лимфомы. Большинство других онкозаболеваний не замедлились благодаря анти-ВИЧ лечению, а их факторы риска остаются такими же, как у здоровых людей. Например, ВИЧ-позитивные курильщики имеют больше шансов получить рак губ, ротовой полости, горла и лёгких, чем здоровые некурящие люди.
Взаимосвязь между ВИЧ и другими онкологическими заболеваниями до сих пор не до конца установлена. Тем не менее, существует мнение, что рак развивается быстрее у людей с иммунной системой, ослабленной ВИЧ. К сожалению, рак у ВИЧ-инфицированных труднее поддается лечению, отчасти из-за ослабленной ВИЧ иммунной системы и сниженного количества белых кровяных телец, что является прямым результатом ВИЧ-инфекции. Прохождение химиотерапии может быть сложным для больных СПИДом, поскольку костный мозг, который должен производить новые клетки крови, иногда оказывается уже пораженным ВИЧ-инфекцией. Больные с подобной проблемой часто не могут пройти полный курс химиотерапии, не нанеся себе при этом серьезного вреда. Внедрение высокоактивной антиретровирусной терапии (ВААРТ) в конце 1990х привела к снижению частоты некоторых видов рака у ВИЧ-инфицированных и увеличило продолжительность жизни больных СПИДом. Это также позволило ВИЧ-позитивным больным проходить полные курсы химиотерапии в случае онкологических заболеваний. На данный момент для ВИЧ-инфицированных разрабатываются альтернативные методы лечения рака на основе моноклональных антител и трансплантации стволовых клеток.
Саркома Капоши (СК) когда-то была редкой болезнью, поражающей преимущественно пожилых мужчин средиземноморского или еврейского происхождения, больных, которым произвели пересадку органов, или молодых людей из Африки. Эта форма называется классической СК. Однако в 1970-х и 80-х годах число людей с СК стремительно возросло
За последние 25 лет большинство случаев СК в США было связано с ВИЧ-инфекцией у мужчин, практикующих секс с мужчинами. Эти случаи относятся кэпидемической СК. Сейчас известно, что СК у ВИЧ-инфицированных связана с другой вирусной инфекцией. Ее вызывает вирус под названием герпес-вирус человека 8-го типа (ГВЧ-8), также известный как герпес вирус, ассоциированный с саркомой Капоши. ГВЧ-8 не вызывает болезни у большинства ВИЧ-отрицательных людей. Инфицирование этим вирусов распространено в Соединенных Штатах среди мужчин, вступающих в половые отношения с мужчинами, хотя он также может передаваться во время секса между мужчиной и женщиной. Вирус был обнаружен в слюне, а значит, может передаваться во время глубоких поцелуев.
В большинстве случаев эпидемическая СК вызывает темно-фиолетовые или коричневатые злокачественные образования дермы (называемые лезиями), которые могут появляться в разных местах на теле. Такие образования могут возникнуть на коже или в полости рта, и повредить лимфатические узлы и другие органы, такие как пищеварительный тракт, лёгкие, печень и селезёнку.
Во время первичной диагностики у некоторых людей с эпидемической СК не обнаруживают никаких других симптомов, особенно если лезии возникают на коже. Однако у многих, даже при отсутствии образований на коже, бывают увеличенные лимфатические узлы, необъяснимое повышение температуры или потеря веса. Со временем симптомы эпидемической СК распространяются по всему телу. Если СК поражает значительную поверхность лёгкого или кишечника, это может приводить к фатальным последствиям.
Обычно больным, у которых диагностируют эпидемическую СК, назначают антиретровирусные препараты и противораковое лечение.
Неходжкинская лимфома (НХЛ) поражает 4-10% больных СПИДом. Это онкологическое заболевание, которое начинается в лимфоидной ткани и может распространяться на другие органы. С момента внедрения антиретровирусной терапии число ВИЧ-инфицированных, у которых развивается лимфома, значительно снизилось, хотя не настолько, как число больных с саркомой Капоши.
Неходжкинские лимфомы, которые обычно возникают у больных СПИДом, часто являются первичными лимфомами центральной нервной системы (ЦНС). Первичная лимфома ЦНС начинается в центральном или спинном мозге. Среди симптомов первичной лимфомы ЦНС могут быть: судороги, паралич лицевого нерва, замешательство, потеря памяти и сонливость (усталость). СПИД-ассоциированная неходжкинская лимфома также может провоцировать развитие других лимфом средней и высокой степени злокачественности, включая лимфому Беркитта.
Прогноз или итог для больных со СПИД-ассоциированной неходжкинской лимфомой частично зависит от типа лимфомы, а частично от функции иммунной системы пациента. Больные с генерализованной стадией неходжкинской лимфомы, количество CD4 Т-лимфоцитов которых составляет менее 200 на микролитр крови и/или те больные, которые не принимают антиретровирусной терапии, обычно чувствуют себя хуже, чем те, у которых эти факторы присутствуют.
По-видимому, наилучшим лечением для СПИД-ассоциированной неходжкинской лимфомы является использование препаратов, которые применяются для ВИЧ-отрицательных пациентов. Одно время лечение состояло из малых доз химиотерапии. Но с появлением ВААРТ многие пациенты могут получать стандартные комбинации лекарств, применяемые для химиотерапии у людей, которые не больны СПИДом. Использование кроветворных (гемопоэтических) факторов в комбинации с химиотерапией также показало многообещающие результаты при лечении ВИЧ-инфицированных пациентов.
Для больных с первичной лимфомой ЦНС, могут использоваться химиотерапия или облучение всего головного мозга. ВААРТ используется для улучшения функции иммунной системы и продления жизни.
ВИЧ-инфицированные женщины имеют повышенный риск развития внутриэпителиальной неоплазии шейки матки (ВНШМ). ВНШМ – это рост аномальных, предраковых клеток в шейке матки или нижней части матки. Со временем ВНШМ может перерасти в инвазивный рак шейки матки, при котором раковые клетки будут поражать более глубокие слои шейки матки (и, в конце концов, могут распространиться по всему организму).
ВНШМ должна своевременно лечиться (путем удаления или уничтожения внешних слоев клеток шейки матки), чтобы не дать ей перерасти в инвазивный рак. Исследования показали, что нелеченная неоплазия шейки матки с большей вероятностью переходит в инвазивный рак у ВИЧ-инфицированных женщин, чем у здоровых. Стандартное лечение ВНШЛ хуже действует на ВИЧ-инфицированных женщин. Шансы на возобновление болезни (рецидив) после прохождения лечения довольно высоки, что связывают с функцией женской иммунной системы. Женщины, имеющие число CD4 клеток меньше 50 на микролитр крови имеют высокие шансы рецидива ВНШМ.
ВИЧ-инфицированные женщины с инвазивным раком шейки матки и хорошей иммунной функцией обычно нормально переносят хирургическое вмешательство и проходят то же лечение, что и ВИЧ-отрицательные женщины. Больным с запущенной формой заболевания само облучение помогает плохо. Женщинам с запущенной формой рака шейки матки или его рецидивом проводят химиотерапию. После прохождения курса лечения больные должны постоянно находиться под наблюдением врача, чтобы убедиться, что болезнь не возобновится. Во время лечения рака иммунный статус больной должен постоянно проверяться, она должна принимать антиретровирусные препараты. Эти лекарства обычно прописываются для улучшения результатов лечения инвазивного рака шейки матки у ВИЧ-инфицированных женщин, невзирая на число CD4 клеток.
Женщины больные СПИДом и раком шейки матки одновременно, вылечиваются от рака не так успешно, как ВИЧ-отрицательные пациентки. Женщины с количеством CD4 клеток больше 500 склонны к более скорому выздоровлению.
Наряду с широким распространением антиретровирусного лечения, СПИД-ассоциированные онкологические заболевания случаются все реже. Однако, поскольку ВИЧ-инфицированные стали жить дольше, у них начали развиваться раковые опухоли, которые не всегда вызваны напрямую ВИЧ, например, рак лёгких, гортани, печени, кишечника и анального канала, а также болезнь Ходжкина и множественная миелома. В большинстве случаев курс лечения включает антиретровирусные препараты и обычное лечение против рака, применяемое для людей без ВИЧ. Одновременно используются любые необходимые лекарства от ВИЧ (например, антибиотики для предотвращения инфекция)
Нередко ВИЧ-инфекция долгое время никак себя не проявляет, и единственный симптом, по которому можно понять, что в организме что-то не в порядке, это увеличение лимфоузлов. При ВИЧ характерно увеличение сразу нескольких групп лимфоузлов, иногда до пяти сантиметров в диаметре. Периодически ВИЧ-положительные пациенты жалуются на боль в лимфоузлах. 
Лимфатические узлы – это естественные образования организма, расположенные по ходу лимфатических сосудов. Через лимфоузлы по лимфатическим сосудам протекает лимфа, собирая из суставов, мышц и органов микробы, токсины и опухолевые клетки. Лимфоузлы расположены, в основном, группами. На ощупь они могут быть разных размеров – от пшеничного зерна до фасоли.
Лимфа, протекая через лимфоузлы, очищается от инородных частиц и обогащается антителами, препятствующими размножению в нашем организме бактерий и вирусов и нейтрализующими вредные токсины. Таким образом, лимфоузлы – это естественные барьеры нашего организма, которые чутко реагируют на присутствие в организме инфекции.
Причины увеличения лимфоузлов
Причин увеличения лимфоузлов достаточно много: от привычного всем кариеса до онкологического заболевания лимфатической системы. Изменение размеров лимфоузлов может указывать, что в организме:
- инфекция: бактериальная, вирусная или грибковая;
- паразиты;
- системное или аутоиммунное заболевание (ревматизм, васкулит, и т.д.);
- онкологические заболевания лимфатической системы, в том числе поражение системы метастазами при опухолевом процессе.
Увеличение лимфоузлов происходит, когда инородных тел в лимфе – вирусов, бактерий, раковых клеток – становится столько, что защитные силы организма не могут справиться с ними тут же, на месте. В этом случае организм начинает экстренно вырабатывать всё новые клетки иммунной системы, лимфоузлы при этом начинают расти.
Если увеличение лимфоузлов не сопровождается покраснением кожи и болезненностью при надавливании, такие изменения называют лимфоаденопатией.
Лимфоаденопатия при ВИЧ
Как правило, увеличение лимфоузлов наблюдается на всех стадиях заболевания. Иногда пациенты замечают, что на шее выросла внушительная шишка, податливая при нажатии, подвижная, часто безболезненная. Обычно такие шишки при ВИЧ появляются сразу в нескольких местах.
Это связано с тем, что ВИЧ поражает сразу весь организм. Причём, если более двух групп лимфоузлов увеличены на протяжении трёх и более месяцев, то назначается обязательный анализ на определение антител к ВИЧ-инфекции, так как это один из наиболее характерных признаков заражения.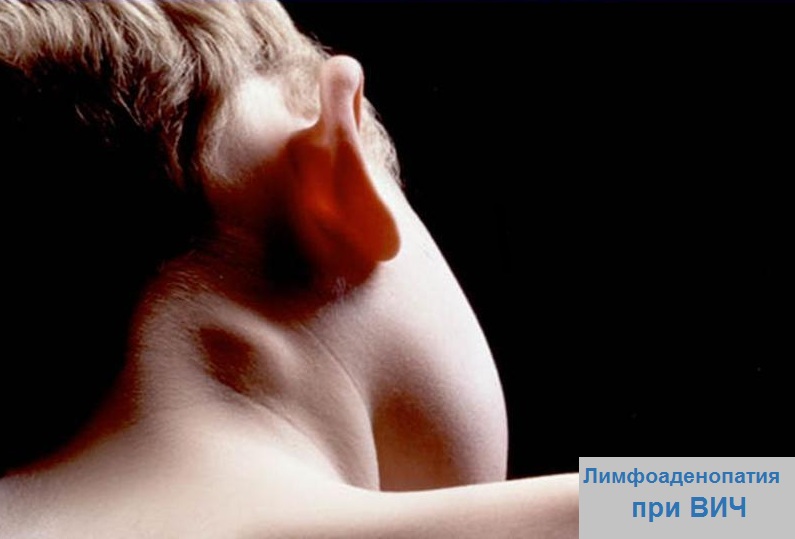
Если к указанным симптомам присоединяется болезненность при нажатии, то речь идёт уже о воспалении лимфоузлов. Воспалительный процесс лимфатических узлов называется лимфаденит. При ВИЧ иммунитет испытывает значительные нагрузки, в отсутствие терапии довольно скоро присоединяются различные инфекции, с которыми организму непросто справиться. Всё это приводит к болезненному воспалению лимфоузлов.
Где воспаляются лимфоузлы при ВИЧ?
Где, насколько и как скоро увеличатся лимфатические узлы у заражённого, обусловлено возможностью иммунитета сопротивляться чужеродным организмам. Если иммунитет серьёзно ослаблен, лимфоаденопатия может проявиться уже в самом начале заболевания, а также может сопровождать ВИЧ-инфекцию в течение многих лет, то появляясь, то снова исчезая.
Иногда увеличение лимфоузлов может быть незначительным и не доставлять дискомфорта больному. Тем не менее, в той или иной степени изменение размеров основной группы лимфоузлов можно заметить при внимательном осмотре.
В первую очередь следует обратить внимание на следующие группы лимфоузлов:
- околоушные,
- подчелюстные,
- затылочные,
- шейные,
- под- и надключичные,
- локтевые.
В норме эти лимфатические узлы практически не прощупываются. При лимфоаденопатии узлы становятся более плотными, но при этом остаются эластичными. Покраснения кожи в районе поражённых лимфоузлов и болезненность при надавливании присутствуют только в случае присоединения инфекции.
При ВИЧ лимфоузлы вырастают в среднем до двух, реже до пяти, сантиметров в диаметре. Иногда увеличенные лимфоузлы могут сливаться между собой, тогда при надавливании ощущается достаточно сильная боль.
Многих ВИЧ-положительных пациентов беспокоит вопрос, насколько сильно увеличатся размеры лимфоузлов и будет ли это заметно окружающим. В основном, значительное увеличение узлов в размере наблюдается на поздних стадиях ВИЧ, в этих случаях на шее, затылке, под челюстью могут вырастать шишки внушительных размеров, заметные невооруженным глазом. В такой ситуации больным приходится маскировать увеличенные узлы волосами, одеждой, аксессуарами.
Лимфоузлы, размерами более двух сантиметров в диаметре, показатель серьёзного снижения иммунитета и повод провериться на наличие сопутствующих инфекций.
Чаще всего увеличиваются лимфоузлы, расположенные выше пояса. Но у ВИЧ-инфицированных рожениц в постродовой период может наблюдаться генерализованная лимфоаденопатия. То есть, увеличение всех групп лимфоузлов, особенно если имеется заражение вирусом герпеса. Если больной обнаруживает у себя значительное увеличение паховых лимфоузлов, это повод провериться на заболевания, передающиеся половым путём (ЗППП), так как увеличение бедренных и паховых лимфоузлов характерно, скорее, для венерических заболеваний, чем для ВИЧ.

Туберкулёз лимфоузлов при ВИЧ
Больные ВИЧ-инфекцией, как лица с ослабленным иммунитетом, особо подвержены туберкулёзу. При попадании бактерии в дыхательные пути образуется первичный очаг болезни. Здесь же происходит заражение лимфы, вместе с током которой бактерия разносится по организму, поражая лимфатические узлы.
Туберкулез лимфоузлов при ВИЧ встречается и при лёгочной форме заражения, и как самостоятельное заболевание. В начальной форме туберкулёз лимфоузлов сложно отличить от лимфоаденопатии, так как узлы, в основном, не превышают одного сантиметра в диаметре и не болят при надавливании. Тем не менее, через некоторое время у больного могут появиться новые жалобы:
- температура достигает 39 градусов;
- кожа излишне бледная;
- больной быстро устаёт;
- появилось излишнее потоотделение.
Вскоре после появления этих симптомов, лимфоузлы начинают напоминать гроздья наростов, при надавливании ощущается острая боль. В последствии могут появляться гнойные свищи, после прорыва которых температура может идти на спад, что затрудняет диагностику туберкулёза лимфоузлов.
Чтобы убедиться в том, что лимфоузлы поражены туберкулёзом, традиционных проб Манту и анализа мокроты может быть недостаточно. Поэтому для подтверждения диагноза рекомендуется провести биопсию или томографию поражённого лимфоузла.

Лимфома и злокачественные опухоли
К увеличению лимфоузлов могут присоединиться и другие симптомы:
- зудящая сыпь;
- ночная потливость;
- потеря веса;
- увеличение печени и селезёнки;
- стойкое увеличение температуры до 37-38 градусов.
Всё это может свидетельствовать о возникновении лимфомы – злокачественного образования лимфатических узлов.
При поражении центральной нервной системы могут также присутствовать периодические эпилептические припадки. В редких случаях у ВИЧ-инфицированных может развиваться лимфома головного мозга. При этом больные часто жалуются, что у них сильно болит голова.
В то же время следует понимать, что головная боль при ВИЧ-инфекции не всегда свидетельствует об онкологических процессах. Причиной головной боли могут быть привычные ОРВИ, повышенное или пониженное давление. А могут и более серьёзные нарушения: менингит, поражение нервных волокон, интоксикация при тяжёлых инфекциях, как, например, пневмония. Если головная боль при ВИЧ продолжается дольше нескольких дней, не реагируя на привычные анальгетики, это серьёзный повод обратиться к врачу.
Для точного подтверждения диагноза помимо врачебного осмотра и общего анализа крови проводят биопсию поражённого лимфоузла. А если лимфоузел расположен в местах, недоступных для осмотра, рекомендуется провести лучевую диагностику, например, томографию. Для определения наличия раковых клеток в костномозговой ткани также проводится исследование костного мозга. В некоторых случаях назначаются дополнительные исследования по усмотрению лечащего врача.
Злокачественное перерождение лимфоидной ткани поражает около трети больных ВИЧ. В основном, лимфомы при ВИЧ-инфекции образуются на последней стадии. Но при отказе от приёма назначенных препаратов и сильном снижении иммунитета, лимфома может образоваться раньше.
Лимфома при ВИЧ-инфекции прогрессирует стремительно, давая метастазы. Большинство ВИЧ-инфицированных при лимфоме умирает в течение года, так как преодолеть это заболевание полностью в этой ситуации весьма трудно, а раковые процессы в организме ухудшают эффективность применения антиретровирусной терапии.
Лечение заболеваний лимфоузлов при ВИЧ
Лечение изменения размера лимфоузлов при ВИЧ зависит от его причины. Иногда бывает достаточно повысить сопротивляемость иммунитета, чтобы лимфоузлы пришли в норму.
В других случаях приходится принимать специальные препараты, чтобы подавить инфекцию, вызвавшую лимфоаденопатию. При туберкулёзе лимфатических узлов назначают антибиотики и противотуберкулёзные препараты.
Лечение при онкологических процессах проходит по стандартным сценариям: если нет противопоказаний, проводятся облучение и/или полихимиотерапия. Среди народных методов лечения при отсутствии индивидуальной непереносимости рекомендуется употребление мёда, сухофруктов, отваров ягод и трав, витаминов и минералов. Использование компрессов на увеличенные лимфоузлы без разрешения врача не рекомендуется.
Одной из важных причин высокой смертности среди больных ВИЧ при присоединении сопутствующих инфекций и злокачественных процессов является выявление болезни на поздних стадиях. Поэтому необходимо своевременно проходить обследования у специалистов и строго следовать назначенной терапии. В этом случае многим больным удаётся вести полноценную жизнь в течение многих лет.
ВИЧ-инфекция — один из факторов, который во много раз повышает вероятность развития рака. Выяснили, какие именно онкозаболевания чаще всего могут возникать при положительном ВИЧ-статусе, как их вовремя обнаружить, и на какие факторы риска еще нужно обратить внимание людям, живущим с ВИЧ.
Главная мишень вируса — CD4-Т-лимфоциты. Они передают сигнал другим клеткам, которые защищают организм от рака. В результате вмешательства вируса количество CD4-T-лимфоцитов постепенно уменьшается. Критически низкий уровень этих клеток - одна из причин отсутствия согласованной работы между звеньями иммунитета и главный механизм, приводящий к развитию СПИДа.
Иммунитет человека с ВИЧ-инфекцией перестает контролировать процессы избыточного клеточного деления и злокачественной трансформации клеток. Вместе с уменьшением количества CD4-T-лимфоцитов происходит накопление раковых клеток. В результате у человека развиваются несколько видов опухолей, которые называют СПИД-индикаторными: появление такого вида рака с очень большой вероятностью означает наличие у человека СПИДа.
Однако повышается риск появления не только СПИД-индикаторных опухолей, но и тех видов рака, которые развиваются из-за потери иммунного контроля над несколькими онкогенными инфекциями: вирусом герпеса человека 8 типа (ВГЧ-8), вирусом папилломы человека (ВПЧ), вирусами гепатита В и С (ВГВ, ВГС), вирусом Эпштейна-Барр (ВЭБ) и другими.
Все эти состояния развиваются у людей с ВИЧ-инфекцией преимущественно на фоне снижения количества CD4-T-лимфоцитов до уровня менее 200 клеток/мкл (при разбросе в норме от 500 до 1100 клеток), но также могут возникать при нормальном или близком к нормальному уровню CD4-T-лимфоцитов.
Саркома Капоши (СК) — СПИД-индикаторная опухоль, при которой происходит злокачественная трансформация клеток лимфатических и кровеносных сосудов. Риск развития СК у пациентов с ВИЧ-инфекцией увеличивается в несколько сотен раз. Различные белки ВИЧ-1 способны усиливать воспаление и нарушать регуляцию в эндотелиальных клетках. Это приводит к тому, что саркома Капоши может развиться до того, как уровень CD4-T-лимфоцитов упадет ниже 200 клеток/мкл. Еще одно обязательное условие для возникновения СК — наличие в организме вируса герпеса человека 8 типа.
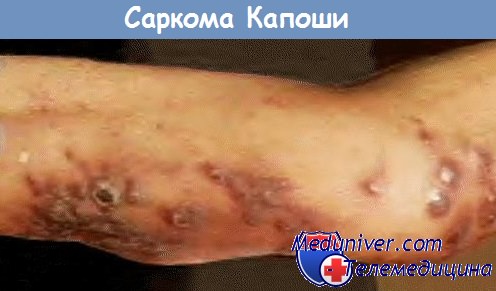
Саркома Капоши развивается в виде папулы, пятна, узелка, бляшки коричневого, розового, красного или темно-красного цвета от нескольких миллиметров до нескольких сантиметров в диаметре. Обычно высыпания концентрируются на ногах, голове, шее, на слизистой оболочке — в области неба, десен, конъюнктивы.
До эры внедрения лекарств от ВИЧ — антиретровирусной терапии (АРТ) 5-летняя выживаемость (с момента диагностики опухоли) пациентов с саркомой Капоши составляла менее 10%. Применение АРТ значительно улучшило ситуацию — сейчас речь идет о 74%, — а также позволило снизить риск развития СК.
Более половины случаев СК (56%) диагностируются сейчас в локальной форме — до того, как опухоль распространится на лимфатические узлы, слизистую ЖКТ, печень, селезенку и другие органы. Прием антиретровирусной терапии помогает значительно замедлить прогрессию болезни и предотвратить распространение СК по всему организму.
К сожалению, обнаружить саркому Капоши до появления симптомов не получится
Однако, человеку с ВИЧ и его амбулаторному врачу-инфекционисту необходимо учитывать несколько факторов риска развития этой опухоли:
- Этническая принадлежность: люди еврейского или средиземноморского происхождения, а также экваториальные африканцы;
- Мужской пол;
- Иммунодефицит: Люди с уровнем CD4-клеток менее 200 кл/мкл, те, кто перенес трансплантацию органов или костного мозга или постоянно принимает глюкокортикостероиды;
- Сексуальная ориентация: мужчины, имеющие секс с мужчинами(МСМ), подвержены более высокому риску развития СК.
К онкологическим заболеваниям, ассоциированным с вирусом папилломы человека, относятся инвазивный рак шейки матки (ИРШМ), сквамозный (чешуйчатый) рак головы/шеи, рак анального канала, вульвы и влагалища. СПИД-индикаторной из них является только ИРШМ.
Распространенность генитальной онкогенной инфекции ВПЧ среди женщин, живущих с ВИЧ, в целом выше, чем у остального населения.
Вирус папилломы человека способен к самопроизвольной элиминации — исчезновению из организма. У ВИЧ-положительных женщин этот процесс занимает больше времени, что увеличивает вероятность появления патологических изменений в шейке матки.
Продолжительный прием АРТ приводит к более низкой распространенности ВПЧ высокого риска и поражений шейки матки и даже предотвращает новые случаи ИРШМ.
Раннее начало антиретровирусной терапии, приверженность лечению обеспечивают снижение вирусной нагрузки — количества вируса в крови. Эти меры очень эффективны в отношении местного иммунитета слизистой оболочки и профилактики ИРШМ.
Скрининг ИРШМ заключается в проведении ПАП-теста и ВПЧ-теста (ПЦР). Женщины с ВИЧ-инфекцией в возрасте от 21 до 29 лет должны пройти ПАП-тест во время первичной диагностики ВИЧ, затем — через 12 месяцев, если анализ не показал патологии. Некоторые эксперты рекомендуют делать следующий ПАП-тест через 6 месяцев после первого. Если результаты трех последовательных мазков без отклонений, повторные тесты следует проводить каждые 3 года. ВПЧ-тест не рекомендуется подключать к ПАП-тесту до 30 лет — высока вероятность положительного результата, при этом оснований для активных действий нет. Лечения ВПЧ не существует, а для развития РШМ требуется, как правило, от 10 лет.
После 30 лет ПАП-тест и ВПЧ-тест проводятся совместно
У пациентов с ВИЧ-инфекцией повышается риск развития:
- гепатоцеллюлярной карциномы (ГЦК), связанной с вирусами гепатита С и В (ВГВ и ВГС) — в три раза;
- рака желудка, ассоциированного с инфекцией H.pylori;
- лимфомы Ходжкина — 8-13 раз. Риск связан с сопутствующей Эпштейн-Барр-инфекцией. Важно, что повсеместное внедрение АРТ не повлияло на показатели заболеваемости лимфомой Ходжкина в популяции людей с ВИЧ.
К факторам риска развития ГЦК у пациентов с ВИЧ относятся: цирроз печени, ожирение, диабет, возраст старше 60 лет, мужской пол.
Скрининг ГЦК проводится с помощью анализа крови на альфа-фетопротеин (АФП), который может продуцироваться раковыми клетками, или инструментальных методик диагностики — УЗИ, КТ, МРТ.
В последние годы всё чаще используется фиброскан для оценки стадии фиброза и близости к циррозу, независимому фактору риска ГЦК.
Предотвратить появление гепатоцеллюлярной карциномы можно с помощью своевременной вакцинации и ревакцинации от вирусного гепатита В и контроля вирусной нагрузки.
Несмотря на появление АРТ, НХЛ остаются актуальной проблемой для людей, длительное время живущих с ВИЧ. Хотя в большом количестве случаев неходжкинские лимфомы являются СПИД-индикаторными, они способны развиваться при нормальном уровне CD4-клеток и являются одной из наиболее частых причин смерти среди ВИЧ-положительных.
Общая выживаемость у пациентов с этим диагнозом низкая: более половины умирают в течение пяти лет от момента постановки диагноза
Отсюда возникают факторы риска развития НХЛ при ВИЧ-инфекции:
- наличие ко-инфекции вирусными гепатитами В, C, H.pylori;
- наличие вирусной нагрузки вируса Эпштейна-Барр или цитомегаловируса;
- наличие аутоиммунных заболеваний до постановки диагноза ВИЧ-инфекция;
- наличие специфических изменений в протеинограмме до или во время ВИЧ-инфекции;
- наличие минимальной вирусной нагрузки ВИЧ, несмотря на АРТ;
- снижение CD4-Т-лимфоцитов.
К скринингу неходжкинских лимфом относятся мониторинг вирусной нагрузки ВЭБ, ВГС, ВГВ и проведение инструментальной диагностики (КТ, МРТ, УЗИ, ФГДС).
С помощью контроля факторов риска и своевременного скрининга можно не только найти опухоль на ранней стадии, но и предотвратить заболевание.
Если рак все же обнаружили, ни в коем случае нельзя прерывать антиретровирусную терапию — она проводится по жизненным показаниям, что означает высокую вероятность неблагоприятного исхода противоопухолевой терапии без сопутствующего противовирусного лечения.
У пациентов со СПИДом часто возникают опухоли, особенно саркома Капоши, неходжкинская В-клеточная лимфома, рак шейки матки у женщин и рак анальной области у мужчин. Подсчитано, что у 25-40% ВИЧ-инфицированных пациентов без терапии со временем развивается злокачественное новообразование.
Все эти опухоли, как полагают, вызваны онкогенными ДНК-вирусами, т.е. герпес-вирусом саркомы Капоши (KSHV), EBV (В-клеточная лимфома) и HPV (карцинома шейки матки и анальной области). Даже у здоровых людей любой из этих вирусов способен вызвать инфекцию, остающуюся латентной, если иммунная система функционирует нормально.
Повышенный риск развития опухолей при СПИДе существует главным образом вследствие реактивации вирусов и неспособности организма больного сдерживать развитие инфекции, а также из-за ослабления противоопухолевого иммунитета.
В начале эпидемии СПИДа до 30% гомо- или бисексуальных мужчин имели саркому Капоши, однако в последние годы с введением HAART наблюдается заметное уменьшение ее частоты — с 15 случаев на 1000 пациентов до менее 5 случаев.
Поражение при саркоме Капоши характеризуется пролиферацией веретенообразных клеток, экспрессирующих маркеры как эндотелиальных (сосудистых или лимфатических) клеток, так и клеток гладких мышц. В изобилии также присутствуют щелевидные сосудистые пространства, указывающие на то, что источником патологии могут быть примитивные мезенхимальные предшественники сосудистых каналов. Кроме того, при саркоме Капоши обнаруживаются хронические воспалительные клеточные инфильтраты.
Многие признаки саркомы Капоши свидетельствуют о том, что она не относится к злокачественным опухолям (несмотря на свое зловещее название). Так, веретенообразные клетки при многих саркомах Капоши имеют поликлональный или олигоклональный характер, хотя в запущенных случаях иногда становятся моноклональными. Веретенообразные клетки часто являются диплоидными, которым для пролиферации необходимы факторы роста.
Когда веретенообразные клетки имплантируют иммунодефицитным мышам, опухоль не образуется, но кратковременно индуцируется образование новых кровеносных сосудов, прерываемых щелевидными пространствами, и воспалительных инфильтратов в окружающих тканях. Эти элементы напоминают признаки саркомы Капоши человека, однако имеют мышиное происхождение, и, когда элиминируются клетки саркомы Капоши человека, воспалительные и неоваскулярные элементы также регрессируют.
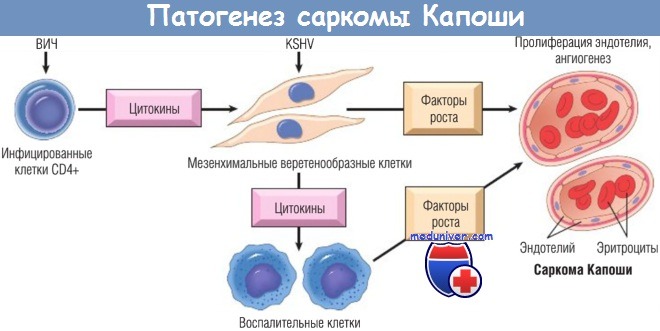
Патогенез саркомы Калоши.
Предполагаемая роль ВИН, герпес-вируса саркомы Капоши (KSHV) и цитокинов в развитии саркомы Капоши.
Цитокины образуются мезенхимальными клетками, инфицированными KSHV, или ВИЧ-инфицированными клетками CD4+.
В-клетки также могут быть инфицированы KSHV; вероятно, эти клетки связаны с лимфомами полостей тела, а также ассоциированы с KSHV-инфекцией, однако их роль при саркоме Капоши неясна.
ВИЧ — вирус иммунодефицита человека.
Существующая модель патогенеза саркомы Капоши, основанная на этих наблюдениях, заключается в том, что веретенообразные клетки продуцируют провоспалительные и ангиогенные факторы, которые мобилизуют воспалительные и неоваскулярные элементы, и последние секвестрируют факторы, способствующие выживаемости или росту веретенообразных клеток.
Однако что именно инициирует этот цикл? Существуют убедительные данные, что сам ВИЧ не является виновником и что саркому Капоши вызывает KSHV, называемый также герпес-вирусом человека 8-го типа (HHV-8). С помощью эпидемиологических и молекулярных исследований установлена связь между KSHV и развитием саркомы Капоши. ДНК KSHV обнаружена практически при всех саркомах Капоши, включая те опухоли, которые встречаются у ВИЧ-отрицательных лиц. KSHV локализован строго в веретенообразных клетках и вызывает преимущественно латентную инфекцию.
Однако для развития саркомы Капоши только KSHV-инфекции недостаточно, нужно участие кофакторов. При СПИДе в качестве такого фактора выступает ВИЧ. (Соответствующий кофактор при ВИЧ-отрицательной саркоме Капоши остается неизвестным.) Продолжается дискуссия о том, каким образом ВИЧ способствует развитию саркомы Капоши. Согласно простейшей модели, опосредованная ВИЧ иммуносупрессия дает возможность KSHV распространяться в организме-хозяине, получая доступ ко все большему числу веретенообразных клеток и направляя их по пути неконтролируемого роста.
Другая гипотеза заключается в том, что ВИЧ-инфицированные Т-клетки продуцируют цитокины или другие белки, способствующие пролиферации и выживаемости веретенообразных клеток. Ясно, что эти предположения не являются взаимоисключающими.
Также еще неизвестно, каким образом KSHV-инфекция приводит к развитию саркомы Капоши. Подобно другим герпес-вирусам, KSHV вызывает латентную инфекцию, во время которой образуется ряд белков, имеющих потенциальное значение в стимуляции пролиферации веретенообразных клеток и предотвращении апоптоза. К этим белкам относятся вирусный гомолог циклина D и различные ингибиторы р53. Такие белки могут давать латентно инфицированным клеткам преимущество в росте и выживаемости in vivo, стимулируя начало их пролиферации.
Кроме того, в небольшой субпопуляции клеток при саркоме Капоши происходит литическая вирусная репликация со смертью клеток и высвобождением прогени вируса. Литический цикл KSHV примечателен продукцией множества паракринных сигнальных молекул, включая вирусные гомологи цитокина IL-6 и различные хемокины. Возможно, последние играют существенную роль в индукции образования воспалительных инфильтратов, важного признака саркомы Капоши. Вклад вирусного IL-6 до сих пор неясен. Другой вирусный белок, продуцируемый во время литической инфекции, представляет собой конститутивно активный рецептор, связанный с G-белком.
Этот белок привлекает внимание, поскольку его экспрессия активирует высвобождение сосудистого эндотелиального фактора роста, способствующего ангиогенезу в окружающей ткани. Следует отметить, что экспрессия вирусного рецептора, связанного с G-белком, у трансгенных мышей приводит к образованию неоваскулярных пространств, отдаленно напоминающих таковые в саркоме Капоши. Таким образом, есть достаточные основания полагать, что и латентная, и литическая KSHV-инфекции вносят свой вклад в патогенез саркомы Капоши.
KSHV-инфекция не ограничена эндотелиальными клетками. Филогенетически вирус родственен подсемейству лимфотропных герпес-вирусов, соответственно его геном обнаруживается в В-клетках инфицированных индивидов. KSHV-инфекция у пациентов со СПИДом также связана с редкой В-клеточной лимфомой (называемой первичной лимфомой, связанной с полостями тела) и мультицентрической болезнью Кеслмена (В-клеточным лимфопролиферативным расстройством).
Саркома Капоши, ассоциированная со СПИДом, клинически отличается от спорадической формы. У ВИЧ-инфицированных индивидов опухоль обычно распространяется, поражая кожу, слизистые облочки, лимфоузлы и легкие. Эта опухоль имеет тенденцию к большей агрессивности, чем классическая саркома Капоши.
б) Лимфомы. Ассоциированные со СПИДом лимфомы разделяют на 3 группы в зависимости от локализации: системные лимфомы, первичные лимфомы ЦНС и лимфомы, связанные с полостями тела. Системные лимфомы поражают лимфоузлы и участки внутренних органов вне лимфоузлов. Частота системных лимфом — 80% всех связанных со СПИДом лимфом. ЦНС является наиболее часто поражаемой областью вне лимфоузлов, за ней следует ЖКТ, реже опухоль возникает практически в любом другом месте, включая глазницы, слюнные железы и легкие.
Подавляющее большинство таких лимфом представляют собой агрессивные В-клеточные опухоли, выявляемые на поздней стадии. ЦНС, помимо поражения системными неходжкинскими лимфомами, является также местом первичной локализации лимфоматоза у 20% пациентов с ВИЧ-инфекцией, у которых возникла лимфома. Первичную лимфому ЦНС регистрируют у пациентов со СПИДом в 1000 раз чаще, чем в общей популяции. Лимфомы, связанные с полостями тела, встречаются редко, однако привлекают внимание необычным проявлением в виде плевральных, перитонеальных и перикардиальных выпотов.
В основе патогенеза В-клеточных лимфом, ассоциированных со СПИДом, лежит, вероятно, длительная поликлональная активация В-клеток, вследствие чего появляются моноклональные или олигоклональные В-клеточные популяции. Предполагают, что в ходе безудержной пролиферации в некоторых клонах происходят мутации или хромосомные транслокации, затрагивающие онкогены или гены-супрессоры опухолей, с последующей неопластической трансформацией (см. главу 7). Есть морфологические данные об активации В-клеток в лимфоузлах; считают, что такая стимуляция В-клеток является многофакторным процессом.
У пациентов со СПИДом отмечаются высокие уровни различных цитокинов, некоторые из них, включая IL-6, являются факторами роста В-клеток. Кроме того, играет определенную роль EBV, известный как поликлональный В-клеточный митоген. 50% системных В-клеточных лимфом и практически все лимфомы, первично возникшие в ЦНС, латентно инфицированы.
Другим признаком, указывающим на инфекцию EBV, служит волосистая лейкоплакия полости рта (белые пятна на языке), возникающая в результате индуцированной EBV плоскоклеточной пролиферации слизистой оболочки рта. Если методом молекулярного футпринтинга EBV не определяется, вероятно, поликлональную активацию В-клеток инициировали другие вирусы и микробы. Отсутствуют доказательства того, что сам ВИЧ способен вызывать неопластическую трансформацию. Редкие эффузионные лимфомы, связанные с полостями тела, постоянно латентно инфицированы KSHV.
В результате увеличения продолжительности жизни пациентов со СПИДом количество лиц с неходжкинской лимфомой неуклонно растет. Считают, что у 6% всех пациентов со СПИДом в течение жизни развивается лимфома. Таким образом, риск возникновения неходжкинской лимфомы среди пациентов со СПИДом в
120 раз выше, чем в общей популяции. В отличие от саркомы Капоши иммунодефицит здесь прочно занял центральное место как предрасполагающий фактор. Предположительно пациенты с числом Т-клеток CD4+ менее 50 в 1 мкл относятся к группе крайне высокого риска.
в) Другие опухоли. У пациентов со СПИДом также повышена частота карциномы шейки матки и анальной области. Вероятно, это обусловлено реактивацией латентной инфекции, вызванной HPV, в результате иммуносупрессии. Считают, что этот вирус тесно связан с плоскоклеточной карциномой шейки матки и предшествующими ей дисплазией шейки матки и карциномой in situ. Ассоциированную с HPV цервикальную дисплазию регистрируют у ВИЧ-инфицированных женщин в 10 раз чаще, чем у неинфицированных женщин, поэтому гинекологическое исследование должно быть частью рутинного обследования ВИЧ-инфицированных женщин.
- Рекомендуем ознакомиться со следующей статьей "Болезни ЦНС при СПИДе"
Читайте также:


