Репликация вируса вич-инфекции происходит в
Просто о сложном


-->СТАТЬИ -->
| [07.07.2014] | [Вирусы] |
| Натуральная оспа (0) | |
| [18.07.2014] | [Вирусы] |
| Вирусы. Краткий обзор (0) | |
| [21.07.2014] | [Общие понятия] |
| Вирусология (0) | |
| [03.07.2014] | [Общие понятия] |
| Немного истории (0) | |
| [04.07.2014] | [Инфекции] |
| Цитомегаловирусная инфекция (0) | |
| [21.08.2014] | [Вирусы] |
| Вирус иммунодефицита человека (ВИЧ) (0) | |
| [22.08.2014] | [Вирусы] |
| Строение и жизненный цикл вируса иммунодефицита человека (ВИЧ) (1) | |
| [09.02.2016] | [Вирусы] |
| Лихорадка Зика (0) | |
Строение вируса иммунодефицита человека
 |
| Строение вируса иммунодефицита человека |
Вирионы ВИЧ имеют вид сферических частиц, диаметр которых составляет около 100—120 нанометров (это приблизительно в 60 раз меньше диаметра эритроцита).
В состав зрелых вирионов входит несколько тысяч белковых молекул различных типов.
Капсид зрелого вириона, состоящий из примерно 2000 молекул белка р24, имеет форму усечённого конуса.
Внутри капсида находится белково-нуклеиновый комплекс: две нити вирусной РНК, прочно связанные с белком нуклеокапсида p7, ферменты (обратная транскриптаза, протеаза, интеграза).
С капсидом также ассоциированы белки Nef и Vif (7—20 молекул Vif на вирион).
Внутри вириона (и, вероятнее всего, за пределами капсида) обнаружен белок Vpr8-11. Кроме того, с капсидом ВИЧ-1 (но не ВИЧ-2) связазны около 200 копий клеточного фермента пептидилпролилизомеразы, необходимого для сборки вириона.
Капсид окружён оболочкой, образованной примерно 2000 молекул матриксного белка p17. Матриксная оболочка в свою очередь окружена двуслойной липидной мембраной, являющейся наружной оболочкой вируса. Она образована молекулами фосфолипидов, захваченными вирусом во время его отпочковывания от клетки, в которой он сформировался.
С помощью белка gp120 вирус присоединяется к рецептору CD4 и корецептору, находящимся на поверхности Т-лимфоцитов человека. Стехиометрическое соотношение p24:gp120 в вирионе составляет 60—100:1.
Белки gp41 и в особенности gp120 интенсивно изучаются в качестве возможных мишеней для разработки лекарств и вакцины против ВИЧ .
При формировании наружной оболочки вируса также происходит захват некоторого количества мембранных белков клетки, в том числе человеческих лейкоцитарных антигенов (HLA) классов I и II и молекул адгезии.
Функции важных структурных белков ВИЧ-1
Сокращение
Описание
Функции
gp41 (TM, transmembrane)
Трансмембранный гликопротеин массой 41 кДа
gp120 (SU, surface)
Гликопротеин массой 120 кДа
Наружный белок вириона. Нековалентно связан с трансмембранным белком gp41. С одной молекулой gp41 связаны 3—5 молекул gp120. Способен связывать рецептор CD4. Играет важную роль в процессе проникновения вируса в клетку.
Белок массой 24 кДа
Образует капсид вируса
Матриксный белок массой 17 кДа
Около двух тысяч молекул этого белка образуют слой толщиной 5—7 нм, располагающийся между внешней оболочкой и капсидом вируса.
p7 (NC, nucleocapsid)
Нуклеокапсидный белок массой 7 кДа
Входит в состав ка псида вируса. Образует комплекс с вирусной РНК.
Геном и кодируемые белки
 |
| Геном ВИЧ-1 |
Геном ВИЧ-1
Генетический материал ВИЧ представлен двумя копиями положительно-смысловой (+)РНК. Геном ВИЧ-1 имеет длину 9000 нуклеотидов. Концы генома представлены длинными концевыми повторами (англ. long terminal repeat, LTR), которые управляют продукцией новых вирусов и могут активироваться и белками вируса, и белками инфицированной клетки. 9 генов ВИЧ-1 кодируют, по крайней мере, 15 белков.
Ген pol кодирует ферменты: обратную транскриптазу (RT), интегразу (IN) и протеазу (PR).
Ген gag кодирует полипротеин Gag/p55, расщепляемый вирусной протеазой до структурных белков p6, p7, p17,p24.
Ген env кодирует белок gp160, расщепляемый клеточной эндопротеазой фурином на структурные белки gp41 и gp120.
Другие шесть генов — tat, rev, nef, vif, vpr, vpu (vpx у ВИЧ-2) — кодируют белки, отвечающие за способность ВИЧ-1 инфицировать клетки и производить новые копии вируса. Репликация ВИЧ-1 in vitro возможна без генов nef, vif, vpr, vpu, однако их продукты необходимы для полноценной инфекции in vivo.
Gag: Полипротеин-предшественник Gag/p55 синтезируется с полноразмерной геномной РНК (которая в данном случае служит в качестве мРНК) в процессе стандартной кэп-зависимой трансляции, но возможна и IRES-зависимая трансляция. Предшественники функциональных белков располагаются в составе полипротеина Gag/p55 в следующем порядке: p17…p24…p2…p7…p1…p6 (р1 и р2 — соединительные пептиды; другие продукты расщепления Gag/p55 описаны выше).
Домен М, расположенный внутри области p17/МА, миристилируется (присоединяются остатки миристиновой кислоты) и направляет Gag/p55 к плазматической мембране. Домен I, находящийся внутри области p7/NC, отвечает за межмолекулярные взаимодействия отдельных мономеров Gag/p55. Домен L, также локализованный в области p7/NC, опосредует отпочковывание вирионов от плазматической мембраны; в этом процессе участвует также р6 область полипротеина Gag/p55.
Vpu: Двумя важными функциями белка Vpu являются:
1) разрушение клеточного рецептора CD4 в эндоплазматическом ретикулуме путём привлечения убиквитинлигазных комплексов и
Vpr: Белок Vpr необходим для репликации вируса в неделящихся клетках, в том числе макрофагах. Этот белок, наряду с другими клеточными и вирусными белками, активирует длинные концевые повторы генома ВИЧ. Белок Vpr играет важную роль в переносе провируса в ядро и вызывает задержку деления клетки в периоде G2.
Nef: Белок Nef выполняет несколько функций. Он подавляет экспрессию молекул CD4 и HLA классов I и II на поверхности инфицированных клеток, и тем самым позволяет вирусу ускользать от атаки цитотоксических T-лимфоцитов и от распознавания CD4+-лимфоцитами. Белок Nef может также угнетать активацию T-лимфоцитов, связывая различные белки-компоненты систем внутриклеточной передачи сигнала.
У инфицированных вирусом иммунодефицита макак-резусов активная репликация вируса и прогрессирование болезни возможны только при интактном гене nef. Делеции гена nef были обнаружены в штаммах ВИЧ, выделенных у группы австралийцев с длительным непрогрессирующим течением инфекции.
Однако у части из них со временем появились признаки прогрессирования инфекции, в том числе снижение числа CD4+-лимфоцитов. Таким образом, хотя делеции гена nef и могут замедлять репликацию вируса, это не гарантирует полной невозможности прогрессирования заболевания.
Tat и Rev: Регуляторные белки Tat (транс-активатор) и Rev накапливаются в ядре клетки и связывают определённые участки вирусной РНК. Белок Tat имеет молекулярную массу около 14-15 кДа, связывает вторичную структуру геномной РНК вблизи 5'-нетранслируемой области активирует обратную транскрипцию геномной РНК ВИЧ, синтез вирусных мРНК, необходим для репликации вируса почти во всех культурах клеток, регулирует выход вирионов из зараженных клеток, нуждается в клеточном кофакторе — циклине T1. Белок Rev регулирует экспрессию белков вириона, связывает мРНК гена env в области RRE (англ. Rev response element) интрона, разделающего экзоны генов Tat и Rev.
Белки Tat и Rev стимулируют транскрипцию провирусной ДНК и транспорт РНК из ядра в цитоплазму, а также необходимы для трансляции. Белок Rev обеспечивает также транспорт компонентов вируса из ядра и переключение синтеза регуляторных белков вируса на синтез структурных.
Жизненный цикл
На схеме показано слияние вирриона ВИЧ и плазматической мембраны Т-лимфоцита человека

Этап 1. Взаимодействие вирусного белка gp120 с клеточным рецептором CD4 (указано красной стрелкой)

Этап 2. Конформационные изменения вирусного белка gp120 обеспечивают связывание с клеточным рецептором CCR5 (указано красной стрелкой)

Этап 3. Концевые участки вирусного белка gp41 проникают в плазматическую мембрану клетки (указано красной стрелкой)

Этап 4. Вирусный белок gp41 подвергается значительным конформационным изменениям, складывается пополам (указано красной стрелкой) и образует спираль, что приводит к сближению и слиянию мембран вириона и клетки. Таким образом ВИЧ захватывает Т-лимфоцит с целью дальнейшей репродукции.
Проникновение в клетку и интеграция
Вирусная инфекция начинается, когда вирион ВИЧ сталкивается с человеческой клеткой, имеющей на своей мембране рецептор CD4. Вирусный гликопротеин gp120 прочно связывает рецептор CD4. В результате такого взаимодействия gp120 претерпевает конформационные изменения, которые позволяют ему также связать молекулу корецептора CXCR4 или CCR5 (экспрессируемых на поверхности Т-лимфоцитов, макрофагов, дендритных клеток и микроглии).
В зависимости от способности связывать эти корецепторы, ВИЧ классифицируют на R5-тропные (связывают только CCR5), X4-тропные (связывают только CXCR4) и R5X4-тропные (могут взаимодействовать с обоими корецепторами). Препараты, блокирующие корецепторы могут быть эффективны против ВИЧ.
После описанных событий мембрана клетки и мембрана вириона ВИЧ сливаются, и содержимое вириона проникает внутрь клетки. Белок gp41 очень важен для слияния мембран, поэтому его рассматривают в качестве мишени для разработки противовирусных препаратов. Внутри клетки вирусная РНК высвобождается из капсида, и происходит обратная транскрипция — синтез ДНК на основе матрицы одноцепочечной геномной РНК вируса, катализируемая обратной транскриптазой.
Большая часть лекарственных препаратов, одобренных для применения при ВИЧ-инфекции, направлена на нарушение работы обратной траскриптазы. Синтезированная ДНК транспортируется внутрь ядра клетки и встраивается в хромосому хозяина под действием интегразы. Несколько препаратов, ингибирующих интегразу, проходят ранние стадии клинических испытаний. Вирусная ДНК, встроившаяся в хромосому клетки, называется провирусом.
Человеческая РНК-полимераза в ядре клетки синтезирует информационную РНК (мРНК), а позднее и геномную РНК вируса. Синтезированные РНК транспортируются обратно в цитоплазму, где на матрице мРНК на рибосомах синтезируются вирусные ферменты, структурные и регуляторные белки.
Сборка и отпочковывание вирионов
Геномная РНК вируса, а также вирусные белки транспортируются к местам сборки вирионов. Сборка вирионов происходит на мембране, куда направляется миристилированный полипротеин Gag/p55. Вирионы первоначально формируются из полипротеинов-предшественников структурных белков и ферментов и на этой стадии не являются инфекционными.
В ходе созревания вирусной частицы вирусная протеаза расщепляет белки-предшественники до функциональных компонентов. Несколько одобренных противовирусных препаратов ингибируют работу протеазы и препятствуют формированию зрелых вирионов.
Новые вирусные частицы отпочковываются от поверхности клетки, захватывая часть её мембраны, и выходят в кровяное русло, а клетка хозяина, несущая рецептор CD4, погибает. Недавние исследования показали, что процесс отпочковывания вирионов может быть более сложным, чем считалось ранее. Так было обнаружено, что благодаря взаимодействию белка Gag с компонентами клетки вирионы накапливаются в особых внутриклеточных мультивезикулярных тельцах, которые обычно служат для экспорта белков. Таким образом вирусные частицы высвобождаются из клетки, эксплуатируя её собственную систему транспорта макромолекул.
Распространение по организму
В период острой фазы ВИЧ-инфекции отсутствие специфического иммунного ответа позволяет вирусу активно реплицироваться и достигать высоких концентраций в крови.
Вирус заселяет органы лимфатической системы, CD4 + -лимфоциты, CD8 + -лимфоциты и макрофаги, а также другие клетки: альвеолярные макрофаги лёгких,клетки Лангерганса, фолликулярные дендритные клетки лимфатических узлов, клетки олигодендроглии и астроциты мозга и эпителиальные клетки кишки.
В лимфоидной ткани ВИЧ размножается на протяжении всего заболевания, поражая макрофаги, активированные и покоящиеся CD4 + -лимфоциты и фолликулярные дендритные клетки. Количество клеток, содержащих провирусную ДНК, в лимфоидной ткани в 5—10 раз выше, чем среди клеток крови, а репликация ВИЧ в лимфоидной ткани на 1—2 порядка выше, чем в крови.
Резервуаром ВИЧ служат лимфатические узлы и конкретно дендритныe клетки, в которых вирус сохраняется длительное время после периода острой виремии.
Для активации CD8 + -лимфоцитов и образования антиген-специфических цитотоксических T-лимфоцитов необходима презентация пептидного антигена в комплексе с человеческим лейкоцитарным антигеном класса I.
Дендритные клетки, необходимыe для начала первичных антиген-специфичных реакций, захватывают антигены, перерабатывают и переносят их на свою поверхность, где эти антигены в комплексе с дополнительными стимулирующими молекулами активируют T-лимфоциты.
Заражённые клетки часто не выделяют дополнительных стимулирующих молекул и поэтому не способны вызвать активацию достаточного числа B и T-лимфоцитов, функция которых зависит от дендритных клеток.
После завершения обратной транскрипции в CD4 + -лимфоците вирусный геном представлен провирусной невстроенной ДНК. Для встраивания провирусной ДНК в геном клетки-хозяина и для образования новых вирусов необходима активация T-лимфоцитов.
Контакт CD4 + -лимфоцитов и антигенпредставляющих клеток в лимфоидной ткани, наличие вирусов на поверхности фолликулярных дендритных клеток и присутствие провоспалительных цитокинов (ИЛ-1, ИЛ-6 и ФНОα) способствуют размножению ВИЧ в инфицированных клетках. Именно поэтому лимфоидная ткань служит самой благоприятной средой для репликации ВИЧ.
На 2014 год ВИЧ-инфекция остаётся неизлечимым заболеванием, так как геном вируса интегрируется в хромосомы клеток и может реактивироваться даже после курса антиретровирусной терапии.
В настоящее время идёт поиск безопасных способов редактирования генома человека и исключения из него провирусной ДНК. В 2014 году был предложен метод удаления генома ВИЧ-1 из заражённых клеток при помощи системы CRISPR/Cas9. С помощью этого метода исследователям удалось вырезать фрагмент провирусной ДНК, заключённый между 5'- и 3'-концевыми LTR-областями из хромосом зарежённых клеток в культуре.
Кроме того, этот метод оказался также эффективным для профилактики заражения неинфицированных клеток. Описанный подход может привести к разработке способа полного избавления от ВИЧ-инфекции.
До настоящего момента мы обсуждали события, происходящие на ранней стадии взаимодействия ВИЧ с клеткой. Это взаимодействие зависит от участвующего в нем типа вируса, экспрессируемых клеточных рецепторов и свойств инфицируемых клеток. После того как вирус проникнет в клетку, различные биологические свойства вирусных белков и нуклеиновых кислот определяют его способность к репликации. На инфекционный цикл ВИЧ также влияют внутриклеточные белки, которые у различных типов клеток могут различаться.
После попадания ВИЧ в клетку нуклеокапсида ВИЧ происходит запуск определенных внутриклеточных процессов, которые приводят к интеграции провирусной ДНК в хромосомы клетки. На раннем этапе вырусная геномная РНК высвобождается из вирусного капсида с помощью белка оболочки нуклеоида р24, связанного с клеточным белком циклофилином. Циклофилин А (СурА) представляет собой фермент пептидил-пролил изомеразу, которая связывается с белком капсида (СА) и способствует репликации ВИЧ.
Он включается в состав вирионов ВИЧ в результате прямого взаимодействия с белком Gag во время сборки вириона. Его активирующее влияние на продуцирование вируса зависит от его присутствия в клетке-мишени. Этот процесс может быть заблокирован циклоспорином.
Все еще находясь в связанном состоянии с белками нуклеоида (в основном с матриксным белком р17), вирусная РНК подвергается процессу обратной транскрипции под действием вирусной РНК-(или ДНК)-зависимой ДНК полимеразы и РНКазы Н2, по окончании которой образуется двухцепочечная ДНК-реплика вирусного генома (или провирусная ДНК).
Для осуществления эффективной обратной транскрипции белок нуклеокапсида (NC) р7, по-видимому, выступает в качестве белка-шаперона. Он способствует сохранности транскриптов ДНК, образующихся в результате обратной транскрипции и позже, перед отпочкованием дочерних вирионов, участвует в правильной упаковке (фолдинге) геномной РНК вирусов. Этот уникальный для ретровирусов белок NC содержит два цинковых пальца, которые необходимы для осуществления его функций.
Образующаяся реплика ДНК входит в состав преинтеграционного комплекса (PIC), который содержит вирусный белок р17, белок Vpr и интегразу(IN).
Недавно проведенные исследования показали, что эмерин, интегральный белок внутренней оболочки мембраны ядра, возможно вносит необходимый вклад в возможность репликации ВИЧ в клетке. При отсутствии эмерина провирусная ДНК не может взаимодействовать с хроматином и встраиваться в хромосому.
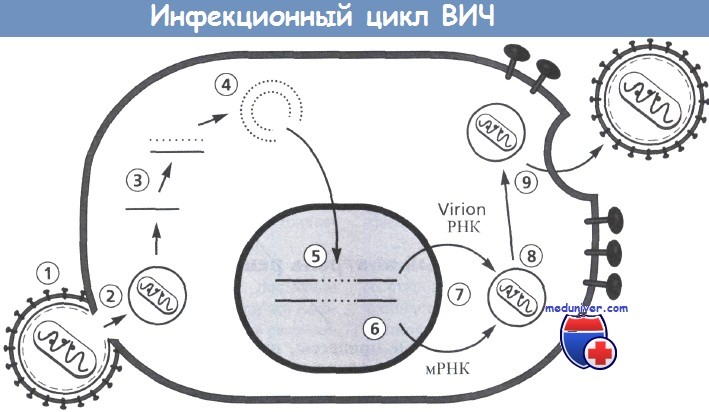
Инфекционный цикл ВИЧ.
Включает следующие этапы: 1 - прикрепление; 2 - декапсидация; 3 - обратная транскрипция;
4 - образование кольцевых форм; 5 - интеграция; 6 - транскрипция; 7 - трансляция;
8 - сборка вирусной сердцевины; 9 - окончательная сборка и отпочкование вирионов.
На этапах от 3 до 5 некоторые белки вирусной сердцевины связываются с вирусным геномом ( РНК, ДНК).
Двухцепочечные циркулярные формы ДНК могут быть связаны ковалентно и нековалентно.
Последние представляют собой формы, которые интегрируются в хромосому клетки. Противовирусная терапия может быть направлена на каждый этап и потенциально способна нарушать репликацию и распространение вируса.
Рисунок предоставлен Н. Kessler.
Интеграция провируса ВИЧ, по-видимому, происходит преимущественно в транскрипционно активных областях генома клетки, особенно в тех, которые были активированы под действием самого ВИЧ. Интеграция может проходить с участием специфического молекулярного комплекса, локализованного в ядре и состоящего состоящего из вирусной интегразы и фактора роста/коактиватора транскрипции, идентифицированного как продукт, секретируемый эпителиальными клетками хрусталика человека и имеющего мол. вес 75 кДа - р75 (LEDGE/p75 - lens epithelium-derived growth factor/transcription coactivator p75).
LEDGE/p75 представляет собой клеточный белок, связанный с хроматином, который, по-видимому, защищает клетку от стресс-индуцированного апоптоза и является главным фактором, связывающим интегразу вируса с хроматином клетки. LEDGE/ р75, по видимому, обеспечивает интеграцию ВИЧ в транскрипционно активных участках клеточной ДНК, в особенности обогащенных G-C последовательностями нуклеотидов. Однако до сих пор неизвестно, насколько связывание интегразы с хроматином через LEDGE/p75 определяет выбор участка действия для интергразы.
Транспорт PIC в ядро может зависеть от взаимодействия вирусных белков р17 и Vpr с клеточным кариофериновым комплексом, содержащим циклофилины. Как отмечали выше, клеточный белок циклофилин А, связанный с Gag внутри вириона, участвует в ранних стадиях репликативного цикла ВИЧ-1. Однако такое участие, по-видимому, не является необходимым, поскольку Gag-белки других реплицирующихся ретровирусов, в том числе ВИЧ-2, SIV и изолятов ВИЧ-1 группы О, не связываются с СурА.
Кроме того, некоторые исследователи, используя вирусные частицы, помеченные зеленым флуоресцентным белком (GFP), смогли показать, что ВИЧ после проникновения связывается с компонентами цитоскелета в цитоплазме и, возможно, переносится на сеть микротрубочек, где и происходит обратная транскрипция еще до удаления капсидного белка. Затем, после образования PIC, он перемещается к ядерной оболочке и проникает внутрь через ядерные поры. Обычно активация клетки усиливает ВИЧ-инфекцию, облегчая проникновение PIC в ядро.
После интеграции вируса первые вирусные информационные РНК, которые синтезируются в инфицированной клетке, представляют собой дважды сплайсированные транскрипты, кодирующие большинство регуляторных белков, в частности tat, rev и nef. Большую часть (80%) таких мРНК составляет мРНК nef, хотя неизвестно, какой из вирусных белков синтезируется первым.
До сих пор точно не выяснено, может ли образовываться инфекционный ВИЧ без интеграции провируса в хромосомы клетки. В нескольких исследованиях была показана необходимость интеграции ВИЧ для эффективной продукции дочерних вирусов. В одном исследовании, проведенном с использованием SIV, мутантных по области генома int/nef, наблюдали существенное снижение репликации вируса, несмотря на то, что небольшая экспрессия вирусных антигенов все же происходила. В настоящее время интеграцию провирусной ДНК в геном клетки-хозяина считают необходимой для продукции дочерних вирусов, но экспрессия отдельных белков ВИЧ (например, Nef или Gag) может происходить и без такой интеграции.
Регуляторные белки вируса необходимы на первых этапах развития инфекции в покоящейся клетке и, таким образом, их ранняя транскрипция играет важную роль и может объяснять, почему эпитопы именно белков Nef и Tat преимущественно распознаются цитотоксическими Т-лимфоцитами в ранние сроки острой инфекции. Предположительно, пребывание ВИЧ в продуктивном или латентном состоянии может определяться интенсивностью продукции вирусных белков. Высокий уровень экспрессии Tat приводит к выраженной активации продукции вирусных частиц.
Nef играет плейотропную роль и обычно увеличивает репликацию вируса, но функциональные преференции Nef зависят от типа инфицированной клетки и конкретной нуклеотидной последовательности гена nef.
Белок Rev, по-видимому, обеспечивает поддержание равновесия между экспрессией регуляторных и структурных белков ВИЧ. Rev способствует транспорту в цитоплазму больших молекул несплайсированной вирусной РНК, отвечающей за трансляцию белков со структурных генов вируса, включая ферменты, а также несплайсированная вирусная РНК становится геномом дочерних вирионов. В результате образуются инфекционные вирусные частицы.
Реализация функций вирусного белка Rev зависит от определенных клеточных факторов (например, CRM-1 и hRIP). Ранние исследования обезьяньего вируса Мэйсона-Пфайзера позволили идентифицировать вирусный ген, который может заменять Rev, взаимодействуя с клеточным фактором, участвующим в транспорте вирусной РНК. На поздних стадиях цикла репликации вируса Rev способен угнетать свою собственную продукцию, вызывая уменьшение образования дочерних вирусов и, возможно, обеспечивая переход вируса в латентное состояние.
В клетках, не способных поддерживать полноценную репликацию ВИЧ, уровень относительной экспрессии регуляторных белков может быть различным, что, в свою очередь определяет судьбу вирусной инфекции: будет она в абортивной форме, будет персистировать на низком уровне или разовьется латентное состояние вирусной инфекции.
Большие белки-предшественники Gag и Gag/Pol локализованы в этих рафтах, и отпочкование вирусных частиц происходит преимущественно в этих областях. Такое прикрепление вириона к липидным рафтам обеспечивается за счет большого количества холестерола и, по-видимому, является необходимым для сборки и высвобождения вируса. Nef может влиять на усиление синтеза холестерола в клетке и его встраивание в участки мембраны, используемые вирионами.
Одним из клеточных белков, участвующих в разрыве клеточной мембраны при высвобождении вируса, является продукт гена чувствительности человека к опухолям №101 (Tsg101 - tumor susceptibility gene 101). Он связан с убиквитин-конъюгированными ферментами с одной стороны и связывает вирусный белок р6 с другой стороны. Этот клеточный белок способствует отпочкованию вируса, направляя большой транслят Gag к мембране клетки и помогая созреванию вирусных частиц и высвобождению вируса из клетки. Tsg101 также может предотвращать полиубиквитинирование и деградацию Gag.
Зрелый нуклеоид ВИЧ к моменту отпочкования напоминает конус фуллерена. Окончательное созревание белков вириона, то есть нарезание больших транслятов на дефинитивные белки вируса под действием вирусных протеаз происходит внутри отпочковывающейся частицы. Белок р2 капсида, также как и Vpu, участвуют в последних этапах сборки вирусной частицы. Как отмечали выше, у многих изолятов ВИЧ-1 важную роль в процессе сборки вирионов также могут играть циклофилины, которые связываются с белком капсида р24.
ВИЧ – самая опасная новая болезнь современности, которая на сегодняшний день не поддается лечению. Для выяснения причины обстоятельств необходимо определить, какие клетки поражает инфекция ВИЧ. В первую очередь, влиянию подвергается иммунная система человека, по мере дальнейшего развития ВИЧ поражаются внутренние органы больного. Как только после заражения вирусом наблюдается поражение жизненно важных анатомических структур человеческого организма, состояние пациента существенно ухудшается – неминуемо приближение смерти.
Структура ВИЧ

Вирион – вирус за пределами клетки, выступающий в роли конечной стадии прогрессирования вирусов. Только вирионы выступают базой для вирусной классификации и ранжирования.
ВИЧ (1, 2 типа) имеет в своей основе ядро (нуклеокапсид), сгруппированный из РНК и ферментных элементов, а также мембрану.
ВИЧ состоит из пары одноцепочечных вирусных РНК и тройки ферментов, в числе которых: ревертаза, интеграза и протеаза. Они соединены капсидными белками. На поверхности капсида расположены молекулы матриксного белка p17. Связь с геномной РНК формируется за счет нуклеокапсидного белка p7 и p9. Белок Vhr – содержимое капсида вириона.
Ревертаза – ферментный элемент, обеспечивающий синтез ДНК на матрице РНК. Обычно описываемые процессы характеризуются обратным порядком – отсюда и название фермента.
Интеграза – ферментный элемент, стимулирующий процесс интеграции вирусной ДНК в хозяйскую хромосому и стимулирующий выработку антител.
Протеаза – ферментный элемент, занимающийся расщеплением пептидных связующих звеньев между белковыми элементами, аминокислотами.
Белки ВИЧ

Когда вирион нуклеокапсид оказывается внутри хозяйской клетки (теперь его именуют вирусом), под действием фермента ревертаза наблюдается синтез ДНК на матрице РНК – получается провирус.
На следующем этапе на матрицах провирусов наблюдается синтезирование новых молекул РНК вируса и структурных, регуляторных белков, ответственных за сборку и процесс отпочкования вирусов. В капсиде располагаются белки, которые вирусная частица захватывает из пораженной клетки.
Ген Gаg ответственен за процесс синтезирования структурных белков. Речь идет об элементах, которые, в отличие от gp4 и gp120, являются составляющими капсида и мембраны.
Капсидные белки – единица геномных белковых соединений, формирующая ферментные элементы. Белок p24 образует мембрану нуклеокапсида, p17 – матриксное вещество, а p7, p9 собирают связь с геномной РНК.
Далее речь пойдет о белках, ответственных за ориентировку для ВИЧ-агентов на определенные клетки-мишени в организме хозяина.
Речь идет об обратной транскриптазе, интегразе, протеазе, кодируемых геном Pol. Как уже упоминалось ранее, эти белки ответственны за интеграцию и размножение вируса.
Гены Tat, Nef, Vif и Rev занимаются кодировкой белков, контролирующих процесс размножения и сборки вирусов.
Какие клетки поражаются вирусом?
Какие клетки, в первую очередь, поражает СПИД? Как только вирусные частицы оказываются в кровотоке человека, организм запускает процесс борьбы с патогенным объектом. Это происходит в результате взаимодействия антигена с особыми иммунокомпетентными клетками с клеточным рецептором CD4.
Строение возбудителя обеспечивает повреждающее действие на иммунные клетки. Белок Rev занят поражением ДНК человеческих клеток. Со стороны иммунитета хозяина в борьбу с ним вступает белок CD317, который несколько притормаживает процесс распространения антигена. При снижении количества этого белка, происходит неизбежное прогрессирование заболевания.
Проникновение вируса в Т-хелперы приводит не только к их гибели, но и стимулирует развитие качественных дефектов. Частые взаимодействия с провокатором становятся следствием развития неспособности Т-лимфоцитов распознавать антигены – противостоять развитию сторонних недугов.
Репликация ВИЧ

Процесс слияния вируса с иммунными клетками осуществляется за счет находящихся на поверхности рецепторов CD4. Провокатор контактирует с мембраной, затем оказывается внутри клетки.
Внутри клетки вирусное РНК выходит из капсида. Посредством обратной транскриптазы на клеточном уровне осуществляется синтез ДНК, основанный на одноцепочечной РНК. Описываемый процесс вызывает последующую интеграцию ДНК.
Синтезированная ДНК, которая поражает клетку-мишень, оказывается внутри клеточного ядра. Затем наблюдается процесс ее встраивания в хромосому, который завершается образованием провируса.
На этом этапе происходит синтез новых РНК на матрице провирусов с участием специальных ферментов. Кроме этого, синтезируются структурные и регуляторные белки, ответственные за сборку и увеличение количества поражающих клеток.
Репликация вирусов продолжается. Вирионы, находящиеся в цитоплазме, сразу не считаются инфекционными, поскольку состоят из белков-предшественников. С развитием заболевания эти компоненты расщепляются на функциональные единицы. Когда вирион созревает, происходит его отпочкование и захват белков из оболочки клетки хозяина. Это необходимо вириону, чтобы сформировать свою мембрану.
Продолжительность жизни вириона в плазме крови – не более 8 часов. Около половины клеток гибнет по истечении 6-ти часов. Если вирион обитает в другом биологическом материале, скажем, слюне, его жизнь существенно сокращается. На выходе из клетки вирионы продолжают инфицировать CD4-лимфоциты, эпителиальные клетки и пр.

Симптомы
До появления первых симптомов ВИЧ может пройти от 3 до 12 недель – этот период называют инкубационным. На втором этапе у большинства зараженных проявляются следующие признаки заболевания:
- Типичные симптомы на проникновение вируса. Повышение температуры тела, увеличение лимфатических узлов, общее недомогание (симптоматика схожа с проявлениями типичной простуды).
- Симптомы со стороны ЛОР-органов. Болезненность в горле, усиливающаяся в момент трапезы, разговора. Человек страдает от лихорадки, слабости.
Косвенными симптомами недуга являются:
- гипертрофия печени;
- увеличение селезенки;
- продолжительная диарея;
- высыпания на коже.
В дальнейшем у человека диагностируются вирусные, грибковые, инфекционные заболевания, поражающие слизистые оболочки и кожный покров больного.
На четвертой стадии патологии наблюдаются следующие симптомы:
- потеря массы тела;
- поражения внутренних органов;
- онкология;
- вирусные, бактериальные недуги слизистых оболочек и кожи.
Выше, собственно, и перечислены симптомы СПИДа. На этом этапе наблюдается истощение организма, развитие осложнений при следующих патологических процессах:
- пневмонии;
- герпеса (с поражением нервной системы и внутренних органов);
- молочницы (нередко сочетается с респираторными недугами);
- токсоплазмоза;
- туберкулеза и пр.
Помимо этого, в процессе развития ВИЧ диагностируются злокачественные опухоли и патологические процессы.
Основной удар по иммунной системе
Как уже упоминалось ранее, развитие патологии сопровождается постепенным угнетением иммунитета человека. Поражение иммунных клеток приводит к невозможности организма больного противостоять вирусу. Какими бы ни были причины развития СПИДа, по истечении нескольких лет пациент в полной мере ощущает, как именно проявляется СПИД, в то время как внутри человеческого организма продолжается процесс взаимодействия вируса со структурными элементами – прочими клетками организма (не Т-лимфоцитами).
Речь идет о самых активных фагоцитах периферической крови. При стремительном развитии заболевания они инфицируются и погибают. Эти элементы, как и Т-лимфоциты, играют роль резервуара для вируса и, несмотря на факт сохранения антимикробной функции, когда поражаются, утрачивают способность к противостоянию инфекции.
ВИЧ поражает также макрофаги. Лимфоциты и макрофаги имеют на своей поверхности CD4-рецепторы, однако, у вторых представителей их количество снижено. Именно по этой причине эти элементы погибают не так быстро, как Т-киллеры. Вирус характеризуется тропностью к внутриэпидермальным макрофагам – клеткам Лангерганса, заполняющим ростковый слой эпидермиса. Эти структурные элементы ответственны за доставку антигенов в лимфоидную ткань, что обеспечивает активацию клеточного и гуморального иммунитета. Если клетки инфицированы, они вырабатывают цитокины, высокое содержание которых приводит к гибели клеток.
Факторов, которые являются причиной гибели этих клеток, несколько. Основные из них: апоптоз и гиперактивация иммунитета в ответ на внедрение вируса в организм. Наибольший урон приносит уничтожение Т-лимфоцитов, дендритных клеток, памяти.
Дендритные клетки отвечают за выработку гуморального и клеточного иммунитета. В большинстве своем они концентрируются в лимфоидной ткани. Они же поглощают различные антигены и передают сигнал Т-лимфоцитам. Соответственно, при их поражении прекращается процесс регулировки иммунного ответа организма – развивается неустойчивость последнего к раздражителям извне.
Вирус склонен приводить к гибели не только иммунные клетки, но и поражать ЦНС инфицированного человека.
Каждая сотая нейроглиальная клетка разрушается за счет вызванной репликации вируса. Процесс гибели последних провоцирует трофические и функциональные повреждения в мозговой ткани и нейронах. Эти клетки приводит в никчемное состояние синдром приобретенного иммунодефицита. Развивающийся в организме больного неопластический процесс и оппортунистическая инфекция также приводят к дегенерации локальной ткани.
Вирусная репликация наиболее оперативно протекает в лимфоидных органах. В первую очередь, речь идет о тимусе и костном мозге. Завершение процесса разрушения локальной ткани приводит к концентрации коллагена – формируется фиброзная ткань в лимфатических узлах и прочих анатомических структурах. Описанное явление становится причиной значительного сокращения количества стромальных и дендритных клеток, предотвращающих развитие апоптоза.
В большинстве случаев при развитии ВИЧ диагностируется поражение ЦНС. Первые симптомы такого явления могут дать о себе знать как в начальный период болезни, так и при вторичных проявлениях заболевания. В некоторых случаях симптоматика поражений клеток мозга выступает единственным признаком развития СПИДа.
В начальной стадии развития инфекции (в течение 6-12 месяцев) о локальных поражениях свидетельствует прогрессирование следующих патологических процессов в организме зараженного:
- менингоэнцефалита;
- нейропатии;
- синдрома Гийена-Барре;
- миелопатии.
При отсутствии соответствующих терапевтических мероприятий следует проявление следующих патологий:
- лимфомы;
- саркома Капоши;
- инфаркта мозга;
- абсцесса и др.
Внимание! Поскольку в большинстве своем в процессе развития патологии происходит поражение мозга, что приводит к нарушению в ЦНС, очень важно своевременно начать терапию, дабы исключить появление осложнений.
В случае с ВИЧ заходит речь и о поражении других внутренних органов, в частности, системы дыхания. Явление выражается в развитии бронхиальной астмы, пневмонии, туберкулеза и других патологий.
В числе ключевых признаков локальных патологических процессов:
- повышение температуры тела;
- выделение мокроты при кашле.
Больные, обозначившие такие признаки, могут продолжать лечиться от предполагаемых заболеваний дыхательной системы. Однако непродолжительное затухание симптоматики вновь сменяется прогрессированием патологического процесса.
При подобных обстоятельствах у инфицированных лиц очень часто появляется туберкулез, так как ослабленный иммунитет не может справиться с инфекцией. У этих пациентов недуг быстро набирает темпы развития, протекает ярко, практически не поддается лечению и быстро приводит к смерти больного.
Множественные дефекты внутренних органов (ткани кишечника, пищеварительной, сердечно сосудистой системы и пр.) приводят к присоединению оппортунистских инфекционных процессов, которые крайне опасны для инфицированного человека.
Профилактические меры

К первичной профилактической мере ВИЧ относят информационный подход. Чем чаще человек слышит об инфекции, тем он больше станет задумываться о реальной опасности недуга. Информирование населения осуществляется через телевидение, печатные издания, лекционные материалы и прочие носители.
Наиболее эффективной профилактика оказывается в случае ведения человеком осознанной половой жизни. Ведь заражению СПИДом чаще всего предшествует именно незащищенный половой акт. Частая смена партнеров и пренебрежение использованием барьерных средств контрацепции – верный способ привести себя к смерти от ВИЧ.
Поскольку в числе наиболее вероятных переносчиков инфекции выступает не только сперма и влагалищные выделения, но и кровь, в целях профилактики ВИЧ людям, зависимым от наркотиков, необходимо отказаться от пагубных веществ. Одурманенные наркотическими средствами люди нередко при введении очередной дозы пользуются одним шприцом или иглой, приумножая риск передачи вируса по кругу.
Кроме этого, в рамках общей профилактической системы человек, обслуживаемый в любом медицинском учреждении, должен удостовериться в том, что все применяемые в его отношении медицинские инструменты подверглись предварительной обработке.
К мерам профилактики можно также отнести предотвращение вероятной беременности инфицированными женщинами. В данном случае речь идет о вероятности заражения вирусом вертикальным путем (в утробе, в процесс родов, через молоко матери). Больным женщинам гораздо проще предупредить зачатие, нежели в дальнейшем предотвращать вероятность инфицирования плода.
Лечение
На сегодняшний день больных СПИДом вылечить невозможно. Однако существуют медикаменты, которые способны продлить жизнь инфицированному. При использовании подобных препаратов CD4-лимфоциты приумножаются, иммунная система человека получает существенную поддержку.
Лечение по мере протекания ВИЧ рознится. Так, при первой стадии терапия не назначается, хоть антитела к ВИЧ в организме больного уже вырабатываются. На втором этапе (стадия 2А) к лечению также не прибегают, за исключением ситуаций с уровнем лимфоцитов меньше 200 на мм 3 . С дальнейшей сменой стадии болезни меняется и тактика терапии недуга. В период развития СПИДа терапевтический курс назначается больному пожизненно.
Однако недавние исследования доказали, что раннее введение терапии приносит гораздо более позитивные результаты. Поэтому с большой долей вероятности представленные рекомендации в скором времени будут скорректированы.
Читайте также:
- Как снять статус вич
- Можно ли не говорить что у тебя вич
- С вич для интернета что это
- Профилактика вич инфекции в республике беларусь
- Профилактика внутрибольничного заражения вич инфекции профилактика внутрибольничного заражения вич инфекции
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.

