Патологическая анатомия вич лейкоэнцефалопатии
Прогрессирующая мультифокальная лейкоэнцефалопатия (ПМЛ) принадлежит к числу редких демиелинизирующих заболеваний головного мозга, развивающихся на фоне дефекта иммунной системы. Впервые ПМЛ описана в 1958 г. Э. Ричардсоном. Заболевание встречается повсеместно, в равной степени у мужчин и женщин, чаще в возрасте 50 лет и более. В настоящее время установлено, что ПМЛ вызывается несколькими штаммами вирусов группы папова JC (VJC), являющихся у человека оппортунистической инфекцией. По данным различных авторов, 70—90% населения заражены VJC еще с детства [2, 7-9]. Различные патологические состояния, сопровождающиеся явлениями иммунодефицита: лимфопролиферативные болезни (лимфомы ЦНС), миелопролиферативные болезни (лейкозы, миеломная болезнь), врожденная гипогаммаглобулинемия, канцероматозы, диффузные болезни соединительной ткани, СПИД, состояния после иммуносупрессивной терапии в связи с пересадкой органов и тканей способствуют реактивации вируса из латентного состояния [4, 10, 14]. Мишенями данной инфекции являются миелин- продуцирующие клетки ЦНС, поэтому их повреждение клинически выражается процессами демиелинизации [3, 8].
Клиническая картина ПМЛ характеризуется постепенным началом, прогрессирующим течением, ранним развитием деменции, нарушением речи, пирамидными и экстрапирамидными расстройствами, псевдобульбарным синдромом, эпилептическими припадками. Реже заболевание проявляется стволовым и мозжечковым синдромами [3, 13]. Описаны случаи дебюта ПМЛ с развития синдрома надъядерного паралича, фокальных двигательных расстройств. Распространение очагов демиелинизации ведет к прогрессированию симптоматики. Специфическая противовирусная терапия ПМЛ не разработана. Спонтанная стабилизация процесса отмечается редко. Большинством исследователей подчеркивается высокая летальность от ПМЛ [3].
Мы наблюдали 10 больных с ПМЛ, 50% из которых погибли спустя 4—9 месяцев от дебюта заболевания. У выживших пациентов установлена I или II группа инвалидности в связи с сохранением грубого неврологического дефицита. Приводим одно из этих наблюдений.
При обследовании: общий анализ крови НЬ 149 г/л, лейкоциты 8,2 • 109, СОЭ 8 мм/ч, в формуле крови выявлена лимфопения 18%, остальные показатели в норме. Биохимический анализ крови без особенностей. Иммунограмма крови: IgG 6,5 г/л, IgA 0,8 г/л, IgM 1,0 г/л. ИФА на ВИЧ отрицательный. СМЖ: белок 0,25 г/л, цитоз 36 • 106 клеток/л. Иммуноферментные исследования крови и СМЖ не выявили достоверного повышения титра антител к вирусу простого герпеса. ЭЭГ: умеренные изменения биоэлектрической активности мозга на сниженном амплитудном уровне. Окулист: острота зрения OD/OS 0,1 с коррекцией 0,9/0,8, глазное дно без патологии. МРТ головного мозга (дважды): в белом веществе полушарий мозга перивентрикулярно выявлены множественные полиморфные, местами сливающиеся между собой, неоднородные, гиперинтенсивные в T2w очаги размерами от 3 до 30 мм в диаметре (рис. 15). Базальные цистерны, желудочки мозга, кортикальные борозды диффузно расширены.

Получал массивную инфузионную и противовоспалительную терапию, ноотропы, антиоксиданты (карнитин, глиатилин), миорелаксанты (баклофен), иммуноглобулин внутримышечно; проведено 5 сеансов плазмафереза. На фоне проводимой терапии состояние больного начало улучшаться: увеличилась сила, снизился мышечный тонус в конечностях, появилась возможность самостоятельной речи, жевания и глотания, а также самостоятельного передвижения с опорой на ходунки. При динамическом наблюдении в течение года у больного сохраняются умеренный псевдобульбарный, легкий акинетико-ригидный синдром, правосторонний гемипарез и выраженные когнитивные нарушения. Установлена I группа инвалидности.
Большой научный и практический интерес представляет изучение особенностей VJC-инфекции, относящейся к группе полиомавирусов. Проведенные исследования установили широкое распространение VJC среди городского населения различных географических регионов [4]. В природе вирус достаточно устойчив. Вирусные частицы остаются стабильными при 20° С более 70 дней. Проникновение VJC или вирусных ДНК в человеческий организм происходит с водой, пищей, воздушно-капельным путем [5]. После заражения вирус включается в ядра клеток. Особенностью данной инфекции является ее способность к персистенции (в почках, костном мозге, лимфоцитах крови), реактивации, хронизации и интермиттирующему течению [9, 13]. Выделено четыре генотипа VJC, имеющих географические особенности. Тип 1 (62%) преобладает в Европе. Тип 2 (9,7%) и тип 3 (8,9%) чаще встречаются в Азии и Африке. Тип 4 (5,4%) является рекомбинантным типов 1—3 и редко служит причиной ПМЛ [15]. Диссеминация вируса в головной мозг осуществляется кровью. Исследования доказали высокую специфичность VJC к миелинпродуцирующим олигодендроцитам мозга. На фоне иммуносупрессии вирус способен к реактивации из латентного состояния, вызывая деструкцию миелина и приводя к неврологическим нарушениям. Мультицентровыми исследованиями подтверждена корреляция между генотипом VJC и неблагоприятным течением заболевания. Установлено, что обнаружение типов 1 и 2 вируса — фактор риска развития ПМЛ [6]. У больных с быстро прогрессирующим течением заболевания VJC определяется в сыворотке в 75% случаев, а в мозге и ликворе в 100% [7].
Патоморфологические исследования при ПМЛ выявляют множественные очаги демиелинизации, особенно в границе между серым и белым веществом, что имело место в нашем случае. В отличие от рассеянного склероза, при ПМЛ крайне редко встречаются очаги демиелинизации в субпиальных и субэпендимарных зонах. При макроскопическом исследовании обнаруживаются слабо выраженные воспалительные реакции и отек.
Микроскопическое исследование указывает на типичные внутриядерные включения в олигодендроцитах, реже в астроцитах, причем последние могут сливаться между собой, образуя гигантские клетки [12].
В патогенезе демиелинизации имеют значение как непосредственное поражение олигодендроцитов, так и аутоиммунные реакции на фоне иммунодефицита. Иммунологическое исследование крови при ПМЛ свидетельствует о генерализованном вовлечении клеточного и гуморального иммунитета. Снижение гуморального иммунного ответа свидетельствует о персистенции инфекции и проявляется в снижении уровня IgG, что также встретилось у нашего больного. Изредка может наблюдаться увеличение IgM в сыворотке крови. Интратекальный синтез IgG к протеину VJC при ПМЛ обнаружен у 76% больных, в отличие от 3,2% у здоровых лиц, и, по мнению Т. Weber и соавт. [14], может использоваться как дополнительный диагностический тест. Этими же авторами установлено, что появление VJC-специфических лимфоцитов ассоциируется с благоприятным клиническим прогнозом.
Клиническая картина ПМЛ не обладает строгой специфичностью. До появления эпидемии СПИД заболевание встречалось редко, однако в настоящее время им страдают 5—10% этих больных [2, 13]. Ранее считалось, что при нормальном функционировании иммунной системы вирус не вызывает никаких клинических симптомов. В настоящее время установлено, что иммунодефицит имеет место у 85% больных, а у остальных ПМЛ может развиться при отсутствии дефекта иммунной системы [14]. Диагностика ПМЛ осуществляется на основании следующих признаков:
• Наличие многоочаговой неврологической симптоматики (головная боль и повышение внутричерепного давления не характерны).
• СМЖ чаще не изменяется.
• Типичная МРТ картина у 90% больных: высокоинтенсивные сигналы в T2w и понижение плотности в Tiw без накопления контраста и масс-эффекта. Характерно поражение аркуатных волокон (V-волокон) затылочно-теменных областей. MPT-изменения в мозге могут быть одно- или двусторонними, единичными или множественными, симметричными или асимметричными. Атипичные нарушения МРТ при ПМЛ включают фокальные геморрагии, атрофию мозга, перифокальный отек, вовлечение базальных ганглиев [11].
• Наличие иммунологических признаков первичного (СПИД) или вторичного иммунодефицита.
• В биоптате мозговой ткани при электронной микроскопии обнаруживают VJC, при иммуноцитохимии — антигены VJC, при полимеразной цепной реакции — вирусный геном в 95,8% случаев [7].
Дифференциальный диагноз проводится с хроническим герпетическим энцефалитом, первично-прогрессирующим течением рассеянного склероза, ВИЧ-энцефалопатией. Для последней при МРТ характерно диффузное поражение мозга, менее интенсивное на T2w и не видное на Тiw, без вовлечения аркуатных волокон. В сложных диагностических случаях применяется стерео-таксическая биопсия мозга [2].
Большинство исследователей подчеркивают прогрессирующее, чаще фатальное течение ПМЛ [1]. Сообщается о выживших больных спустя 4 года после установления диагноза ПМЛ на основании патоморфологического и вирусологического обследования [3]. Специфическая терапия ПМЛ не разработана. Описаны положительные клинико-иммунологические, гематологические результаты внутривенного и эндолюмбального введения цитарабина в сочетании с интерфероном-альфа, а также интерлейкина-2 в дозе 0,5 мЕ/м2 ежедневно [10]. В литературе встречаются сообщения о стабилизации процесса сроком на год у 36% больных после введения цитозин-арабинозида внутривенно. Подчеркивается, однако, что этот препарат обладает токсическим действием [1]. Перспективным в лечении ПМЛ является использование высокоактивной антиретровирусной терапии и цидофовира, которые будут применяться в будущем [2, 13].
Изменения белого вещества больших полушарий видны макроскопически. Но при острых формах общие размеры мозга, его форма и вес не изменены. При хронически протекающих формах болезни наблюдается уменьшение размеров и веса полушарий мозга, иногда весьма значительное. Пораженное белое вещество семиовальных центров имеет серовато-желтый или серовато-розовый цвет. Свежие очаги поражения представляются более розовыми, чем более старые. Пораженное белое вещество изменено в своей консистенции — оно желатинообразно или губчато. Отмечается атрофия белого вещества. В одном случае с хроническим, весьма длительным (15 лет) течением болезни, атрофия белого вещества была выражена очень резко. В отдельных случаях описано образование кист. Иногда отмечено равномерное расширение желудочков, изредка кистообразное расширение, исходящее из какого-либо одного желудочка. В некоторых случаях с острым течением в белом веществе были обнаружены небольшие очаги кровоизлияний. При большой длительности процесса отмечено значительное уплотнение белого вещества. Только в очень редких случаях пораженное белое вещество макроскопически имеет нормальный вид и плотность.
Поражение обоих полушарий может быть симметричным по расположению и величине очагов, но бывает и асимметричным. Одно полушарие может быть сильнее поражено, чем другое. Наблюдаются большие по размерам очаги, распространяющиеся на всё или почти на всё полушарие (чаще, с затылочной области к лобной), или различное число ограниченных по размерам очагов. Наряду с обширными очагами, в окружности их могут находиться отдельные, хорошо очерченные участки поражения, весьма сходные с бляшками рассеянного склероза.
Аналогичные по характеру изменения были обнаружены в наружной и внутренней капсуле, в мозолистом теле, в хиазме зрительных нервов, а изредка также в проводящих системах мозгового ствола и мозжечка. Обнаруженные некоторыми авторами очаги поражения в спинном мозгу, аналогичные по характеру с изменениями в ^головном мозгу, дают основания говорить об энцефаломиелите и весьма осложняют дифференцировку от других форм демиелинизирующих болезней, в частности, от рассеянного склероза.
Основным гистологическим признаком является полная демиелинизация в очагах поражения. В ранней фазе заболевания можно обнаружить маленькие зоны — пятна демиелинизации, расположенные вокруг сосудов. Очаги демиелинизации увеличиваются путем непосредственного распространения процесса и отграничиваются от системы дугообразных волокон, которые поражаются только в редких случаях. Волокна в очагах поражения представляются обнаженными, лишенными миелиновой оболочки. Вокруг очага полной демиелинизации можно обнаружить волокна с разбухшим, распадающимся миелином и наличием обломков миелина. В центре очага демиелинизации имеются изменения и в осевых цилиндрах, которые становятся более тонкими и извитыми, иногда набухшими, варикозными, утолщенными на концах. В редких случаях, которые отличаются острым течением болезни, обнаружены явления общего размягчения с гибелью не только миелиновых влагалищ, но и самих осевых цилиндров. В случаях с хроническим течением болезни, особенно в семейных, также часто отмечается тяжелое повреждение осевых цилиндров, вплоть до полного их исчезновения.
Эти данные показывают, что поражение осевых цилиндров не является исключением и название периаксиальный не совсем точно определяет характер процесса; его можно принять, только исходя из того, что миелин поражается прензде всего и больше всего.
Мозговая кора, включая систему дугообразных пучков, относительно сохранена. Ганглиозные клетки коры в большинстве остаются сохранными и мало отличаются от нормальных. В некоторых клетках мозговой коры отмечаются набухание цитоплазмы с изменением тиг- роида, изменения ядра клетки. В части клеток развивается ретроградное перерождение с хроническим сморщиванием и атрофией. Часто наблюдается сателлитоз. Выраженность поражения ганглиозных клеток зависит от длительности и остроты патологического процесса. Изменения клеток коры, по данным Билыновского и Геннеберга, больше выражены в III и V слоях, а по Боуману — в V и VI слоях.
Во многих случаях выражены изменения глии. Отмечается реакция астроцитов, которые увеличиваются в количестве и размерах. Местами имеется скопление астроцитов с разрастанием волокон, образующих как бы сетку или рубец. Клетки макроглии часто дегенерируют, набухают и приобретают округлую форму; в их цитоплазме много липоидов; они становятся многоядернымп, причем ядра могут набухать или, наоборот, сморщиваться. Вследствие этого репаративные явления не всегда являются хорошо выраженными. Количество микроглиальных элементов увеличено, а сами клетки, нагруженные продуктами распада миелина, увеличиваются в размерах и принимают форму зернистых шаров. Изменения олигодендроглии появляются, по-видимому, уже на ранних стадиях процесса. Цитоплазма олигодендроцитов резко набухает и часто подвергается мукоидному перерождению. В поврежденной ткани можно обнаружить и свободно лежащие комочки мукоидного вещества, по форме напоминающие тутовые ягоды или виноградные грозди. В центре пораженного участка чаще, чем на его периферии, скапливаются такие свободно лежащие вне клеток мукоидные шарики. Олигодендроциты в пораженных участках ткани иногда совсем исчезают.
В некоторых случаях были обнаружены воспалительные, энцефалитические явления: наличие лимфоцитарных инфильтратов, иногда с примесью плазматических клеток и полибластов, порозность сосудов и небольшие геморрагии. Эндотелий сосудов иногда набухает, в клетках интимы может наблюдаться скопление липоидов. Вокруг сосудов могут возникать скопления фагоцитов и разрастание волокнистой глии. Но следует подчеркнуть, что клеточная реакция мезенхимы выражена мало или совсем отсутствует. При выраженной реакции астроцитарной глии пораженные участки в последующем становятся более плотными, затвердевают; при преобладании микроглиальной реакции они размягчаются. Реакция мозговых оболочек отсутствует или мало выражена.
Приведенные данные анатомо-гистологического изучения показывают, что основными признаками диффузной лейкоэнцефалопатии являются:
- демиелинизация белого вещества мозговых полушарий;
- менее грубое, но выраженное поражение осевых цилиндров в поврежденных зонах;
- относительная сохранность клеток и волокон мозговой коры, включая пучки дугообразных волокон;
- выраженная реакция макро- и микроглии с ранней дегенерацией олигодендроглии, которая исчезает или часто подвергается мукоидному перерождению.
При подостром ВИЧ-энцефалите отмечается атрофический процесс в головном мозге, о чем свидетельствуют расширение борозд и истончение извилин коры больших полушарий и расширение желудочковой системы. Атрофия мозга может быть выявлена прижизненно с помощью компьютерной томографии. При осмотре мозга отмечается также бледность белого вещества больших полушарий.
При микроскопическом исследовании определяется картина подострого менингоэнцефалита. В головном и спинном мозге повсеместно выявляется периваскулярная инфильтрация; она более выражена в белом веществе полушарий головного мозга, чем в коре; в большей степени страдают лобные и затылочные доли, подкорковые узлы, мозжечок, варолиев мост. В составе периваскулярных инфильтратов обнаруживаются мононуклеары, макрофаги с пенистой цитоплазмой и макрофаги, содержащие бурый пигмент, а также микроглиоциты.
Важной патоморфологической особенностью подострого ВИЧ-энцефалита является наличие в инфильтратах многоядерных гигантских клеток, что связано с одним из существенных биологических свойств ВИЧ -- придавать зараженным клеткам способность формировать синцитий (слияние клеток). Многоядерные клетки являются настолько важной и характерной особенностью морфологических изменений головного (и спинного) мозга при ВИЧ-энцефалите, что некоторые авторы (Price R.W, Brew B.J., 1988) считают правомерным использование термина "многоядерноклеточный энцефалит" для его обозначения. Взгляды различных исследователей на происхождение многоядерных клеток расходятся. Предполагается, что эти клетки могут быть или инфицированными макрофагами, или гистиоцитами, или Т-хелперами, утратившими Т4-эпитопы; последнее предположение подтверждается формированием многоядерных гигантских клеток из Т4-клеток в их культуре.
Помимо периваскулярной инфильтрации в веществе головного мозга обнаруживаются микроглиальные узелки, очаги некроза, демиелинизация и астроцитарный глиоз.
С помощью иммунохимических методов было показано, что клетки периваскулярных инфильтратов содержат белки ядра и оболочек ВИЧ (р24 и р41), однако, количество вирусного антигена неодинаково в разных случаях; антигены ВИЧ обнаруживаются в глиальных и эндотелиальных клетках, а также в многоядерных клетках; в нервных клетках антигены ВИЧ обнаруживаются редко. Таким образом, ВИЧ не проявляет отчетливого нейротропизма, имея в качестве клеток-мишеней систему макрофагов-моноцитов. [2]
Имеется предположение о том, что инфильтрация мозговой ткани макрофагами сопровождается освобождением цитокинов, таких как фактор некроза опухолей, а также пероксидазы и свободных кислых радикалов, что может привести к повреждению миелина, которое обнаруживается при СДК.
При ВИЧ-инфекции в головном мозге определяются также и некоторые другие изменения, не являющиеся, однако, ВИЧ-специфическими. К числу таких изменений относятся вакуолярная лейкоэнцефалопатия, спонгиоформные изменения и утрата пигмента черной субстанцией.
Вакуолярная лейкоэнцефалопатия представлена вакуолизацией белого вещества височных и затылочных долей больших полушарий головного мозга, мозолистого тела, белого вещества мозжечка и варолиева моста. Гистологические исследования дают основания предполагать, что вакуоли могут быть результатом дегенерации олигодендроцитов или интрааксональной дегенерации.
Спонгиоформные изменения представлены образованием большого числа мелких вакуолей в поверхностных слоях коры и перивентрикулярных областях мозга; этим изменениям сопутствует реактивный астроцитарный глиоз и уменьшение числа нервных клеток. Подобные изменения обнаруживаются при болезни Альцгеймера и при алкогольной энцефалопатии. Предполагается, что спонгиоформные изменения могут возникать в результате отека мозга или вызываться токсическими веществами, имеющимися в ЦСЖ.
Депигментация черной субстанции обнаружена у 90% больных СПИДом. Микроскопически отмечается дегенерация клеток черной субстанции в виде грубых изменений ядра и цитоплазмы или цитолиза с остатками гранул меланина на месте лизированной клетки. Причина этих изменений неизвестна.
Патоморфологическая картина подострого ВИЧ-энцефалита в полной мере соответствует клинически наблюдающейся деменции субкортикального типа и сочетающимися с ней неврологическими расстройствами.
Степень выраженности деменции коррелирует с числом многоядерных клеток. [2]
Рис. 1. МРТ картина ВИЧ-энцефалопатии (атрофия головного мозга, расширение его борозд и желудочков).
Версия: Справочник заболеваний MedElement
Общая информация
Примечание. Из данной подрубрики исключена "Субкортикальная сосудистая деменция (F01.2).
Этиология и патогенез
Описаны семейные случаи заболевания с началом до 40 лет, без артериальной гипертензии. Более чем в 80% случаев болезнь дебютирует в возрастном промежутке от 50 до 70 лет.
Страдают также и более крупные артерии диаметром до 500 мкм, и все микроциркуляторное русло.
Эпидемиология
Болезнь (энцефалопатия) Бинсвангера встречается довольно часто. По данным клинико-компьютерно-томографического исследования, она составляет около 1/3 всех случаев сосудистой деменции.
Возраст. Более чем в 80% случаев болезнь дебютирует в возрастном промежутке от 50 до 70 лет.
Факторы и группы риска
Клиническая картина
Клиническая картина болезни Бинсвангера характеризуется прогрессирующими когнитивными нарушениями, нарушениями функции ходьбы и тазовыми расстройствами. На последнем этапе заболевания клиническая картина представлена слабоумием, полной беспомощностью больных (не ходят, не обслуживают себя, не контролируют функцию тазовых органов).
Картина слабоумия может значительно варьироваться по степени тяжести и особенностям симптоматики.
В целом для болезни Бинсвангера характерно неуклонно-прогредиентное течение, но возможны и периоды длительной стабилизации. Причинами слабоумия в этих случаях считаются разобщение корково-подкорковых связей, наступающее в результате поражения подкоркового белого вещества, а также дисфункция базальных ганглиев и таламуса.
Основные характеристики лобной диспраксии ходьбы, связанной с дезавтоматизацией ходьбы, следующие:
• замедление ходьбы;
• укорочение шага;
• затруднение в начале ходьбы (инициация ходьбы);
• неустойчивость при поворотах (постуральная дисфункция);
• расширение базы опоры;
• снижение длины шагов.
Двигательные нарушения могут также характеризоваться (помимо нарушения ходьбы): другой экстрапирамидной патологией в виде паркинсоноподобной симптоматики, а также легкими или умеренными центральными моно- или гемипарезами, часто быстро регрессирующими (регресс очаговой двигательной симптоматики становится неполным по мере прогрессирования заболевания). Характерен псевдобульбарный синдром.
Эмоционально-волевые нарушения представлены астеническим, неврозоподобным или астено-депрессивным синдром. По мере прогрессирования заболевания на первый план выходят не астения и депрессия, а нарастание эмоционального оскудения, сужение круга интересов и спонтанности.
В критериях подчеркивается, что у пациента должны отсутствовать множественные или двухсторонние корковые очаги по данным КТ и МРТ, и тяжелая деменция.
Диагностика
Осложнения
- 1) Транзиторная ишемическая атака .
Транзиторные ишемические атаки (ТИА, преходящие нарушения мозгового кровообращения) характеризуются кратковременными симптомами локальной ишемии мозга.
ТИА обычно связаны с гемодинамической недостаточностью, возникающей при выраженном атеросклеротическом стенозе сонных или позвоночных артерий в их дистальных ветвях или артериальной эмболией.
В большинстве случаев транзиторные ишемические атаки разрешаются в течение 5-20 минут.
Клиническое значение ТИА состоит в том, что они служат предвестниками не только инсульта, но и инфаркта миокарда и представляют собой сигналы опасности, требующие от врача быстрых действий. Больных с ТИА необходимо госпитализировать в инсультное отделение для наблюдения, всестороннего обследования и проведения профилактики ишемического инсульта.
ТИА часто проявляются при снижении АД, физической нагрузке, натуживании, приеме пищи; при этом очаговые неврологические симптомы нередко проявляются на фоне предобморочного состояния, иногда по нескольку раз в день. Больные часто жалуются на предобморочное состояние, головокружение, нарушения зрения, слабость в конечностях, тошноту и рвоту, нарушения памяти, шум в ушах, нарушения чувствительности, неожиданную утрату равновесия.
2) Инсульты - острые нарушения мозгового кровообращения (ОНМК) .
Различают инсульты - ишемический инсульт и внутримозговое (паренхиматозное) кровоизлияние .
Ишемический инсульт возникает в результате критического снижения или прекращения кровоснабжения участка мозга с последующим развитием очага некроза мозговой ткани.
Внутримозговое кровоизлияние возникает в результате разрыва патологически измененных сосудов мозга, приводящего к кровоизлияниям.
Вирусные, аутоиммунные и сосудистые заболевания головного мозга нередко сопровождаются разрушением нервных волокон и утратой важнейший функций органа. Так, прогрессирующая лейкоэнцефалопатия характеризуется поражением оболочек отростков нейронов и постепенной дегенерацией центральной нервной системы. Это редкая патология, формирующаяся у пациентов со сниженным иммунитетом.
Существуют и другие механизмы поражения нервной системы. Сосудистая энцефалопатия хорошо поддается лечению, однако при обнаружении вирусной инфекции ЦНС прогноз неблагоприятный.
Классическая лейкоэнцефалопатия
Прогрессирующая мультифокальная лейкоэнцефалопатия – это редкое инфекционное заболевание, характеризующееся постепенным разрушением миелиновых оболочек нервов и нарушением функций ЦНС. Патологические изменения в головном мозге обусловлены активацией полиомавируса человека 2 типа, возникающем у пациентов со сниженным иммунитетом. У 85-90% людей этот вирус присутствует в тканях, но при этом никак себя не проявляет. Разработка полноценного лечения все еще находится на этапе экспериментов и системных исследований, поэтому на сегодняшний день у болезни неблагоприятный прогноз.
До открытия вируса иммунодефицита человека считалось, что очаговая лейкоэнцефалопатия диагностируется примерно у одного пациента из 100 000 человек. Ближе к концу 20 века случаи обнаружения болезни участились. К этому моменту врачи выявили связь между иммунодефицитом, возникающим на фоне ВИЧ-инфекции, и активацией полиомавируса в тканях мозга. ВИЧ-инфекция и СПИД обнаруживаются у 90% пациентов, страдающих от лейкоэнцефалопатии. Оставшиеся 10% случаев возникновения болезни ассоциированы с другими иммунодефицитными состояниями и аутоиммунными патологиями.
Заболевание проявляется неврологической и психической симптоматикой. Многие пациенты с лейкоэнцефалопатией страдают от психических расстройств. Постепенное прогрессирование недуга приводит к развитию мышечного паралича. Существующие методы терапии дают возможность замедлить патологический процесс и облегчить некоторые симптомы, однако в 50% случаев инфекция заканчивается смертью пациентов.
Головной мозг образован нейронами, их отростками и вспомогательными клетками. Это важнейший регуляторный орган, необходимый для поддержания жизненно важных функций организма и сознательной деятельности. Образующие подкорковые ядра и кору больших полушарий нейроны имеют длинные отростки (аксоны), проводящие импульсы в другие отделы мозга и отдаленные участки тела. С помощью аксонов все участки ЦНС сообщаются друг с другом, благодаря чему сохраняется координации в работе. При этом нормальная передача импульса по отросткам невозможна без специальной оболочки.
Миелиновая оболочка — это белково-липидный комплекс, покрывающий отростки нейронов в центральной нервной системе. Образуют миелин глиальные клетки. Эта структура необходима для электрической изоляции аксонов и быстрого проведения сигнала. Миелиновые оболочки очень важны для быстрой регуляции двигательной активности и поддержания когнитивных способностей, включая эмоциональный контроль, память и интеллект.
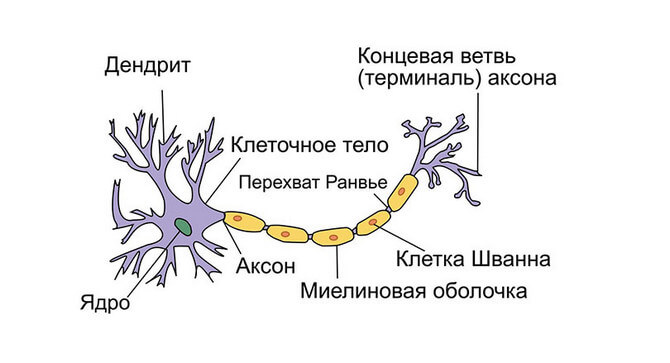
Типичная структура нейрона
Демиелинизация представляет собой процесс разрушения миелиновой оболочки нейронов. Такое осложнение характерно для инфекционных и аутоиммунных заболеваний, включая лейкоэнцефалопатию. Разрушение изоляционной оболочки приводит к тому, что электрические импульсы начинают распространяться в нервах медленно. Возникают разнообразные неврологические расстройства, влияющие на сознательную деятельность и общую регуляцию организма.
Разрушение белого вещества головного мозга наблюдается и при других патологических состояниях.
- Мелкоочаговая лейкоэнцефалопатия — поражение отдельных участков белого вещества головного мозга, возникающее из-за недостаточного кровоснабжения органа. Болезнь преимущественно диагностируется у пожилых мужчин и женщин, страдающих от артериальной гипертензии и атеросклероза.
- Перивентрикулярная лейкоэнцефалопатия. Патология характеризуется одновременным повреждением белого и серого вещества головного мозга. Обнаруживается у пожилых людей с нарушенным церебральным кровообращением и у детей, пострадавших от внутриутробной или родовой гипоксии.
- Задняя обратимая лейкоэнцефалопатия — это тяжелое неврологическое расстройство, формирующееся из-за болезней почек, сниженного иммунитета и лечения кортикостероидами.
- Лейкоэнцефалопатия с накоплением лактата — редкий вид заболевания. Миелин разрушается в основании головного мозга и в структурах спинного мозга.
Другие классификации основаны на области появления патологических изменений и клинических проявлениях болезни. Так, лейкоэнцефалопатия лобных долей в первую очередь негативно влияет на сознательную деятельность человека.
Причины формирования
Патологические изменения в головном мозге, характерные для классической лейкоэнцефалопатии, возникают при первичном заражении или реактивации полиомавируса человека 2 типа в организме. Главным условием формирования болезни является снижение иммунитета. В норме защитные системы организма не позволяют вирусу проявить свои свойства, поэтому инфекционный агент в неактивной форме сохраняется в почках, селезенке и других органах. В случае иммунодефицита полиомавирус активируется в виде оппортунистической инфекции.
Другие виды недуга связаны с нарушением функций сердечно-сосудистой системы. Так, сосудистая лейкоэнцефалопатия представляет собой дегенеративное заболевание головного мозга, характеризующееся постепенным поражением белого и серого вещества на фоне нарушения кровотока. Это отдельная патология, которую можно отнести к разновидностям дисциркуляторной энцефалопатии.
Причины активации вируса:
- Заражение вирусом иммунодефицита человека. Вирусы постепенно уничтожают большое количество иммунокомпетентных клеток, в результате чего механизм сдерживания условно-патогенных инфекционных агентов нарушается. Диффузная лейкоэнцефалопатия диагностируется у 5% людей, страдающих от СПИДа.
- Врожденный иммунодефицит. Это синдром Ди Джорджи, атаксия-телеангиэктазия и другие наследственные патологии, характеризующиеся сниженным иммунитетом и врожденными аномалиями. При такой этиологии лейкоэнцефалопатия нередко выявляется у детей.
- Нарушение кроветворных и иммунных функций при гемобластозах. Онкологические заболевания костного мозга и других структур, образующих компоненты иммунной системы, увеличивают риск возникновения демиелинизирующих процессов.
- Аутоиммунные расстройства — болезни, при которых защитные системы организма начинают атаковать здоровые ткани. Заболевание возникает у пациентов, страдающих от системной красной волчанки, ревматоидного артрита и других патологий иммунитета. Также аутоиммунная лейкоэнцефалопатия появляется при агрессивной иммуносупрессивной терапии.
Таким образом, формирование лейкоэнцефалопатии может быть обусловлено нарушением иммунного контроля организма или недостаточным кровоснабжением нейронов.
Семейство полиомавирусов (Polyomaviridae) было описано во второй половине 20 века. Изначально данные инфекционные агенты были обнаружены в организме птиц и млекопитающих, однако позже ученые доказали опасность отдельных видов вируса для человека. Полиомавирусы способны не только поражать структуры нервной системы, но и увеличивать риск роста опухолей.
Клинически значимые виды вируса:
- полиомавирус человека первого типа — поражает почки и дыхательную систему, часто активируется после пересадки органов;
- полиомавирус человека второго типа — разрушает почки, селезенку и структуры головного мозга, вызывает лейкоэнцефалопатию;
- полиомавирус человека пятого типа — патоген, ассоциированный с редким видом рака кожи.
До 80% людей заражается вирусом еще в детском возрасте. Источником инфекции может быть любой человек с носительством полиомавируса или острой инфекцией. Патогены передаются воздушно-капельным путем. Если иммунодефицит не возникает, вирусные частицы никак себя не проявляют и сохраняются в тканях в течение всей жизни человека.
Врачам известны факторы риска возникновения болезни, связанные с образом жизни, индивидуальным и семейным анамнезом пациентов. Эти признаки увеличивают вероятность появления расстройства, но не обуславливают формирование инфекции или сосудистого недуга напрямую.
Основные факторы риска:
- Медикаментозное лечение рассеянного склероза. В терапии этого демиелинизирующего заболевания иногда используются лекарственные средства, увеличивающие риск активации полиомавируса.
- Патологические состояния, сопровождающиеся сужением просвета артерий и повреждением сосудистой оболочки. Это отложение жировых бляшек в сосудах (атеросклероз), повышенное кровяное давление и врожденные аномалии.
- Пересадка органов с последующей иммуносупрессивной терапией. Защита организма ослабевает, и инфекция начинает поражать головной мозг.
- Аутоиммунные и иммунодефицитные состояния у близких родственников пациента.
- Позднее начало лечения ВИЧ-инфекции и врожденных патологий, нарушающих иммунитет.
- Применение химиотерапии для лечения онкологических заболеваний. Цитостатические препараты негативно влияют на функцию красного костного мозга и снижают иммунитет.
Своевременное обнаружение факторов риска играет важную роль в профилактике заболевания.
Симптомы
Классическая форма болезни вызывает неврологические расстройства уже через несколько дней после активации полиомавируса. В отличие от других инфекций ЦНС, прогрессирующая лейкоэнцефалопатия не проявляется общемозговой и менингеальной симптоматикой. Инфекционные агенты в первую очередь поражают структуры, ответственные за поддержание когнитивных способностей. Позже возникают двигательные нарушения. Разрушение белого вещества мозга ишемической природы также влияет на интеллект и личность, однако патологические изменения развиваются гораздо медленнее. Деменция диагностируется через нескольких лет после начала болезни.

Симптомы и признаки:
- немотивированная смена настроения;
- раздражительность, агрессия;
- снижение остроты зрения;
- апатия и снижение трудоспособности;
- постоянная паранойя;
- снижение интеллекта;
- нарушение памяти;
- неспособность к обучению;
- мышечная слабость;
- нарушение походки.
Вирусная лейкоэнцефалопатия имеет более агрессивное течение. Практически у каждого второго пациента появляются психические расстройства. В случае сосудистой патологии на первый план выходят когнитивные изменения, характерные для деменции.
К какому врачу обращаться
Диагностикой и лечением разных видов энцефалопатии занимаются неврологи. Во время первичного приема врач расспросит пациента о жалобах и изучит анамнестические данные для выявления факторов риска заболеваний ЦНС. Затем проводится общий неврологический осмотр, включающий оценку рефлекторной деятельности. Невролог обращает внимание на походку пациента и координацию работы мышц в целом.
В первичной диагностике может принять участие психотерапевт. Врач этого профиля выявляет психические расстройства, характерные для энцефалопатии, и оценивает степень нарушения когнитивных способностей. Выраженность интеллектуальных и эмоциональных изменений указывает на стадию патологического процесса. Окончательный диагноз может быть поставлен только после проведения инструментальных и лабораторных обследований.
Постановка диагноза
Для обнаружения неврологического расстройства инфекционной природы необходимы визуальные и лабораторные исследования. Важно исключить другие болезни, проявляющиеся похожими симптомами и осложнениями.
- Магнитно-резонансная томография — высокоинформативное визуальное исследование, позволяющее детально оценить состояние всех отделов головного мозга. На изображениях можно обнаружить разнообразные очаги утраты миелина в белом веществе и ядрах органа. Сразу исключается лейкоэнцефалопатия сосудистого генеза.
- Биопсия тканей. С помощью трепанации черепа и пункции врач получает небольшой образец тканей из поврежденного участка органа. Гистологическое исследование материала позволяет подтвердить диагноз.
- Поиск вирусных частиц в спинномозговой жидкости с помощью полимеразной цепной реакции (ПЦР). Это точное лабораторное исследование, направленное на поиск активной инфекции. Для проведения теста проводится люмбальная пункция.
- Офтальмологические обследования, направленные на оценку остроты зрения и поиск специфических отклонений, характерных для болезни.
Основные признаки заболевания можно увидеть на МРТ. Уточняющие исследования необходимы для оценки тяжести состояния.
Этот вид поражения головного мозга обнаруживается с помощью иных инструментальных исследований. Неврологу необходимо оценить состояние церебральных сосудов.
- Ультразвуковая диагностика сосудов головы и шеи — безопасное визуальное исследование, необходимое для оценки эффективности кровоснабжения ЦНС.
- Магнитно-резонансная ангиография. С помощью томографа невролог получает объемные изображения артерий и вен разных участков мозга. МР-признаки сосудистой лейкоэнцефалопатии в основном представлены очагами ишемии и дегенерации нейронов.
- Исследование сердечно-сосудистой системы с помощью электрокардиографии, суточного мониторинга ЭКГ и ультразвукового обследования.
Для уточнения состояния сосудов может быть назначена консультация кардиолога. Также проводится офтальмологическое обследование.
Методы лечения
Многоочаговая лейкоэнцефалопатия вирусной природы не поддается лечению. Существуют только схемы поддерживающей терапии, замедляющей развитие болезни. Пациентам назначают нейропротекторные лекарственные средства. Если заболевание возникло на фоне терапии аутоиммунных патологий, проводится очистка крови (плазмаферез). В последнее время появились сведения об эффективности некоторых нейролептиков и антидепрессантов в лечении заболевания, однако исследования такой терапии еще не завершились.
Сосудистая лейкоэнцефалопатия может быть скорректирована медикаментозно. Врачи подбирают лекарственные препараты, непосредственно влияющие на механизм развития болезни. Необходимо восстановить кровообращение в ЦНС и устранить негативные факторы, включая повышенное кровяное давление и атеросклероз. При обнаружении структурных патологий крупных артерий проводится оперативное вмешательство.
Лекарственные назначения при сосудистой форме патологии:
- блокаторы кальциевых каналов и антагонисты адренорецепторов для улучшения кровоснабжения тканей;
- антиагреганты для предотвращения формирования тромбов в артериях и венах;
- нейропротекторные медикаменты, включая ноотропы, витамины и микроэлементы.
Схема медикаментозной терапии первичных сердечно-сосудистых заболеваний подбирается кардиологом. Пациентам с артериальной гипертензией необходимо постоянно контролировать кровяное давление и соблюдать диету. При любых формах энцефалопатии необходимо отказаться от приема алкоголя и курения. Избыточные физические нагрузки также могут усугубить состояние.
Сколько живут с таким диагнозом
Вирусная лейкоэнцефалопатия характеризуется крайне неблагоприятным прогнозом. Каждый второй пациент впадает в кому и умирает через несколько месяцев после появления патологических изменений. Важно учитывать, что до 90% больных страдает от СПИДа или врожденного иммунодефицита, поэтому прогноз также зависит от сопутствующих заболеваний. Качество жизни выживших пациентов значительно ухудшается из-за когнитивных и неврологических осложнений.
Сосудистое поражение головного мозга не так опасно. Адекватная медикаментозная терапия дает возможность замедлить развитие болезни и значительно улучшить состояние. При регулярном приеме назначенных врачом препаратов и правильном образе жизни больные живут в течение пяти и более лет после постановки диагноза. Если помимо основной патологии у пациента диагностируют инсульт и деменцию, прогноз неблагоприятный.
Читайте также:


