Моноклональные антитела при вич
Суперантитела почти победили ВИЧ
У больных СПИДом пока есть только одна надежда – антиретровирусная терапия, которая основана на препаратах, препятствующих размножению ВИЧ. Геном этого вируса записан в РНК, поэтому после попадания в клетку он с помощью фермента ревертазы (обратной транскриптазы) делает копию ДНК на шаблоне собственной РНК. Потом с этой ДНК собственные белки клетки начинают штамповать вирусную РНК. Если, скажем, подавить работу обратной транскриптазы вируса, то он не сможет размножаться.
Но даже коктейли антиретровирусных препаратов помогают лишь перевести болезнь из острой фазы в хроническую. Такая терапия ничего не может сделать с вирусом, который плавает в крови или находится в клетке в спящем состоянии. Поэтому исследователи ищут способ избавления от самого вируса, а не просто подавления его способности к размножению. (К слову, обычная антиВИЧ-терапия теоретически позволяет избавиться от вируса, но лишь при особых условиях, и такие случаи, увы, единичны.)
Когда же речь заходит о том, чтобы полностью изгнать ВИЧ, то все соглашаются, что лучше антител тут инструмента не найти. С одной стороны, здесь всё просто: достаточно найти иммуноглобулины, которые узнавали бы белок вирусной оболочки, связывались бы с ним и сигнализировали иммунным клеткам-убийцам о том, что этот комплекс нужно уничтожить. Проблема, однако, в том, что ВИЧ обладает колоссальной изменчивостью, и антитела обычно ловят только некую долю вирусных частиц, ибо тот же самый белок у них наделён рядом отличий, благодаря которым антитела его не видят.
Однако наш иммунитет всё же способен справиться с таким разнообразием вируса, создавая антитела широкого спектра действия. То, что иммунитет может вырабатывать иммуноглобулины, распознающие более 90% разновидностей ВИЧ, учёные обнаружили в 2010 году, и это открытие, разумеется, вселило во всех надежду, что СПИД вот-вот падёт. Но со временем выяснилось, что такие антитела возникают редко и через огромный промежуток времени, к тому же исключительно в ответ на настоящую инфекцию – то есть спровоцировать их синтез с помощью вакцины из убитого патогена не получится.
Тем не менее учёные продолжили работать с подобными антителами. И не так давно удалось обнаружить универсальные антитела, которые появляются гораздо раньше и выглядят проще, чем те, что наблюдались до этого, – правда, и универсальность их оказалась пониже. Но обязательно ли заставлять сам иммунитет вырабатывать такие антитела? Как показали эксперименты двух исследовательских групп – из Медицинского центра дьяконицы Бет Израэль и Национального института аллергии и инфекционных болезней (оба – США), – иммуноглобулины широкого спектра действия, просто введённые в кровь, эффективно понижают уровень ВИЧ.

ВИЧ между эпителиальной клеткой (снизу) и лимфоцитом (сверху) (фото Visuals Unlimited / Corbis).
Сразу стоит сказать, что группы Дана Баруха (Dan Barouch) и Малкольма Мартина (Malcolm Martin) экспериментировали с обезьянами: резусов заражали гибридным обезьянье-человеческим ВИЧ, который размножался в макаках, но выглядел похожим на человеческий вирус. Оружием против него послужили антитела широкого спектра действия, полученные от пациентов со СПИДом.
Дан Барух и его коллеги использовали коктейль из трёх видов антител, и, как пишут исследователи в Nature (Therapeutic efficacy of potent neutralizing HIV-1-specific monoclonal antibodies in SHIV-infected rhesus monkeys), в течение недели уровень вируса упал настолько, что его нельзя было обнаружить! Похожий результат был и тогда, когда вместо смеси иммуноглобулинов применяли только один их вид. После того как содержание таких антител в крови начало снижаться, концентрация вируса снова поднялась, однако у некоторых обезьян она по-прежнему оставалась неразличимо низкой даже без введения дополнительных порций антител.
В другой работе, выполненной Малкольмом Мартином и его коллегами и опубликованной в том же журнале (Antibody-mediated immunotherapy of macaques chronically infected with SHIV suppresses viraemia), речь идёт примерно о том же, только тут исследователи использовали иные разновидности антител против ВИЧ. И вновь концентрация вируса падала у макак в течение семи дней до неразличимого (ещё раз: неразличимого!) уровня и оставалась такой на протяжении 56 дней, пока антитела сами не начинали исчезать. Дальше всё зависело от того, сколько вируса было у обезьян изначально: если мало, то после исчезновения антител вирус оставался под контролем собственного иммунитета животных, если же его изначально было много, то уровень начинал расти.
При этом, как подчёркивают исследователи, вирус исчезал как из крови, так и из других тканей, и никакой устойчивости к вводимым антителам у него не появлялось. (Правда, было одно исключение: когда во втором исследовании вводили лишь одно антитело, и подопытной была макака с 3-летним опытом сожительства с вирусом, у неё возникал устойчивый вирусный штамм.)
Что дальше? Стоимость антител гораздо выше, чем антиретровирусных препаратов, да и обращаться с ними сложнее. Но авторы работ полагают, что такие антитела нужно соединить с обычными антиВИЧ-лекарствами: это снизит стоимость лечения, и, скорее всего, повысит его эффективность – если к антителам добавить также вещества, препятствующие размножению вируса в клетке.
Подготовлено по материалам Национального института аллергии и инфекционных болезней (HIV Antibody Infusions Show Promise for Treating SHIV-Infected Monkeys) и Медицинского центра дьяконицы Бет Израэль (Monoclonal Antibodies Show Promise As Effective HIV Therapy).
Конкурирующие интересы: YR, XJ, LM и LU связаны с коммерческой компанией PlantVax, а ML связан с Bioqual. Это не изменяет приверженность авторов политикам PLOS ONE по обмену данными и материалами.
Задуманные и разработанные эксперименты: YR MS DM CL RF XJ. Выполнили эксперименты: DM CL LU ML LM XJ. Анализировали данные: YR MS DM CL XJ. Используемые реагенты / материалы / инструменты анализа: DM CL. Написал документ: YR MS DM CL.
Идентификация сильнодействующих широко нейтрализующих антител (bnAbs) против ВИЧ-1 и успешность профилактики инфекции SHIV после их пассивного введения повысили вероятность того, что стратегии иммунотерапии могут быть приняты для профилактики и лечения инфекции ВИЧ-1. Однако, хотя широкая и мощная нейтрализующая активность является необходимым условием, свойства in vivo, такие как хорошая стабильность кровообращения и неиммуногенность, одинаково важны для развития лечения человека. В настоящем исследовании гликоформы bnAbs 10-1074, NIH45-46G54W, 10E8, PGT121, PGT128, PGT145, PGT135, PG9, PG16, VRC01 и b12 получали с помощью Agrobacterium-опосредованной переходной трансфекции Nicotiana benthamiana и оценивали после введения в резус макаки. Результаты показывают, что (i) N-гликаны в домене VL ухудшают стабильность плазмы bnAbs растений и (ii), в то время как PGT121 и b12 не обладают иммуногенностью в макаках резуса после нескольких инъекций, VRC01, 10-1074 и NIH45-46G54W вызывают высокие титры против идиотипических антител после второй инъекции. Эти анти-идиотипические антитела специфически связывают введенный bnAb или близкий член семьи и ингибируют bnAb в анализах нейтрализации. Эти данные свидетельствуют о том, что определенные мутации в некоторых bnAbs способствуют их иммуногенности и обращают внимание на то, что эти мутированные bnAbs будут иммуногенными у людей, что потенциально может снизить их ценность для профилактики и лечения ВИЧ-1.
Все данные содержатся в документе.
Развитие широкомасштабного скрининга ВИЧ-инфицированных лиц, продуцирующих широко нейтрализующие антитела к ВИЧ, вместе с эффективными методами клонирования антител к одной клетке привело к выявлению все более мощных ВИЧ-аннабенов 1. Поскольку защита от заражения химерными изолятами simian-HIV (SHIV) за счет использования коктейлей первого поколения bnAb ранее была достигнута у макак 5, наличие bnAbs с превосходными нейтрализующими свойствами значительно увеличивает вероятность того, что терапевтические стратегии, связанные с пассивная иммунотерапия найдет применение в профилактике инфекции у людей в случае передачи от матери ребенку, передачи половым путем и в контроле как острых, так и хронических инфекций 11.
Эпитопы оболочек ВИЧ этих сильнодействующих и широко нейтрализующих антител обычно делятся на несколько категорий: те, которые преимущественно нацелены либо на сайт связывания CD4 (CD4b), эпитопы, частично содержащие углеводы на gp120 14, проксимальный внешний участок мембраны (MPER) и эпитоп, охватывающий как gp120, так и gp41 [17,18]. Внутри семейства гликановых эпитопов становятся очевидными подгруппы, хотя почти все mAb направлены на олигоманнозные гликаны, например. (i) высокие маннозные эпитопы в переменном контуре V1 / V2 (PG9 / PG16) и (ii) чувствительный к N332A комплексный гликан в контуре V3 (2G12, PGT, 10-1074). В последней группе незначительные различия могут привести к заметным изменениям потенции. Таким образом, хотя PGT128 взаимодействует с двумя олигоманнозными гликанами N301 и N332, а также с основанием петли V3, более мощный mAb PGT121 больше зависит от N332, чем N301, и однозначно распознает сложный гликановый эпитоп, заканчивающийся в галактозе или α2-6 -связанной сиаловой кислоты [19, 20].
В последнее время мы показали, что полученные на растительной основе mAb 2F5, 4E10, b12 и VRC01, полученные на растительном уровне в переходной системе N.benthamiana / p19 (Nb / p19), демонстрируют потенцию и функциональные свойства, подобные их клетке млекопитающих коллег [24]. В настоящем исследовании система переходных растений Nb / p19 использовалась для получения и тестирования различных гликоформ bnAbs PG9, PG16, 10-1074, NIH45-46G54W, 10E8, PGT121, PGT128, PGT145, PGT135, в дополнение к b12 и мутантные формы (N92T) VRC01 (mVRC01) и NIH45-46G54W (mNIH45-46G54W), и оценить их свойства in vivo у макак, чтобы отличить тех, которые, скорее всего, будут составлять или стать компонентом доступного и эффективного иммунотерапевтического коктейля для предотвращения или контролировать ВИЧ-инфекцию у людей.
Животные размещались на объектах BIOQUAL в Роквилле, штат Мэриленд. Уход и разведение всех нечеловеческих приматов осуществлялись в соответствии с федеральными законами и руководящими принципами, а также в соответствии с рекомендациями, содержащимися в руководстве NIH, и другими общепринятыми стандартами лабораторного ухода за животными и их использования. BIOQUAL аккредитован Ассоциацией по оценке и аккредитации лабораторного ухода за животными (файл AAALAC № 624) и имеет удостоверение в файле с Национальным институтом здравоохранения, Управление по защите исследовательских рисков, как того требует Политика общественного здравоохранения США о гуманном уходе и использовании лабораторных животных. Файл PHS Animal Welfare Assurance № A-3086-01. Животных седировали с помощью кетамина или telazol для всех технических процедур. Кетамину давали i.m. в количествах, необходимых для краткосрочных процедур, таких как рисование крови.
Выделение антител с помощью экспрессии гена-предшественника, экспрессируемого Agrobacterium в N. benthamiana, выполняли, как описано ранее [24]. Переменные домены с оптимизированным синтетическим кодоном были фланкированы сайтами рестрикции типа II и клонированы в векторы экспрессии растений pTRA, несущие константные домены IgG1 и kappa. Первоначально опубликованные аминокислотные последовательности антител использовались, если не указано иное. Антитела продуцировали путем совместного инфильтрации 6-8-недельных растений или листьев с рекомбинантными суспензиями Agrobacteria, индивидуально несущими плазмиды экспрессии на основе тромбоцитов и легкой цепи pTRA, а также супрессор-ограничитель p19 на основе pBIN из вируса тотального пушистого трюка. Через 10-12 дней растворимые белки экстрагировали и очищали хроматографией на белке-А, производя 100-400 мг / кг, в зависимости от bnAb. Также были выражены мутантные формы N92T VRC01 и NIH45-46 bnAb. Для bnAbs mNIH45-46G54W и 10-1074 для удержания ER использовали С-концевой тег SEKDEL для генерации гликоформ с высокой маннозой.
Фармакокинетические и иммуногенетические исследования растений, продуцируемых ВИЧ-mAb, проводились в Bioqual с использованием индийских резус-макак 3-6 кг (Macaca mulatta) обоих полов в зависимости от наличия. Для оценки удержания плазмы каждого bnAb после введения двум макакам / группе вводили один или несколько раз i.v. с дозами 5, 7,5 или 10 мг / кг каждого из mAb и кровоточить (0,5 мл) из бедренной артерии в нулевое время и в течение 2-3 недель в указанное время (см. рисунки). Исследования с использованием каждого bnAb повторялись несколько раз. Затем образцы плазмы или сыворотки тестировали на оба уровня циркулирующего mAb, измеренные нейтрализующей активностью антител или с помощью ELISA, а также для индукции антитела против человека bnAb. Число цифр в макаке включено в цифры. Никакие макаки не болели ни в одном из исследований.
Анализ нейтрализующих антител проводили в клетках TZM-bl, как описано ранее [25], с очищенными bnAbs, а также с образцами плазмы, собранными из макак в разное время после i.v. инъекции bnAbs. Очищенные рекомбинантные антитела тестировали начиная с 50 мкг / мл с серийными 3-кратными разведениями. Плазма (как инактивированная нагреванием, так и не нагретая) была испытана, начиная с разведения 1:20. Разведенные тестовые образцы предварительно инкубировали с псевдовирусом (
150 000 относительных легких единичных эквивалентов) в течение 1 часа при 37 ° C перед добавлением клеток. После 48 часов инкубации клетки лизировали и активность репортерного гена люциферазы (Luc) определяли с использованием люминометра с микротитровальной пластиной и реагента BriteLite Plus (Perkin Elmer). Титры нейтрализации — это разведение образца (для плазмы) или концентрация антител (для очищенного mAb), при котором относительные единицы люминесценции (RLU) были уменьшены на 50% по сравнению с RLU в контрольных лунках вируса после вычитания фонового RLU в контрольных лунках клеток.
Для определения фармакокинетики и иммуногенности вводимого bnAbs использовали два типа ELISA. Для контроля скорости очистки циркулирующих bnAbs 96-луночные планшеты Immuno Module (Nunc) были покрыты очищенной растительной высокой маннозой 89,6P gp140-KDEL (1 мкг / мл) и инкубировали в течение 2 часов при комнатной температуре с серийными разведениями экстрактов листьев или очищенных mAb клеток, полученных из растений или млекопитающих [24]. В некоторых случаях, например, обнаружение уровней PGT121, лунки были покрыты LC-каппами человека (50 мл 1 мкг / мл) (SIGMA K3502) или с помощью CHO-мономерного HIV BaL-gp120 (NIH HIV Reagent Program) или m.CONgp140 env (добрый дар д-ра Барта Хейнса, Duke Univ., NC), которые содержат гликаны комплекса млекопитающих, необходимые для связывания [12]. Контроль HEK-293 VRC01 любезно предоставлен VRC, NIH и CHO-производным PGT121 от IAVI, NY. Скважины блокировали 5% (мас. / Об.) Молоко в PBST, промывали 3-5 раз PBST, инкубировали с 1/8000 разбавлением меченого пероксидазой козьего анти-человеческого IgG (Fc) (A0170, Sigma) и развивали с системой жидкого субстрата тетраметилбензидина (ТМБ) (T0440, Sigma Chemical Co, MO). Реакции прекращали с помощью 0,5 N H2SO4, а конечные точки определяли при 450 нм с использованием планшетного считывателя SPECTRA max PLUS (Molecular Devices). Из-за изменчивости на фоне отдельных макаков были вычтены начальные предварительно упакованные значения OD450.
Для контроля присутствия ответа на антитела против макаки против введенного ВИЧ-ангиопластика человека, ELISA-планшеты покрывали при RT целевыми антителами при 1,2 мкг / мл в течение 2-4 часов. После инкубации лунки блокировали, промывали и инкубировали в течение 2 часов с помощью плазмы обезьяны или образцов сыворотки при 1/500 и 1/2500 разведениях с последующей третьей 2-часовой инкубацией с 1/4000 мышиного антимакакового IgG (1B3-HRP, Ресурс для реанимации пришельцев).
Тестирование реакционной способности bnAb на основе растений, начиная с 50 мкг / мл, любезно выполнялось Krissy Lloyd (Duke University) против группы из 9 аутоантигенов, связанных с наличием аутоиммунных заболеваний (антигены Sjogren’s антигенов A и B, антигена Смита, рибонуклеопротеина, центромер B, гистон, склеродерма 70, белки Jo-1 и dsDNA). CH98 реагирует с dsDNA с использованием 4E10 и 2F5 в качестве контролей, тогда как все bnAbs растения отрицательны (данные не показаны).
Широкая распространенность ВИЧ вызывает серьезную тревогу у работников здравоохранения. В мире примерно каждый сотый инфицирован. СПИД, вызванный вирусом иммунодефицита человека, уже давно не болезнь наркоманов – сейчас все чаще возбудитель находят у людей, ведущих вполне обычный образ жизни. Поэтому одним из главных вопросов, который волнует не только врачей, но, пожалуй, практически каждого жителя нашей планеты – когда найдут лекарство от ВИЧ-инфекции?
Характеристика вируса
Вирус иммунодефицита человека относится к категории РНК-содержащих – то есть его генетический материал содержится в двух цепочках рибонуклеиновой кислоты. Примечателен тем, что поражает, в основном, лимфоидную ткань, а именно – Т-лимфоциты, являющиеся основой клеточного иммунитета. Существует 4 его разновидности, больше всего распространены 1 и 2, передавшиеся человеку от двух разных видов обезьян. Наиболее распространен и вирулентен первый тип.
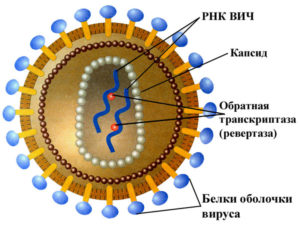
Чтобы создать лекарство против ВИЧ, человечеству необходимо было понять его строение. Сейчас известно – он состоит из ядра, представленного РНК и специальными энзимами, капсида с суперкапсидом – оболочек из липопротеидов, фосфолипидов. Большое значение имеют ферменты ядра: ревертаза (используется, когда патоген начинает размножаться в организме человека, нужна для синтеза ДНК), интеграза (для внедрения генетической информации вируса в хромосому хозяина), протеаза (делит белки на аминокислоты).
Размножается, как любой вирус, только в организме человека.
Процесс состоит из нескольких этапов:
- Сближение и слияние с человеческой клеткой.
- Сбрасывание оболочки (капсида).
- Превращение РНК вируса в ДНК при помощи ревертазы.
- Внедрение чужеродной ДНК в хромосому клетки.
- Синтез вирусных РНК (при этом используются ресурсы пораженной клетки).
- Сборка вирусных тел, их выход из клетки с последующим распространением.
Поражаются Т-лимфоциты, снижается их количество. Это ослабляет иммунную систему, развивается синдром приобретенного иммунодефицита.
Сейчас наука ставит перед собой важный вопрос – возможно ли вылечить СПИД?
По каким причинам сложно создавать лекарство
Ученые, изучающие проблемы ВИЧ – инфекционисты, микробиологи, генетики – направляют свои усилия на создание лекарства. О том, что человечество скоро ждет победа над ВИЧ еще рано. В СМИ часто мелькает информация – “найдено новое лекарство от ВИЧ”, но действительно эффективных препаратов, навсегда излечивающих от болезни, по-прежнему нет.
Основная причина того, почему до сих пор не создано средство от СПИДа – возбудитель способен многократно мутировать у каждого пациента, повышая устойчивость к используемым препаратам. Другими причинами являются: способность персистировать в клетках крови, механизм антигенной мимикрии – способность создавать белки, подобные человеческим, благодаря чему не распознается иммунитетом как чужеродный агент, а также непереносимость фармакотерапии, встречающаяся у части больных.
Перспективы лечения – снижение вирусной нагрузки, поддержание работы иммунной системы. Это называется антиретровирусной терапией. Такое лечение лишь замедляет прогрессирование заболевания – о полном избавлении от патогена пока речи нет. Становится ясно – повлиять можно лишь на течение болезни, то есть чем раньше начать фармакотерапию, тем меньше вреда будет нанесено иммунной системе. Противовирусные таблетки необходимо принимать пожизненно. Также ведется работа над созданием вакцины. Для этого изучается феномен людей, которые обладают иммунитетом к этому вирусу.
Ученые научились лечить ВИЧ у животных – пока только у мышей. Путем модернизации их генома (удаляя из каждой клетки вирусную ДНК) достигнуто полное выздоровление. Неизвестно, сколько лет пройдет, прежде чем подобная технология будет применяться у людей. Также нельзя точно сказать, в каком году ликвидируют эту болезнь, есть ли другие лекарства от ВИЧ-инфекции. Перспективы полного избавления от ВИЧ у человека пока далеки от реальности – ученые не могут найти причину того, почему он так стремительно мутирует.
Существует ли лекарство от ВИЧ

При лечении врачи ставят перед собой определенные цели: продление срока жизни с улучшением ее качества, минимизация осложнений, снижение вероятности передачи возбудителя от данного пациента его партнеру. Эти цели реализуются через принципы: оптимальная психологическая обстановка, своевременное начало терапии, предотвращение и ранняя диагностика вторичных патологий, их устранение.
Впервые ученые изобрели лекарство от ВИЧ в 1986 – это был азидотимидин. Когда при помощи него никто не излечился от ВИЧ, стало ясно – можно только отсрочить прогрессирование болезни. Пока нельзя сказать точно, существует ли лекарство от ВИЧ. Правда ли, что ученые нашли лекарство и вирус ВИЧ в скором времени победят? К сожалению, нет. Результаты будут хорошими тогда, когда появится возможность вылечить болезнь полностью. Последние исследования утверждают – ВИЧ можно победить, но они проводились пока только на животных. На вопрос “излечим ли СПИД в наше время?” можно ответить, что, когда развивается СПИД – помочь гораздо сложнее, процесс уже необратим, можно лишь замедлить его развитие.
В интернете можно встретить громкие заголовки “вся правда о препаратах против ВИЧ”, которые заставляют население сомневаться, лечится ли в наше время СПИД, вызванный ВИЧ, есть ли смысл принимать препараты. Конечно, полностью выздороветь невозможно, но можно повысить качество жизни, предотвратить осложнения, если начать принимать антиретровирусные как можно раньше. Остается надеяться, что скоро специалисты найдут вещества, которые убивают ВИЧ.
История препаратов от ВИЧ-инфекции

Есть ли надежда, что найдут лекарство? Ученые уже давно работают над этим вопросом.
Первое было создано в 1986 – ингибитор ревертазы зидовудин. Вначале препарат казался достаточно эффективным, но потом выяснилось – к нему быстро развивается устойчивость. Это стало стимулом для проведения новых исследований.
Следующим прорывом в лечении стало создание ВААРТ – высокоактивной антиретровирусной терапии. Это произошло в 1996 году. Фармакотерапия стала комплексной, была подтверждена эффективность комбинации препаратов – ингибиторов ревертазы, протеазы, интегразы. Позднее появились блокаторы рецепторов и слияния. В начале 2000-х годов проведены исследования, доказывающие эффективность этой терапии для предотвращения перинатальной передачи патогена плоду от инфицированной матери, созданы безопасные комбинации медикаментов.
Конечно, даже ВААРТ не способна полностью избавить организм от возбудителя. Однако, было достигнуто снижение вирусной нагрузки на организм, увеличилась продолжительность жизни пациентов. К сожалению, появились и определенные сложности – выяснилось, что ВААРТ имеет много побочных эффектов. К ним относят диарею и запоры, чувство тошноты и рвота, лекарственный гепатит и цирроз печени, аллергические реакции, анемия, нарушение функции почек, ожирение, поражение периферической нервной системы. Пациенты, узнав об этом, склонны отказываться от лечения. Важно информировать больных, что многие побочные действия прекращаются спустя 1-2 месяца от начала терапии. Над этим ведется работа, ведь лечение назначается практически пожизненно, и новые медикаменты хорошо переносятся.
Современная наука работает не только в направлении изобретения новых медикаментов. Также ведутся работы по созданию вакцины от вируса иммунодефицита человека.
Современные лекарства, применяемые в медицине
Современные таблетки от ВИЧ объединены в комплекс, который называется высокоактивной антиретровирусной терапией. В нее входят следующие группы препаратов:
1. Ингибиторы ферментов и процессов:
- Ревертазы – невирапин, ифавиренц, абакавир, ламивудин. Блокируют синтез вирусной ДНК, а следовательно, размножение патогена.
- Интегразы – ралтегравир, элвитегравир. Предотвращают встраивание чужеродной ДНК в генетическую информацию клетки-хозяина.
- Протеазы – саквинавир, индинавир, ритонавир. Блокируют заключительный этап размножения патогена.
- Слияния – энфувиртид. Блокируют проникновение возбудителя в клетку.
2. Антагонисты рецепторов CCR5 – маравирок. Блокируют проникновение возбудителя в клетку.
Цены на медикаменты достаточно высоки. Их стоимость для одного пациента зависит от применяемой схемы, входящих в нее препаратов и составляет от 11 до 380 тыс.руб ежегодно. В России лечение пациентов с ВИЧ осуществляется за счет государственного бюджета.
Результатом многочисленных исследований стало изобретение Ledgin (новый блокатор интегразы) в 2010 году. Этот современная разработка – настоящий прорыв, ведь вещество не только препятствует встраиванию вирусной ДНК в клетку-мишень, но и заставляет патоген локализоваться на тех участках, где размножение невозможно, то есть эффект сохраняется после прекращения приема. Это позволит пациентам делать перерывы в терапии.
Препараты в стадии разработки и тестирования
Ученые долго искали способ, как вылечиться от ВИЧ-инфекции. И вот в 2017 появилось сообщение об испытании новых лекарств от СПИДа. Как
показали последние исследования, появилась надежда победить ВИЧ навсегда. Ответ на вопрос “излечим ли ВИЧ полностью?” появится, когда пройдут испытания новые методы, тогда можно будет сказать, найдено ли средство от СПИДа.
Теперь подробнее о новых методах лечения.
Это медикаменты, препятствующие образованию внешней оболочки вируса, тем самым, не давая размножаться. Пока испытания проведены только на лабораторных животных.
GS–CA1 – новейший препарат, который препятствует сборке капсида. Связывается с наименее подверженным мутации фрагментом, а также эффективен в предотвращении проникновения возбудителя в клетку, блокируя распад капсида и транспорт чужеродной РНК в клетку-мишень.
Моноклональные антитела – иммуноглобулины, выработанные одной плазматической клеткой к определенному антигену.
Как известно, вирус иммунодефицита человека тропен к Т-лимфоцитам. Он “узнает” их по белку CD4, расположенному на поверхности клетки. Моноклональные антитела – препараты, которые связывают молекулу этого белка, делая клетку “неузнаваемой” для патогена. Особенно поможет такой метод больным уже развившейся резистентностью к “старым препаратам”, длительно принимающим ВААРТ. Представитель группы – имализумаб. Характеризуется хорошей переносимостью.
PRO-140 – новый препарат, в отличие от имализумаба, действует на ко-рецепторы CCR5, помогающие вирусу проникнуть в клетку-мишень. Может быть компонентом ВААРТ или применяться в качестве монотерапии.

Разработка медикаментов ведется не только в направлении открытия новых молекул. Изучаются свойства давно открытых веществ. Создаются другие способы введения веществ, проходят испытания пролонгированные формы, делающие прием лекарств более удобным. Это также важно – ведь ВААРТ назначается пожизненно.
Важным аспектом является профилактика ВИЧ-инфекции у контактных лиц. Один из препаратов, который планируют использовать с этой целью – Карботегравир. По механизму действия он не является принципиально новым — это ингибитор протеазы. Инъекционная пролонгированная форма позволит применять его 1 раз в 28 дней.
Также для профилактики и лечения создают новые комбинированные медикаменты. Именно сочетание веществ в одной таблетке облегчает прием и повышает приверженность больного к терапии – психологически принимать одну-две пилюли легче. Таким препаратом является Трувада, состоящий из ингибиторов обратной транскриптазы тенофовира и эмтрицитарабина (нуклеозидный). Принимается один раз в сутки.
Эти молекулы относятся к уже известным классам препаратов от вируса иммунодефицита человека.
GS-9131 – новый блокатор обратной транскриптазы. Пока испытан только на культуре клеток. Активен даже при мутациях вируса.
GS-PI1 – высокоэффективный ингибитор протеазы. Возможно использование без других препаратов (усилителей фармакокинетики), поэтому снижается вероятность поражения печени, нежелательных негативных эффектов. Уже тестируется на животных.
MK-8591 – нуклеозидный ингибитор ревертазы. Имеет тройной механизм действия – блокирует фермент, затрудняет и предотвращает “коррекцию” неверно скопированных участков ДНК, пристраивая к цепочке “лишний” нуклеозид. Обладает очень выраженным длительным эффектом (до полугода), достигаются значительные концентрации в слизистой влагалища и прямой кишке, позволяющие использовать его для профилактики заражения здоровых партнеров пациента. Уже исследуется на человеке.
Работа над вакциной
Для многих людей, страдающих ВИЧ, важно, чтобы от болезни не пострадали их близкие. С самого открытия вируса иммунодефицита человека ученые предпринимают попытки создать вакцину. Ни одна еще не запущена в производство.
Сам принцип работы вакцины состоит во введении ослабленного возбудителя или его компонентов в организм, помогая иммунной системе выработать специфические антитела.
Есть несколько вакцин, которые проходят испытания – HVTN702, VRCO1 (антитела, практически идентичные синтезируемым в организме), Ad26 (создана из антигенов различных типов вируса), PENNVAX-GP (комплексная, содержащая 4 антигенных компонента, вызывающая не только образование антител, но и клеточный иммунный ответ).
Препарат “Гаммора” против ВИЧ
Еще недавно казалось – не существует веществ, которые полностью лечат ВИЧ. Но наука не стоит на месте – в Израиле ученые изобрели новое лекарство против СПИДа и ВИЧ, точнее, нашли белок, помогающий бороться с этой болезнью. Это “Гаммора”.
Его действие принципиально отличается от привычных антиретровирусных препаратов. Препарат Gammora уничтожает клетки, содержащие патоген. При этом здоровые ткани не страдают. Действующим веществом является белок, нарушающий передачу чужеродной ДНК в клетку-мишень. Обычно вирус передает одну копию своей генетической информации, но при применении данного препарата количество копий увеличивается, запускается процесс “самоубийства” клетки – апоптоз. Вместе с пораженной клеткой погибает вирус.
Купить данный медикамент нельзя, но, скорее всего, он будет продаваться в Израиле в ближайшие годы.
Случаи полного излечения

При кажущейся неутешительной ситуации в отношении ВИЧ-инфекции, редко, но встречаются люди, излечившиеся от этой болезни.
Известно несколько случаев:
- История Тимоти Рэя – первый человек, который полностью вылечился от ВИЧ. Этот пациент из Берлина заразился в 1995 году. Так как Рэй сразу начал принимать антиретровирусную терапию, болезнь не переходила в СПИД. Но в 2006 у него был диагностирован лейкоз. Понадобилась трансплантация клеток костного мозга. Уже тогда науке была известна роль белка CCR5 в проникновении ВИЧ в клетку-мишень, поэтому лечащий врач решил найти донора с мутацией этого рецептора. После трансплантации было подтверждено отсутствие вирусных тел в организме данного больного – полное излечение от ВИЧ.
- Эффект группы Visconti – исследование, подтверждающее эффективность как можно более раннего начала антиретровирусной терапии. Люди этой группы (около 20 чел.) начали принимать медикаменты спустя 2 месяца после заражения. Даже после прекращения лечения концентрация патогена осталась низкой, а болезнь течет бессимптомно. Примечательно, что генетически эти пациенты не принадлежат к группе “элитных контроллеров” – людей, чей организм способен длительно бороться с вирусом или не подвержен его действию.
- Девочка из Миссисипи – еще один пример эффективности раннего начала лечения. Мать девочки была ВИЧ-положительной, сразу после родов ребенку начали вводить ВААРТ. Первые три года жизни вирус в ее крови не обнаруживался. По неизвестным причинам, когда девочке было 4 года, возбудитель был найден в ее крови.
- Двое мужчин из Бостона – также подверглись трансплантации костного мозга из-за опухолевого заболевания лимфоидного аппарата. Но возбудитель появился в крови после отмены противовирусных препаратов.
Читайте также:


