Какие клетки использует вич для репликации
Информация о вирусе иммунодефицита человека (или сокращенно, HIV или ВИЧ) появилась сравнительно недавно, ближе к середине
Сначала подобное заболевание воспринималось как нечто экзотическое, случаи инфицирования отмечали среди низших социальных категорий населения.
Но в настоящее время в мире не существует страны, где нет своей печальной статистики заболеваемости и смертности от ВИЧ и последующего СПИДа.
По данным на 2014—2015 год, ежегодно в мире регистрируется порядка 2,5 млн. случаев инфицирования. При этом почти 50% носителей ВИЧ не подозревают о наличии болезни.
В соответствии с медицинской классификацией, вирус иммунодефицита человека — ретровирус, относящийся к семейству лентивирусов.
Известно, что инфекции, спровоцированные данной группой патогенов, отличаются длительным упорным, хроническим течением, часто поражают структуры центральной и периферической нервной системы.
Выделяют две разновидности инфекции — ВИЧ-1 и ВИЧ-2. Причем наибольшее распространение получил ВИЧ-1, ВИЧ-2 встречается только у 1% пациентов, и все случаи инфицирования зарегистрированы в странах Западной Африки. Подобную статистику объясняют относительно низкой патогенностью ВИЧ-2.
Внутри ВИЧ-1 выделяют три группы M, N и O, причем группа M состоит из 9 подтипов, которые названы по буквам английского алфавита (с A по K соответственно). У ВИЧ-2 8 подтипов. Поэтому при описании клинических проявлений и других особенностях заболевания по умолчанию имеется ввиду только ВИЧ-1 подтипа М, которые размножаются в сотню раз быстрее, чем ВИЧ-1 подтипа О.
При проведении микроскопии ВИЧ-1 и ВИЧ-2 во многом выглядят одинаково, разнятся они лишь белковой структурой. Размер вириона составляет около 100 нм, вирусная частица окружена липопротеиновой оболочкой. Она состоит из связанных между собой 72 гликопротеиновых комплексов. В строении каждого из них выделяют поверхностную (gp120) и трансмембранную (gp41) часть.

Центральная часть вириона ВИЧ состоит из так называемого ядерного антигена (р24), который в свою очередь содержит 2 копии РНК (сочетание белков, нуклеиновых кислот, нуклеопротеина р27, обратной транскриптазы). Также в состав вируса входят интеграза р32, протеаза р11 и другие ферменты, облегчающие распространение ВИЧ в организме человека.
Заражение инфекцией и ее последующая активность зависит от индивидуальной реакции иммунной системы и восприимчивости клеток к вирусу. Отличительной особенностью заболевания служит тот факт, что дальнейшему распространению болезни способствует передача ВИЧ от зараженной клетки к здоровой.
В ходе клинических исследований было продемонстрировано, что ВИЧ способен поражать не только иммунокомпетентные клетки. Под прицел попадают структуры центральной нервной системы, толстого кишечника, почек, простаты у мужчин, шейки матки у женщин т.д. Кроме того, даже в минимальной концентрации ВИЧ поражает и неактивные лимфоциты типа CD4.
Критическое снижение количества CD4 — клеток и является патофизиологической причиной неадекватного иммунного ответа, что служит одним из основных проявлений СПИДа.
В течении заболевания выделяют такие стадии:
- Инкубационный период (иногда его именуют стадией инкубации). Продолжается с момента попадания вириона в организм человека до появления первых проявлений.
- Ранняя стадия первичных симптомов. Клиническая картина на данном этапе обусловлена ответной иммунной реакцией на репликацию патогена. На этой стадии возможно обнаружение различных частиц вируса в сыворотке крови при целевом обследовании. Эта стадия в свою очередь подразделяется на ПА, когда симптомы заболевания отсутствуют (такое течение считается более благоприятным с точки зрения дальнейшего прогноза), и ПБ (отмечают у большей половины пациентов). Она характеризуется выраженной клинической картиной.
- Латентная стадия. Острая симптоматика исчезает, а развитие вируса замедляется. Однако прогрессирует иммунодефицит. Как правило, продолжается до 7 лет, в некоторых случаях — несколько десятков лет.
- Стадия вторичных заболеваний. Патологии возникают на фоне истощения защитных сил организма и падения уровня CD4 лимфоцитов. Протекает поэтапно. Сначала развивается IVA стадия (концентрация CD4 клеток составляет 500 — 350 на мкл). Затем следует IVБ стадия (уровень CD4 клеток падает до 350 — 200 на мкл). IVБВ стадия характеризуется снижением количества CD4 лимфоцитов до 200 на мкл и ниже. Перечисленные этапы протекают с чередованием периодов ремиссии и обострения.
- Терминальная стадия. Концентрация CD4 клеток падает до критических показателей. При отсутствии лекарственной терапии высока вероятность летального исхода.
Сейчас повсеместно открываются центры профилактики и терапии СПИДа, где можно анонимно сдать анализы на ВИЧ. Также разработана техника экспресс-исследования для подтверждения или исключения данной инфекции. Процедура взятия материала для проведения теста занимает считанные минуты, расшифровка результатов также проходит достаточно быстро. Это — надежный способ провериться после незащищенного полового акта.
Признаки ВИЧ: клиническая картина заболевания, особенности течения инфекции у детей, факторы риска
Вирус иммунодефицита человека в большинстве случаев не имеет склонности к быстрому прогрессированию. Каждая стадия может длиться недели, а некоторые этапы и годы. Нарастание явной клинической симптоматики обусловлены снижением концентрации CD4 лимфоцитов и ухудшающейся недостаточностью иммунной системы человека.

Скрытый период заболевания может продолжаться от 3 до 12 недель. Это сугубо индивидуально и зависит от активности защитных сил организма зараженного человека. Отсутствие симптомов обусловлено размножением вируса и поражением все большего числа клеток.
На второй стадии признаки ВИЧ могут быть не выражены.
Однако приблизительно у половины пациентов данный этап сопровождается такими клиническими проявлениями:
- Типичная реакция организма на внедрение патогенного вируса. Это повышение температуры до фебрильных значений, увеличение размера лимфоузлов, общее недомогание. Подобная симптоматика характерна для большинства ОРВИ, поэтому некоторые пациенты не обращаются к врачу, хотя анализ методом ПЦР и другие способы диагностики позволяют выявить ВИЧ.
- Признаки со стороны ЛОР—органов. Беспокоит боль в горле, усиливающаяся при глотании слюны или пищи, разговоре и т.д. Такая картина дополняет лихорадку и слабость, поэтому пациент чаще обращается не к врачу, а в аптеку, приобретая Аспирин и другие лекарства от ОРВИ.
Косвенно указывать на развитие ВИЧ могут гипертрофия печени и селезенки (подобные признаки можно отметить при пальпации либо на УЗИ), расстройства стула, сыпь на эпидермальном покрове различной локализации и характера.
На начальных стадиях заподозрить ВИЧ достаточно сложно. Характерные внешние симптомы возникают практически у каждого, особенно в сезон простуд и распространения ОРВИ. Предположить наличие вируса иммунодефицита можно, если за 2 недели или месяц до развития такой клинической картины был незащищенный половой контакт или присутствовали другие факторы риска попадания инфекции в организм.
На третьей стадии (латентной) признаки ВИЧ становятся не столь выраженными. Только время от времени отмечают увеличение размера лимфоузлов (без четкой локализации). Данный этап может продлиться от 4—5 до 15—20 лет. Самочувствие пациента при этом остается удовлетворительным. Однако снижение иммунокомпетентных клеток дает о себе знать подверженностью к различным заболеваниям.
Для четвертой стадии ВИЧ характерны:
- прогрессирующая потеря массы тела вплоть до истощения;
- многочисленные поражения практически всех внутренних органов;
- онкологические заболевания;
- микотические, вирусные и бактериальные патологии слизистых и эпидермальных покровов.
Четвертый этап ВИЧ — это собственно и есть СПИД, когда истощение иммунной защиты организма провоцирует развитие многочисленных вторичных осложнений. Как правило, они возникают на фоне отсутствия терапии. Доктора отмечают развитие:
- пневмоцистной (характерна только для пациентов с ВИЧ) и бактериальных пневмоний;
- вируса герпеса, заболевание может проявляться в виде внешних симптомов на кожных и слизистых покровах лица или гениталий, также высока вероятность поражения нервной системы и внутренних органов;
- кандидоз, может сочетаться с респираторными инфекциями либо протекать индивидуально на слизистых ротовой полости и половых органов;
- токсоплазмоз, обычно проявляется в виде поражения головного мозга;
- цитомегаловирусная инфекция, в первую очередь затрагивает органы зрения;
- туберкулез, встречается очень часто и может появиться и на второй стадии ВИЧ с поражением легких, а затем и других органов;
- другие инфекции кожи и внутренних органов, спровоцированные патогенной флорой различных видов.
Кроме того, на фоне СПИД достаточно часто отмечают возникновение злокачественных новообразований и патологий (саркома Капоши, различные лимфомы), болезнь Ходжкина. Для лечения лимфом разработан инновационный препарат Адцетрис, а также средство Блеомицин. Нередко ВИЧ ассоциируется с карциномами, аутоиммунными поражениями. Патогенез развития подобных осложнений до конца не выяснен.
Всем сексуально активным лицам, которые не имеют постоянного полового партнера, анализы на выявление вируса иммунодефицита рекомендуют сдавать ежегодно.
Однако в обязательном порядке следует посетить врача при:
В группу риска возникновения ВИЧ/СПИД попадают следующие категории населения:

У ребенка в большинстве случаев заражение происходит от больной матери во время родов, при последующем уходе и грудном вскармливании. Клиническое течение ВИЧ/СПИД у детей также проходит в несколько стадий, однако развиваются они гораздо стремительнее, чем у взрослых. Нередко летальный исход наступает уже на второй — третьей стадии от типичных для раннего возраста инфекций.
Указывать на развитие синдрома иммунодефицита могут такие признаки ВИЧ:
- постоянно рецидивирующие бактериальные поражения респираторного тракта, центральной нервной системы и других органов;
- кандидоз ротовой полости, особенно если подобное заболевание появилось у ребенка старше 1 месяца, не связано с приемом антибиотиков и продолжается более 4 недель несмотря на фунгицидную терапию;
- хронический паротит, характеризующийся воспалением околоушных лимфатических узлов и повышением температуры;
- мультиочаговая лимфаденопатия;
- увеличение размеров печени;
- лихорадка неясного генеза, носящая постоянный или рецидивирующий характер;
- разнообразные неврологические расстройства;
- высыпания на коже в сочетании с грибковыми поражениями ногтевых пластин;
- проявления опоясывающего лишая.
Для проведения адекватной терапии всем детям, рожденным от больных матерей, необходимо провести своевременную диагностику. Сразу же начинают антиретровирусную терапию, проводят мероприятия, направленные на укрепление иммунной системы, выполняют симптоматическое лечение.
Как передается ВИЧ и основные пути заражения инфекцией
Вирионы иммунодефицита человека в максимальной концентрации содержатся в крови, сперме у мужчин, в меньшем — в грудном молоке и влагалищном секрете у женщин. Поэтому наиболее распространенным способом, как передается ВИЧ, является незащищенный половой контакт.
До настоящего момента мы обсуждали события, происходящие на ранней стадии взаимодействия ВИЧ с клеткой. Это взаимодействие зависит от участвующего в нем типа вируса, экспрессируемых клеточных рецепторов и свойств инфицируемых клеток. После того как вирус проникнет в клетку, различные биологические свойства вирусных белков и нуклеиновых кислот определяют его способность к репликации. На инфекционный цикл ВИЧ также влияют внутриклеточные белки, которые у различных типов клеток могут различаться.
После попадания ВИЧ в клетку нуклеокапсида ВИЧ происходит запуск определенных внутриклеточных процессов, которые приводят к интеграции провирусной ДНК в хромосомы клетки. На раннем этапе вырусная геномная РНК высвобождается из вирусного капсида с помощью белка оболочки нуклеоида р24, связанного с клеточным белком циклофилином. Циклофилин А (СурА) представляет собой фермент пептидил-пролил изомеразу, которая связывается с белком капсида (СА) и способствует репликации ВИЧ.
Он включается в состав вирионов ВИЧ в результате прямого взаимодействия с белком Gag во время сборки вириона. Его активирующее влияние на продуцирование вируса зависит от его присутствия в клетке-мишени. Этот процесс может быть заблокирован циклоспорином.
Все еще находясь в связанном состоянии с белками нуклеоида (в основном с матриксным белком р17), вирусная РНК подвергается процессу обратной транскрипции под действием вирусной РНК-(или ДНК)-зависимой ДНК полимеразы и РНКазы Н2, по окончании которой образуется двухцепочечная ДНК-реплика вирусного генома (или провирусная ДНК).
Для осуществления эффективной обратной транскрипции белок нуклеокапсида (NC) р7, по-видимому, выступает в качестве белка-шаперона. Он способствует сохранности транскриптов ДНК, образующихся в результате обратной транскрипции и позже, перед отпочкованием дочерних вирионов, участвует в правильной упаковке (фолдинге) геномной РНК вирусов. Этот уникальный для ретровирусов белок NC содержит два цинковых пальца, которые необходимы для осуществления его функций.
Образующаяся реплика ДНК входит в состав преинтеграционного комплекса (PIC), который содержит вирусный белок р17, белок Vpr и интегразу(IN).
Недавно проведенные исследования показали, что эмерин, интегральный белок внутренней оболочки мембраны ядра, возможно вносит необходимый вклад в возможность репликации ВИЧ в клетке. При отсутствии эмерина провирусная ДНК не может взаимодействовать с хроматином и встраиваться в хромосому.
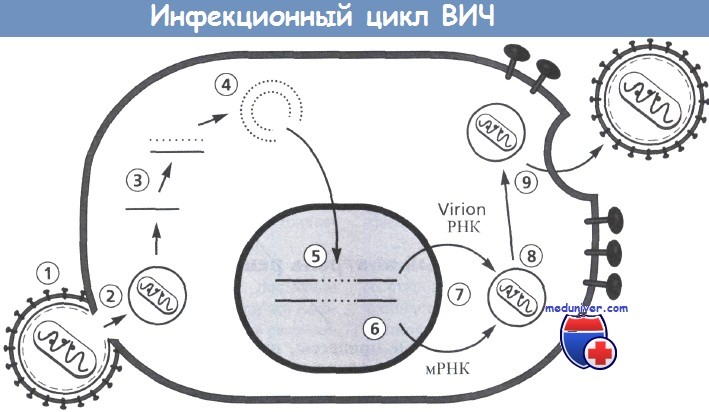
Инфекционный цикл ВИЧ.
Включает следующие этапы: 1 - прикрепление; 2 - декапсидация; 3 - обратная транскрипция;
4 - образование кольцевых форм; 5 - интеграция; 6 - транскрипция; 7 - трансляция;
8 - сборка вирусной сердцевины; 9 - окончательная сборка и отпочкование вирионов.
На этапах от 3 до 5 некоторые белки вирусной сердцевины связываются с вирусным геномом ( РНК, ДНК).
Двухцепочечные циркулярные формы ДНК могут быть связаны ковалентно и нековалентно.
Последние представляют собой формы, которые интегрируются в хромосому клетки. Противовирусная терапия может быть направлена на каждый этап и потенциально способна нарушать репликацию и распространение вируса.
Рисунок предоставлен Н. Kessler.
Интеграция провируса ВИЧ, по-видимому, происходит преимущественно в транскрипционно активных областях генома клетки, особенно в тех, которые были активированы под действием самого ВИЧ. Интеграция может проходить с участием специфического молекулярного комплекса, локализованного в ядре и состоящего состоящего из вирусной интегразы и фактора роста/коактиватора транскрипции, идентифицированного как продукт, секретируемый эпителиальными клетками хрусталика человека и имеющего мол. вес 75 кДа - р75 (LEDGE/p75 - lens epithelium-derived growth factor/transcription coactivator p75).
LEDGE/p75 представляет собой клеточный белок, связанный с хроматином, который, по-видимому, защищает клетку от стресс-индуцированного апоптоза и является главным фактором, связывающим интегразу вируса с хроматином клетки. LEDGE/ р75, по видимому, обеспечивает интеграцию ВИЧ в транскрипционно активных участках клеточной ДНК, в особенности обогащенных G-C последовательностями нуклеотидов. Однако до сих пор неизвестно, насколько связывание интегразы с хроматином через LEDGE/p75 определяет выбор участка действия для интергразы.
Транспорт PIC в ядро может зависеть от взаимодействия вирусных белков р17 и Vpr с клеточным кариофериновым комплексом, содержащим циклофилины. Как отмечали выше, клеточный белок циклофилин А, связанный с Gag внутри вириона, участвует в ранних стадиях репликативного цикла ВИЧ-1. Однако такое участие, по-видимому, не является необходимым, поскольку Gag-белки других реплицирующихся ретровирусов, в том числе ВИЧ-2, SIV и изолятов ВИЧ-1 группы О, не связываются с СурА.
Кроме того, некоторые исследователи, используя вирусные частицы, помеченные зеленым флуоресцентным белком (GFP), смогли показать, что ВИЧ после проникновения связывается с компонентами цитоскелета в цитоплазме и, возможно, переносится на сеть микротрубочек, где и происходит обратная транскрипция еще до удаления капсидного белка. Затем, после образования PIC, он перемещается к ядерной оболочке и проникает внутрь через ядерные поры. Обычно активация клетки усиливает ВИЧ-инфекцию, облегчая проникновение PIC в ядро.
После интеграции вируса первые вирусные информационные РНК, которые синтезируются в инфицированной клетке, представляют собой дважды сплайсированные транскрипты, кодирующие большинство регуляторных белков, в частности tat, rev и nef. Большую часть (80%) таких мРНК составляет мРНК nef, хотя неизвестно, какой из вирусных белков синтезируется первым.
До сих пор точно не выяснено, может ли образовываться инфекционный ВИЧ без интеграции провируса в хромосомы клетки. В нескольких исследованиях была показана необходимость интеграции ВИЧ для эффективной продукции дочерних вирусов. В одном исследовании, проведенном с использованием SIV, мутантных по области генома int/nef, наблюдали существенное снижение репликации вируса, несмотря на то, что небольшая экспрессия вирусных антигенов все же происходила. В настоящее время интеграцию провирусной ДНК в геном клетки-хозяина считают необходимой для продукции дочерних вирусов, но экспрессия отдельных белков ВИЧ (например, Nef или Gag) может происходить и без такой интеграции.
Регуляторные белки вируса необходимы на первых этапах развития инфекции в покоящейся клетке и, таким образом, их ранняя транскрипция играет важную роль и может объяснять, почему эпитопы именно белков Nef и Tat преимущественно распознаются цитотоксическими Т-лимфоцитами в ранние сроки острой инфекции. Предположительно, пребывание ВИЧ в продуктивном или латентном состоянии может определяться интенсивностью продукции вирусных белков. Высокий уровень экспрессии Tat приводит к выраженной активации продукции вирусных частиц.
Nef играет плейотропную роль и обычно увеличивает репликацию вируса, но функциональные преференции Nef зависят от типа инфицированной клетки и конкретной нуклеотидной последовательности гена nef.
Белок Rev, по-видимому, обеспечивает поддержание равновесия между экспрессией регуляторных и структурных белков ВИЧ. Rev способствует транспорту в цитоплазму больших молекул несплайсированной вирусной РНК, отвечающей за трансляцию белков со структурных генов вируса, включая ферменты, а также несплайсированная вирусная РНК становится геномом дочерних вирионов. В результате образуются инфекционные вирусные частицы.
Реализация функций вирусного белка Rev зависит от определенных клеточных факторов (например, CRM-1 и hRIP). Ранние исследования обезьяньего вируса Мэйсона-Пфайзера позволили идентифицировать вирусный ген, который может заменять Rev, взаимодействуя с клеточным фактором, участвующим в транспорте вирусной РНК. На поздних стадиях цикла репликации вируса Rev способен угнетать свою собственную продукцию, вызывая уменьшение образования дочерних вирусов и, возможно, обеспечивая переход вируса в латентное состояние.
В клетках, не способных поддерживать полноценную репликацию ВИЧ, уровень относительной экспрессии регуляторных белков может быть различным, что, в свою очередь определяет судьбу вирусной инфекции: будет она в абортивной форме, будет персистировать на низком уровне или разовьется латентное состояние вирусной инфекции.
Большие белки-предшественники Gag и Gag/Pol локализованы в этих рафтах, и отпочкование вирусных частиц происходит преимущественно в этих областях. Такое прикрепление вириона к липидным рафтам обеспечивается за счет большого количества холестерола и, по-видимому, является необходимым для сборки и высвобождения вируса. Nef может влиять на усиление синтеза холестерола в клетке и его встраивание в участки мембраны, используемые вирионами.
Одним из клеточных белков, участвующих в разрыве клеточной мембраны при высвобождении вируса, является продукт гена чувствительности человека к опухолям №101 (Tsg101 - tumor susceptibility gene 101). Он связан с убиквитин-конъюгированными ферментами с одной стороны и связывает вирусный белок р6 с другой стороны. Этот клеточный белок способствует отпочкованию вируса, направляя большой транслят Gag к мембране клетки и помогая созреванию вирусных частиц и высвобождению вируса из клетки. Tsg101 также может предотвращать полиубиквитинирование и деградацию Gag.
Зрелый нуклеоид ВИЧ к моменту отпочкования напоминает конус фуллерена. Окончательное созревание белков вириона, то есть нарезание больших транслятов на дефинитивные белки вируса под действием вирусных протеаз происходит внутри отпочковывающейся частицы. Белок р2 капсида, также как и Vpu, участвуют в последних этапах сборки вирусной частицы. Как отмечали выше, у многих изолятов ВИЧ-1 важную роль в процессе сборки вирионов также могут играть циклофилины, которые связываются с белком капсида р24.
Просто о сложном


-->СТАТЬИ -->
| [07.07.2014] | [Вирусы] |
| Натуральная оспа (0) | |
| [18.07.2014] | [Вирусы] |
| Вирусы. Краткий обзор (0) | |
| [21.07.2014] | [Общие понятия] |
| Вирусология (0) | |
| [03.07.2014] | [Общие понятия] |
| Немного истории (0) | |
| [04.07.2014] | [Инфекции] |
| Цитомегаловирусная инфекция (0) | |
| [21.08.2014] | [Вирусы] |
| Вирус иммунодефицита человека (ВИЧ) (0) | |
| [22.08.2014] | [Вирусы] |
| Строение и жизненный цикл вируса иммунодефицита человека (ВИЧ) (1) | |
| [09.02.2016] | [Вирусы] |
| Лихорадка Зика (0) | |
Строение вируса иммунодефицита человека
 |
| Строение вируса иммунодефицита человека |
Вирионы ВИЧ имеют вид сферических частиц, диаметр которых составляет около 100—120 нанометров (это приблизительно в 60 раз меньше диаметра эритроцита).
В состав зрелых вирионов входит несколько тысяч белковых молекул различных типов.
Капсид зрелого вириона, состоящий из примерно 2000 молекул белка р24, имеет форму усечённого конуса.
Внутри капсида находится белково-нуклеиновый комплекс: две нити вирусной РНК, прочно связанные с белком нуклеокапсида p7, ферменты (обратная транскриптаза, протеаза, интеграза).
С капсидом также ассоциированы белки Nef и Vif (7—20 молекул Vif на вирион).
Внутри вириона (и, вероятнее всего, за пределами капсида) обнаружен белок Vpr8-11. Кроме того, с капсидом ВИЧ-1 (но не ВИЧ-2) связазны около 200 копий клеточного фермента пептидилпролилизомеразы, необходимого для сборки вириона.
Капсид окружён оболочкой, образованной примерно 2000 молекул матриксного белка p17. Матриксная оболочка в свою очередь окружена двуслойной липидной мембраной, являющейся наружной оболочкой вируса. Она образована молекулами фосфолипидов, захваченными вирусом во время его отпочковывания от клетки, в которой он сформировался.
С помощью белка gp120 вирус присоединяется к рецептору CD4 и корецептору, находящимся на поверхности Т-лимфоцитов человека. Стехиометрическое соотношение p24:gp120 в вирионе составляет 60—100:1.
Белки gp41 и в особенности gp120 интенсивно изучаются в качестве возможных мишеней для разработки лекарств и вакцины против ВИЧ .
При формировании наружной оболочки вируса также происходит захват некоторого количества мембранных белков клетки, в том числе человеческих лейкоцитарных антигенов (HLA) классов I и II и молекул адгезии.
Функции важных структурных белков ВИЧ-1
Сокращение
Описание
Функции
gp41 (TM, transmembrane)
Трансмембранный гликопротеин массой 41 кДа
gp120 (SU, surface)
Гликопротеин массой 120 кДа
Наружный белок вириона. Нековалентно связан с трансмембранным белком gp41. С одной молекулой gp41 связаны 3—5 молекул gp120. Способен связывать рецептор CD4. Играет важную роль в процессе проникновения вируса в клетку.
Белок массой 24 кДа
Образует капсид вируса
Матриксный белок массой 17 кДа
Около двух тысяч молекул этого белка образуют слой толщиной 5—7 нм, располагающийся между внешней оболочкой и капсидом вируса.
p7 (NC, nucleocapsid)
Нуклеокапсидный белок массой 7 кДа
Входит в состав ка псида вируса. Образует комплекс с вирусной РНК.
Геном и кодируемые белки
 |
| Геном ВИЧ-1 |
Геном ВИЧ-1
Генетический материал ВИЧ представлен двумя копиями положительно-смысловой (+)РНК. Геном ВИЧ-1 имеет длину 9000 нуклеотидов. Концы генома представлены длинными концевыми повторами (англ. long terminal repeat, LTR), которые управляют продукцией новых вирусов и могут активироваться и белками вируса, и белками инфицированной клетки. 9 генов ВИЧ-1 кодируют, по крайней мере, 15 белков.
Ген pol кодирует ферменты: обратную транскриптазу (RT), интегразу (IN) и протеазу (PR).
Ген gag кодирует полипротеин Gag/p55, расщепляемый вирусной протеазой до структурных белков p6, p7, p17,p24.
Ген env кодирует белок gp160, расщепляемый клеточной эндопротеазой фурином на структурные белки gp41 и gp120.
Другие шесть генов — tat, rev, nef, vif, vpr, vpu (vpx у ВИЧ-2) — кодируют белки, отвечающие за способность ВИЧ-1 инфицировать клетки и производить новые копии вируса. Репликация ВИЧ-1 in vitro возможна без генов nef, vif, vpr, vpu, однако их продукты необходимы для полноценной инфекции in vivo.
Gag: Полипротеин-предшественник Gag/p55 синтезируется с полноразмерной геномной РНК (которая в данном случае служит в качестве мРНК) в процессе стандартной кэп-зависимой трансляции, но возможна и IRES-зависимая трансляция. Предшественники функциональных белков располагаются в составе полипротеина Gag/p55 в следующем порядке: p17…p24…p2…p7…p1…p6 (р1 и р2 — соединительные пептиды; другие продукты расщепления Gag/p55 описаны выше).
Домен М, расположенный внутри области p17/МА, миристилируется (присоединяются остатки миристиновой кислоты) и направляет Gag/p55 к плазматической мембране. Домен I, находящийся внутри области p7/NC, отвечает за межмолекулярные взаимодействия отдельных мономеров Gag/p55. Домен L, также локализованный в области p7/NC, опосредует отпочковывание вирионов от плазматической мембраны; в этом процессе участвует также р6 область полипротеина Gag/p55.
Vpu: Двумя важными функциями белка Vpu являются:
1) разрушение клеточного рецептора CD4 в эндоплазматическом ретикулуме путём привлечения убиквитинлигазных комплексов и
Vpr: Белок Vpr необходим для репликации вируса в неделящихся клетках, в том числе макрофагах. Этот белок, наряду с другими клеточными и вирусными белками, активирует длинные концевые повторы генома ВИЧ. Белок Vpr играет важную роль в переносе провируса в ядро и вызывает задержку деления клетки в периоде G2.
Nef: Белок Nef выполняет несколько функций. Он подавляет экспрессию молекул CD4 и HLA классов I и II на поверхности инфицированных клеток, и тем самым позволяет вирусу ускользать от атаки цитотоксических T-лимфоцитов и от распознавания CD4+-лимфоцитами. Белок Nef может также угнетать активацию T-лимфоцитов, связывая различные белки-компоненты систем внутриклеточной передачи сигнала.
У инфицированных вирусом иммунодефицита макак-резусов активная репликация вируса и прогрессирование болезни возможны только при интактном гене nef. Делеции гена nef были обнаружены в штаммах ВИЧ, выделенных у группы австралийцев с длительным непрогрессирующим течением инфекции.
Однако у части из них со временем появились признаки прогрессирования инфекции, в том числе снижение числа CD4+-лимфоцитов. Таким образом, хотя делеции гена nef и могут замедлять репликацию вируса, это не гарантирует полной невозможности прогрессирования заболевания.
Tat и Rev: Регуляторные белки Tat (транс-активатор) и Rev накапливаются в ядре клетки и связывают определённые участки вирусной РНК. Белок Tat имеет молекулярную массу около 14-15 кДа, связывает вторичную структуру геномной РНК вблизи 5'-нетранслируемой области активирует обратную транскрипцию геномной РНК ВИЧ, синтез вирусных мРНК, необходим для репликации вируса почти во всех культурах клеток, регулирует выход вирионов из зараженных клеток, нуждается в клеточном кофакторе — циклине T1. Белок Rev регулирует экспрессию белков вириона, связывает мРНК гена env в области RRE (англ. Rev response element) интрона, разделающего экзоны генов Tat и Rev.
Белки Tat и Rev стимулируют транскрипцию провирусной ДНК и транспорт РНК из ядра в цитоплазму, а также необходимы для трансляции. Белок Rev обеспечивает также транспорт компонентов вируса из ядра и переключение синтеза регуляторных белков вируса на синтез структурных.
Жизненный цикл
На схеме показано слияние вирриона ВИЧ и плазматической мембраны Т-лимфоцита человека

Этап 1. Взаимодействие вирусного белка gp120 с клеточным рецептором CD4 (указано красной стрелкой)

Этап 2. Конформационные изменения вирусного белка gp120 обеспечивают связывание с клеточным рецептором CCR5 (указано красной стрелкой)

Этап 3. Концевые участки вирусного белка gp41 проникают в плазматическую мембрану клетки (указано красной стрелкой)

Этап 4. Вирусный белок gp41 подвергается значительным конформационным изменениям, складывается пополам (указано красной стрелкой) и образует спираль, что приводит к сближению и слиянию мембран вириона и клетки. Таким образом ВИЧ захватывает Т-лимфоцит с целью дальнейшей репродукции.
Проникновение в клетку и интеграция
Вирусная инфекция начинается, когда вирион ВИЧ сталкивается с человеческой клеткой, имеющей на своей мембране рецептор CD4. Вирусный гликопротеин gp120 прочно связывает рецептор CD4. В результате такого взаимодействия gp120 претерпевает конформационные изменения, которые позволяют ему также связать молекулу корецептора CXCR4 или CCR5 (экспрессируемых на поверхности Т-лимфоцитов, макрофагов, дендритных клеток и микроглии).
В зависимости от способности связывать эти корецепторы, ВИЧ классифицируют на R5-тропные (связывают только CCR5), X4-тропные (связывают только CXCR4) и R5X4-тропные (могут взаимодействовать с обоими корецепторами). Препараты, блокирующие корецепторы могут быть эффективны против ВИЧ.
После описанных событий мембрана клетки и мембрана вириона ВИЧ сливаются, и содержимое вириона проникает внутрь клетки. Белок gp41 очень важен для слияния мембран, поэтому его рассматривают в качестве мишени для разработки противовирусных препаратов. Внутри клетки вирусная РНК высвобождается из капсида, и происходит обратная транскрипция — синтез ДНК на основе матрицы одноцепочечной геномной РНК вируса, катализируемая обратной транскриптазой.
Большая часть лекарственных препаратов, одобренных для применения при ВИЧ-инфекции, направлена на нарушение работы обратной траскриптазы. Синтезированная ДНК транспортируется внутрь ядра клетки и встраивается в хромосому хозяина под действием интегразы. Несколько препаратов, ингибирующих интегразу, проходят ранние стадии клинических испытаний. Вирусная ДНК, встроившаяся в хромосому клетки, называется провирусом.
Человеческая РНК-полимераза в ядре клетки синтезирует информационную РНК (мРНК), а позднее и геномную РНК вируса. Синтезированные РНК транспортируются обратно в цитоплазму, где на матрице мРНК на рибосомах синтезируются вирусные ферменты, структурные и регуляторные белки.
Сборка и отпочковывание вирионов
Геномная РНК вируса, а также вирусные белки транспортируются к местам сборки вирионов. Сборка вирионов происходит на мембране, куда направляется миристилированный полипротеин Gag/p55. Вирионы первоначально формируются из полипротеинов-предшественников структурных белков и ферментов и на этой стадии не являются инфекционными.
В ходе созревания вирусной частицы вирусная протеаза расщепляет белки-предшественники до функциональных компонентов. Несколько одобренных противовирусных препаратов ингибируют работу протеазы и препятствуют формированию зрелых вирионов.
Новые вирусные частицы отпочковываются от поверхности клетки, захватывая часть её мембраны, и выходят в кровяное русло, а клетка хозяина, несущая рецептор CD4, погибает. Недавние исследования показали, что процесс отпочковывания вирионов может быть более сложным, чем считалось ранее. Так было обнаружено, что благодаря взаимодействию белка Gag с компонентами клетки вирионы накапливаются в особых внутриклеточных мультивезикулярных тельцах, которые обычно служат для экспорта белков. Таким образом вирусные частицы высвобождаются из клетки, эксплуатируя её собственную систему транспорта макромолекул.
Распространение по организму
В период острой фазы ВИЧ-инфекции отсутствие специфического иммунного ответа позволяет вирусу активно реплицироваться и достигать высоких концентраций в крови.
Вирус заселяет органы лимфатической системы, CD4 + -лимфоциты, CD8 + -лимфоциты и макрофаги, а также другие клетки: альвеолярные макрофаги лёгких,клетки Лангерганса, фолликулярные дендритные клетки лимфатических узлов, клетки олигодендроглии и астроциты мозга и эпителиальные клетки кишки.
В лимфоидной ткани ВИЧ размножается на протяжении всего заболевания, поражая макрофаги, активированные и покоящиеся CD4 + -лимфоциты и фолликулярные дендритные клетки. Количество клеток, содержащих провирусную ДНК, в лимфоидной ткани в 5—10 раз выше, чем среди клеток крови, а репликация ВИЧ в лимфоидной ткани на 1—2 порядка выше, чем в крови.
Резервуаром ВИЧ служат лимфатические узлы и конкретно дендритныe клетки, в которых вирус сохраняется длительное время после периода острой виремии.
Для активации CD8 + -лимфоцитов и образования антиген-специфических цитотоксических T-лимфоцитов необходима презентация пептидного антигена в комплексе с человеческим лейкоцитарным антигеном класса I.
Дендритные клетки, необходимыe для начала первичных антиген-специфичных реакций, захватывают антигены, перерабатывают и переносят их на свою поверхность, где эти антигены в комплексе с дополнительными стимулирующими молекулами активируют T-лимфоциты.
Заражённые клетки часто не выделяют дополнительных стимулирующих молекул и поэтому не способны вызвать активацию достаточного числа B и T-лимфоцитов, функция которых зависит от дендритных клеток.
После завершения обратной транскрипции в CD4 + -лимфоците вирусный геном представлен провирусной невстроенной ДНК. Для встраивания провирусной ДНК в геном клетки-хозяина и для образования новых вирусов необходима активация T-лимфоцитов.
Контакт CD4 + -лимфоцитов и антигенпредставляющих клеток в лимфоидной ткани, наличие вирусов на поверхности фолликулярных дендритных клеток и присутствие провоспалительных цитокинов (ИЛ-1, ИЛ-6 и ФНОα) способствуют размножению ВИЧ в инфицированных клетках. Именно поэтому лимфоидная ткань служит самой благоприятной средой для репликации ВИЧ.
На 2014 год ВИЧ-инфекция остаётся неизлечимым заболеванием, так как геном вируса интегрируется в хромосомы клеток и может реактивироваться даже после курса антиретровирусной терапии.
В настоящее время идёт поиск безопасных способов редактирования генома человека и исключения из него провирусной ДНК. В 2014 году был предложен метод удаления генома ВИЧ-1 из заражённых клеток при помощи системы CRISPR/Cas9. С помощью этого метода исследователям удалось вырезать фрагмент провирусной ДНК, заключённый между 5'- и 3'-концевыми LTR-областями из хромосом зарежённых клеток в культуре.
Кроме того, этот метод оказался также эффективным для профилактики заражения неинфицированных клеток. Описанный подход может привести к разработке способа полного избавления от ВИЧ-инфекции.
Читайте также:
- Где получают лекарства вич инфицированные
- Мельхиседек друнвало про вич
- Семя льна при вич
- Первично латентная форма бруцеллеза
- Проведение постконтактной профилактики заражения вич инфекцией
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.

