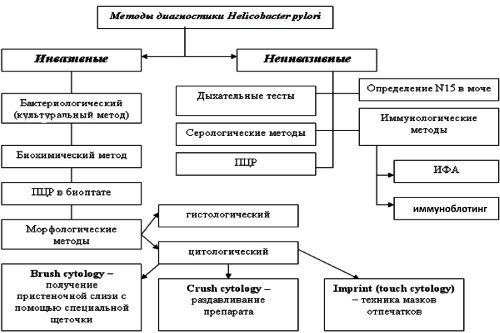
Золотой стандарт диагностики хеликобактер пилори
Бактерии Helicobacter pylori повреждают поверхностный эпителий желудка и вызывают воспаление. Чаще всего обнаруживаются у пациентов с язвенной болезнью желудка (в 60-80 % случаев) и двенадцатиперстной кишки (90-100 % случаев).В настоящее время диагностика хеликобактериоза не представляет трудностей.
Чтобы выявить инфицирование бактериями, нужно сдать анализ крови из вены или пробы выдыхаемого воздуха (аэротест). В период обострения заболеваний желудка и двенадцатиперстной кишки назначается гастроскопия (ФГДС), при проведении которой врач-эндоскопист может взять участок слизистой (биоптат) для экспресс-теста или морфологического исследования на наличие Helicobacter pylori.
Методы диагностики
- доступен всем пациентам;
- не сопровождается выраженным дискомфортом и стрессом при проведении процедуры (инъекционный метод забора крови);
- прием лекарственных препаратов, применяемых для лечения заболеваний желудка и двенадцатиперстной кишки, не оказывает влияние на результат исследования.
Процедура забора крови проводится утром натощак.
- За сутки до исследования из рациона исключается жирная пища.
- Курение прекращают за 8 часов до анализа.
Забор крови производится путем венепункции. Материал отбирают в стерильную вакуумную пробирку с активатором свертывания для быстрого отделения сыворотки. Кровь доставляется в лабораторию в течение 2 часов. Микропробирки с сывороткой разрешается хранить в холодильнике при температуре 2-8 °С или в морозильной камере при -20 °С до 10 суток.
Для выявления бактерий применяется иммуноферментный анализ – ИФА. Это лабораторный метод предполагает исследование сыворотки крови. Путем химических реакций врачи определяют наличие в ней антител – специфических белков иммунологической природы, выделяющихся при воздействии на организм человека различных антигенов, не знакомых ему (чужеродных бактерий, вирусов, грибов, токсинов, аллергенов и т. д.). Helicobacter pylori является инфекционным возбудителем гастропатологии. При попадании в желудочно-кишечный тракт он активирует систему иммунитета и вызывает выработку антител – иммуноглобулинов (Ig). ИФА помогает диагностировать наличие или отсутствие данной инфекции.
Бывают ситуации, когда обнаруженные антитела в сыворотке крови является ложноположительным результатом. Это может быть связано с длительным циркулированием в плазме иммуноглобулинов после уничтожения бактерий вследствие эрадикационной терапии. Антитела присутствуют в крови в течение месяца после лечения, а у некоторых остаются пожизненно. В другом случае все наоборот. Инфицирование есть, а антитела в сыворотке крови не определяются (ложноотрицательный результат). Это может быть связано с ранним периодом после заражения. Антитела не успевают выработаться из-за слабого иммунного ответа. Чтобы избежать неточностей в результатах, необходимо дополнительно исследовать фракции иммуноглобулинов 3 видов: M, G, A.
Характеристики специфических белков крови:

Существует качественное и количественное определение антител к Helicobacter pylori. В первом случае диагностируют наличие специфических иммуноглобулинов, а во втором их концентрацию. При качественном анализе определяются суммарные антитела (IgM, IgG, IgA). При количественном исследовании используют нормы содержания специфических белков в крови.
У каждой лаборатории свои референсные значения, применяемые для определенного вида реактивов.
| Вид исследования | Норма | Патология |
| Качественный анализ на антитела к Helicobacter pylori | Отрицательный (отсутствие антител) | Положительный (наличие антител) |
| Количественный анализ на антитела к Helicobacter pylori: | Нормальные референсные значения | Превышение показателей |
| Отрицательный (значения IgM в пределах нормы) |
При нормальных показателях IgG и IgA инфицирования нет
Определяется сразу после заражения хеликобактериозом (выявляется в течение 3-4 недель от контакта с возбудителем)
- IgG
IgG может быть ложноотрицательным в течение 3-4 недель после заражения (IgM положительный)
Инфицирование Helicobacter pylori
Может превышать норму в течение месяца после эрадикационной терапии
- IgA
Может быть ложноотрицательным в ранний период после контакта с возбудителем (в течение 2-3 недель от момента заражения)
Чем выше концентрация IgA в сыворотке крови, тем активнее протекает воспалительный процесс
Возможны сомнительные результаты исследования. В таких случаях анализ на антитела к Helicobacter pylori повторяют через 2-3 недели.
- помогает выявить даже низкие концентрации возбудителя;
- безопасный метод, не сопровождается радиоактивной нагрузкой на пациента (при использовании тестовых растворов мочевины, меченой нерадиоактивными изотопами);
- оценивается процент бактерий на всей поверхности слизистой желудка;
- удобен для пациентов (неинвазивный метод);
- дыхательный уреазный тест с раствором карбамида разрешен беременным и младенцам;
- является точным диагностическим исследованием.
- Дыхательный уреазный тест проводится натощак. Перед исследованием с утра можно почистить зубы без применения ополаскивателей и освежителей для полости рта. Не рекомендуется использовать жевательные резинки.
- Накануне забора проб разрешен легкий ужин. С 22 часов вечера и до начала процедуры есть нельзя, питье отменяют за час до исследования.
![]()
- За 2-3 дня до аэротеста запрещен прием алкоголя (пары алкоголя искажают результаты проб). Также на этот период исключаются продукты, вызывающие метеоризм (капуста, бобовые, чеснок, яблоки, грибы, черный хлеб и другие).
- Курение прекращают за 8 часов до начала процедуры.
- За 2 недели до исследования отменяют препараты висмута (“Де-нол”, “Викалин”, “Викаир”), ингибиторы протонной помпы (“Омез”, “Нольпаза”, “Нексиум” и другие). Данные средства угнетают активность уреазы.
- За неделю до проведения теста прекращают прием нестероидных противовоспалительных и антибактериальных препаратов.
- За 2 дня до процедуры исключаются лекарственные средства из группы блокаторов Н2 – гистаминовых рецепторов (“Гистодил”, “Примамет”, “Ранитидин”, “Фамотидин” и другие).
- Разрешены препараты, снижающие избыточную продукцию соляной кислоты желудком (антациды – “Алмагель”, “Фосфалюгель”, “Маалокс”, “Гевискон” и т. д.).
Специфичность метода
Дыхательный уреазный тест на Helicobacter pylori связан с особенностями жизнедеятельности бактерии. Возбудитель в процессе своего существования выделяет защитный фермент – уреазу. Это биологически активное соединение помогает микроорганизму справляться с агрессивным воздействием соляной кислоты, выделяемой в составе желудочного сока. В процессе пищеварения уреаза расщепляет продукт метаболизма белков – мочевину. В результате образуется аммиак и углекислота. Эта химическая реакция стала основой для аэротеста. При дыхании пациента можно измерить концентрацию углекислого газа в выдыхаемом воздухе.
- Аэротест с применением тестового раствора или драже мочевины, меченой радиоактивным углеродом ( 14 С). Данный метод применяется редко из-за лучевой нагрузки на организм человека.
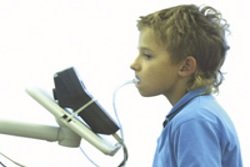
Пациент дышит через специальную трубку, находящуюся глубоко в ротовой полости. Дыхание должно быть ровным и спокойным. Трубка подсоединяется к специальному газовому спектрометру, замеряющему процент меченого углекислого газа в выдыхаемом воздухе. В начале процедуры берут 2 фоновые пробы аэротеста. Затем пациенту дают выпить тестовый раствор или проглотить специальное драже с мочевиной, меченой радиоактивным изотопом. Через каждые 15 минут (в течение часа) осуществляют забор дополнительных 4 проб выдыхаемого воздуха. Не допустимо попадание слюны в трубку, результат исследования может стать недостоверным. В этом случае пробу придется повторить через 40-60 минут после предыдущей. Чтобы избежать неприятной ситуации, трубку во время процедуры необходимо периодически вынимать, а слюну сглатывать.
- Дыхательный уреазный тест с применением стабильного раствора мочевины, меченой нерадиоактивным углеродом ( 13 С). Данный метод является “золотым стандартом” в диагностике хеликобактериоза (подробнее о методе см. здесь).
Во время исследования осуществляют забор 2 проб выдыхаемого воздуха. Процедура проводится на голодный желудок, в положении сидя. Пациент делает глубокий вдох и на несколько секунд задерживает дыхание. Затем выдыхает в герметичный одноразовый пакет, который сразу же плотно закрывают. Пациенту дают выпить тестовый раствор мочевины, меченой нерадиоактивным изотопом. Через полчаса осуществляют повторный забор выдыхаемого воздуха. С помощью масс-спектрометра измеряют концентрацию углекислоты в выдыхаемом воздухе. Полученные результаты сравнивают и делают выводы о наличии инфицирования.
- Аэротест с применением раствора мочевины (карбамида). Данная методика не является максимально точной. Рекомендуется для диагностики хеликобактериоза у беременных женщин и маленьких детей.
Методика схожа с предыдущим тестом. У пациента делают забор 2 проб выдыхаемого воздуха. Измеряют концентрацию углекислого газа до и после применения тестового раствора карбамида.
| Вид исследования | Норма | Патология |
| Качественное определение уреазной активности Helicobacter pylori | Отрицательный аэротест |
Инфицирования нет или полное излечение после эрадикационной терапии
Инфицирование Helicobacter pylori
Хеликобактериоза нет
- 1-3,4% – легкое инфицирование Helicobacter pylori
- 3,5-6,4% – среднетяжелый воспалительный процесс
- 6,5-9,4% – тяжелое инфицирование
- Более 9,5% – крайне тяжелая степень хеликобактериоза
Во время проведения гастроскопии (ФГДС) врач-эндоскопист берет кусочек слизистой из любого отдела желудка. Биоптат помещают на реагентную тест-полоску, обработанную раствором мочевины. Под действием фермента уреазы, выделяемой бактериями Helicobacter pylori, происходит ощелачивание среды. Мочевина расщепляется. Вследствие этого индикаторная полоска меняет свою окраску – с желтой на малиновую. Тест считается положительным. От скорости изменения цвета реагента зависит выраженность воспалительного процесса и концентрация возбудителя в биоптате.
Оценка полученного результата:
- Helicobacter pylori (+) – слабое инфицирование (реагентная тест-полоска изменила свой цвет в течение суток).
- Helicobacter pylori (++) – умеренный инфекционный процесс (реагентная тест-полоска изменила свой цвет в течение 2-3 часов).
- Helicobacter pylori (+++) – тяжелое инфицирование (реагентная тест-полоска изменила свой цвет в течение одного часа).
- наиболее точный метод диагностики Helicobacter pylori (специфичность до 100%);
- исключает возможность ложноположительных результатов, подтверждает наличие инфекции.
![]()
Процедура ФГДС предусматривает 3-х дневную диету с исключением продуктов, раздражающих пищеварительный тракт (нельзя жареные, копченые, соленые, жирные и острые блюда).- Запрещаются газированные напитки, кофе, алкоголь.
- Диета бесшлаковая на основе легкоусвояемого меню (каши на воде, отварное мясо, йогурты, овощные салаты и т. д.). Последний прием пищи за 12 часов до проведения ФГДС.
- За 3 часа до начала исследования необходимо отказаться от сигарет.
- Нельзя принимать лекарства перед эндоскопической процедурой.
- Прием жидкости прекращают за 1-2 часа до начала исследования.
- Не разрешается перед процедурой чистить зубы, применять ополаскиватели или освежители для полости рта, а также жевательные резинки.
- Гастроскопия проводится на голодный желудок.
ФГДС сопровождается введением специального зонда в желудок. Процедура неприятна из-за диспепсических проявлений. Во время проглатывания зонда происходит раздражение рецепторов ротоглотки, и пациент испытывает чувство тошноты и рвотные позывы. Длительность процедуры обычно не превышает 10-15 минут. За это время специалист осматривает слизистую желудка и двенадцатиперстной кишки, выявляет очаги воспаления (эрозии, язвы, дефекты и т. д.) и проводит забор материала для последующего морфологического исследования.
Для бактериологического посева биоптата на питательную среду потребуется не менее 5 образцов тканей. Их помещают в стерильные пробирки с транспортным раствором. Затем доставляют в бактериологическую лабораторию. Helicobacter pylori выращивают на питательных средах в течение 3-6 дней, иногда дольше (до 12 суток).
Гистологическое исследование мазков-отпечатков, полученных из биоптатов слизистой желудка, является “золотым стандартом” среди инвазивных методов диагностики хеликобактериоза. Участки тканей при ФГДС берут с неповрежденного эпителия (исключают эрозивно-язвенные дефекты). Helicobacter pylori живет на здоровой слизистой желудка и двенадцатиперстной кишки. Затем полученные мазки-отпечатки окрашивают (по Романовскому-Гимзе, по Граму или другими красителями). Производят микроскопию. Бактерии обнаруживаются в желудочной слизи, располагаются свободно. Helicobacter pylori имеет характерные для него изогнутые формы: спиралевидную, в виде буквы “S” или распахнутых крыльев птицы.
| Вид исследования | Норма | Патология |
| Бактериологический посев биоптата на Helicobacter pylori | Отрицательный |
(рост бактерий не обнаружен)
(на питательной среде выросли культуры Helicobacter pylori)
(бактерии в мазке отсутствуют)
- Слабая обсемененность Helicobacter pylori (+) – в поле зрения не более 20 бактерий
- Умеренная обсемененность Helicobacter pylori (++) – в поле зрения от 20 до 50 микроорганизмов
- Высокая обсемененность Helicobacter pylori (+++) – в поле зрения более 50 микробных тел
Резюме
Таким образом, существует 2 точных диагностических метода выявления хеликобактериоза. Они являются “золотым стандартом” в современной гастроэнтерологии. Первый метод – неинвазивный: дыхательный уреазный тест с раствором мочевины, меченой нерадиоактивным углеродом; второй – инвазивный: ФГДС с биопсией и последующим гистологическим изучением образцов тканей.
Для подтверждения инфицирования Helicobacter pylori требуется не менее 2 различных исследований. Диагноз ставят на основании клинической симптоматики и результатов, полученных в процессе лабораторных и эндоскопических мероприятий.
Helicobacter pylori
Многочисленные серологические тесты, основанные на обнаружении иммуноглобулина G (IgG), широко доступны для диагностики H. pylori. Определять IgM и IgA не рекомендуется поскольку. H. pylori является хронической инфекцией.
Диагностическая точность серологических методов диагностики инфекции H. pylori варьируется в зависимости от продолжительности воздействия H. pylori, перекрестной антигенности с другими распространенными антигенно родственными бактериями, такими как Campylobacter, разнообразием штаммов H. pylori в разных регионах, от антигена, используемого в коммерческом наборе, иммунного ответа хозяина, степени гастрита и обсемененности H. pylori [ 50 ].
Серологические тесты часто используются для скрининга в эпидемиологических исследованиях из-за их не дороговизны, быстроты и приемлемы для пациентов. Серологические тесты следует использовать для первичной диагностики H. pylori [22].
Колонизация H. pylori вызывает системный иммунный ответ. Через 3-4 недели после инфицирования в крови больных появляются антитела к H. pylori. Эти антитела определяются путем иммуноферментного анализа (ИФА). Поскольку инфекция является хронической и ее спонтанный клиренс невозможен, то положительные серологические тесты у нелеченых пациентов указывают на наличие текущей инфекции. Специфичность метода 93-94%, чувствительность 59-71% [ 51 ].
Преимуществом серологического метода для первичной диагностики
H. pylori является возможность его использования у лиц, принимающих ИПП и антибиотики [4], а так же после состоявшегося желудочно-кишечного кровотечения и при атрофии слизистой оболочки желудка. Все перечисленные ситуации ассоциированы со снижением бактериальной
Helicobacter pylori
13С-уреазный дыхательный тест ( 13 C-УДТ) для выявления H. pylori впервые был разработан и применен Дэвидом Грэмом в 1987 году [ 53 ]. С 1996 года FDA (Food and Drug Administration) в США и EMA (European Medicines Agency) в Европе разрешили применять 13 С-УДТ в клинических целях. В 2000 году (Маастрихт II-2000) 13 С-УДТ был принят в качестве
Метод 13 С-УДТ основан на способности H. pylori продуцировать фермент уреазу, которая в желудке гидролизует мочевину до NH4+ и HCO3- с последующим образованием диоксида углерода и аммиака. Уреаза является ферментом с абсолютной субстратной специфичностью и способна катализировать превращение только одного вещества, т.е. катализирует гидролиз только мочевины [ 55 ].
13С-УДТ является неинвазивным методом диагностики H. pylori. Основным реагентом в данном тесте является водный раствор мочевины, обогащенной изотопом углерода 13 С, в которой 12 С-атом углерода заменён
на 13 С-изотоп. При наличии в желудке H. pylori продуцируемая бактерией уреаза расщепляет поступившую в желудок 13 С-мочевину на аммиак и 13 С- углекислый газ, который затем всасывается в кровь, попадает в лёгкие и выводится с выдыхаемым воздухом, изменяя в нем соотношение 13 С/ 12 С в сторону увеличения 13 С, которое регистрируется на приборе (Рисунок 6). Если в желудке H. pylori отсутствует, то 13 С-мочевина в неизмененном виде всасывается в кровь и выделяется из организма почками через несколько часов. Таким образом, по появлению в выдыхаемом воздухе 13 С мы с высокой точностью можем определить инфицирован ли пациент H. pylori, а по величине соотношения 13 С/ 12 С можно дать оценку степени инфицированности.
Процедура проведения теста (Рисунок 7). Исходно проводится сбор выдыхаемого пациентом воздуха в специальный герметичный пакет №1. Затем пациент выпивает 200 мл тестового раствора, состоящего из лимонного сока (также может использоваться апельсиновый, грейпрутовый сок) и раствора мочевины меченной изотопом углерода 13 С. Сам раствор мочевины без вкуса и запаха, его прием не сопровождается никакими неприятными ощущениями, аллергических реакций не вызывает. Затем в течение получаса следует находиться в спокойном состоянии, чтобы на результаты исследования не повлиял углекислый газ, выделяющийся при физической нагрузке. Через 30 минут производится забор второй пробы воздуха в пакет №2, который также герметично закрывается. Затем пробы воздуха анализируют на инфракрасном спектрометре, который определяет изотопное соотношение 13 С/ 12 С. Если пациент инфицирован H. pylori, то во второй пробе воздуха появится увеличенное количество 13 СО2 по сравнению с его содержанием в первой (контрольной) пробе.
Прирост меченного CO2 выражается как дельта по сравнению с исходным значением (DOB). Обычно в качестве критерия присутствия инфекции H. pylori используют DOB 2,0‰ более. Было показано, что значение DOB положительно коррелируют с бактериальной нагрузкой H. pylori [ 56 ]. Чувствительность 13 C-УДТ составляет 96%, специфичность - 93%
Были описаны множество вариаций УДТ, в которых была изменена доза, время, состав субстрата, использование адъювантов, тестовые приемы пищи, тип детектора разных производителей и было показано, что все методики эффективны [ 58 ].
Ложноположительные результаты редки, но могут наблюдаться после выполнения ЭГДС с биопсией непосредственно перед тестом, у больных, перенесших резекцию желудка, а также при значительном снижении секреции желудка. Ложноположительные тесты чаще всего вызывают гидролиз мочевины бактериями в ротовой полости или бактериями, содержащими уреазу в желудке [ 60 ]. Это особенно вероятно в присутствии ахлоргидрии или гипохлоргидрии. Небольшое количество ложноотрицательных может быть связано с нарушением методики взятия и хранения проб выдыхаемого воздуха, физической нагрузкой накануне и в процессе выполнения теста. Как и при большинстве других тестов, достоверный результат УДТ может быть получен после 2-недельной отмены ИПП и не ранее, чем через 4 недели после прекращения приема антибиотиков и препаратов висмута. Консенсус Маастрихт V оценивает УДТ с меченой мочевиной как лучший способ диагностики H. pylori с высокой чувствительностью и специфичностью, и отличной производительностью, как для первичной диагностики инфекции, так и для оценки эффективности эрадикации.
Определение антигена Helicobacter pylori в кале
Анализ кала на антиген H. pylori (Helicobacter pylori stool antigen – HpSA-test) - это другой неинвазивный метод диагностики с высокой чувствительностью (94%) и специфичностью (97%) [22]. Для проведения этого исследования необходима небольшая порция стула, причем пробы могут храниться при температуре -20°С неограниченно долго. Существует два варианта исследования: иммуноферментный анализ (ИФА) и иммунохроматографический анализ (ИХА) с использованием поликлональных антител (ПА) или моноклональных антител (МА).
В 1997 году появился первый анализ кала на антиген с поликлональными антителами. В настоящее время для анализа используются моноклональные антитела. Тесты на основе МА более точны, а ИФА обеспечивают более надежные результаты, чем ИХА [ 63 ]. Наряду с 13 С-УДТ моноклональный тест на основе ИФА рекомендован как для первичной диагностики H. pylori, так и для контроля эрадикации [4]. Моноклональный антиген в кале является удобным и эффективным тестом для диагностики H. pylori у детей [ 64 ]. Кроме того, исследование антигена H. pylori можно применять для эпидемиологических исследований и программ скрининга в виду относительно невысокой стоимости исследования и оборудования [29].
Причинами ложноотрицательных результатов могут являться неравномерное распределение антигена в каловых массах, разрушение антигена при замедлении эвакуации каловых масс (запоры), желудочно- кишечное кровотечение. Ложноотрицательные результатов могут быть вызваны низкой колонизацией бактерий в желудке, что приводит к низкой концентрации антигенов H. pylori в фекалиях и неспособности реагировать в тесте [ 65 ].
Диагностическая точность HpSA-теста, особенно чувствительность, снижается при кровотечении из верхних отделов желудочно-кишечного тракта, приеме ингибиторов протонной помпы в течение 2-х недель, антибактериальных препаратов в течение последнего месяца, наличия атрофии и метаплазии желудочного эпителия, а отрицательный результат теста должен подтверждаться дальнейшими диагностическими методами [ 66 ].
Helicobacter pylori
4.1. Методы, рекомендованные для первичной диагностики инфекции Helicobacter pylori
Основными задачами, стоящими перед врачом, являются диагностика
H. pylori, подбор эффективной схемы терапии и, в дальнейшем, оценка эффективности проведенного лечения. При выборе метода тестирования H. pylori необходимо, в первую очередь, учитывать его чувствительность и специфичность. Каждый из этих тестов, если он правильно выполнен, гарантирует высокую точность диагностики, и положительный результат в каждом из этих тестов является показанием к эрадикационной терапии.
БУТ обеспечивает быстрый результат с возможностью начать лечение без задержки; гистологическое обследование обеспечивает оценку состояния слизистой оболочки желудка, которую можно динамически контролировать.
Культуральный метод имеет самую высокую специфичность, но чувствительность метода снижается в виду того что требуется особая осторожность при обращении с образцом слизистой оболочки желудка. Культуральный метод является методом выбора для тестирования чувствительности H. pylori к антибиотикам и имеет решающее значение для выбора адекватной эрадикационной терапии, учитывая высокую устойчивость H. pylori к антибиотикам в настоящее время.
Диагностическая точность серологического метода с определением антител IgG к H. pylori, при правильном проведении, сопоставима с гистологическим методом, неинвазивными тестами, но не позволяет заключить, является ли инфекция H. pylori текущей в настоящее время или была в прошлом.
Все тесты, используемые для обнаружения H. pylori, должны рассматриваться индивидуально, учитывая их преимущества и недостатки в различных клинических ситуациях и их выполнение должно проводиться соответствующим образом. При выборе метода исследования и интерпретации полученных результатов должны учитываться особые состояния, такие как кровотечение при язвенной болезни, атрофический гастрит с или без кишечной метаплазии, влияние лекарств, таких как ИПП, антибиотики и соли висмута.
Прием ИПП ограничивает точность диагностических методов в связи со снижением уреазной активности H. pylori, а также уменьшением количества вегетативных (спиралевидных) форм бактерии. Однако, в одном исследовании сравнивалось подавляющее действие ИПП на H. pylori и было показано, что пантопразол не ингибирует рост и уреазу H. pylori в отличие от омепразола и лансопразола и использование пантопразола в течение 14 дней не влияет на диагностическую точность методов диагностики H. pylori.
Пятидневный прием ИПП в высокой дозе оказывают значительное влияние на активность уреазы (при выполнении БУТ и 13C-УДТ), поэтому необходимо тщательно рассмотреть прием ИПП и его продолжительность. Прием менее пяти дней высокодозных ИПП (например, омепразол 80 мг) не оказывают существенного влияния на активность уреазы, при поведении БУТ или 13C-УДТ[ 67 ].
Каждый из применяемых сегодня методов имеет свои недостатки, и поэтому ограничиваться в практической деятельности только одним из них не желательно.
ЭГДС с биопсией
· Быстрый уреазный тест*
· Антитела к H. pylori IgG
· 13C-уреазный дыхательный тест*
· 14C-уреазный дыхательный тест*
· Антиген моноклональный в стуле*
Примечание: * тест достоверен, если больной более месяца не принимал по любому поводу антибиотики, препараты висмута, более 2 недель – ИПП, H2- блокаторы.
Контроль эффективности эрадикации H. pylori, независимо от используемых тестов, следует проводить не ранее, чем через 30 дней после завершения приема всех препаратов схемы. Несоблюдение этого правила ведет к ложному заключению об эффективности терапии.
Предпочтение следует отдавать неинвазивным методам: 13 С-УДТ и определению антигена H. pylori в кале. Для контроля эрадикации БУТ не рекомендуется. Исключение могут составлять случаи, требующие проведения повторной ЭГДС, при которой может быть получен биоптат для гистологического, цитологического или бактериологического исследования. Вместе с тем, обычно контрольная ЭГДС у больных с обострением язвенной болезни проводится на фоне продолжающегося приема ИПП, что делает невозможным диагностику H. pylori. Проведение ЭГДС через месяц после завершения лечения только с целью выявления инфекции может быть оправдана только при недоступности и невозможности применения неинвазивных методов. При этом не следует использовать БУТ для исключения инфекции [ 68 ]. Методы, которые можно использовать для контроля эффективности терапии (Таблица 4).
ЭГДС с биопсией
· 13C-уреазный дыхательный тест
· 14C-уреазный дыхательный тест
· Антиген моноклональный в стуле
Примечание: * проводится не ранее, чем через 30 дней после завершения эрадикационой терапии, и не ранее чем через 2 недели после завершения приема ИПП.
В клинической практике нередко наблюдается ситуация, когда обращается пациент с симптомами диспепсии, которому ранее не проводилось лечение H. pylori, но в настоящее время он принимает или недавно принимал ИПП, антибактериальные или висмут содержащие препараты. В таком случае для диагностики H. pylori возможно выполнение иммуноферментного анализа крови на антитела к H. pylori класса IgG, остальные методы диагностики будут малоинформативны. Вместе с тем известно, что 28-дневный прием висмута трикалия дицитрата способен в ряде случаев (до 33%) привести к эрадикации H. pylori [ 71 ], поэтому для принятия решения о лечении инфекции следует в плановом порядке провести неинвазивную диагностику (к примеру, 13 С-УДТ) не ранее, чем через 30 дней после проведенной терапии.
Если ранее пациент лечился от H. pylori, и в настоящее время он принимает или принимал ИПП, антибактериальные или висмут содержащие препараты, то достоверная диагностика H. pylori возможна не ранее, чем через 30 дней после завершения приема антибиотиков и препаратов висмута, и не ранее, чем через 2 недели после прекращения приема ИПП. Может быть использован любой тест, за исключением серологического. Если нет показаний для проведения ЭГДС, предпочтительна неинвазивная диагностика.
Лечение инфекции возможно только после ее выявления. После завершения терапии ее успех должен быть доказан. Диагностическая ценность большинства тестов снижается при низкой бактериальной обсемененности, что наблюдается текущем или предшествующем приеме антисекреторных и антибактериальных препаратов, а также при атрофическом гастрите [ 72 ].
Адекватная интерпретация результатов возможна только при условии отмены ИПП за 2 недели, а антибиотиков и препаратов висмута - за 4 недели до проведения теста. Каждый метод имеет свои преимущества, недостатки и ограничения.
Сводная характеристика методов диагностики H. pylori представлена в Таблице 5.
Алгоритм диагностики Н.pylori приведен на Рисунке 8.
Инвазив- ный метод
Неинвазив- ный метод
антибиоти- ков, ИПП, препаратов висмута
первичной диагности- ки
контроля эрадика- ции
Антитела к H. pylori IgG в
Рис.8. Алгоритм диагностики Н.pylori. Адаптировано Malfertheiner P. et al. Gut 2012;61:646-664. Megraud F., Lehours P. Clin microbiol rev. 2007;20(2):280-322.
Хомерики С.Г., Касьяненко В.И., Лабораторная диагностика инфекции H. pylori. СПб, 2011
4.4. Какой метод диагностики Helicobacter pylori выбрать у пациентов с частичной резекцией желудка
Еще одной проблемой является диагностика H. pylori у пациентов с частичной резекцией желудка, этой проблеме уделяется меньше внимания, поскольку эти пациенты представляют собой очень небольшую часть населения в целом.
В метаанализе, сравнивающем три часто используемых теста у пациентов с частичной резекцией желудка, гистология показала лучшие результаты, на втором месте оказался БУТ, в то время как 13С-УДТ имел низкую диагностическую точность. Чувствительность и специфичность гистологического метода, БУТ и 13С-УДТ составляли 93% и 85%; 79% и 94%; 77% и 89% соответственно. Несмотря на то, что 13 C-УДТ является быстрым, безопасным и надежным методом, который способен точно определить инфекцию H. pylori, у пациентов после частичной резекции желудка метод показывает меньшую чувствительность и специфичность. Возможная причина низкой информативности теста может быть обусловлена ускоренной эвакуацией из культи желудка, в результате чего тестовый раствор мочевины недостаточно задерживается по времени в культе желудка для взаимодействия с уреазой, продуцируемой H. pylori, а также низкой бактериальной нагрузкой. Таким образом, гистологический метод будет более предпочтительным, чем остальные для диагностики инфекции H. pylori после частичной гастрэктомии [ 73 ].
Другим альтернативным и надежным методом для выявления H. pylori у пациентов с дистальной резекцией желудка может быть серологический метод. В одном исследовании оценивалась диагностическая точность серологического метода, у пациентов с дистальной гастрэктомией. Чувствительность и специфичность теста выявления антигена H. pylori в кале (HpSA) были 100%, 90,5% соответственно [ 74 ].
Высокая распространенность и этиопатогенетическая связь H. pylori с наиболее значимыми заболеваниями желудка диктует необходимость оптимизации диагностики этой инфекции с учетом чувствительности и специфичности тестов, а также условий их проведения. До назначения терапии инфекция должна быть выявлена, а после лечения – подтвержден его успех. Важно подчеркнуть, что отсутствие оценки эффективности эрадикации H. pylori, с одной стороны, не позволяет документировать достижения цели у конкретного больного, с другой стороны, лишает врача возможности оценить эффективность назначаемых схем лечения в данном регионе. Последнее принципиально важно для критического переосмысления и улучшения клинической практики. Широкий арсенал диагностических тестов при рациональном их применении позволяет успешно решать эти задачи.
Читайте также:




