Транспортные среды для коклюша
Коклюш относят к инфекциям с весьма длительным течением, что делает возможным применение двух основных (бактериологический, серологический) и одного вспомогательного (микроскопический) методов диагностики.
I. МИКРОСКОПИЧЕСКИЙ МЕТОД
Микроскопический метод является вспомогательным вариантом диагностики, так как коклюшные бактерии не имеют четких морфотинкториальиых особенностей.
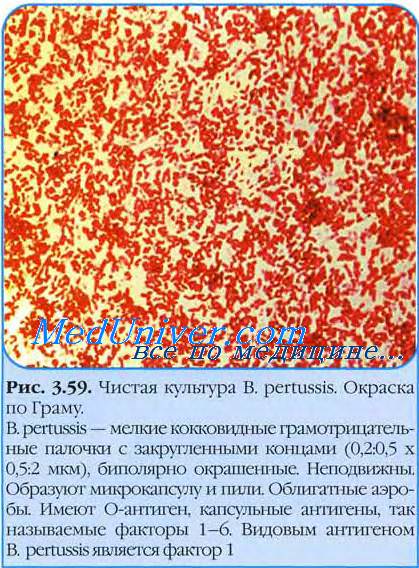
Диагностическое значение имеет лишь 1 фаза существования коклюшных бактерий, соответствующих S - форме. В таком варианте патогенные штаммы возбудителя коклюша выделяются из организма. Это грамотрицательные, мелкие однородные, овоидной формы палочки без спор, но с нежными капсулами. При переходе во II и III фазы появляются полиморфные длинные или, наоборот, кокковидные бактерии. Для отличия названных стадий развития коклюшных палочек микроскопический метод незаменим.
II. БАКТЕРИОЛОГИЧЕСКИЙ МЕТОД
Выделение чистой культуры возбудителя является самым ранним и достоверным способом диагностики коклюша. Материалом для исследования служат мокрота, слизь и смывы из носоглотки больного, выделяемые цри кашле или искусственно собранные стерильными носоглоточными тампонами.
Возбудитель коклюша очень требователен к питательным средам. Поэтому для его выделения используются элективные среды: казеиново-угольный агар (КУА), Борде-Жангу и молочно-кровяной агар Осиповой.
КАЗЕИНОВО-УГОЛЬНЫЙ АГАР ИЛИ СРЕДУ КУА готовят из сухого субстрата, выпускаемого ИЭМ имени Н. Ф. Гaмалей. Перед употреблением 4-5 г сухого порошка растворяют в 100 мл дистиллированной воды, стерилизуют в автоклаве 30 минут при +110 °C и, соблюдая стерильность, разливают в чашки Петри или пробирки. Готовые среды можно хранить при +4, +10 °C до двух недель.
Колонии коклюшных бактерий на среде КУА появляются на 3-4 день. Они мелкие, выпуклые, блестящие, гладкие, серовато-кремовые. Колонии паракоклюшных бактерий такие же, но более крупные и дают коричневое окрашивание среды.
СРЕДА БОРДЕ-ЖАНГУ. 500 г мелко нарезанного очищенного картофеля заливают 1 л дистиллированной воды с 40 мл глицерина, варят до размягчения, а затем доводят дистиллированной водой до исходного объема, фильтруют через 2-3 слоя марли и дают отстояться до просветления. К 500 мл прозрачного картофельно-глицеринового экстракта добавляют 1,5 л солевого раствора, содержащего следующий комплекс солей: К2НРО4- 2,25 г; MgS04-0,075 г; КН2Р04 -0,75 г; NaCl-7,5 г; КС1 -1,50 г. После этого прибавляют 60 г агар-агара (3%), кипятят на огне с асбестовой сеткой до растворения, устанавливают pH = 7,1-7,2, фильтруют и, разлив в соответствующую посуду, стерилизуют 30 минут при +110 °C или 25 минут при +120 °C. Это основа среды. Она может храниться очень долго.
Перед употреблением среду растапливают, охлаждают до 4-45 °C и добавляют 15-20% стерильной дефебринированной крови (барана, кролика, человека, лошади).
Готовая среда светло-вишневого цвета (без пузырьков воздуха). Для подавления посторонней микрофлоры добавляют 0,25-0,50 единиц пенициллина на 1 мл среды (1 ед. тормозит развитие коклюшных бактерий).
Колонии коклюшных бактерий на этой среде гладкие, блестящие, прозрачные, куполообразные с жемчужным или ртутным оттенком, окруженные зоной гемолиза. Колонии паракоклюшных бактерий крупные с коричневым окрашиванием среды и зоной гемолиза.
МОЛОЧНО-КРОВЯНОЙ АГАР ОСИПОВОЙ. 5% МПА расплавляют на водяной бане, добавляют 1% поваренной соли и смешивают с таким же количеством обезжиренного подогретого молока. Стерилизуют в автоклаве при 0,5 атм. 40 минут. Горячую смесь отфильтровывают от свернувшегося молока, разливают по флаконам и автоклавируют при 0,5 атм. 20 минут. К остуженному до +45°, +50 °C агару добавляют 20% дефибринированной крови барана и пенициллин из того же расчета, что и в среде Борде-Жангу.
При выделении чистой культуры возбудителя следует учитывать большую требовательность к питательным средам, сравнительно медленное развитие колоний, отсутствие потемнения среды вокруг колоний, относительную биохимическую инертность, морфологическую однородность и способность агглютинироваться специфической противококлюшной сывороткой первой фазы.
При выделении чистой культуры коклюшных бактерий очень важно отдифференцировать их от часто встречающихся гемоглобинофильных бактерий паракоклюша и септического бронхита.
Антигенная дифференциация коклюшных и паракоклюшных бактерий должна проводиться с учетом общности и различий в их антигенном составе. При отсутствии необходимых монорецепторных сывороток отличием могут служить прочие, в частности культурально-биохимические признаки.

| Свойство бактерий коклюша и их отличие от палочек паракоклюша | ||
| Свойства | Бактерии коклюша | Бактерии паракоклюша |
| Морфология | мелкие, коккобактерии | крупные палочки |
| Капсулы | есть, нежные | нет |
| Рост на простом МПА | - | + |
| Энергия роста | слабая, колонии видны на 3-4 день | средняя, колонии видны на 2-3 день |
| Образование коричневого пигмента на казеиновоугольном агаре (КУА) | - | + |
| Рост МПА с 0,1% тирозина | - | + |
| Гемолиз на кровяном МПА | + четкий | + слабый |
| Рост на пептонной воде, | - | + |
| с гематином | + | - |
| с дрожжами (экстракт) | + | - |
| Ферментация углеводов: | ||
| глюкозы | - | + |
| галактозы | - | + |
| левулезы | - | + |
| Разложение мочевины | - | + |
| Щелочение лакмусового молока | на 10-14 день | в первые 1-4 дня |
| Специфические видовые антигены | 1 | 14 |
| Типовые антигены | 2, 3, 4, 5, 6, 13 | 8, 9, 10 |
Отношение к мочевине выясняется пробой Закса, широко используемой при дифтерии.
Основные различия между коклюшными палочками и бактериями септического бронхита приведены ниже.
| Микробы | Признаки | |
| Рост на МПА | Наличие уреазы | |
| Коклюшные бактерии | не растут | - |
| Бактерии септического бронхита | растут без изменения цвета среды | + |
СЕРОЛОГИЧЕСКИЙ МЕТОД ДИАГНОСТИКИ КОКЛЮША
Начиная с 3-4 недели заболевания в крови больных начинают появляться антитела, которые можно обнаружить серологическим методом c помощью реакции агглютинации и реакции связывания комплемента по Борде-Жангу.
РЕАКЦИЯ АГГЛЮТИНАЦИИ. Для выполнения реакции берут кровь больного в количестве 0,8-1 мл (из пальца или пятки ребенка), помещают на 10-15 минут в термостат, а после этого - в холодильник для уплотнения и отделения сгустка. Затем проводят центрифугирование, сьшоротку отсасывают и разводят физиологическим раствором от 1:5 до 1:2500. В качестве антигена используется изготовленный производственным способом диагностикум. Схема постановки реакции следующая.
| Ингредиенты | Пробирки | |||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | |
| контроль антигена | контроль сыворотки | |||||||||
| Физ. раствор | 0,25 | 0,25 | 0,25 | 0,25 | 0,25 | 0,25 | 0,25 | 0,25 | 0,25 | |
| Сыворотка больного в разведении 1:5 | 0,25 | 0,25 | 0,25 | 0,25 | 0,25 | 0,25 | 0,25 | 0,25 | - | 0,25 |
| Разведение | 1:10 | 1:20 | 1:40 | 1:80 | 1:160 | 1:320 | 1:640 | 1:1280 | 1:5 | |
| Диагностикум в каплях | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | - |
Пробирки с разведенной сывороткой и добавленным в них диагностикумом помещают на 2 часа в термостат при 37 °C, а затем на сутки оставляют при комнатной температуре.
Агглютинация носит мелкозернистый характер. Поэтому учет ее производят с помощью агглютиноскопа.
Реакция считается положительной при четкой агглютинации с интенсивностью на ++ + + и + + +. Диагностическим является титр 1:40. Результаты серологических реакций имеют диагностическое значение только при изучении их в динамике, в связи с чем они повторяются не менее двух раз в течение болезни с интервалами 5-7 дней.
РСК ПО БОРДЕ-ЖАНГУ. Реакцию ставят по общепринятой методике. Особенностью ее является: длительное связывание (18-24 часа на холоду при +4 °C); в качестве диагностикума берется свежеприготовленная 1 млрд. взвесь 2-дневной культуры палочек коклюша, выращенных на 20% картофельно-глицериновом агаре и смытых физиологическим раствором. Омыв бактерий центрифугируют до полного просветления, осадок эмульгируют в дистиллированной воде для растворения случайно смытых со среды эритроцитов. После повторного центрифугирования готовят 1 млрд. суспензию культуры, инактивируют при +56 °C 1 час и подвергают титрованию.
Антиген титруют в присутствии комплемента.
| Схема титрования антигена коклюшных бактерий | ||||||||
| Ингредиенты в мл | Номера пробирок и их содержимое в мл | Контроль | ||||||
| 1 | 2 | 3 | 4 | 5 | 6 | антигенная гемотоксичность | комплемента | |
| Антиген | 0,05 | 0,1 | 0,12 | 0,15 | 0,2 | 0,25 | 0,25 | - |
| Комплемент в рабочей дозе | 0,25 | 0,25 | 0,25 | 0,25 | 0,25 | 0,25 | - | 0,25 |
| Физиологический раствор | 0,45 | 0,40 | 0,38 | 0,35 | 0,30 | 0,25 | 0,50 | 0,50 |
| Встряхнуть, в термостат на 35-40 минут при +37 °C. Затем добавить гемолитическую систему. | ||||||||
| Гемолитическая система | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 |
| Учет результатов | гемолиз | гемолиз | гемолиз | гемолиз | - | - | - | гемолиз |
Титром антигена считают то его максимальное количество, при котором еще возможен гемолиз (в данном примере - 0,15 мл). Рабочая доза должна быть на 20% ниже (0,12 мл).
После этого антиген используют для постановки РСК.
Рекомендуемая литература:
- Дяченко С. С. Микробиологические методы диагностики инфекционных заболеваний. 1962; стр. 238-244.
- Земсков М. В., Степанов И. И. Медицинская микробиология. Пособие для студентов медицинских институтов, 1962, стр. 182-185.
- Руководство по микробиологии, клинике и эпидемиологии инфекционных болезней, 1964, т. VI, разд. VI, стр. 349-374.
- Руководство по микробиологической диагностике инфекционных заболеваний, под ред. проф. К. И. Матвеева и М. И. Соколова, 1964, стр. 438-449, 493, 497.
- Сборник официальных материалов по лабораторному делу. Книга первая, 1961, стр. 338-343.
- Ашмарин И. И. Практическая медицинская микробиология, 1966, изд. "Медицина", Уз. ССР, стр. 157.
Источник: Мотавкина Н.С., Пьянова Р.Е. Микробиологическая диагностика некоторых капельных инфекций и токсоплазмоза. Методическая разработка для студентов. ВГМУ, 1973
Приложение 1
к приказу министерства здравоохранения
Нижегородской области и
Управления Нижегородской области
от 19 декабря 2012 г. N 3012/58-о
Порядок
взятия и транспортировки материала для бактериологической диагностики коклюша
1. Бактериологическое обследование с диагностической целью проводят в ранние сроки заболевания (но не позднее 3 недели) двукратно ежедневно или через день. Обследование при первичном обращении проводится до назначения лечения.
2. При госпитализации с подозрением на коклюш 2-кратное бактериологическое обследование на наличие возбудителя коклюша проводят в первые 3 дня поступления в стационар независимо от назначения антибиотиков.
3. Взятие материала может проводиться двумя способами: "кашлевыми пластинками" и заднеглоточными тампонами.
4. Забор материала заднеглоточными тампонами:
4.1. Взятие материала для исследования (носоглоточная слизь) осуществляется натощак или не ранее, чем через 2 часа после еды, а также до применения полоскания или других видов лечения.
4.2. Используются 2 заднеглоточных тампона одновременно - сухой, который сразу засевается на питательную среду, и увлажненный фосфатным буфером с углем (согласно инструкции по бактериологическому и серологическому исследованиям при коклюше и паракоклюше (1984)), который доставляется в бактериологическую лабораторию в течение 3 часов, где засевается на питательные среды.
4.3. Техника забора материала: шпателем, находящимся в левой руке, фиксируют корень языка, правой рукой вводят тампон в полость рта за корень языка, не касаясь слизистой языка, щек, миндалин. Кончиком тампона и его выпуклой частью касаются задней стенки глотки, делая два штриха справа - налево. Тампон извлекают из полости рта, также не касаясь слизистой языка, щек, миндалин.
4.4. Коммерческие транспортные среды для взятия материала на коклюш не применяются.
4.5. При заборе материала на коклюш можно использовать стерильные сухие ватные тампоны коммерческие (на деревянных палочках, не использовать дакроновые тампоны) или приготовленных # в лабораторных условиях с учетом требований инструкции по бактериологическому и серологическому исследованиям при коклюше и паракоклюше (1984). Тампоны должны иметь форму "капли", а не "веретена".
4.6. При невозможности доставки исследуемого материала в баклабораторию в установленные сроки, т.е. не позднее 3-х часов (удаленные территории, проведение обследования во второй половине дня, праздники), материал засевается на питательные среды и термостатируется при температуре 37°C до утра следующего дня, но не более 1 суток.
5. Метод "кашлевых пластинок":
5.1. Используют только с диагностической целью при наличии кашля. У детей грудного возраста взятие материала рекомендуется брать заднеглоточным тампоном.
5.2. Взятие материала "кашлевыми пластинками" производят на 2 чашки с питательной средой КУА. Во время приступа кашля левой рукой снимают крышку чашки, а правой подносят ее ко рту на расстоянии 10 - 12 см так, чтобы капельки слизи из дыхательных путей попали на поверхность среды. Чашку в таком положении держат некоторое время (в течение 6 - 8 кашлевых толчков). При непродолжительном покашливании можно эту чашку поднести повторно. На питательную среду не должны попадать слюна, рвотные массы, мокрота. Затем чашку с питательной средой закрывают крышкой и доставляют в лабораторию.
5.3. При невозможности доставки исследуемого материала в баклабораторию, материал помещается в термостат при температуре 37°C до утра следующего дня, но не более 1 суток.
6. Для обеспечения биологической безопасности и поддержания оптимальной температуры (+4°C - +37°C) в условиях термоконтейнеров осуществляется транспортировка:
- чашек с питательными средами и пробирок с увлажненными тампонами как из лаборатории к месту хранения, так и врачом к пациенту
- материал для исследования как на чашках, так и на тампонах в пробирках к месту посева.
7. В холодное время необходимо принимать меры по предотвращению замораживания материала (использование грелок).
8. В направлении материала на исследование указывается: наименование учреждения, направившего материал на исследование, фамилия, имя, отчество, возраст и домашний адрес обследуемого, причина обследования, дата заболевания, дата и время взятия материала, число обследований, наименование материала и метод его забора, подпись лица, взявшего материал.
9. Ответ при бактериологическом исследовании на коклюш выдается не ранее 5 суток.
| > Порядок взятия и транспортировки материала для ПЦР-исследования на коклюш, паракоклюш и бронхосептикоз |
| Содержание Приказ Министерства здравоохранения Нижегородской области и Управления Федеральной службы по надзору в сфере защиты прав потребителей. |
Откройте актуальную версию документа прямо сейчас или получите полный доступ к системе ГАРАНТ на 3 дня бесплатно!
Если вы являетесь пользователем интернет-версии системы ГАРАНТ, вы можете открыть этот документ прямо сейчас или запросить по Горячей линии в системе.
Коклюш, паракоклюш, бронхисептикоз.
Коклюш - заболевание, продолжающееся минимум две недели, без явлений интоксикации и повышения температуры тела, протекающее с приступообразным кашлем, усиливающимся ночью и по утрам, сопровождающимся покраснением лица, шумными вдохами (репризами), заканчивающимся отхождением вязкой слизи или рвотой в конце приступа кашля.
Осложнения коклюша:
Специфические: эмфизема легких, эмфизема средостения и подкожной клетчатки, ателектазы, коклюшная пневмония, нарушения ритма дыхания (задержки дыхания - до 30 с; остановки - апноэ - более 30 с), нарушение мозгового кровообращения, кровотечения (из носа, заднеглоточного пространства, бронхов, наружного слухового прохода), кровоизлияния (в кожу и слизистые оболочки, склеру и сетчатку глаз, головной и спинной мозг), грыжи (пупочная, паховая), выпадение слизистой оболочки прямой кишки, разрывы барабанной перепонки и диафрагмы.
Неспецифические осложнения обусловлены наслоением вторичной бактериальной флоры (пневмония, бронхит, ангина, лимфаденит, отит и др.). Резидуальные явления: хронические бронхолегочные заболевания (хронический бронхит, бронхоэктатическая болезнь); задержка психомоторного развития, неврозы, судорожный синдром, различные речевые расстройства; энурез; редко - слепота, глухота, парезы, параличи.
Лабораторная диагностика
Лабораторные исследования проводят с диагностической целью и по эпидемическим показаниям:
1) с диагностической целью:
- детям, кашляющим в течение 7 дней и более, независимо от указаний на контакт с больным коклюшем;
- детям с подозрением на коклюш и коклюшеподобные заболевания по клиническим данным; - взрослым с подозрением на коклюш и коклюшеподобные заболевания, работающим в родильных домах, детских больницах, санаториях, детских образовательных учреждениях и школах, в т.ч. закрытого типа;
2) по эпидемическим показаниям (лицам, бывшим в контакте с больным):
- детям, посещающим детские образовательные учреждения, находящимся в детских больницах, санаториях, в которых были выявлены больные коклюшем/паракоклюшем, а также всем детям до 14 лет, общавшимся с больным коклюшем/паракоклюшем в домашних условиях;
- взрослым, работающим в указанных выше детских учреждениях, при выявлении в них больных коклюшем/паракоклюшем, а также при общении с больным коклюшем/паракоклюшем в домашних условиях.
Диагноз "коклюш, вызванный B. pertussis" ставится при подтверждении клинического диагноза "коклюш" хотя бы одним из указанных методов:
- выделение культуры B. pertussis; - обнаружение специфического фрагмента генома B. pertussis методом ПЦР; - у привитых детей и взрослых: выраженная сероконверсия, т.е. увеличение или уменьшение в 4 и более раз уровня специфических IgG и/или IgA (ИФА) или уровня агглютинирующих антител (РА) при исследовании парных сывороток, взятых с интервалом не менее 2 недель;
- у взрослых: допустимо однократное обнаружение специфических IgM (ИФА); - у непривитых детей: однократное обнаружение специфических IgM, и/или IgA, и/или IgG (ИФА) или антител в титре 1/80 и более (РА).
Диагноз "коклюш, вызванный B. parapertussis" ставится в случае: - выделения культуры B. parapertussis; - или при обнаружении фрагмента генома B. parapertussis методом ПЦР;
- или при обнаружении антител к B. parapertussis методом РА в титре не менее 1/80.
Диагноз "бронхисептикоз" ставится при выделении культуры B. bronchiseptica или при обнаружении специфического фрагмента генома B. bronchiseptica методом ПЦР.
Обследование методом ПЦР нередко оказывается эффективнее бактериологического метода в более поздние сроки заболевания и на фоне лечения антибиотиками.
Материал для исследования:
1.мазки со слизистой нижнего носового хода и задней стенки ротоглотки
2. культуры микроорганизмов.
Взятие мазков со слизистой нижнего носового хода
Мазки берут сухим стерильным назофарингеальным велюр-тампоном на пластиковом аппликаторе. Если полость носа заполнена слизью, перед процедурой рекомендуется провести высмаркивание. Зонд вводят легким движением по наружной стенке носа на глубину 2-3 см до нижней раковины. Затем зонд слегка опускают книзу, вводят в нижний носовой ход под нижнюю носовую раковину до носоглотки, делают вращательное движение и удаляют вдоль наружной стенки носа.После взятия материала тампон (рабочую часть зонда с тампоном) помещают до места слома в стерильную одноразовую пробирку с 500 мкл транспортной среды для хранения и транспортировки респираторных мазков. Конец зонда отламывают с расчетом, чтобы он позволил плотно закрыть крышку пробирки. Пробирку с раствором и рабочей частью зонда закрывают и маркируют.
Взятие мазков из ротоглотки
Мазки из ротоглотки берут сухими стерильными зондами с вискозными тампонами вращательными движениями с поверхности миндалин, небных дужек и задней стенки ротоглотки.
После взятия материала тампон (рабочую часть зонда с вискозным тампоном) помещают в стерильную одноразовую пробирку с 500 мкл транспортной среды для хранения и транспортировки респираторных мазков. Конец зонда отламывают, придерживая крышкой пробирки с расчетом, чтобы он позволил плотно закрыть пробирку. Пробирку с раствором и рабочей частью зонда закрывают, маркируют.
Хранение
Допускается хранение клинического материала до проведения исследования в течение 3 суток при температуре от 2 до 8 °С или 1 неделю – при температуре не выше минус 16 °С.
|