Течении и септических осложнений
Д. Б. Утешев А. А. Карабиненко Е. Н. Филатова Г. И. Сторожаков, член-корр. РАМН, доктор медицинских наук, профессор РГМУ НО МФ МСЧ № 1 АМО ЗиЛ, Москва По официальным данным
РГМУ НО МФ
МСЧ № 1 АМО ЗиЛ, Москва
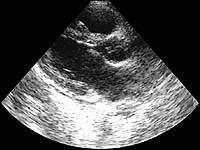 |
| Рисунок 3. ЭхоКГ больной Л., 22 года |
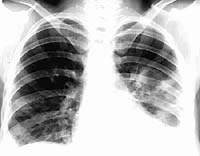 |
| Рисунок 4. Рентгенограмма больной Л., 22 года |
Как показывают наши примеры, встречаемость инфекционного эндокардита среди наркоманов увеличивается в связи с широким распространением внутривенного употребления наркотиков. Наиболее часто поражается трикуспидальный клапан. По данным литературы, в процесс могут также вовлекаться и другие клапаны [3]. В кантональном госпитале Цюриха было проведено проспективное исследование 22 пациентов с инфекционным эндокардитом (средний возраст 23 года). Период наблюдения составил три года [3]. Трикуспидальный клапан был поражен у 13 человек, митральный клапан — у четырех, комбинированное трикуспидально-митральное поражение наблюдалось у пяти пациентов и аортальный клапан был поражен у одного больного. Золотистый стафилококк оказался наиболее частым возбудителем (у 15 человек). Потенциальными факторами его патогенности, определяющими клиническую картину септического процесса, являются следующие энтеротоксины: SEA, SEB, SEC, SED и токсин синдрома токсического шока (TSST-1). Эти вещества связываются белками интерстицильного матрикса: фибронектином, колллагеном I и II типа и костным сиалопротеином (BSP). Однако эти факторы не являются преобладающими среди больных с инфекционным эндокардитом, вызванным Staphylococcus aureus [2]. BSP преобладает у больных с кожными поражениями, в то время, как у больных с эндокардитом чаще всего выделяются штаммы микроорганизмов, не вырабатывающие энтеротоксины. На наш взгляд, исходя из такой особенности выработки патогенов, можно предположить, что клинические проявления септического процесса, связанные с первичным очагом инфекции в коже (например, фурункулез), являются по своей картине однородными, в то время как при стафилококковом эндокардите факторы патогенности разнородны или вообще отсутствуют. Это может быть причиной отрицательного результата посевов крови.
Streptococci, по данным швейцарских врачей, являлись причиной бактериального эндокардита у четыреx пациентов, Corynebacteria — у двуx и в одном случае имелась смешанная инфекция [3]. Шесть пациентов были ВИЧ-инфицированы и 17 имели хронический вирусный гепатит. Десять пациентов (трое из них ВИЧ-инфицированные) подверглись хирургическому лечению. При кардиохирургическом лечении было проведено: рассечение трикуспидального клапана с заменой (у одного больного) или без замены (у четыреx больных) клапана, удаление вегетаций и замена клапана (у двух больных), замена митрального клапана (у двуx больных), протезирование аортального клапана (у одного больного). В случае эндокардита трехстворчатого клапана тактика оперативного вмешательства (выполнить резекцию, удалить вегетации или осуществить замену клапана) была выбрана с учетом тяжести поражения клапана и состояния психосоциального статуса пациента. В случае если вегетации присутствуют только на одной створке клапана и могут быть легко удалены, используется вегетоэктомия с аннулопластикой аутологичным перикардом. Удаление клапана без его протезирования является средством выбора среди тех пациентов, у которых нельзя исключить употребление наркотиков в будущем. Протезирование биопротезом используется в том случае, когда налицо полное разрушение клапана и доказано, что пациент воздерживался от употребления наркотиков в течение длительного времени до операции.
1. Медицинская микробиология / Гл. ред. В. И. Покровский, О. К. Поздеев. М.: Гэотар Медицина, 1999. 1200 с.
2. Carrel T., Schaffner A., Pasic M. et al. Surgery of endocarditis in the drug dependent and HIV patient. A prospective comparison with conservative treatment // Helv. Chir. Acta. 1993. Vol. 60. №3. Р. 439-445.
3. Hogevik H., Soderquist B., Tung H. S. et al. Virulence factors of Staphylococcus aureus strains causing infective endocarditis a comparison with strains from skin infections // APMIS. 1998. Vol. 106. № 9. P. 901-908.
Частота гнойно-септических осложнений после ранений груди и живота в течение многих лет остается на постоянном уровне. Официальные источники указывают, что в хирургических стационарах такие осложнения развиваются у 12-18,5% пострадавших. Спектр возбудителей представлен микроорганизмами, относящимися к различным группам бактерий (анаэробы, аэробы), вирусам, грибам, и включает как патогенные, так и условно-патогенные микроорганизмы. Однако, по данным некоторых авторов, в зависимости от характера и локализации повреждений количество осложнений может достигать 48% [Бисенков Л.Н., Ерюхин И. А. и др., Роостар Л., Розанов В.Е. и др., Tacyiliz I.H. et al., Degiannis E. et al., Bostrom L., Nilsson В., Nagy K.K. et al.].
Хирургическое лечение ранений шеи, груди и живота сопряжено с риском инфицирования тканей, частота которого, по некоторым данным, достигает 25% [Baric P. S. et al.].
Н. Wacha и соавт. приводят следующие факторы риска возникновения раневой инфекции:
— квалификация хирурга;
— продолжительность операции более 2 ч с увеличением риска с каждым часом;
— инфицирование зоны ранения;
— гемотрансфузия;
— продолжительность наркоза;
— одновременные операции в нескольких областях тела;
— гипоксия;
— переохлаждение;
— использование ранорасширителя.
P. Gastmeier и соавт. пришли к выводу, что плохая хирургическая техника может привести к нарушению асептики или непреднамеренному вскрытию полого органа с контаминацией зоны хирургического вмешательства.
Обращает на себя внимание тот факт, что авторы этих исследований на первое место ставят уровень квалификации хирурга, и с этим выводом приходится согласиться. Подчеркнем еще такие факторы, относящиеся непосредственно к нашим пациентам, как вмешательство сразу в нескольких областях тела, что и имеет место при сочетанных ранениях, а также использование реберного расширителя, без которого не обходится ни одна классическая торакотомия.
Что касается послеоперационного периода, то Н. Wacha и соавт. выделяют такие факторы риска:
— наличие дренажей серозных полостей на протяжении более 3 сут;
— острый респираторный дисстресс-синдром;
— переохлаждение;
— инвазивные методики лечения (катетеризация мочевого пузыря, дренирование плевральной полости, назогастральное дренирование, катетеризация центральных вен).
С нашей точки зрения, для возникновения гнойно-септических осложнений необходимо сочетание нескольких факторов — внешних (по отношению к организму пострадавшего) и внутренних.
К внешним факторам, не зависящим от организма, следует отнести в первую очередь степень контаминации нанесенных пациенту ран. При наличии более 100 тыс. микроорганизмов на 1 г ткани риск нагноения существенно возрастает даже при высоком уровне иммунитета. Бактериальное загрязнение из внешней среды обусловлено либо самим ранящим предметом, либо частицами земли, одежды и т.д. При нарушении целости органов пищеварительного тракта, мочеполовых и воздухоносных путей обширная контаминация стерильных тканей происходит как в момент ранения, так и в течение времени, пока рана остается открытой. Т. Krizek и соавт. показали, что при наличии инородных тел порог для возникновения раневой инфекции снижается в 1000 раз.

Не менее важными факторами являются вид ран (резаная, рвано-ушибленная, огнестрельная), ее глубина, локализация, наличие некротических тканей и степень кровоснабжения тканей в ее окружности. Последний упомянутый фактор хорошо известен — чем скуднее кровоснабжение тканей, тем легче возникает инфекционно-воспалительный процесс.
К внешним, не менее значимым факторам, следует отнести многие медицинские манипуляции, которые, нарушая естественные механические и биологические барьеры, также способствуют инвазии микробной флоры. Эндотрахеальные и трахеостомические трубки, желудочные и тонкокишечные зонды, сосудистые и мочевые катетеры являются инородными телами и представляют собой факторы риска, даже при строгом соблюдении асептики. Если же учесть, что реально при критическом состоянии пострадавшего с ранами шеи, груди и живота рутинными правилами асептики нередко пренебрегают, становится ясным значение этих факторов в генезе гнойно-септических осложнений.
Однако более существенную роль играют внутренние факторы, весь спектр которых в конечном итоге сводится к состоянию иммунитета (степень кровопотери, сопутствующая хроническая патология, возраст и т.д.). Еще в 1988 г. D. H. Livingston и М.А. Malungoni в экспериментах на животных доказали прямую зависимость тяжести течения гнойно-септических процессов от степени кровопотери. В последующем было уточнено, что одним из главных факторов, определяющих риск возникновения инфекции, является уровень напряжения кислорода в тканях, поскольку активность полиморфноядерных лейкоцитов зависит от содержания кислорода [Kinighton D.R. et al.].
Одним из важных, но по-прежнему дискуссионных вопросов является целесообразность назначения антибиотиков в целях профилактики гнойных осложнений. В связи с этим следует признать, что проведенные еще в середине XX века исследования показали неэффективность антибактериальной профилактики пневмонии у пациентов в группе риска. Гораздо действенней оказались такие меры, как полноценное обезболивание, коррекция гомеостаза, тщательная санация трахеобронхиального дерева, строгое соблюдение правил асептики при установке и смене эндотрахеальных трубок и возможно более раннее их удаление.
В ряде более поздних исследований — D. Demetriades и соавт., Р. J. Cant и соавт., R. P. Gonzalez и соавт. — доказывается эффективность профилактического назначения антибиотиков, в то время как в других — R. L. Nichols и соавт., А. К. Mandall и соавт. — не было выявлено заметной разницы в частоте развития осложнений в группах пациентов, которым антибиотики применяли и которым — не применяли. На основании 5474 наблюдений дренирования плевральной полости А. К. Mandall и соавт. доказали, что единственным фактором риска развития эмпиемы плевры при этом является остаточный (свернувшийся) гемоторакс.
Действительно, если считать, что частота развития эмпиемы плевры при проникающих ранениях груди составляет в среднем около 2 %, то для предотвращения двух случаев развития эмпиемы необходимо пролечить антибиотиками 100 пострадавших с проникающими ранениями и получить у них устойчивую к антибиотику микрофлору.
Однако на самом деле приведенные выше исследования не учитывают наиболее значимый, с нашей точки зрения, фактор — степень кровопотери. Любые, даже самые совершенные методы компенсации кровопотери, включая аппаратные методы реинфузии крови, не могут восполнить все компоненты циркулирующей крови и прекратить процесс, запущенный в организме самим фактом острой кровопотери.
Целесообразность введения антибиотиков в группах риска (массивная кровопотеря, повреждения полых органов, позднее поступление пациентов с проникающими ранениями) не вызывает сомнений. Многими исследователями — D. H. Livingston и соавт., C.D. Ericsson и соавт., R. L. Reed и соавт. — установлено, что в группах риска высокие дозы антибиотиков в тканях на начальных этапах лечения более важны, чем большая продолжительность курса лечения. При этом в работе С. D. Ericsson и соавт. доказана одинаковая эффективность профилактического введения антибиотиков в течение 24 ч и на протяжении 72 ч после ранения.
Профилактическое применение современных сильных антибиотиков резко уменьшило частоту гнойных осложнений, в том числе и при ранениях толстой кишки. Это позволило ряду хирургов пересмотреть хирургическую тактику и сократить показания к наложению колостом [Nichols R. L. et al., Demetriadcs D. et al.]. С точки зрения этих авторов, единственной причиной несостоятельности швов, наложенных на стенку толстой кишки, является недостаточная декомпрессия желудочно-кишечного тракта в послеоперационном периоде. Однако эту точку зрения поддерживают далеко не все хирурги, тем более что опыт последних лет свидетельствует о том, что вера в эффективность антибактериальной терапии себя не оправдала.

Мы считаем, что ведущим фактором, влияющим на развитие гнойно-септических осложнений послеоперационного периода, является объем кровопотери. Руководствуясь современной концепцией деэскалационной антибактериальной терапии, мы рекомендуем профилактическое применение антибиотиков у пострадавших с кровопотерей более 2 л и у пострадавших с повреждением полых органов. Первое введение антибиотиков должно быть на операционном столе либо в первый час после операции в условиях отделения интенсивной терапии. При ранениях шеи и груди (без повреждений полых органов) можно ограничиться применением цефалоспоринов 3-го поколения, при ранениях живота и повреждениях полых органов — сочетанием аминогликозидов с клиндамицином.
Эти же группы риска с первых суток послеоперационного периода нуждаются в проведении неспецифической иммунной терапии. Как известно, для реализации адекватного иммунного ответа на повреждающее действие необходимо определенное время, в течение которого происходит пролиферация иммунокомпетентных клеток и синтез специфических белков. Особенно уязвимой иммунная система становится при дефиците иммуноглобулинов и снижении фагоцитарной активности вследствие большой кровопотери.
В связи с этим большое значение приобретает профилактическая иммунокоррекция. Ее мы рассматриваем не только как средство заместительной терапии, восполняющей дефицит быстро потребляемых при тяжелых ранениях факторов иммунитета, но и как средство направленного изменения иммунного ответа для профилактики системных нарушений гомеостаза.
Наиболее известными препаратами являются тактивин (тимоген), который способствует дифференцировке Т-лимфоцитов и восстанавливает прямую и обратную связь между иммунной и эндокринной системой, и миелопид, который активирует окислительный метаболизм и фагоцитоз нейтрофилов, образование зрелых моноцитов и функциональную активность Т-хелперов. Эти препараты применяют в течение первых 3 сут после ранения и хирургической операции.
Однако не всегда их применение сопровождается заметным клиническим эффектом, так как при тяжелой травме иммунокомпетентные клетки не в состоянии отвечать на введение подобного рода препаратов.
Полноценные иммуноглобулины и специфические антибактериальные антитела, содержащиеся в высокой концентрации в плазме от иммунизированных доноров, восстанавливают комплексообразование и процессы опсонизации, в результате чего активируется фагоцитоз, уменьшается эндотоксикоз и снижается риск инфицирования.
Одним из необходимых компонентов, определяющих полноценное функционирование всех регулирующих систем организма, являются плазменные белки, дефицит или дисбаланс которых вследствие острой кровопотери поддерживает состояние иммунного дисбаланса. Донорская плазма содержит фибронектин в концентрации, необходимой для обеспечения репаративных и санирующих процессов, в том числе — фагоцитарной активности, выведения циркулирующих иммунных комплексов и белковых фрагментов, а также антиоксиданты, предупреждающие воспалительную деструкцию тканей.
Содержащиеся в плазме иммунизированных доноров медиаторы ускоряют дифференцировку клеток и их межклеточные взаимодействия, что способствует процессу иммунореабилиации после ранения и кровопотери.
Учитывая нарушение механизмов синтеза белков в раннем послеоперационном периоде у пострадавших с массивной кровопотерей, мы широко используем свежезамороженную антибактериальную плазму или плазму неиммунизированных доноров как средство заместительной терапии.
Опыт показывает, что тяжелые гнойные осложнения чаще всего развиваются у пострадавших с повреждениями, сопровождающимися массивной кровопотерей, с повреждениями нескольких анатомических областей и жизненно важных органов, а также с повреждениями, сопровождающимися массивным инфицированием. Поэтому проведение иммунопрофилактики у пострадавших с признаками развития вторичного иммунодефицитного состояния мы основываем на следующих положениях:
1) при множественных сочетанных ранениях шеи, груди и живота обоснованная иммунопрофилактика должна быть начата как можно ранее с момента получения ранения;
2) основанием к назначению иммуномодуляторов является несоответствие клинической картины и данных лабораторных методов исследования: если при наличии обширных повреждений с массивной кровопотерей в первые 2 сут отсутствует лейкоцитоз, имеется абсолютная лимфопения с преобладанием незрелых форм гранулоцитов, диспротеинемия;
3) основной задачей иммунопрофилактики является возмещение утраченных звеньев иммунорегуляции для обеспечения адекватной воспалительной реакции;
4) не менее важно обоснованное применение препаратов, способных снизить чрезмерную воспалительную активность моноцитов/макрофагов и полиморфноядерных нейтрофилов и ограничить поступление в кровоток избыточного количества медиаторов системной воспалительной реакции, эндо- и экзотоксинов (препараты антиоксидантного действия, ингибиторы протеаз, нестероидные противовоспалительные препараты).
52. Септические осложнения. Лечение сепсиса
Инфекционно-токсический шок имеет сложный патогенез: с одной стороны, бактериальные токсины вызывают снижение тонуса артериол и нарушение в системе микроциркуляции, с другой – наблюдается нарушение системной гемодинамики в связи с токсическим миокардитом. При инфекционно-токсическом шоке ведущим клиническим проявлением становится острая сердечно-сосудистая недостаточность. Наблюдается тахикардия – 120 ударов в минуту и выше, тоны сердца приглушены, пульс слабого наполнения, систолическое АД снижается (90–70 мм рт. ст. и ниже). Кожа бледная, конечности холодные, нередка потливость. Наблюдается снижение мочеотделения. Как правило, предвестником шока является резкое повышение температуры с ознобом (до 40–41 °C), затем температура тела снижается до нормальных цифр, разворачивается полная картина шока.
Основные звенья лечения.
1. Ликвидация интоксикации.
2. Санация гнойно-воспалительных очагов и подавление инфекции.
3. Коррекция иммунных нарушений.
Во многом для достижения этих целей применяются одинаковые мероприятия (в качестве дезинтоксикационной терапии)
1. Массивная инфузионная терапия. До 4–5 л в сутки плазмозамещающих растворов (неокомпенсана, гемодеза, реополиглюкина, гидроксилированного крахмала). При проведении инфузионной терапии особое внимание следует уделить коррекции электролитных нарушений, сдвигов в кислотно-основном состоянии (ликвидации ацидоза).
2. Форсированный диурез.
4. Лимфо– и гемосорбция.
5. Гипербарическая оксигенация.
6. Удаление гноя.
Для санации очагов инфекции – местное лечение:
1) удаление гноя, некротизированных тканей, широкое дренирование раны;
2) применение антибактериальных средств местного применения (левомеколя и др.).
1) массивная антибактериальная терапия с применением как минимум двух препаратов широкого спектра действия или направленного действия с учетом чувствительности выделенного возбудителя. Антибиотики только парентерально (в мышцу, вену, регионарную артерию или эндолимфатически).
2) антибактериальная терапия проводится длительно (на протяжении месяцев) до отрицательного результата посева крови или клинического выздоровления, если посев первично роста не дал.
Для коррекции иммунных нарушений могут применяться различные методы: введение лейкоцитарной взвеси, применение интерферона, гипериммунной антистафилококковой плазмы, в тяжелых случаях – применение глюкокортикостероидов.
Данный текст является ознакомительным фрагментом.
Читать книгу целиком
Похожие главы из других книг:
4. Брюшной тиф. Клиника. Осложнения. Диагностика. Лечение Клинические проявления. У детей заболевание проявляется незначительно выраженным гастроэнтеритом или тяжело протекающей септицемией. Обычно отмечаются рвота, вздутие живота и диарея.Инкубационный период
19. Осложнения гнойных заболеваний среднего и внутреннего уха. Клиника. Лечение КлиникаНа первом месте среди внутричерепных отоген-ных осложнений находится менингит, на втором – абсцессы височной доли головного мозга и мозжечка, на третьем – синус-тромбоз.Отогенный
38. Глазничные осложнения. Классификация. Лечение КлассификацияВыделяют следующие виды осложнений:1) реактивные отеки клетчатки глазницы и век;2) диффузное негнойное воспаление клетчатки глазницы и век;3) периостит (остеопериостит);4) субпериостальный абсцесс;5) абсцесс
52. Нефроптоз. Осложнения, дифференциальная диагностика, лечение, профилактика Осложнения. Гидронефроз и гидроуретер в результате перегибов мочеточника, фиксированного рубцовыми тяжами, добавочными сосудами. Частое осложнение нефроптоза – венная гипертензия в почке,
ОСЛОЖНЕНИЯ В зависимости от времени возникновения выделяют ранние и поздние осложнения. Ранние осложнения относятся к катаральному периоду и периоду высыпаний. Поздние осложнения возникают в периоде пигментации. В зависимости от того, какие органы или системы
ОСЛОЖНЕНИЯ После перенесения заболевания у детей осложнения бывают очень редко. Одно из самых тяжелых – краснушный энцефалит (воспаление головного мозга), развивается спустя 5 дней после появления кожных высыпаний. Характерной чертой этого осложнения являются сильные
ОСЛОЖНЕНИЯ Скарлатина является опасным заболеванием в том числе и потому, что появление осложнений не имеет четкой зависимости от формы и течения заболевания. По выражению Н. Ф. Филатова, скарлатина относится «к числу самых коварных болезней, так как различные
50. Патогенез сепсиса Микроорганизмы по-прежнему считаются главной причиной возникновения сепсиса, определяющей его течение, причем решающее значение имеют вирулентность возбудителя, его доза (титр микроорганизмов должен быть не менее 10: 5 в грамме ткани). Крайне важными
3. НЕЙРОЦИРКУЛЯТОРНАЯ АСТЕНИЯ (ОСНОВНЫЕ ТИПЫ, ДИАГНОСТИКА, ОСЛОЖНЕНИЯ, ЛЕЧЕНИЕ) Тип НЦА формируется в зависимости от характера и выраженности нарушений функций симпатоадрена-ловой и холинергической систем, а также от взаимоотношения между адрено– и холинергическими
2. Патогенез сепсиса Микроорганизмы по-прежнему считаются главной причиной возникновения сепсиса, определяющей его течение, причем решающее значение имеют вирулентность возбудителя, его доза (титр микроорганизмов должен быть не менее 10 : 5 в грамме ткани). Крайне важными
4. Септические осложнения. Лечение сепсиса Основными осложнениями сепсиса, от которых и погибают больные, следует считать:1) инфекционно-токсический шок;2) полиорганную недостаточность.Инфекционно-токсический шок имеет сложный патогенез: с одной стороны, бактериальные
Теодор Бильрот (Австрия, 1829–1894) Грязь в госпиталях — причина сепсиса* Еще в середине прошлого столетия среди хирургов господствовало убеждение, что жизнь человека на операционном столе подвергается большей опасности, чем на поле брани. В хирургических отделениях многих
Интенсивная терапия сепсиса В настоящее время сепсис продолжает оставаться одной из наиболее важных общебиологических проблем. Сформировавшееся еще в начале прошлого столетия представление о сепсисе в последние два десятилетия претерпело серьезные изменения. На
Глава 23 Неврологические осложнения остеохондроза позвоночника. Консервативное и хирургическое лечение Позвоночник человека выполняет сложную функцию опорной конструкции и конструкции, обеспечивающей значительную подвижность. Эти функциональные возможности
Осложнения Основными осложнениями при варикозном расширении вен являются: флебит – воспаление вен, тромбофлебит – воспаление вен с образованием сгустков крови (тромбов), тромбоз – наличие тромбов, распространенный тромбоз – распространение тромбов по венам на всю
Послеродовые инфекции – группа заболеваний инфекционной этиологии, развивающихся в течение 6-ти недель после родов и непосредственно связанных с ними. Включают в себя локальные раневые инфекции, инфекции органов малого таза, генерализованные септические инфекции. В диагностике послеродовых инфекций первостепенное значение имеет время их развития и связь с родами, картина периферической крови, данные гинекологического осмотра, УЗИ, бактериологического исследования. Лечение послеродовых инфекций включает антибиотикотерапию, иммуностимулирующую и инфузионную терапию, экстракорпоральную детоксикацию, санацию первичного очага и др.
Общие сведения
Послеродовые (пуэрперальные) инфекции - гнойно-воспалительные заболевания, патогенетически обусловленные беременностью и родами. Включают в себя раневые инфекции (послеродовые язвы, эндометрит), инфекции, ограниченные полостью малого таза (метрит, параметрит, сальпингоофорит, пельвиоперитонит, метротромбофлебит и др.), разлитые инфекции (перитонит, прогрессирующий тромбофлебит) и генерализованные инфекции (септический шок, сепсис). Временные рамки, в течение которых могут развиваться данные осложнения - от момента выделения последа до окончания шестой недели послеродового периода. Пуэрперальные заболевания инфекционной этиологии встречаются у 2-10% родильниц. Септические осложнения играют ведущую роль в структуре материнской смертности, что ставит их в ряд приоритетных проблем акушерства и гинекологии.

Причины послеродовых инфекций
Возникновение послеродовых инфекций обусловлено проникновением микробных агентов через раневые поверхности, образовавшиеся в результате родов. Входными воротами могут выступать разрывы промежности, влагалища и шейки матки; внутренняя поверхность матки (плацентарная площадка), послеоперационный рубец при кесаревом сечении. При этом возбудители могут попасть на раневую поверхность как извне (с инструментария, рук и одежды персонала, операционного белья, предметов ухода и пр.), так и из эндогенных очагов в результате активации собственной условно-патогенной флоры.
Этиологическая структура послеродовых инфекций весьма динамична и вариабельна. Из условно-патогенных микроорганизмов преобладают аэробные бактерии (энтерококки, кишечная палочка, стафилококки, стрептококки группы В, клебсиелла, протей), однако довольно часто встречаются и анаэробы (фузобактерии, бактероиды, пептострептококки, пептококки). Велика значимость специфических возбудителей - хламидий, микоплазм, грибов, гонококков, трихомонад. Особенностью послеродовых инфекций является их полиэтиологичность: более чем в 80% наблюдений высеваются микробные ассоциации, которые обладают большей патогенностью и устойчивостью к антибиотикотерапии.
Риск развития послеродовых инфекций существенно повышен у женщин с патологией беременности (анемия, токсикоз) и родов (раннее отхождение вод, слабая родовая деятельность, пролонгированные роды, кровотечение, задержка частей плаценты, лохиометра и др.), экстрагенитальной патологией (туберкулез, ожирение, сахарный диабет). Эндогенными факторами, предрасполагающими к микробному обсеменению родовых путей, могут служить вульвовагиниты, кольпиты, цервициты, пиелонефрит, тонзиллит, синуситы у родильницы. При инфицировании высоковирулентной флорой либо значительном снижении иммунных механизмов у родильницы инфекция может распространяться за пределы первичного очага гематогенным, лимфогенным, интраканаликулярным, периневральным путем.
Классификация послеродовых инфекций
На основании анатомо-топографического и клинического подхода выделяют 4 этапа прогрессирования послеродовой инфекции (авторы - С. В. Сазонова, А. В. Бартельс).
- 1-й этап – местная инфекция, не распространяющаяся за область раневой поверхности (послеродовая язва промежности, влагалища и стенки матки, нагноение швов, нагноение гематом, послеродовой эндометрит)
- 2-й этап – послеродовая инфекция, выходящая за границы раневой поверхности, но ограниченная полостью малого таза (метроэндометрит, аднексит, параметрит, метротромбофлебит, ограниченный тазовый тромбофлебит, пельвиоперитонит)
- 3-й этап – разлитая послеродовая инфекция (перитонит, прогрессирующий тромбофлебит)
- 4-й этап – генерализованная септическая инфекция (сепсис, инфекционно-токсический шок).
В качестве отдельной формы послеродовой инфекции выделяют лактационный мастит. Тяжесть инфекционных осложнений после родов зависит от вирулентности микрофлоры и реактивности макроорганизма, поэтому течение заболеваний варьирует от легких и стертых форм до тяжелых и летальных случаев.
Симптомы послеродовых инфекций
Послеродовая язва образуется в результате инфицирования ссадин, трещин и разрывов кожи промежности, слизистой влагалища и шейки матки. В клинической картине данного послеродового осложнения преобладают местные симптомы, общее состояние обычно не нарушается, температура не превышает субфебрильных цифр. Родильница жалуется на боли в области швов, иногда зуд и дизурические явления. При осмотре родовых путей обнаруживается язва с четкими границами, локальный отек и воспалительная гиперемия. На дне язвы определяется серовато-желтый налет, участки некроза, слизисто-гнойное отделяемое. Язвенный дефект легко кровоточит при контакте.
Послеродовой эндометрит (метроэндометрит) среди прочих послеродовых инфекций встречается наиболее часто - в 36-59% случаев. Различают классическую, стертую, абортивную формы и метроэндометрит после кесарева сечения. В типичном (классическом) варианте послеродовой эндометрит манифестирует на 3-5 сутки после родов с повышения температуры до 38-39 °С и озноба. Местно отмечается субинволюция матки, ее болезненность при пальпации, мутные гноевидные выделения из цервикального канала со зловонным запахом. Абортивная форма послеродовой инфекции развивается на 2-4 сутки, однако претерпевает быстрое обратное развитии в связи с началом терапии. Для стертого течения послеродового эндометрита типично позднее начало (5-8 сутки), затяжное или волнообразное протекание, менее выраженная симптоматика. Клиническая манифестация эндометрита после родоразрешения путем кесарева сечения приходится на 1-5 сутки; патология протекает с общими и местными проявлениями.
Послеродовой параметрит развивается на 10–12 день при переходе инфекции на параметрий - околоматочную клетчатку. Типичная клиника включает озноб, фебрильную лихорадку, которая длится 7-10 дней, интоксикацию. Родильницу беспокоят боли в подвздошной области на стороне воспаления, которые постепенно нарастают, иррадиируют в поясницу и крестец. Через несколько дней от начала послеродовой инфекции в области боковой поверхности матки пальпируется болезненный инфильтрат сначала мягковатой, а затем плотной консистенции, спаянный с маткой. Исходами послеродового параметрита может быть рассасывание инфильтрата или его нагноение с формированием абсцесса. Самопроизвольное вскрытие гнойника может произойти во влагалище, мочевой пузырь, матку, прямую кишку, брюшную полость.
Послеродовые тромбофлебиты могут затрагивать поверхностные и глубокие вены. В последнем случае возможно развитие метротромбофлебита, тромбофлебита вен нижних конечностей и вен таза. Обычно проявляются в течение 2-3 недель после родов. Клиническими предвестниками послеродовых осложнений данного типа служат длительная лихорадка; стойкое ступенеобразное учащение пульса; боли в ногах при движении и надавливании на мягкие ткани; отеки в области лодыжек, голени или бедра; цианоз нижних конечностей. На развитие метротромбофлебита указывает тахикардия до 100 уд./мин., субинволюция матки, длительные кровяные выделения, пальпация болезненных тяжей по боковым поверхностям матки. Тромбофлебит вен таза опасен развитием илеофеморального венозного тромбоза и тромбоэмболии легочной артерии.
Послеродовой пельвиоперитонит, или воспаление брюшины малого таза, развивается на 3-4 день после родов. Манифестация острая: температура тела быстро нарастает до 39-40°С, появляются резкие боли внизу живота. Может возникать рвота, метеоризм, болезненная дефекация. Передняя брюшная стенка напряжена, матка увеличена. Послеродовая инфекция разрешается рассасыванием инфильтрата в малом тазу или образованием абсцесса дугласова пространства.
Диагностика послеродовых инфекций
Факторами, указывающими на развитие послеродовых инфекций, служат признаки инфекционно-гнойного воспаления в области родовой раны или органов малого таза, а также общие септические реакции, возникшие в ранний период после родов (до 6-8 недель). Такие осложнения, как послеродовая язва, нагноение швов или гематомы диагностируются на основании визуального осмотра родовых путей. Заподозрить послеродовые инфекции органов малого таза гинекологу позволяет влагалищное исследование. В этих случаях обычно обнаруживается замедленное сокращение матки, ее болезненность, пастозность околоматочного пространства, инфильтраты в малом тазу, мутные зловонные выделения из половых путей.
Дополнительные данные получают при проведении гинекологического УЗИ. В случае подозрения на тромбофлебит показана допплерография органов малого таза, УЗДГ вен нижних конечностей. При послеродовом эндометрите информативна гистероскопия; при гнойном параметрите - пункция заднего свода влагалища. По показаниям применяют лучевые способы диагностики: флебографию, гистерографию, радиоизотопное исследование.
Для всех клинических форм послеродовой инфекции характерно изменение картины периферической крови: значительный лейкоцитоз с нейтрофильным сдвигом влево, резкое увеличение СОЭ. С целью идентификации инфекционных агентов производится бакпосев отделяемого половых путей и содержимого матки. Гистологическое исследование последа может указывать на признаки воспаления и, следовательно, высокую вероятность развития послеродовых инфекций. Важную роль в планировании терапии и оценке тяжести течения осложнений имеет исследование биохимии крови, КЩС, электролитов крови, коагулограммы.
Лечение послеродовых инфекций
Весь комплекс лечебных мероприятий при послеродовых инфекциях делится на местные и общие. Постельный режим и прикладывание льда к животу помогает остановить дальнейшее распространение инфекции из полости таза.
Локальные процедуры включают обработку ран антисептиками, перевязки, мазевые аппликации, снятие швов и раскрытие раны при ее нагноении, удаление некротизированных тканей, местное применение протеолитических ферментов. При послеродовом эндометрите может потребоваться проведение кюретажа или вакуум-аспирации полости матки (при задержке в ней плацентарной ткани и других патологических включений), расширение цервикального канала, аспирационно-промывное дренирование. При формировании абсцесса параметрия производится его вскрытие через влагалище или путем лапаротомии и дренирование околоматочной клетчатки.
Местные мероприятия при послеродовых инфекциях проводятся на фоне интенсивной общей терапии. В первую очередь, подбираются антибактериальные средства, активные в отношении всех выделенных возбудителей (пенициллины широкого спектра действия, цефалоспорины, аминогликозиды и другие), которые вводятся внутримышечно или внутривенно в сочетании в метронидазолом. На время лечения целесообразно прервать грудное вскармливание. С целью дезинтоксикации и устранения водно-солевого дисбаланса используются инфузии коллоидных, белковых, солевых растворов. Возможно проведение экстракорпоральной детоксикации: гемосорбции, лимфосорбции, плазмафереза.
При послеродовых инфекциях стафилококковой этиологии с целью повышения специфической иммунологической реактивности применяется антистафилококковый гамма-глобулин, стафилококковый анатоксин, антистафилококковая плазма. С целью профилактики тромбозов назначают антикоагулянты, тромболитики, антиагреганты под контролем коагулограммы. В комплексе медикаментозной терапии широко используются антигистаминные препараты, витамины, глюкокортикоиды. На этапе реабилитации назначают лазеротерапию, местное УФО, УВЧ-терапию, ультразвук, электростимуляцию матки, бальнеотерапию и другие методы физиотерапевтического воздействия.
В отдельных случаях может потребоваться хирургическая помощь – удаление матки (гистерэктомия) при ее гнойном расплавлении; тромбэктомия, эмболэктомия или флебэктомия - при тромбофлебитах.
Прогноз и профилактика
При раневых инфекциях и инфекциях, ограниченных областью малого таза, прогноз удовлетворительный. Своевременная и адекватная терапия позволяет остановить дальнейшее прогрессирование послеродовых инфекций. Однако в отдаленном периоде прогноз в отношении репродуктивной функции может быть вариабельным. Наиболее тяжелые последствия для здоровья и жизни родильницы влекут за собой разлитой перитонит, сепсис и септический шок.
Профилактика послеродовых инфекций обеспечивается строгим и неукоснительным соблюдением санитарно-гигиенического режима в родовспомогательных учреждениях, правил асептики и антисептики, личной гигиены персонала. Важное значение имеет санация эндогенной инфекции на этапе планирования беременности.
Читайте также:


