Сепсис и бета блокаторы
Абдоминальный сепсис и послеоперационный перитонит. Принципы антибактериальной терапии абдоминального сепсиса:
- дополнение хирургического лечения, а не его замена;
- предотвращение продолжающегося после операции реинфицирования и, таким образом, профилактика рецидивирующей интраабдоминальной инфекции;
- создание оптимальной концентрации в очаге воспаления, что определяется фармакодинамической характеристикой антибиотика;
- учет потенциальных побочных и токсических реакций препарата, тяжести основной и сопутствующей патологии;
- адекватная эмпирическая терапия до получения микробиологических данных.
Для эмпирической антибактериальной терапии при сепсисе выбирают антибиотик широкого спектра с бактерицидным типом действия или комбинацию препаратов, активных в отношении потенциально возможных в данной клинической ситуации возбудителей. Недостаточность механизмов антиинфекционной защиты требует достижения возможно более полной эрадикации микроорганизмов и, следовательно, назначения антибиотиков с бактерицидным типом действия (аминогликозиды, фторхинолоны и β-лактамы: карбапенемы, цефалоспорины IV поколения, ингибиторозащищенные пенициллины). Выбор определяется тяжестью состояния пациента, локализацией инфекции и предполагаемыми возбудителями.
Внутривенный путь введения антимикробных препаратов при сепсисе является обязательным. При заболеваниях средней степени тяжести внутримышечное введение с адекватным интервалом создает эффективную концентрацию препарата в крови, однако при тяжелом состоянии больных всасывание препаратов из мышц значительно нарушается вследствие ухудшения перфузии тканей. В связи с этим наиболее эффективным способом введения антибиотиков будет внутривенный.
Выбор дозы и кратности введения препарата зависят от типа бактерицидности и наличия постантибиотического эффекта, а также чувствительности микроорганизмов. После уточнения характера микрофлоры и ее чувствительности при необходимости вносят коррекцию в лечение: возможен переход на монотерапию, препарат более узкого спектра или менее дорогой. Первая коррекция терапии осуществляется спустя 18-36 ч на основании данных антибиотикограммы, повторная - на 3-4 день по данным полного бактериологического обследования. В большинстве ситуаций не следует длительно (более 7 дней) применять аминогликозиды. Использование гентамицина в качестве компонента эмпирической комбинированной терапии возможно лишь при сепсисе внебольничного происхождения. При госпитальных инфекциях предпочтение следует отдать амикацину или нетилмицину.
Об окончательной эффективности антибактериальной терапии при интраабдоминальной инфекции можно судить лишь при полном устранении всех исходных симптомов патологического процесса, что крайне сложно у хирургического больного. Системная воспалительная реакция в послеоперационном периоде может быть вызвана многими факторами, связанными с продолжающимся процессом в брюшной полости, появлением вторичных экстраабдоминальных очагов инфекции.
Сохранение на фоне рациональной антибактериальной терапии системной воспалительной реакции должно побуждать клинициста не к смене антибиотиков (хотя и об этом следует думать), а к настойчивому поиску очага инфекции. Это может быть интраабдоминальный (рецидивирующий или рекуррентный очаг инфекции) или альтернативный источник инфекции вне брюшной полости. При тяжелом сепсисе, наличии одновременно нескольких источников инфекции (ЖКТ, легкие и т. д.) стойкий терапевтический эффект нередко наблюдается при продолжительности антибактериальной терапии не менее 3-4 недель. Однако отсутствие каких-либо существенных изменений в более ранние сроки может свидетельствовать как о недостаточном хирургическом вмешательстве, так и о неадекватной антибактериальной терапии.
Во многих случаях интраабдоминальных хирургических инфекций традиционно используют комбинацию аминогликозида с β-лактамным препаратом, обладающим антианаэробной активностью, или линкозаминами:
- аминогликозид + пиперациллин или азлоциллин + метронидазол;
- аминогликозид + цефалоспорин I, II, III + метронидазол;
- аминогликозид + клиндамицин.
Несмотря на достаточно высокую эффективность комбинаций аминогликозидов с другими антибиотиками в лечении интраабдоминальной инфекции и сепсиса, эта тактика не лишена недостатков, что обусловлено побочными эффектами и развитием резистентности. Эффективное проведение монотерапии при осложненной интраабдоминальной инфекции стало возможным благодаря внедрению новых препаратов широкого спектра действия - ингибиторозащищенных пенициллинов:
- пиперациллина/тазобактама, тикарцилина/ клавуланата;
- цефалоспоринов IV поколения (цефепим) и карбапенемов (имипенем, меропенем).
Данный факт связан с ультрашироким спектром действия препаратов, низким уровнем приобретенной резистентности, возможностью применения у лиц с полиорганной дисфункцией.
Аналогичная тактика оправдана и при абдоминальном послеоперационном сепсисе. Во многих клинических ситуациях интраабдоминальной хирургической инфекции одного из этих препаратов (карбапенемы, ингибиторозащищенные пенициллины, цефепим) либо в комбинации с антианаэробным средством достаточно для клинической эффективности, даже более высокой, чем при использовании комбинации аминогликозидов с другим антибиотиком. Клиническая и бактериологическая эффективность β-лактамов при абдоминальном сепсисе достаточно высока и составляет около 80%. Так, при тяжелом абдоминальном сепсисе с тяжестью состояния более 15 баллов по APACHE II наиболее эффективно применение карбапенемов.
Дискутабельным остается вопрос о приемлемости монотерапии карбапенемами при синегнойной инфекции. Вероятно, он должен обсуждаться в каждом конкретном случае отдельно, ориентируясь на тяжесть состояния пациента, уровень резистентности микроорганизмов. При синегнойной инфекции (неферментирующая грамотрицательная бактерия по данным микробиологического исследования) целесообразно назначение ципрофлоксацина, амикацина, пиперациллина/тазобактама, тикарцилина/клавуланата; цефепима или цефтазидима, карбапенемов (имипенем, меропенем), лучше в комбинации из двух препаратов.
Схемы антибактериальной терапии при послеоперационном перитоните, интраабдоминальном или послеродовом сепсисе:
- Цефалоспорины III поколения -
цефотаксим 2,0 внутривенно каждые 8-12 ч,
цефтриаксон 2,0 каждые 12 ч,
цефоперазон 2,0 каждые 12 ч + клиндамицин 0,6 г внутривенно 4 раза/сут
или фторхинолон + метронидазол внутривенно 0,5 г 3 раза/сут. - Цефалоспорины III поколения + аминогликозид + метронидазол.
- Амоксициллин/клавуланат + аминогликозид ± метронидазол.
- Фторхинолоны + метронидазол.
- Аминогликозиды + метронидазол.
- Пиперациллин/тазобактам или тикарциллин/клавуланат ± аминогликозид.
Для монотерапии можно использовать:
- цефепим 1-2 г каждые 12 ч (максимально 6 г/сут),
- или имипенем, или меропенем 0,5-1 г каждые 8 ч (максимально 3-4 г/сут).
Во избежание бактериального шока не следует использовать цефтазидим-фортум и азтреонам.
Для лечения послеоперационной раневой инфекции, которая вызывается смешанной флорой, следует использовать цефокситин или амикацин (1-1,5 г/сут).
Практический врач чаще сталкивается с микст-инфекцией, тем не менее случаи моноинфекции встречаются, но требуют тщательного исключения кооперативных микроорганизмов, которые, будучи клинически латентными и поэтому не диагностированными, могут при неадекватном или неэтиологичном лечении способствовать манифестации воспалительного процесса. Изолированные инфекции подлежат своевременной и полной этиотропной терапии.
Современную кардиологию невозможно представить без препаратов группы бета-адреноблокаторов, которых в настоящее время известно более 30 наименований.
Современную кардиологию невозможно представить без препаратов группы бета-адреноблокаторов, которых в настоящее время известно более 30 наименований. Необходимость включения бета-адреноблокаторов в программу лечения сердечно-сосудистых заболеваний (ССЗ) очевидна: за последние 50 лет кардиологической клинической практики бета-адреноблокаторы заняли прочные позиции в профилактике осложнений и в фармакотерапии артериальной гипертонии (АГ), ишемической болезни сердца (ИБС), хронической сердечной недостаточности (ХСН), метаболическом синдроме (МС), а также при некоторых формах тахиаритмий. Традиционно в неосложненных случаях медикаментозное лечение АГ начинают с бета-адреноблокаторов и диуретиков, снижающих риск развития инфаркта миокарда (ИМ), нарушения мозгового кровообращения и внезапной кардиогенной смерти.
Концепция опосредованного действия лекарственных средств через рецепторы тканей различных органов была предложена N.?Langly в 1905 г., а в 1906 г. H.?Dale подтвердил ее в практике.
В 90-е годы было установлено, что бета-адренорецепторы подразделяются на три подтипа:
Способность блокировать влияние медиаторов на бета1-адренорецепторы миокарда и ослабление влияния катехоламинов на мембранную аденилатциклазу кардиомиоцитов с уменьшением образования циклического аденозинмонофосфата (цАМФ) определяют основные кардиотерапевтические эффекты бета-адреноблокаторов.
Антиишемический эффект бета-адреноблокаторов объясняется снижением потребности миокарда в кислороде, вследствие уменьшения частоты сердечных сокращений (ЧСС) и силы сердечных сокращений, возникающих при блокировании бета-адренорецепторов миокарда.
Бета-блокаторы одновременно обеспечивают улучшение перфузии миокарда за счет уменьшения конечного диастолического давления в левом желудочке (ЛЖ) и увеличения градиента давления, определяющего коронарную перфузию во время диастолы, длительность которой увеличивается в результате урежения ритма сердечной деятельности.
Антиаритмическое действие бета-адреноблокаторов, основанное на их способности уменьшать адренергическое влияние на сердце, приводит к:
Бета-адреноблокаторы повышают порог возникновения фибрилляции желудочков у больных острым ИМ и могут рассматриваться как средства профилактики фатальных аритмий в остром периоде ИМ.
Гипотензивное действие бета-адреноблокаторов обусловлено:
Препараты из группы бета-адреноблокаторов отличаются по наличию или отсутствию кардиоселективности, внутренней симпатической активности, мембраностабилизирующим, вазодилятирующим свойствам, растворимости в липидах и воде, влиянию на агрегацию тромбоцитов, а также по продолжительности действия.
Влияние на бета2-адренорецепторы определяет значительную часть побочных эффектов и противопоказаний к их применению (бронхоспазм, сужение периферических сосудов). Особенностью кардиоселективных бета-адреноблокаторов по сравнению с неселективными является большое сродство к бета1-рецепторам сердца, чем к бета2-адренорецепторам. Поэтому при использовании в небольших и средних дозах эти препараты оказывают менее выраженное влияние на гладкую мускулатуру бронхов и периферических артерий. Следует учитывать, что степень кардиоселективности неодинакова у различных препаратов. Индекс ci/бета1 к ci/бета2, характеризующий степень кардиоселективности, составляет 1,8:1 для неселективного пропранолола, 1:35 — для атенолола и бетаксолола, 1:20 — для метопролола, 1:75 — для бисопролола (Бисогамма). Однако следует помнить, что селективность дозозависима, она снижается с повышением дозы препарата (рис. 1).
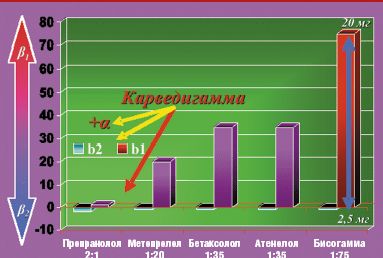
В настоящее время клиницисты выделяют три поколения препаратов с бета-блокирующим эффектом.
I поколение — неселективные бета1- и бета2-адреноблокаторы (пропранолол, надолол), которые наряду с отрицательными ино-, хроно- и дромотропными эффектами обладают способностью повышать тонус гладкой мускулатуры бронхов, сосудистой стенки, миометрия, что существенно ограничивает их использование в клинической практике.
II поколение — кардиоселективные бета1-адреноблокаторы (метопролол, бисопролол), благодаря высокой селективности в отношении бета1-адренорецепторов миокарда обладают более благоприятной переносимостью при длительном применении и убедительной доказательной базой долгосрочного прогноза жизни при лечении АГ, ИБС и ХСН.
В середине 1980-х годов на мировом фармацевтическом рынке появились бета-адреноблокаторы III поколения с низкой селективностью к бета1, 2-адренорецепторам, но с сочетанной блокадой альфа-адренорецепторов.
Препараты III поколения — целипролол, буциндолол, карведилол (его дженерический аналог с брендовым названием Карведигамма®) обладают дополнительными вазодилятирующими свойствами за счет блокады альфа-адренорецепторов, без внутренней симпатомиметической активности.
В 1982–1983 годах в научной медицинской литературе появились первые сообщения о клиническом опыте применения карведилола при лечении ССЗ.
Ряд авторов выявили протективное действие бета-адреноблокаторов III поколения на клеточные мембраны. Это объясняется, во-первых, ингибированием процессов перекисного окисления липидов (ПОЛ) мембран и антиоксидантным действием бета-блокаторов и, во-вторых, снижением влияния катехоламинов на бета-рецепторы. Некоторые авторы связывают мембранстабилизирующее действие бета-блокаторов с изменением проводимости натрия через них и ингибированием ПОЛ.
Указанные дополнительные свойства расширяют перспективы применения данных лекарственных средств, поскольку нивелируют характерное для первых двух поколений отрицательное влияние на сократительную функцию миокарда, углеводный и липидный обмен и в то же время обеспечивают улучшение перфузии тканей, позитивное влияние на показатели гемостаза и уровень оксидативных процессов в организме.
Карведилол метаболизируется в печени (глюкуронирование и сульфатация) с помощью ферментной системы цитохрома Р450, с использованием семейства ферментов — CYP2D6 и CYP2C9. Антиоксидантное действие карведилола и его метаболитов обусловлено наличием в молекулах карбазольной группы (рис. 2).
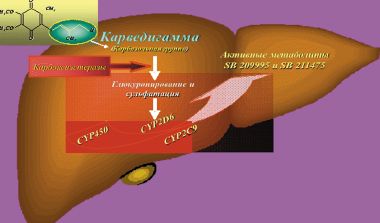
Метаболиты карведилола — SB 211475, SB 209995 угнетают ПОЛ в 40–100 раз активнее, чем сам препарат, а витамин Е — примерно в 1000 раз.
Применение карведилола (Карведигаммы®) при лечении ИБС
Согласно результатам целого ряда завершенных многоцентровых исследований, бета-адреноблокаторы оказывают выраженный антиишемический эффект. Необходимо отметить, что антиишемическая активность бета-адреноблокаторов соизмерима с активностью антагонистов кальция и нитратов, но, в отличие от этих групп, бета-адреноблокаторы не только улучшают качество, но и увеличивают продолжительность жизни пациентов с ИБС. Согласно результатам метаанализа 27 многоцентровых исследований, в которых приняло участие более 27 тыс. человек, селективные бета-адреноблокаторы без внутренней симпатомиметической активности у больных с острым коронарным синдромом в анамнезе снижают риск развития повторного ИМ и смертность от инфаркта на 20% [1].
Благодаря этим уникальным фармакологическим свойствам, карведилол может превосходить традиционные бета1-селективные адреноблокаторы в плане улучшения перфузии миокарда и способствовать сохранению систолической функции у больных ИБС. Как показано Das Gupta et al., у больных с дисфункцией ЛЖ и сердечной недостаточностью, развившейся вследствие ИБС, монотерапия карведилолом снижала давление наполнения, а также увеличивала фракцию выброса (ФВ) ЛЖ и улучшала показатели гемодинамики, при этом не сопровождаясь развитием брадикардии [3].
Согласно результатам клинических исследований у больных хронической стабильной стенокардией, карведилол снижает ЧСС в покое и при физической нагрузке, а также увеличивает ФВ в покое. Сравнительное исследование карведилола и верапамила, в котором принимало участие 313 пациентов, показало, что, по сравнению с верапамилом, карведилол в большей степени уменьшает ЧСС, систолическое АД и произведение ЧСС ´ АД при максимально переносимой физической нагрузке. Более того, карведилол обладает более благоприятным профилем переносимости [4].
Важно, что карведилол, по-видимому, более эффективен при лечении стенокардии, чем обычные бета1-адреноблокаторы. Так, в ходе 3-месячного рандомизированного многоцентрового двойного слепого исследования карведилол напрямую сравнивали с метопрололом у 364 пациентов со стабильной хронической стенокардией. Они принимали карведилол по 25–50 мг два раза в сутки или метопролол по 50–100 мг два раза в сутки [5]. В то время как оба препарата продемонстрировали хорошее антиангинальное и противоишемическое действие, карведилол более значительно увеличивал время до депрессии сегмента ST на 1 мм при физической нагрузке, чем метопролол. Переносимость карведилола была очень хорошей, и, что важно, при увеличении дозы карведилола не произошло заметных изменений типов нежелательных явлений.
Примечательно, что карведилол, не обладающий, в отличие от других бета-адреноблокаторов, кардиодепрессивным действием, улучшает качество и продолжительность жизни пациентов с острым ИМ (CHAPS) [6] и постинфарктной ишемической дисфункцией ЛЖ (CAPRICORN) [7]. Многообещающие данные были получены в ходе исследования Carvedilol Heart Attack Pilot Study (CHAPS) — пилотного исследования влияния карведилола на развитие ИМ. Это было первое рандомизированное исследование, в котором сравнивали карведилол с плацебо у 151 больного после острого ИМ. Лечение начинали в течение 24 часов с момента появления болей в грудной клетке, а дозу препарата увеличивали до 25 мг два раза в сутки. Главными конечными точками исследования были функция ЛЖ и безопасность препарата. Больных наблюдали в течение 6 месяцев с момента начала заболевания. Согласно полученным данным, частота развития серьезных кардиальных событий уменьшилась на 49%.
Полученные в ходе исследования CHAPS эхографические данные 49 пациентов со сниженной ФВ ЛЖ (
А. М. Шилов*, доктор медицинских наук, профессор
М. В. Мельник*, доктор медицинских наук, профессор
А. Ш. Авшалумов**
*ММА им. И. М. Сеченова, Москва
**Клиника Московского института кибернетической медицины, Москва
Определение
Определение сепсиса показывает эволюцию взглядов на этиологию и патогенез данного состояния. Само определение неоднократно менялось, ранее считалось, что главенствующую роль в патогенезе играет системный воспалительный ответ, однако на данный момент центральную роль отводят нарушению действий воспалительной и противовоспалительной систем. Решение о необходимости изменения дефиниции было принято в 2017 году European Society of Intensive Care Medicine и Society of Critical Care Medicine.
Сепсис ― угрожающая жизни органная дисфункция, вызванная дезрегулирующим ответом организма хозяина на инфекцию.
Септический шок ― подвид сепсиса, в основе которого лежит нарушение циркуляции, а патологические изменения в клетках и метаболизме достаточно глубоки, чтобы в значительной степени увеличить летальность.
Диагностика
Исходя из определения и патогенеза, для скрининга сепсиса было предложено использовать шкалу qSOFA (quick Sepsis-related Organ Failure Assessment).
- Системное артериальное давление ≤ 100 мм рт. ст.;
- Частота дыхания ≥ 22 в минуту;
- Любое нарушение сознания ( Таблица 1 | Критерии SOFA
После выставления диагноза проводится начальная интенсивная терапия, важной частью которой является проведение массивной инфузии, далее определяется среднее артериальное давление (СрАД), а также уровень лактата. Среднее артериальное давление определяется по формуле: СрАД = САД – ДАД + ⅓ ДАД, где САД ― систолическое артериальное давление, а ДАД ― диастолическое артериальное давление. При необходимости применения вазопрессоров для поддержания адекватного среднего артериального давления ( ≥ 65 мм рт. ст.), а также при высоком уровне лактата ( > 2 ммоль/л) выставляется диагноз септический шок.
Начальная терапия
Интенсивная терапия сепсиса должна начинаться сразу же после постановки диагноза. Рекомендации по ведению сепсиса 2012 года предлагали использовать цели, которые необходимо было достигнуть за определенное время. К сожалению, после проведения крупных испытаний данная стратегия не показала преимуществ по сравнению со стандартной терапией, а также оказалась более затратной.
После выявления сепсиса для коррекции сепсис-индуцированной гипоперфузии в начальном периоде используются кристаллоиды в объеме 30 мл/кг внутривенно в первые 3 часа. Последующая инфузия должна проводиться на основании имеющихся в наличии данных о физиологии пациента (частота сердечных сокращений, артериальное давление, артериальная сатурация кислорода, частота дыхания, температура и другие данные), полученных с помощью неинвазивных и инвазивных методов. Предпочтение желательно отдавать динамическим методам измерения.
У пациентов с септическим шоком, требующим применения вазопрессоров, необходимо поддерживать среднее артериальное давление на уровне не менее 65 мм рт. ст. Пациентам с повышенными уровнями лактата (маркер тканевой гипоперфузии) необходимо проводить интенсивную инфузионную терапию с целью его снижения до нормальных уровней.
Всем организациям здравоохранения рекомендуется разрабатывать собственные или усовершенствовать имеющиеся программы по ведению сепсиса и септического шока, методам скрининга у тяжелобольных пациентов, а также оценке риска развития сепсиса. Допустимо применение других шкал для скрининга состояния тяжелобольных пациентов: привычная шкала ССВО, LODS (Logistic Organ Disfunction System), NODS (National Organ Disfunction System).
Интенсивная терапия сепсиса
Антибактериальная терапия
До начала антибактериальной терапии необходимо взять посевы (кровь, спинномозговую жидкость, мочу, секрет из дыхательных путей, раневое отделяемое или другие жидкости организма) для определения чувствительности микроорганизмов к антибиотикам с использованием как минимум двух наборов культур: анаэробной и аэробной. Однако взятие посевов не должно существенно затягивать начало антибактериальной терапии сепсиса. Антибиотикотерапия должна начинаться в максимально ранние сроки, до 1 часа после постановки диагноза сепсиса или септического шока. Любое промедление в назначении антибактериальных средств значительно повышает смертность пациентов. Эмпирическую антимикробную терапию рекомендуется начинать с одного или нескольких антибиотиков (АБ) из двух разных классов, с широким спектром активности, действующих на предполагаемую флору (бактериальную и/или грибковую).
При выборе АБ необходимо учитывать: анатомический источник и типичную его флору, преобладающую флору в госпитале или вне его, резистентность преобладающего патогена, иммунные нарушения у пациента (нейтропения, спленэктомия, плохо контролируемая ВИЧ-инфекция, приобретенные или врожденные дефекты иммуноглобулина, системы комплемента или функции лейкоцитов), а также возраст пациента и наличие сопутствующей патологии, хронических заболеваний. Дозу и время введения необходимо оптимизировать на основании фармакодинамики/фармакокинетики и специфических свойств препаратов. Необходимо помнить о том, что у пациентов зачастую есть нарушение функции почек и/или печени, а также о возможной резистентности микроорганизмов. При применении бета-лактамных АБ важно достигнуть концентраций выше минимальной ингибирующей в течение как можно более длительного времени, в то время как для аминогликозидов и фторхинолонов главную роль играет достижение пиковой концентрации.
Деэскалацию (замена АБ широкого спектра действия на АБ более узкого спектра действия) антибактериальной терапии проводят в течение нескольких последующих дней после того, как определены микроорганизмы, вызвавшие сепсис и септический шок, и их спектр чувствительности к антибиотикам, либо наступает значительное клиническое улучшение/ухудшение. По возможности каждый день оцениваются клинические данные, и на их основании проводится решение об деэскалации. Рекомендуемая длительность антибактериальной терапии составляет 7–10 дней, что зачастую достаточно для большинства серьезных инфекций, ассоциированных с развитием сепсиса и септического шока.
При проведении антибиотикотерапии необходимо руководствоваться уровнем прокальцитонина (ПКТ), это позволяет сократить продолжительность курса, а также отменить АБ у пациентов, у которых имелись подозрение на сепсис и слабые доказательства наличия инфекции. При снижении уровня прокальцитонина более, чем на 80 % от пикового значения или снижении ПКТ менее 0,5 мкг/л необходимо прекратить введение АБ.
Контроль очага
Необходимо как можно быстрее (не позже 6‒12 часов после постановки диагноза) выявить или исключить наличие очага инфекции в организме и провести вмешательство по его удалению. Следует обратить особое внимание на внутрисосудистые девайсы (центральные венозные катетеры), так как они могут быть источниками инфекции.
Инфузионная терапия
Препаратами выбора для инфузионной терапии при развитии сепсиса и септического шока являются кристаллоиды. Предпочтительней применять сбалансированные растворы, так как они не вызывают развитие гиперхлоремического метаболического ацидоза (раствор Хартмана или Рингер-лактат), при их отсутствии допустимо применение несбалансированных растворов (Рингер или физиологический раствор NaCl 0,9 %). Недостаточно данных об использовании препаратов желатина для восстановления объема внутрисосудистого русла при сепсисе.
При необходимости инфузии значительных объемов кристаллоидов допускается добавление инфузии коллоидов (альбумина 20 %) с целью достижения плазменного уровня альбумина > 30 г/л. На основании данных проведенных исследований не рекомендуется использование при сепсисе и септическом шоке растворов гидроксиэтилкрахмала.
Вазоактивные препараты
Добутамин может назначаться пациентам, имеющим признаки тканевой гипоперфузии, на фоне адекватной инфузии и использовании других вазопрессоров. Дозу данного препарата необходимо тщательно титровать для достижения желаемого эффекта (восстановление тканевой перфузии), а при развитии аритмий или усугублении гипотензии незамедлительно прекратить его введение. Всем пациентам с септическим шоком желательно установить артериальный катетер для контроля показателей гемодинамики.
Кортикостероиды
Нет необходимости использовать глюкокортикоиды, когда на фоне инфузионной терапии и применения вазопрессоров достигнута гемодинамическая стабильность. Если же невозможно поддерживать гемодинамику на должном уровне на фоне приведенной выше терапии (инфузия + прессоры), допускается применение гидрокортизона внутривенно в дозе 200 мг/сутки.
Препараты крови
Трансфузия эритроцитов проводится при снижении уровня гемоглобина менее 70 г/л у взрослых без признаков тяжелой гипоксемии, ишемии миокарда или острого кровотечения. Эритропоэтин у пациентов с сепсисом не применяется. Свежезамороженная плазма может использоваться при нарушениях свертываемости крови перед планированием инвазивных процедур или при наличии активного кровотечения.
Трансфузия тромбоцитов проводится в зависимости от клинической необходимости при уровне:
- 9 , если отсутствует риск кровотечения;
- 9 при наличии значительного риска развития кровотечения;
- ≤ 50 х 10 9 при наличии активного кровотечения, проведении хирургического вмешательства или инвазивной процедуры.
Иммуноглобулины
Эксперты не рекомендуют использовать иммуноглобулины у пациентов с сепсисом и септическим шоком.
Очистка крови
Эффект применения различных технологий очистки крови не доказан. Необходимо провести дополнительные исследования.
Искусственная вентиляция легких (ИВЛ)
На фоне сепсиса у пациентов часто развивается сепсис-индуцированный острый респираторный дистресс синдром (ОРДС). При развитии ОРДС проводится ИВЛ со следующими параметрами:
- Целевой дыхательный объем 6 мл/кг на прогнозируемую массу тела (ПМТ). ПМТ у мужчин = 50 + 0,91 * (рост в см – 152,4), ПМТ у женщин = 45,5 + 0,91 * (рост в см –152,4);
- Верхний предел давления плато (Рplat) = 30 см вод. ст.;
- Высокий PEEP — около 10‒12 см вод. ст., для подбора оптимального PEEP можно использовать таблицы, основанные на значениях FiO2;
- Использование рекрутмент маневра и прон-позиции при отношении PaO2/FiO2 Седация и анальгезия
Необходимо избегать продолжительной или интермиттирующей седации пациентов, которым проводится ИВЛ. Если же все-таки необходима седация, то предпочтительнее использовать короткодействующие препараты (пропофол или дексмедетомидин).
Контроль гликемии
Рекомендуется поддержание уровня глюкозы ≤ 10 ммоль/л. При наличии двух последовательных проб крови с превышением данного уровня глюкозы необходимо незамедлительно начать введение инсулина. Мониторинг гликемии проводится каждые 1–2 часа до момента, когда уровни глюкозы и инфузия инсулина не стабилизируются; после стабилизации контроль проводится каждые 4 часа. Для измерения уровней глюкозы предпочтительнее использовать артериальную кровь. Допустимо использование портативных глюкометров, однако нужно критически относиться к результатам данных исследований.
Почечно-заместительная терапия (ПЗТ)
При развитии у пациентов с сепсисом острого повреждения почек и наличии показаний к диализу может применятся длительная или перемежающаяся почечно-заместительная терапия. Во время ПЗТ возможен контроль и изменение баланса жидкости у гемодинамически нестабильных пациентов.
Применение бикарбоната натрия
Не рекомендуется раннее применение бикарбоната натрия при индуцированном гипоперфузией лактат-ацидозе с pH ≥ 7,15.
Профилактика венозной тромбоэмболии (ВТЭ)
Рекомендуется проводить профилактику ВТЭ у пациентов с сепсисом и септическим шоком, предпочтительнее низкомолекулярными гепаринами (НМГ) либо с помощью нефракционированного гепарина (НФГ). Возможно использование механических методов профилактики (компрессионные чулки или устройства для перемежающейся пневматической компрессии) как дополнение к основной терапии или как самостоятельный метод при наличии противопоказаний к применению НМГ и НФГ .
Не рекомендуется применение антитромбина III.
Профилактика язв
У пациентов с сепсисом и септическим шоком, имеющих факторы риска желудочно-кишечного кровотечения (проведение ИВЛ > 48 часов, заболевания печени, коагулопатии, проведение ПЗТ), необходимо проводить профилактику стрессовых язв с помощью блокаторов протонной помпы или антагонистов Н2-гистаминовых рецепторов.
Питание
Рекомендуется раннее начало энтерального питания у пациентов с сепсисом. В зависимости от переносимости могут использоваться трофические/гипокалорические смеси или полное раннее энтеральное питание. Начинать парентеральное питание следует не ранее 8 суток при невозможности обеспечить раннее энтеральное питание. При непереносимости энтерального питания или наличии высокого риска аспирации может проводиться измерение остаточного объема желудка, а также использоваться пост-пилорические зонды для кормления. Пациентам с гастропарезом, диабетом или получающим седативные и вазоактивные препараты может потребоваться применение прокинетиков (метоклопрамид, домперидон). При применении прокинетиков необходим ЭКГ мониторинг для ранней детекции синдрома удлиненного QT и снижения риска внезапной смерти.
Отсутствуют данные о положительном эффекте применения омега-3-жирных кислот, внутривенного введения селена, аргинина, глютамина и карнитина.
Источники:
- Singer M. et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3) //Jama. – 2016. – Т. 315. – №. 8. – С. 801-810.
- Rhodes A. et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock: 2016 //Intensive care medicine. – 2017. – Т. 43. – №. 3. – С. 304-377.
Читайте также:


