При всех формах чумы для бак исследования забирают
III. ОСНОВНЫЕ ТРЕБОВАНИЯ К ОТБОРУ
1. Материал отбирается непосредственно из очага пораже
ния или соответствующее отделяемое (мокрота, моча, желчь и т.д.).
2. При отборе материала необходимо соблюдать правила
асептики, не допуская загрязнения его микрофлорой окружающей
среды.
3. Материал отбирается до начала антибактериальной те
рапии или через период, достаточный для его элиминации из орга
низма. Если материал взят на фоне антибактериальной терапии, об
этом указывается в направлении.
4. Материал для исследования отоирается в период наи
большего содержания в нем возбудителей заболевания (кровь во
время озноба, фекалии во время диареи и т.д.).
У больных исследованию подлежат: кровь, моча, испражнения, слюна, мокрота, рвотные массы, смывы с поверхности слизистых оболочек, отделяемое язв, содержимое кожных высыпаний (например пустулы), содержимое лимфатических узлов, бубонов, спинномозговая жидкость, а также секционный материал при вскрытии трупов людей или погибших животных; кровь, кусочки внутренних органов, прежде всего имеющих признаки патологического процесса.
5. Для предупреждения инфицирования во время взятия
проб и их транспортировки медперсонал долен строго выполнять
соответствующие инструкции по соблюдению эпидрежима при ра
боте с особо опасными материалами (защитная одежда, специаль
ные маски, очки, респираторы или противогазы).
6. Сроки взятия материала должны соответствовать патоге
незу инфекции, циклическому развитию возбудителя заболевания и
другим условиям.
Кровь у людей берут стерильным шприцем из локтевой вены, соблюдая правила асептики, в количестве 8-10 мл и развивают ее в 3-4 стерильные ;стеклянные пробирки или специальные пластиковые пробирки с пробкой. Для предупреждения свертывания крови в одну из таких пробирок добавляют гепарин (0,01 мг на 1 мл крови). Одновременно готовят 2-3 мазка крови на предметных стеклах обычным способом. Как правило, мазки не фиксируют. О том, что мазок не фиксирован, делают отметку в сопроводительном документе. Предметные стекла с высохшими мазками складывают попарно, намазанными сторонами внутрь, прокладывая между ними полоски фильтровальной бумаги.
Выделения и смывы с поверхности слизистых оболочек верхних дыхательных путей берут с помощью небольших стерильных ватных тампонов, слегка смоченных в стерильном изотоническом растворе хлорида натрия (физиологический раствор), которым протирают носоглотку и ротовую полость; смывы (полоскания носоглотки) также производятся физиологическим раствором, жидкость сливается в ту же пробирку, куда помещается и тампон. Слизь из носа, налеты в зеве берут (раздельно из носа и зева) также тампонами, которые затем помещают в пробирки и герметизируют.
Испражнения собирают в чистое подкладное судно, на лист плотной бумаги или непосредственно из прямой кишки. Используют для этого универсальные пробирки с тампоном и миниатюрной ложечкой, которая применяется для сбора фекалий из подкладного судна (бумаги) в пробирку. Для ускорения результатов бактериологического анализа целесообразно производить посев на питательные среды непосредственно у постели больного. Пробирки вместе с посевом срочно направляют в лабораторию.
Мочу для бактериологического анализа собирают в стеклянную посуду. Наружное отверстие мочеиспускательного канала предварительно очищают ватным тампоном, смоченным раствором сулемы или другим дезинфицирующим раствором, и тщательно об-
мывают после этого стерильной водой. Первую порцию мочи выливают, затем собирают для анализа 50-60 мл
Материал из бубона берут стерильным шприцем. Если бубон имеет сохранившуюся кожу (не вскрывшийся бубон), то её протирают предварительно спиртом. Пункцию бубона производят как в его центре, так и на периферии. Из вскрывшегося бубона материал забирают в местах с сохраненной тканью, а также берут отделяемое бубона. Готовят мазки на предметных стеклах, полученный материал в пробирках плотно закрывают и направляю в лабораторию.
При наличии у больного на коже папул, везикул, пустул кроме забора проб из этих образований, берут на анализ также отделяемое слизистой полости рта и носоглотки. Для этого используй стерильные ватные тампоны, смоченные стерильным физиологическим раствором. Полученный материал помещают в пробирки и плотно закрывают. Одновременно готовят 2-3 мазка на предметных стеклах, высушивают их на воздухе без фиксации и отправляют в лабораторию.
Папулы, везикулы, пустулы перед взятием материала очищают ватным тампоном, смоченным эфиром или спиртом, затем прокалывают их у основания стерильной иглой или тонким капилляром пастеровской пипетки. Для ускорения поступления материала элемент сверху надавливают иглой. Корку или верхнюю часть везикул отделяют от кожи иглой, скальпелем, а папулы соскабливают скальпелем. Из полученной жидкости и пульпы готовят мазки на предметных стеклах, высушивают их на воздухе без фиксации, затем помещают в соответствующую тару таким образом, чтобы стекла не соприкасались между собой. Мягкие корки везикул осторожно зажимают между предметными стеклами Полученные материалы помещают в полиэтиленовые мешочки, герметизируют и отправляют в лабораторию. Если материал пересылается на большие расстояния, то полученные пробы замораживают или помещают в консервант Процедура взятия материала и упаковка должны исключать возможность заражения окружающих людей и предметов.
При подозрении на заболевание чумой в зависимости от клинической формы исследованию будут подвергаться различные объекты. При бубонной форме исследуется пунктат или отделяемое из вскрывшихся бубонов, а также кровь. При легочной форме чумы исследованию подвергают материал из зева, взятый тампоном, мокроту и кровь.
При подозрении на холеру материалом для исследования служат испражнения и рвотные массы больных, содержимое желчного пузыря и тонких кишок умерших.
При обследовании на вибрионосительство рековалесцентов или лиц, соприкасавшихся с больными, обследуемым предварительно дают слабительное (лучше всего сернокислую магнезию в количестве 25-30 г) для того, чтобы собрать испражнения из верхних отделов кишечника.
В условиях стационара материал собирают в чистое подкладное судно, тщательно обмытое кипятком. При массовом обследовании на вибрионосительство допускается взятие проб из прямой' кишки ректальным (ватным, марлевым или другими) тампоном, резиновыми катетерами, петлями из алюминиевой проволоки и т.д. Допускается исследуемый материал сразу засевать во флаконы или пробирки с 30-50 мл 1% пептонной воды и в таком виде доставлять в лабораторию. При крайней необходимости проведения массовых исследований на вибрионосительство разрешается пользоваться методом групповых посевов. Для этого во флакон, содержащий 50-100 мл 1% пептонной воды, засевают материал от 10 (не более) обследуемых лиц. В случае обнаружения вибрионов в групповой пробе проводят раздельное исследование испражнений каждого из 10 лиц, у которых был взят материал в общий флакон.
При подозрении на заболевание сибирской язвой исследованию подлежат: содержимое везикулы или пустулы, отделяемое карбункула или язвы - при кожной форме; мокрота - при лёгочной форме; испражнения, рвотные массы и моча - при кишечной форме, кровь - при септической и других формах заболевания. Для постановки посмертного диагноза исследуется кровь, а также материалы, взятые при патологоанатомическом вскрытии трупа (селезёнка, кровянисто инфильтрированные ткани), жидкость желудочков мозга, пораженные участки кожи и т.п.).
При подозрении туляремии материалами для исследования могут быть пунктат из бубона или гнойное отделяемое слизистой глаза (до конца третьей недели болезни), содержимое пустулы или кожной язвы, слизь из зёва или кровь, взятые в течение первой недели болезни.
При подозрении на заболевание сапом материалом для бактериологического исследования служат носовые истечения, гнойное отделяемое язв, пунктаты нагноившихся лимфатических узлов и
подкожных (внутримышечных) абсцессов, кровь и взятые при вскрытии трупов кусочки пораженных легких, печени, селезёнки.
При подозрении на заболевание мелиоидозом материалом для бактериологической диагностики служат содержимое гнойных абсцессов, носовые истечения, эксудаты, кровь, моча и в исключительных случаях - спинномозговая жидкость.
При подозрении на ботулизм материалом для исследования являются промывная вода из желудка (в количестве 50 мл), моча (50 мл), испражнения(20-25 г), кровь (10-20 мл).
При подозрении на заболевание риккетсиозом материалом для выявления возбудителя является кровь больного, взятая в первые дни или на высоте лихорадочного периода. При подозрении на риккетсиоз пневмонии для исследования может поступить мокрота больного, плевральная жидкость. В ряде случаев могут быть использованы также спинномозговая жидкость, моча, планцента рожениц, соскобы (лимфа) с розеол, содержимое язвочек, образовавшихся на месте укуса клещей и т.п.
↑ Забор материала. Микроскопическое исследование
Чума является чрезвычайно контагиозной, поэтому взятие материала от больного (особенно легочной формы) производится с соблюдением мер предосторожности. Работа в очаге проводится в полном противочумном костюме. В лабораторию могут быть доставлены следующие материалы:
- содержимое бубона (легочная форма чумы);
- отделяемые язвы или пунктет из карбункула (кожная форма чумы);
- материал из зева, взятый тампоном и мокрота (легочная форма чумы);
- секционный материал (кусочки органов трупа, кровь);
- живые грызуны;
- трупы грызунов;
- блохи грызунов;
- вода;
- пищевые продукты.
Материал необходимо брать до назначения лечения. Значение микробиологического диагноза огромно, особенно для выявления первых случаев чумы. Предварительный диагноз устанавливают на основании микроскопического исследования материала, окончательный - на основании выделения и идентификации культуры.
Микроскопическое исследование - мазки фиксируют погружением полностью в жидкость Инпифорова на 20 мин. Окраска по Граму обязательна во всех случаях. Одновременно окрашивают мазок метиленовым синим Лефлера, так как этот метод лучше выявляет биполярность.
Бактериологическое исследование - посевы исследуемого материала производят на агар добавлением стимуляторов роста (кровь, сульфит натрия). При исследовании материала, обильно загрязненного посторонней микрофлорой (загнившие трупы, мокрота) к агару добавляют генциановый фиолетовый 1 : 100 000. В случаях подозрения на наличие бактериофага посевы обрабатывают антифаговой сывороткой. Инкубацию посевов проводят при 28 °С. В положительных случаях через 12 ч появляются колонии в виде характерных "кружевных платочков".
Когда чистая культура выделена путем прямого посева она подлежит идентификации на основании следующих данных:
- внешний вид колонии на агаре;
- характерный рост на бульоне;
- типичная морфология микробов в мазках и отрицательная окраска по Граму;
- типичная патологоанатомическая у лабораторных животных при заражении их чистой культурой;
- агглютинация со специфической сывороткой;
- отношение к специфическому бактериофагу.
Исследование ферментативных свойств, подвижности и т. п., производят лишь в специальных случаях для дифференциального диагноза с родственными видами бактерий. Проба с фагом осуществляется на твердых средах путем нанесения капли фага на свежий посев культуры и на жидких путем добавления в бульонную культуру фага в количестве 1/10 объема культуры. Окончательное заключение делают на основании изучения комплекса признаков исследуемой культуры. При этом не следует забывать явлении изменчивости.
Биологическая проба обязательна при исследовании; наиболее чувствительными из лабораторных животных являются морские свинки и белые мыши. Для постановки биологической пробы животных заражают внутрибрюшинно, подкожно или внутрикожно, а в случае загрязнения материала посторонней микрофлорой - втиранием в скарифицированную кожу.
В зависимости от способа заражения и степени чувствительности к возбудителю животные погибают от чумы на 3-9-й день после инфицирования изменения во внутренних органах в виде геморрагического воспаления, кровоизлияния: в мазках-отпечатках из органов - множество чумных микроорганизмов; посевы инфицированных органов и крови дают обильный рост возбудителя.
Ускоренные методы бактериологического исследования. Метод ускоренного обнаружения возбудителя чумы с помощью бактериофага, внесенного в исследуемый материал, используют для исследования объектов, имеющих основное практическое значение: материал от больного, от трупа, из внешней среды.
Исследуемый материал наносят на 3 агаровые пластины с гемолизированной кровью и генциановым фиолетовым. На первой и второй агаровой пластине в исследуемый материал сразу же вносят чумной бактериофаг (разведенный в 10 раз). На третью чашку бактериофаг не добавляют (контроль).
Результаты начинают читать через 2,5 -- 3 ч после помещения их в термостат. При наличии значительного количества микробов чумы в исследуемом материале уже через 2 ч на фоне начального роста чумного микроба видны мелкие палочки бактериофага. Метод ускоренной диагностики чумы основан на свойстве чумного бактериофага быстро (30-40 мин) размножаться в присутствии микроба чумы.
Большого внимания заслуживает люминесцентно-серологическй метод, с помощью которого можно обнаружить возбудитель чумы в воздухе, воде, пищевых продуктах. Реакция нарастания титра фага (в качестве индикаторного фага предложен чумной бактериофаг, выпускаемый институтом "Микроб" в качестве эталонной культуры). Применение реакции нарастания титра фага для индикации чумных микробов основано на экспериментальном исследовании; пользуясь реакцией нарастания титра фага, за 3-31/2 ч удается обнаружить 1 млн. палочек чумы.
В качестве исследуемого материала могут быть использованы вода, кровь, отпечатки из органов, выделения из бубона. Материал сначала подращивают на средах, затем прибавляют генциан фиолетовый (1 мл 0,1 %-ный водно-спиртовой раствор на 100 мл среды), для подавления посторонней микрофлоры, а затем добавляют в пробирки разные концентрации фага.
↑ Лабораторная диагностика чумы
Серологические реакции в практике нашли широкое применение. Они используются при подозрительных на чуму заболеваниях для ретроспективного диагноза, при обследования природных источников чумы. С этой целью применяют иммуноферментную агглютинацию, реакцию пассивной гемагглютинации, реакции непрямой агглютинации. Экспресс-методом является люминесцентно-серологический, позволяющий обнаружить возбудителя в исследуемом материале через 2 ч.
ВНИМАНИЕ! САЙТ ЛЕКЦИИ.ОРГ проводит недельный опрос. ПРИМИТЕ УЧАСТИЕ. ВСЕГО 1 МИНУТА.
Микробиологическая диагностика чумы и туляремии
Перечень бактериологических лабораторий, проводящих исследования с особо опасными возбудителями заболеваний
1. Лаборатория отдела особо опасных инфекций центра ГосСанЭпидНадзора СПб. (Санкт-Петербург, Лиговский пр., 29)
2. Лаборатория особо опасных и вирусологических исследований (СПб, ул. Оборонная, д.35, лит.А).
3. Лаборатория особо опасных инфекций центр Гигиены и Эпидемиологии в Ленинградской области (Санкт-Петербург, ул. Ольминского, 27)
Перечень субъектов Российской Федерации, граничащих со странами,
на территории которых имеются активные природные очаги чумы – Республика Казахстан, Китайская Народная Республика, Монголия
| Субъект Российской Федерации | Страна, из которой существует угроза заноса чумы |
| Алтайский край Астраханская область Волгоградская область Курганская область Новосибирская область Омская область Оренбургская область Республика Алтай Самарская область Саратовская область Тюменская область Челябинская область | Республика Казахстан |
| Забайкальский край Республика Алтай Республика Бурятия Республика Тыва | Монголия |
| Амурская область Еврейская автономная область Забайкальский край Приморский край Хабаровский край | Китайская Народная Республика |
Правила взятия материала от больного с подозрением на чуму
Пунктат из бубона (везикул, пустул, карбункулов) берут шприцем емкостью не менее 5 мл. Кожу на участке, намеченном для прокола, обрабатывают 70 0 -ным спиртом, а затем смазывают 5%-ным раствором йода и вновь протирают 70 0 -ным спиртом. Иглу вводят с таким расчетом, чтобы ее острие достигло центральной части бубона, после чего, оттянув до отказа поршень, медленно вытягивают иглу. Так как экссудат в чумном бубоне расположен между плотными тканями, количество его, попадающее в шприц, как правило, незначительно и часто заполняет только просвет иглы. После извлечения иглы из бубона через нее набирают в шприц 0,5 мл стерильного питательного бульона (рН 7,2), содержимое выливают в стерильную пробирку и закрывают стерильной резиновой пробкой. Бульон можно набрать в шприц и до начала пункции. В качестве метода, повышающего возможность выделения культуры чумного микроба, и в случае невозможности получить материал, в бубон вводят 0,3-0,5 мл стерильного изотонического раствора натрия хлорида или питательного бульона. При вскрывшемся бубоне забирают материал отдельно из периферической плотной части и отделяемое свища. Обе порции исследуют раздельно.
При кожных поражениях иглу шприца вводят у края везикулы (пустулы) и затем продвигают к середине. У карбункулов и язв пунктируют плотный край.
Мокроту собирают в широкогорлые банки с притертой пробкой. Слизь из зева берут стерильным ватным тампоном по общепринятой методике.
Кровь забирают из локтевой вены в количестве 10 мл разовым шприцем и в нем доставляют кровь в лабораторию.
У больных чумой с локализацией первичных бубонов в области головы и шеи дополнительно забирают на исследование слизистое отделяемое ротовой полости и глотки стерильным ватным тампоном.
К каждой пробе прикладывают направление с указанием сведений о материале (Ф.,И.,О. больного, наименование пробы, дата и час забора материала), а также сопроводительный документ, в котором содержатся сведения о больном (Ф.,И.,О., предполагаемый диагноз, получал ли больной до взятия материала антибиотики, какие и в каком количестве, какой материал направляется на исследование).
Время от момента взятия материала до начала исследования не должно превышать 5-6 ч, если нет условий для его хранения на холоде.
Материал для исследования:
· при легочной форме чумы - мокрота, при ее отсутствии - мазок из зева, кровь из вены, моча;
· при септической форме - кровь, моча;
· при бубонной форме - пунктат бубона, кровь, моча;
· при кожной форме - отделяемое язвы, кровь, моча;
· при кишечной форме - кал, кровь, моча;
· при менингиальных явлениях - спинномозговая жидкость.
· секционный материал (кусочки органов трупа, кровь);
· живые грызуны; трупы грызунов; блохи грызунов;
· вода, воздух, загрязненные вещи, посуда, белье и так далее.
Задача:В лабораторию поступил материал от пациентов со схожими симптомами – главным из которых, был - наличие бубонов в шейной области. Материал из бубонов обоих пациентов был доставлен в лабораторию особо опасных инфекций.
Й этап
| Образец 1 | Образец 2 |
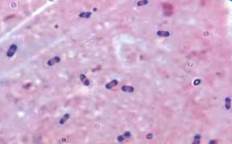 | 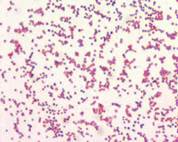 |
| Опишите морфологию возбудителя. Окраска по Граму, х100 | Опишите морфологию возбудителя. Окраска по Граму, х100 |
| Морфология клеток Y.pestis вакцинный штамм EV, УТС, ув.х80000 | |
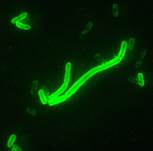 | 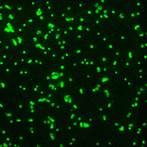 |
| Диагностикум с флюоресцирующими АТ к Y.pestis. Результат РИФ: | Диагностикум с флюоресцирующими АТ к Francisella tularensis. Результат РИФ: |
 Контроль(+) Образец 1 Образец2 | |
| Оцените результат реакции ПЦР |
Предположительный диагноз_________________________________________________
2 этап (2-5 часов от начала исследования):
выдача предварительного положительного ответана Y.pestis на основании наличия в мазках биполярно окрашенных грамотрицательных овоидных палочек, их специфического свечения при окраске мазка флюоресцирующими иммуноглобулинами, положительной ПЦР.
Исследование Образца 1 (подозрение на Y.pestis)
 |  |
| Оцените посев на кровяной агар | Оцените характер роста на сердечно-мозговом бульоне |
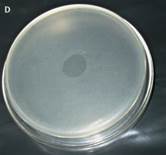 |  Образец Контроль(-) |
| Оцените результат пробы нативного материала с диагностическим бактериофагом Покровской и/или Л-413С к Y.pestis | Оцените результат латекс-агглютинационной тест-системы для выявления капсульного антигена F1 Y. pestis (при температуре 30 о С и выше Y.pestis синтезирует капсульный гликопротеид - фракцию 1 (антиген F1)). |
  Контроль (-) Образец | |
| Оцените результат биопрбы на животных (заражение внутрибрюшинно, подкожно и/или накожно). |
В качестве стимуляторов роста Y.pestis используют сульфит натрия в концентрации 1:4000 (1 мл 2,5 % раствора на 100 мл агара), гемолизированную кровь в концентрации 0,01-1 %, стимулятор роста чумного микроба из сарцин (стимулятор Карпузиди) согласно инструкции по применению препарата. В очагах, где циркулируют тиаминзависимые штаммы, в качестве стимулятора роста используют витамин B1 в концентрации 0,0001 мг на 100 мл среды или синтетическую среду 199 (3 мл на 100 мл среды).
Для подавления роста посторонней микрофлоры используют генцианвиолет в концентрации 1:100000-1:800000. Рабочую дозу определяют для каждой серии препарата перед обследовательским сезоном и указывают в паспорте на рабочий раствор генцианвиолета.
Помимо этого, для ингибирования посторонней флоры могут быть использованы теллурит калия в концентрации 1 300000, дезоксихолат натрия - 1 мг %, фосфомицин 50-100 мкг/мл.
3 этап (24-48 часов от начала исследования):
выдача подтверждения предварительного положительного ответа на основании наличия характерного роста на жидких и плотных питательных средах, наличия в мазках из этих сред грамотрицательных овоидных палочек с биполярным окрашиванием, положительной пробой с бактериофагами (лизис культуры чумными бактериофагами Покровской и Л-413С).
1.Исследованию подлежит: при легочной - мокрота, при ее отсутствии - мазок из зева,
кровь из вены, моча. Мокроту собирают в широкогорлые банки с притертой пробкой. Слизь из зева берут стерильным ватным тампоном по общепринятой методике. Кровь забирают из локтевой вены в количестве 10 мл.
2.Азопирамовая проба.
1.Приготовление исходного раствора. Для приготовления 1 л раствора азопирама отвешивают 100 г амидопирина и 1,0-1,5 г солянокислого анилина, смешивают их в сухой мерной посуде и доводят до объема 1 л (дм 3 ) 95% этиловым спиртом. Смесь тщательно перемешивают до полного растворения ингредиентов.
Исходный раствор азопирама следует хранить в плотно закрытом флаконе в темноте. Допустимый срок хранения при температуре 4"С (в холодильнике) - 2 месяца; при комнатной температуре (20±2°С) - не более 1 месяца.
2.Приготовление реактива азопирам. Перед постановкой пробы готовят реактив азопирам, смешивая равные объемные количества исходного раствора азопирама и 3% раствора перекиси водорода.
Реактив азопирам хранить не более 2 часов. При температуре выше +25°С раствор розовеет быстрее, поэтому его необходимо использовать в течение 30-40 мин.
Методика постановки пробы: наносят 2-3 капли реактива на изделие с помощью пипетки.
Качество очистки катетеров и других полых изделий оценивают путем введения реактива внутрь изделия с помощью чистого шприца или пипетки. Реактив оставляют внутри изделия на 1 мин, после чего сливают на марлевую салфетку. Количество реактива, вносимого внутрь изделия, зависит от его величины
При положительной азопирамовой пробе в присутствии следов крови немедленно или не позднее, чем через 1 мин появляется вначале фиолетовое, затем быстро, в течение нескольких секунд, переходящее в розово-сиреневое или буроватое окрашивание реактива.
Азопирам, кроме гемоглобина, выявляет наличие на изделиях остаточных количеств:
пероксидаз растительного происхождения; окислителей (хлорамина, стирального порошка с отбеливателем и др.); - ржавчины (окислов и солей железа). При наличии на исследуемых изделиях ржавчины и указанных окислителей наблюдается бурое окрашивание реактива, в остальных случаях происходит окрашивание в розово-сиреневый цвет.
При постановке азопирамовой пробы окрашивание реактива, наступившее позже, чем через 1 мин после постановки пробы, не учитывается.
3. Питание в больничных организациях здравоохранения должно соответствовать следующим требованиям:
при составлении меню-раскладок должны учитываться основные принципы составления меню диет; должно быть разнообразным;
должно соответствовать утвержденным нормам среднесуточного набора продуктов питания для одного пациента;
должно соответствовать лечебным показаниям по химическому составу, пищевой ценности, набору продуктов, режиму питания.
Ежедневно на кухне должен осуществляться отбор суточных проб каждого приготовленного блюда.
Отбор суточных проб приготовленных блюд должен проводиться ответственным лицом (заведующий производством, шеф-повар) в продезинфицированные емкости с крышками. Каждое приготовленное блюдо должно отбираться в отдельную емкость объемом 200 – 250 миллилитров. Супы, напитки (сладкие блюда), гарниры (каши, творожное, яичное блюда) отбирают в объеме не менее 100 миллилитров, мясные, рыбные блюда, холодные закуски (салаты) – в объеме не менее 70 – 100 граммов. Допускается не отбирать суточные пробы приготовленных блюд от партии менее 30 порций. Суточные пробы приготовленных блюд могут отбираться в уменьшенном объеме, но не менее чем 50 граммов, если это предусмотрено выходом блюда.
Суточные пробы приготовленных блюд должны храниться в холодильнике для готовой продукции в течение 24 часов при температуре +2 о – +6 о С.
По истечении срока хранения суточные пробы приготовленных блюд должны утилизироваться, емкости должны тщательно мыться с применением моющих средств и дезинфицироваться.
Выдача готовой пищи должна осуществляться после снятия пробы.
Оценку органолептических показателей и качества блюд должна проводить бракеражная комиссия, назначенная администрацией больничной организации здравоохранения.
При неудовлетворительных результатах бракеража блюдо к выдаче не допускается.
Транспортировка готовой пищи в буфетные помещения отделений должна производиться в условиях, исключающих ее загрязнение, с соблюдением температурного режима.
Хлеб должен транспортироваться в условиях, исключающих его загрязнение.
Доставка пищи к палатам должна проводиться с использованием специально выделенных тележек.
При хранении пищевых продуктов в холодильниках отделения и тумбочках пациентов должны соблюдаться правила и сроки годности (хранения) пищевых продуктов. Хранение пищевых продуктов с истекшим сроком годности (хранения), без указания фамилии пациента при хранении в общем холодильнике отделения, а также имеющих признаки порчи запрещается.
4. В приемной ЦСО осуществляют проверку, сортировку и регистрацию изделий и материалов, доставляемых из отделений в стерилизационных коробках или мягкой упаковке с соответствующей маркировкой упаковки (названия или номера отделения).
Использованные ИМН должны доставляться в ЦСО после обеззараживания. Белье должно приниматься из отделений в чистом, высушенном, упакованном для стерилизации виде. Шовный и перевязочный и другие виды расходных материалов поступает из отделений в подготовленном для стерилизации виде. Прием изделий и материалов для стерилизации должен производиться по графику, составленному с учетом режима работы основных структурных подразделений.
Хранение принимаемых из отделений ИМН проводится в помещении приемной на стеллажах, шкафах или столах с отдельно выделенными и промаркированными полками по числу отделений. Стеллажи должны иметь гигиеническое покрытие. Влажная уборка и дезинфекция стеллажей производится ежедневно после их освобождения. В помещении для предстерилизационной подготовки проводят ПСО инструментов.
В упаковочной проводят упаковку сухих изделий и материалов и их маркировку. Упакованные в мягкие виды упаковки изделия и материалы должны накапливаться в сетчатых корзинах или поддонах. Перемещение подготовленных к стерилизации контейнеров (биксов), упаковок из мягких материалов должно производиться с использованием транспортных тележек.
По окончании стерилизации изделия выгружают из стерилизаторов в стерильной зоне стерилизационной и перевозят в места хранения стерильных изделий. Хранение производится на стеллажах, укрытых стерильными простынями. На время остывания простерилизованных изделий запрещено сквозное проветривание. Перевод простерилизованных изделий и материалов в экспедицию производится при положительных результатах контроля качества стерилизации всей загрузки наружными и внутренними химическими индикаторами.
В экспедиции осуществляют: прием, осмотр, регистрацию, сортировку и комплектование по заявкам отделений стерилизованных изделий; выдачу стерильных изделий и материалов.
При выдаче стерильные изделия и материалы осматривают на отсутствие повреждений упаковки. В ЦСО должна быть обеспечены возможность хранения минимального суточного запаса стерильных изделий и материалов. Срок хранения простерилизованных изделий и материалов на складе и в экспедиции включается в общий срок хранения.
Результаты проводимого контроля качества ПСО, стерилизации должны регистрироваться после каждого цикла обработки в учетной медицинской документации.
5. Пунктат из бубона (везикул, пустул, карбункулов) берут шприцем 5 мл. Кожу на участке, намеченном для прокола, обрабатывают 70 0 -ным спиртом, а затем смазывают 5%-ным раствором йода и вновь протирают 70 0 -ным спиртом. Иглу вводят с таким расчетом, чтобы острие достигло центральной части бубона, затем, оттянув до отказа поршень, медленно вытягивают иглу (количество, попадающее в шприц, незначительно и часто заполняет только просвет иглы). После извлечения иглы из бубона через нее набирают в шприц 0,5 мл стерильного питательного бульона
(рН 7,2), содержимое выливают в стерильную пробирку и закрывают стерильной резиновой пробкой. В случае невозможности получить материал, в бубон вводят 0,3-0,5 мл стерильного 0,9 % р-ра натрия хлорида или питательного бульона. При вскрывшемся бубоне забирают материал из периферической плотной части и отделяемое свища. Обе порции исследуют раздельно.
При кожных поражениях иглу шприца вводят у края везикулы (пустулы) и затем продвигают к середине. У карбункулов и язв пунктируют плотный край. У больных чумой с локализацией первичных бубонов в области головы и шеи дополнительно забирают на исследование слизистое отделяемое ротовой полости и глотки стерильным ватным тампоном.
Дата публикования: 2015-02-03 ; Прочитано: 1174 | Нарушение авторского права страницы
studopedia.org - Студопедия.Орг - 2014-2020 год. Студопедия не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования (0.003 с) . 
Читайте также:


