Питательный агар для культивирования и выделения возбудителя бруцеллеза
Глава 29. Возбудители бруцеллеза
В 1886 г. Д. Брюс в селезенке больного, погибшего от мальтийской лихорадки, обнаружил маленькую коккобактерию, которую выделил в чистой культуре и назвал Micrococcus.
В 1896 г. Б. Банг из околоплодной жидкости при аборте коров также выделил коккобактерии. В 1914 г. Ж. Траум выделил подобную палочку от больных свиней. А в 1916 г. Ивенс, изучив все выделенные микроорганизмы, определила их схожесть и в честь Брюса они были названы бруцеллами. В дальнейшем (1953, 1957, 1966) были открыты и другие виды бруцелл. Все они объединены в род Brucella.
В настоящее время бруцеллы подразделяют на виды по признаку их основного хозяина: В. melitensis - болеет мелкий рогатый скот (овцы, козы); В. abortus - болеет крупный рогатый скот; В. suis - болеют свиньи и т. д.
Каждый вид бруцелл подразделяют на биовары: В. melitensis включает 3 биовара; В. abortus - 9 биоваров; В. suis - 5 биоваров. Наиболее патогенным для человека является В. melitensis. B. abortus редко вызывают клиническое проявление заболевания у человека.
Морфология. Возбудители бруцеллеза мелкие 0,6-0,8 × 0,3-0,5 мкм бактерии палочковидной или овоидной формы. Неподвижны. Спор не имеют. Образуют нежную капсулу. Грамотрицательны. В мазке располагаются беспорядочно.
Культивирование. Бруцеллы - аэробы. Прихотливы к питательным средам. Характеризуются замедленным ростом (2-3 нед). Выращивают их на специальных питательных средах: сывороточно-декстрозном агаре, на агаре из картофельного настоя с сывороткой и кровяным агаром (5% овечьей крови), среде "Д", печеночном агаре МПА и МПБ. Растут они при температуре 37° С и рН 6,8-7,2. Некоторые штаммы требуют для роста 5-10% СО2, особенно при первоначальном выделении. На плотных питательных средах вырастают нежные, мелкие, бесцветные, выпуклые с перламутровым блеском колонии в S-форме. Под влиянием некоторых факторов они могут диссоциировать в R-форму. Под действием антибиотиков у них возникают L-формы. В жидких питательных средах бруцеллы дают равномерную муть. Бруцеллы можно культивировать в желточном мешке куриного эмбриона.
Дифференцируют виды бруцелл на основании их способности образовывать сероводород и расти на средах с красителями - основным фуксином и тионином (табл. 44).
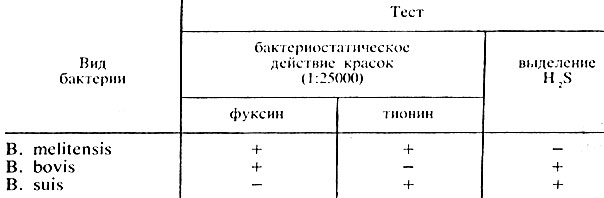
Таблица 44. Биологические свойства бруцелл
Ферментативные свойства. Бруцеллы расщепляют D-рибозу, D-галактозу, аланин, аспарагин. Некоторые штаммы гидролизуют аминокислоты с образованием аммиака.
Бруцеллы образуют гиалуронидазу, каталазу, пероксидазу, липазу, фосфатазу и др. Бруцеллы обладают выраженными инвазивными и агрессивными свойствами.
Токсинообразование. Патогенное действие бруцелл определяется, по-видимому, наличием эндотоксина. Кроме того, они обладают аллергенными свойствами.
Антигенная структура. Бруцеллы содержат два соматических антигена А и М. Эти антигены являются видоспецифичными. Они всегда входят в состав микробной клетки, но в разных соотношениях. У В. melitensis преобладает антиген М, у В. abortus и В. suis - антиген А. Кроме того, у них выявлен термолабильный Vi-антиген.
Устойчивость к факторам окружающей среды. При 100° С бруцеллы погибают мгновенно. При температуре 80-85° С - через 5 мин, при 60° С - через 30 мин. К низким температурам они очень устойчивы. Прямые солнечные лучи действуют на них губительно. Во влажной среде бруцеллы сохраняются длительно - 3-4 мес. В молочных продуктах - до 40-45 дней, замороженном мясе - до 5 мес, почве и воде - до 3-5 мес.
Восприимчивость животных. Бруцеллезом болеют в основном сельскохозяйственные животные: мелкий и крупный рогатый скот, свиньи, олени и др. Каждый вид бруцелл поражает определенный вид животного. Но бруцеллы могут мигрировать, т. е. переходить от одного вида животного другому. Например, В. abortus могут поражать мелкий рогатый скот.
Основными признаками заболевания являются: у самок - аборты, у самцов - орхиты. Кроме того, у них бывает поражение суставов, похудание, выпадение шерсти и т. д. Но бруцеллез у животных может протекать в скрытой форме, что способствует распространению инфекции.
Из экспериментальных животных к бруцеллам чувствительны белые мыши и морские свинки. После заражения они абортируют, резко худеют, у них выпадает шерсть. У мышей иногда развивается септицемия.
Источники инфекции. Основным источником заболевания бруцеллезом людей являются мелкий и крупный рогатый скот. Роль человека в передаче бруцеллезной инфекции эпидемиологического значения не имеет.
Пути передачи. Пищевой, контактно-бытовой, воздушно-капельный.
Контактный путь - при работе с животными: в процессе ухода за животными, на предприятиях, перерабатывающих сырье и продукты животного происхождения; при соприкосновении с выделениями больных животных, плодом, в процессе убоя, разделки туши и т. д.
Аэрогенным путем бруцеллы проникают в кожу и неповрежденные слизистые оболочки.
Пищевой путь - употребление зараженных пищевых продуктов. Наиболее опасны молочные продукты - молоко, брынза и т. д.
Патогенез. Попав в организм, бруцеллы по лимфатическим путям проникают в лимфатические узлы, кровь, костный мозг, паренхиматозные органы и локализуются внутри клеток. При обострении процесса бруцеллы из клеток вновь попадают в кровь и возникает рецидив. Заболевание характеризуется воспалением суставов, невралгией и естественными абортами.
Иммунитет - обусловливается клеточными (фагоцитоз) и гуморальными факторами - агглютининами, комплементсвязывающими антителами и др. Иммунитет сочетается с состоянием аллергии. В опытах на морских свинках было показано, что устойчивость к повторному заражению у них сочеталась с положительной реакцией к бруцеллину.
Профилактика. Плановые обследования в животноводческих хозяйствах, на пастбищах, в убойных пунктах, на мясных и молочных комбинатах.
Специфическая профилактика. Вакцинация живой вакциной В. abortus (штамм 19-ВА). Прививки проводят накожным методом однократно, ревакцинируют через 8-12 мес.
Лечение. Антибиотики: левомицетин, эритромицин. Для предупреждения рецидивов используют также бруцеллезный иммуноглобулин.
1. Какие Вы знаете виды бруцелл и какой из них патогенен для человека?
2. На каких средах культивируют бруцеллы и чем характеризуется их рост на средах?
3. С чем связано патогенное действие бруцелл?
Цель исследования: выявление возбудителя бруцеллеза.
Работу с бруцеллами проводят в строго режимных условиях.
2. Спинномозговая жидкость.
5. Грудное молоко.
6. Секционный материал.

Способы сбора материала

Ход исследования

Ход исследования
1. В каких условиях проводят работу с материалом, полученным от больного бруцеллезом?
2. Какой материал служит для диагностического исследования?
3. Перечислите основные методы исследования.
4. На каких животных ставят биологическую пробу?
Сывороточно-декстрозный агар. Основой этой среды является питательный агар, который готовят следующим образом: к 835 мл дистиллированной воды добавляют 15 г агар-агара, 10 г пептона, 5 г х. ч. хлорида натрия и 165 мл мясной воды. Все ингредиенты вводят в сосуд и подвергают обработке текучим паром в течение часа. Устанавливают рН 7,8. Затем сосуд ставят в автоклав, при 2 атм, температуре 120° С выпадают фосфаты. Среду фильтрют через бумажные фильтры, устанавливают рН 7,4, разливают в мерную посуду и стерилизуют при температуре 116° С в течение 15 мин. Заготовленный таким образом агар по мере надобности расплавляют на водяной бане и охлаждают до 50° С. Затем к нему добавляют нормальную инактивированную (при 56° С 30 мин) лошадиную или бычью сыворотку и раствор декстрозы, простерилизованный путем фильтрации через фильтр Зейтца. Окончательная концентрация сыворотки должна быть 5% и декстразы - 1%.
Кровяной агар. См. главу 7.
Среда "Д": а) бульон "Д" - к 100 мл холодной дистиллированной воды добавляют 2,5 г порошка стандартного бульона "Д", прогревают и тщательно размешивают до полного его растворения; затем бульон фильтруют, разливают в необходимую посуду и стерилизуют при 120° С в течение 20 мин (рН среды 7,1-7,2); б) агар "Д" - к 100 мл холодной дистиллированной воды добавляют 20 г порошка стандартного агара "Д", прогревают при помешивании до полного растворения порошка, не допуская его подгорания, затем фильтруют, разливают в необходимую посуду и стерилизуют при 120° С в течение 20 мин (рН среды 7,2). Среды готовит Институт эпидемиологии и микробиологии имени Н. Ф. Гамалея АМН СССР.
Окраска бруцелл по Шуляку-Шин. Мазок фиксируют на пламени, окрашивают 2 минуты карболовым фуксином Циля, разведенным водой 1:5, промывают водой, окрашивают 5 минут 2%-ным водным раствором метиленового синего, промывают водой. Микроскопическая картина: бруцеллы — красные, другие бактерии имеют синий цвет.
Окраска бруцелл по Кюстеру. Препарат фиксируют на пламени, окрашивают 60 секунд щелочным раствором сафранина, промывают водой, обрабатывают 15 секунд 0,05%-ным раствором серной кислоты, тщательно промывают водой, окрашивают 15-20 секунд 3%-ным водным раствором метиленового синего. Микроскопическая картина: бруцеллы — красные, другие бактерии синего цвета.
Микроскопическое исследование исходного материала
Из поступившего материала готовят мазки, окрашивают их по Граму и одним из специальных методов (по Козловскому, Стампу и т.д.), а также бруцеллезными люминесцирующими сыворотками.
В препаратах, окрашенных по методу Грама, бруцеллы имеют форму мелких, коротких, коккоподобных или палочковидных грамотрицательных бактерий, размером 0,5-0,7х0,6-1,5 мкм, истинной капсулы не образуют, расположены одиночно, реже — парами, короткими цепочками или небольшими группами.
Для бруцелл характерно более медленное окрашивание и отдача красителя при промывании водой или обработке слабыми растворами кислот по сравнению с другими видами бактерий, что позволило ряду авторов предложить дифференциальные методы окраски клеток возбудителя.
Окраска бруцелл по Е.В. Козловскому. Мазок фиксируют на пламени, окрашивают 2%-ным водным раствором сафранина 2 минуты с подогреванием до появления пузырьков, затем промывают водой и докрашивают 0,75-1%-ным водным раствором бриллиантовой или малахитовой зелени (или метиленового синего) в течение 1-2 минут, споласкивают водой. Микроскопическая картина: бруцеллы — ярко-красные, другие бактерии — зеленого или синего цвета.
Окраска бруцелл по Стампу (модифицированный метод Циля- Нильсена). Мазок фиксируют на пламени, окрашивают фуксином Пфейффера в течение 10 минут, промывают водой, обрабатывают
30 секунд 0,5%-ным водным раствором уксусной кислоты, промывают водой, окрашивают 20-30 секунд 1%-ным водным раствором метиленового синего, промывают водой. Микроскопическая картина: бруцеллы — красные, прочие бактерии имеют синий цвет.
Приготовление щелочного раствора сафранина (ex tempore). Смешивают 5 капель 3%-ного водного раствора сафранина и 1,5 мл нормального раствора КОН (5,6 г на 100 мл воды).
Иммунолюминесцентное выявление бруцелл проводят прямым или непрямым способом.
Культивирование.Обычно исследуемый материал засевают в пробирку с жидкой и в несколько пробирок (5-10) — с агаровой питательной средой (мясо-пептонный печеночный бульон, мясо-пептонный-печеночно-глюкозный-глицериновый бульон, альбими-бульон, аналогичные агаровые среды, сывороточнокартофельный агар, сывороточно-декстрозный агар). Бруцеллы хорошо растут на кровяном агаре (5-10%). Загрязненный материал высевают на сывороточно-декстрозный агар с ингибиторами (рекомендация Объединенного комитета экспертов ФАО/ВОЗ по бруцеллезу): генцианвиолет 1:200 тыс. или кристаллический фиолетовый 1:100 тыс., уксуснокислый натрий (0,25 мг/мл) или паранитрофенилглицерин (0,005-0,007%).
Бруцеллы — аэробы или микроаэрофилы. Температурный оптимум 37°С, диапазон - 20-40°С, оптимум рН 6,6-7,4. Микроаэрофильные свойства проявляют В. abortus и В. ovis. Поскольку не известно, какой вид бруцелл присутствует в исследуемом материале от крупного рогатого скота, то половину пробирок с посевами инкубируют в условиях обычной атмосферы, вторую — в атмосфере с повышенным содержанием СО2 (10-12%). Посевы при исследовании на наличие В. ovis инкубируют только в атмосфере СО2. В первой генерации бруцеллы обладают замедленным ростом, поэтому посевы культивируют, периодически просматривая, до 30 дней. Подготовка и исследование различных материалов имеют некоторые особенности.
При исследовании абортированного плода производят посев тканевого гомогената или пастеровскими пипетками непосредственно из органов. Посевы делают из экссудата грудной и брюшной полостей, содержимого желудка, крови сердца, печени, селезенки, легких. При посеве из паренхиматозных органов выбирают участки с фокусами некрозов, кровоизлияниями.
Для изготовления тканевого гомогената кусочки паренхиматозных органов обжигают, растирают в ступке со стерильным кварцевым песком и физиологическим раствором (1:10), гомогенат высевают на среды. Аналогичным образом подготавливают для посева материал, взятый при диагностическом убое животных.
При осмотре плаценты отбирают участки с утолщенными ворсинками и стенками, с наличием гнойного экссудата. Поверхность плаценты обрабатывают тампонами с дезинфектантами, просушивают стерильными тампонами, прижигают выбранный участок, вырезают необходимые фрагменты, измельчают, как было описано выше, и высевают на среды с ингибиторами.
Порции молока из каждой четверти вымени центрифугируют при 1000-3000 об/мин в течение 10-20 минут. Посев производят из осадка и слоя сливок на селективные среды. Рекомендуется исследовать пробы молока, взятые от животного несколько раз с интервалом 5-10 суток.
Мочу (75-100 мл) перед посевом на питательные среды центрифугируют при 3000 об/мин в течение 10 минут и осадок высевают на селективные среды. Возможна концентрация бруцелл путем добавления к моче бруцеллезной агглютинирующей сыворотки (1-2%) с титром не менее 1:800. После непродолжительного инкубирования мочу центрифугируют и осадок высевают на питательные среды.
Эффективен посев в жировые куриные яйца при исследовании крови, мочи и других материалов, содержащих малое количество возбудителя. Используют свежие куриные яйца (3-5 дней). На каждый материал берут 3-5 яиц. Исследуемый материал в количестве 0,2 мл вводят в желточный мешок, инкубируют при 37° С в течение пяти суток, вскрывают, набирают пастеровскими пипетками белок и желток и высевают на плотные и жидкие питательные среды (методика Одесского ИМ имени И.И. Мечникова).
Кровь высевают сразу после взятия в жидкие питательные среды с антикоагулянтом (2%-ный цитрат натрия). В 100 мл среды засевают около 20 мл крови. В качестве питательной среды используют бульон Альбими, триптозный бульон, среду Первушина, МПБ с 1% глюкозы и 2-3% глицерина. Хорошие результаты получаются при посеве на комбинированные среды (метод Кастанеда). Например, в колбе (пробирке) скашивают агар (ППГГА), добавляют какую-либо жидкую питательную среду, чтобы она покрывала половину поверхности агара, и в нее засевают кровь (П.А. Триленко 1976). Через 4-6 дней культивирования поверхность агара увлажняют жидкой средой и в последующем периодически просматривают с целью обнаружения колоний бруцелл.
Характер роста бруцелл на питательных средах.Колонии бруцелл появляются на поверхности плотных питательных сред на 5-10-е, реже — на 20-25-е сутки. В первичных посевах формируются, как правило, колонии S-формы: бесцветные, круглые, выпуклые, с ровными краями, гладкой маслянистой поверхностью, полупрозрачные, диаметр колоний в зависимости от типа питательной среды от 0,1-0,7 до 2,0-2,5 мм и более. По мере старения колонии теряют прозрачность, мутнеют и темнеют за с 1ст появления пигмента. На ППГГА в проходящем свете колонии имеют ян-гарный оттенок.
При изучении колоний в косопроходящем пучке света они имеют зеленовато-серо-голубой цвет с небольшим красновато-желтым центром.
При исследовании материала от животных с хроническим течением бруцеллеза могут быть выделены бруцеллы в R-форме, отличающиеся не только по форме, но особенно по характеру свечения колоний.
В жидких питательных средах бруцеллы растут с равномерным помутнением среды, медленным появлением небольшого, голубоватого в проходящем свете пристеночного кольца или кольца и поверхностной пленки. На дне пробирки постепенно образуется рыхлый осадок.
Морфология и тинкториальные свойства клеток бруцелл в культуре.Из подозрительных колоний делают мазки, окрашивают по Граму, Козловскому. Клетки бруцелл в культуре не отличаются по морфологии от клеток возбудителя в исходном материале (см. выше), жгутиков не имеют.
Если испытуемая культура дает положительную РА (два креста и более) с обеими или любой одной диагностической сывороткой и отрицательный результат с физиологическим раствором, то ее относят к бруцеллам.
Оценка результатов РА проводится при условии, что R- и S-сыворотки дают в контролях с гомологичными антигенами агглютинацию интенсив ностью минимум на три креста, при отсутствии реакции с гетерологичными антигенами. Агглютинация с R-сывороткой происходит замедленно, с ней всегда реагируют культуры В. ovis и В. canis.
Бруцеллы не обладают подвижностью, образуют каталазу, обычно ок-сидазу (кроме В. ovis и В. neotomae) и уреазу (кроме В. ovis и некоторых штаммов В. melitensis), редуцируют нитраты, не образуют индол.
Наставлением по диагностике бруцеллеза животных (2000) в РФ предусмотрено использование полимеразной цепной реакции.
Идентификация бруцелл на уровне вида и биовара.Критерии дифференциации видов и биоваров бруцелл представлены в таблицах.
Определение вида и биовара выделенной культуры бруцелл дает возможность более детально проводить эпизоотологический и эпидемиологический анализ.
Разработанные методы дифференциации видов бруцелл предполагают работу с бруцеллами в S-форме (кроме В.ovis и В. canis), поэтому перед проведением таких исследований проверяют популяцию на диссоциацию методом окраски колоний кристаллвиолетом по Уайту-Вильсону. Для этого готовят взвесь 48-часовой изучаемой агаровой культуры в стерильном физиологическом растворе концентрацией 0,5-1 млрд. микробных клеток в 1 мл по бруцеллезному стандарту мутности. Одну каплю взвеси засевают последовательно шпателем на поверхность агаровой среды в трех чашках Петри.
Посевы инкубируют 5 суток при 37-38°С. При таком методе посева на плотной среде вырастает достаточно большое количество изолированных колоний бруцелл. В чашки Петри с колониями осторожно пастеровской пипеткой наливают рабочий раствор кристаллвиолета 1 тонким слоем. Через пять минут краситель осторожно отсасывают пипеткой и сливают в емкость с дезраствором. Затем колонии изучают при помощи стереоскопического микроскопа.
Диссоциированные колонии имеют цвет от темно-фиолетового до светло-синего, S-колонии окрашиваются в светло-желтый, реже — в светло-зеленый цвет. Для изучения отвивают несколько колоний в
S-форме.
Питательный агар для культивирования и выделения возбудителя бруцеллеза, сухой. Набор реагентов для бактериологических исследований.
Описание
Набор реагентов состоит из одной банки с Бруцеллагаром и 12 флаконов с селективными добавками (СД 1 и СД 2).
Бруцеллагар представляет собой смесь сухих компонентов в виде мелкодисперсного гигроскопичного порошка светло-коричневого цвета.
СД 1: 6 флаконов с полимиксином В сульфат – мелкодисперсный порошок белого цвета.
СД 2: 6 флаконов с афотерицином В – пористая масса желтого цвета.
Бруцеллагар выпускается в полиэтиленовых банках по 250 г, СД 1 и СД 2 во флаконах по 0,005 г и 0,01 г соответственно.
Совокупность компонентов, входящих в состав среды, обеспечивает питательные потребности для роста бруцелл и др. высокотребовательных микроорганизмов.
Бруцеллагар представляет собой смесь сухих компонентов из расчета, г/л:
| Панкреатический гидролизат рыбной муки (ПГРМ) …………………… | 7,5 |
| Пептон мясной ……………………………………………………………. | 7,5 |
| Панкреатический гидролизат казеина (ПГК) …………………………….. | 10,0 |
| Стимулятор роста гемофильных микроорганизмов ……………………… | 5,0 |
| Дрожжевой экстракт ………………………………………………………. | 3,0 |
| Д-глюкоза …………………………………….……………………………. | 2,0 |
| Натрий хлористый …………………………………………………………. | 3,5 |
| Тиамина хлорид ….……………………………………………..………… | 0,005 |
| meso-Erythritol ……………………………………………………………. | 0,01 |
| Натрий пиросернистокислый (натрия метабисульфит) …………..…….. | 0,1 |
| Агар микробиологический …………………………………….…………… | 10,0±3,0 |
| СД 1, г/л: | |
| Полимиксина В сульфат …………………………………………………. | 0,005 |
| СД 2, г/л: | |
| Амфотерицин В …………………………………………………………… | 0,01 |
Бруцеллагар Оболенск обеспечивает рост бруцелл не позднее 72 ч инкубации при температуре (37±1)°С и подавляет рост эшерихий и грибов.
Объекты исследований в клинической микробиологии.
7.1 Приготовление Бруцеллагара для культивирования бруцелл.
Препарат в количестве, указанном на этикетке, тщательно размешивают в 1 л дистиллированной воды, кипятят в течение 3 мин до полного расплавления агара и стерилизуют автоклавированием при температуре 121 °С в течение 15 мин.
7.2 Приготовление Бруцеллагара с селективными добавками для выделения бруцелл.
Для приготовления 1 л среды с селективными добавками во флаконы с СД 1 и СД 2 наливают по 5 мл дистиллированной воды, вносят в стерильный, охлажденный до температуры 50-55 °С Бруцеллагар (п. 7.1), тщательно перемешивают и разливают в чашки Петри.
Готовая питательная среда непрозрачная коричневого цвета с темно-коричневыми вкраплениями.
Готовую среду можно использовать в течение 7 сут после её приготовления при условии хранения при температуре 2-8 °С.
7.4. Исследуемый материал вносят соответственно на две чашки Петри с Бруцеллагаром с СД и равномерно распределяют микробную взвесь покачиванием чашек по всей поверхности. Инкубируют при температуре (37±1) °С в течение 72 ч.
Учет результатов проводят не позднее 72 ч инкубации визуально учитывая наличие и характер роста бруцелл — выпуклые, гладкие, бесцветные, мутноватые, круглые колонии диаметром 1,0-1,5 мм.
Отмечают отсутствие роста тест-штаммов E.coli и C. albicans на чашках Петри со средой Бруцеллагар и наличие роста на контрольных средах.
Для получения достоверных результатов посевы образцов производить не менее чем в трех повторностях.
Набор реагентов необходимо хранить в герметично закрытой упаковке при температуре от 2 до 30 С. СД хранят при температуре 2-8 °С.
Срок годности набора реагентов: Бруцеллагара – 2 года, СД 1 и СД 2 – не менее срока годности среды. Среда с истекшим сроком годности использованию не подлежит. После вскрытия банки с Бруцеллагаром гарантируется соответствие требуемым параметрам при соблюдении условий хранения (влажность, температура, герметичность) до окончания срока годности.
Для получения надежных результатов необходимо строгое соблюдение настоящей инструкции по применению.
Окраска бруцелл по Шуляку-Шин. Мазок фиксируют на пламени, окрашивают 2 минуты карболовым фуксином Циля, разведенным водой 1:5, промывают водой, окрашивают 5 минут 2%-ным водным раствором метиленового синего, промывают водой. Микроскопическая картина: бруцеллы — красные, другие бактерии имеют синий цвет.
Окраска бруцелл по Кюстеру. Препарат фиксируют на пламени, окрашивают 60 секунд щелочным раствором сафранина, промывают водой, обрабатывают 15 секунд 0,05%-ным раствором серной кислоты, тщательно промывают водой, окрашивают 15-20 секунд 3%-ным водным раствором метиленового синего. Микроскопическая картина: бруцеллы — красные, другие бактерии синего цвета.
Микроскопическое исследование исходного материала
Из поступившего материала готовят мазки, окрашивают их по Граму и одним из специальных методов (по Козловскому, Стампу и т.д.), а также бруцеллезными люминесцирующими сыворотками.
В препаратах, окрашенных по методу Грама, бруцеллы имеют форму мелких, коротких, коккоподобных или палочковидных грамотрицательных бактерий, размером 0,5-0,7х0,6-1,5 мкм, истинной капсулы не образуют, расположены одиночно, реже — парами, короткими цепочками или небольшими группами.
Для бруцелл характерно более медленное окрашивание и отдача красителя при промывании водой или обработке слабыми растворами кислот по сравнению с другими видами бактерий, что позволило ряду авторов предложить дифференциальные методы окраски клеток возбудителя.
Окраска бруцелл по Е.В. Козловскому. Мазок фиксируют на пламени, окрашивают 2%-ным водным раствором сафранина 2 минуты с подогреванием до появления пузырьков, затем промывают водой и докрашивают 0,75-1%-ным водным раствором бриллиантовой или малахитовой зелени (или метиленового синего) в течение 1-2 минут, споласкивают водой. Микроскопическая картина: бруцеллы — ярко-красные, другие бактерии — зеленого или синего цвета.
Окраска бруцелл по Стампу (модифицированный метод Циля- Нильсена). Мазок фиксируют на пламени, окрашивают фуксином Пфейффера в течение 10 минут, промывают водой, обрабатывают
30 секунд 0,5%-ным водным раствором уксусной кислоты, промывают водой, окрашивают 20-30 секунд 1%-ным водным раствором метиленового синего, промывают водой. Микроскопическая картина: бруцеллы — красные, прочие бактерии имеют синий цвет.
Приготовление щелочного раствора сафранина (ex tempore). Смешивают 5 капель 3%-ного водного раствора сафранина и 1,5 мл нормального раствора КОН (5,6 г на 100 мл воды).
Иммунолюминесцентное выявление бруцелл проводят прямым или непрямым способом.
Культивирование.Обычно исследуемый материал засевают в пробирку с жидкой и в несколько пробирок (5-10) — с агаровой питательной средой (мясо-пептонный печеночный бульон, мясо-пептонный-печеночно-глюкозный-глицериновый бульон, альбими-бульон, аналогичные агаровые среды, сывороточнокартофельный агар, сывороточно-декстрозный агар). Бруцеллы хорошо растут на кровяном агаре (5-10%). Загрязненный материал высевают на сывороточно-декстрозный агар с ингибиторами (рекомендация Объединенного комитета экспертов ФАО/ВОЗ по бруцеллезу): генцианвиолет 1:200 тыс. или кристаллический фиолетовый 1:100 тыс., уксуснокислый натрий (0,25 мг/мл) или паранитрофенилглицерин (0,005-0,007%).
Бруцеллы — аэробы или микроаэрофилы. Температурный оптимум 37°С, диапазон - 20-40°С, оптимум рН 6,6-7,4. Микроаэрофильные свойства проявляют В. abortus и В. ovis. Поскольку не известно, какой вид бруцелл присутствует в исследуемом материале от крупного рогатого скота, то половину пробирок с посевами инкубируют в условиях обычной атмосферы, вторую — в атмосфере с повышенным содержанием СО2 (10-12%). Посевы при исследовании на наличие В. ovis инкубируют только в атмосфере СО2. В первой генерации бруцеллы обладают замедленным ростом, поэтому посевы культивируют, периодически просматривая, до 30 дней. Подготовка и исследование различных материалов имеют некоторые особенности.
При исследовании абортированного плода производят посев тканевого гомогената или пастеровскими пипетками непосредственно из органов. Посевы делают из экссудата грудной и брюшной полостей, содержимого желудка, крови сердца, печени, селезенки, легких. При посеве из паренхиматозных органов выбирают участки с фокусами некрозов, кровоизлияниями.
Для изготовления тканевого гомогената кусочки паренхиматозных органов обжигают, растирают в ступке со стерильным кварцевым песком и физиологическим раствором (1:10), гомогенат высевают на среды. Аналогичным образом подготавливают для посева материал, взятый при диагностическом убое животных.
При осмотре плаценты отбирают участки с утолщенными ворсинками и стенками, с наличием гнойного экссудата. Поверхность плаценты обрабатывают тампонами с дезинфектантами, просушивают стерильными тампонами, прижигают выбранный участок, вырезают необходимые фрагменты, измельчают, как было описано выше, и высевают на среды с ингибиторами.
Порции молока из каждой четверти вымени центрифугируют при 1000-3000 об/мин в течение 10-20 минут. Посев производят из осадка и слоя сливок на селективные среды. Рекомендуется исследовать пробы молока, взятые от животного несколько раз с интервалом 5-10 суток.
Мочу (75-100 мл) перед посевом на питательные среды центрифугируют при 3000 об/мин в течение 10 минут и осадок высевают на селективные среды. Возможна концентрация бруцелл путем добавления к моче бруцеллезной агглютинирующей сыворотки (1-2%) с титром не менее 1:800. После непродолжительного инкубирования мочу центрифугируют и осадок высевают на питательные среды.
Эффективен посев в жировые куриные яйца при исследовании крови, мочи и других материалов, содержащих малое количество возбудителя. Используют свежие куриные яйца (3-5 дней). На каждый материал берут 3-5 яиц. Исследуемый материал в количестве 0,2 мл вводят в желточный мешок, инкубируют при 37° С в течение пяти суток, вскрывают, набирают пастеровскими пипетками белок и желток и высевают на плотные и жидкие питательные среды (методика Одесского ИМ имени И.И. Мечникова).
Кровь высевают сразу после взятия в жидкие питательные среды с антикоагулянтом (2%-ный цитрат натрия). В 100 мл среды засевают около 20 мл крови. В качестве питательной среды используют бульон Альбими, триптозный бульон, среду Первушина, МПБ с 1% глюкозы и 2-3% глицерина. Хорошие результаты получаются при посеве на комбинированные среды (метод Кастанеда). Например, в колбе (пробирке) скашивают агар (ППГГА), добавляют какую-либо жидкую питательную среду, чтобы она покрывала половину поверхности агара, и в нее засевают кровь (П.А. Триленко 1976). Через 4-6 дней культивирования поверхность агара увлажняют жидкой средой и в последующем периодически просматривают с целью обнаружения колоний бруцелл.
Характер роста бруцелл на питательных средах.Колонии бруцелл появляются на поверхности плотных питательных сред на 5-10-е, реже — на 20-25-е сутки. В первичных посевах формируются, как правило, колонии S-формы: бесцветные, круглые, выпуклые, с ровными краями, гладкой маслянистой поверхностью, полупрозрачные, диаметр колоний в зависимости от типа питательной среды от 0,1-0,7 до 2,0-2,5 мм и более. По мере старения колонии теряют прозрачность, мутнеют и темнеют за с 1ст появления пигмента. На ППГГА в проходящем свете колонии имеют ян-гарный оттенок.
При изучении колоний в косопроходящем пучке света они имеют зеленовато-серо-голубой цвет с небольшим красновато-желтым центром.
При исследовании материала от животных с хроническим течением бруцеллеза могут быть выделены бруцеллы в R-форме, отличающиеся не только по форме, но особенно по характеру свечения колоний.
В жидких питательных средах бруцеллы растут с равномерным помутнением среды, медленным появлением небольшого, голубоватого в проходящем свете пристеночного кольца или кольца и поверхностной пленки. На дне пробирки постепенно образуется рыхлый осадок.
Морфология и тинкториальные свойства клеток бруцелл в культуре.Из подозрительных колоний делают мазки, окрашивают по Граму, Козловскому. Клетки бруцелл в культуре не отличаются по морфологии от клеток возбудителя в исходном материале (см. выше), жгутиков не имеют.
Если испытуемая культура дает положительную РА (два креста и более) с обеими или любой одной диагностической сывороткой и отрицательный результат с физиологическим раствором, то ее относят к бруцеллам.
Оценка результатов РА проводится при условии, что R- и S-сыворотки дают в контролях с гомологичными антигенами агглютинацию интенсив ностью минимум на три креста, при отсутствии реакции с гетерологичными антигенами. Агглютинация с R-сывороткой происходит замедленно, с ней всегда реагируют культуры В. ovis и В. canis.
Бруцеллы не обладают подвижностью, образуют каталазу, обычно ок-сидазу (кроме В. ovis и В. neotomae) и уреазу (кроме В. ovis и некоторых штаммов В. melitensis), редуцируют нитраты, не образуют индол.
Наставлением по диагностике бруцеллеза животных (2000) в РФ предусмотрено использование полимеразной цепной реакции.
Идентификация бруцелл на уровне вида и биовара.Критерии дифференциации видов и биоваров бруцелл представлены в таблицах.
Определение вида и биовара выделенной культуры бруцелл дает возможность более детально проводить эпизоотологический и эпидемиологический анализ.
Разработанные методы дифференциации видов бруцелл предполагают работу с бруцеллами в S-форме (кроме В.ovis и В. canis), поэтому перед проведением таких исследований проверяют популяцию на диссоциацию методом окраски колоний кристаллвиолетом по Уайту-Вильсону. Для этого готовят взвесь 48-часовой изучаемой агаровой культуры в стерильном физиологическом растворе концентрацией 0,5-1 млрд. микробных клеток в 1 мл по бруцеллезному стандарту мутности. Одну каплю взвеси засевают последовательно шпателем на поверхность агаровой среды в трех чашках Петри.
Посевы инкубируют 5 суток при 37-38°С. При таком методе посева на плотной среде вырастает достаточно большое количество изолированных колоний бруцелл. В чашки Петри с колониями осторожно пастеровской пипеткой наливают рабочий раствор кристаллвиолета 1 тонким слоем. Через пять минут краситель осторожно отсасывают пипеткой и сливают в емкость с дезраствором. Затем колонии изучают при помощи стереоскопического микроскопа.
Диссоциированные колонии имеют цвет от темно-фиолетового до светло-синего, S-колонии окрашиваются в светло-желтый, реже — в светло-зеленый цвет. Для изучения отвивают несколько колоний в
S-форме.
Читайте также:


