Окраска метиленовым синим на хеликобактер
- Пищеварение
- Питание
- Методы обследования
- Обследование больных с длительным субфебрилитетом
- Обязательные исследования, предшествующие трансфузии крови и её препаратов
- Эзофагогастродуоденоскопия
- Колоноскопия
- Эндоскопическая ретроградная холангиопанкреатография
- Биопсия печени
- Лапароскопия
- Лучевые методы диагностики
- Другие методы исследования
- Функциональные тесты
- Гастроинтестинальные гормоны
- Диагностика helicobacter pylori
- Гастроэнтерологические проблемы у лиц пожилого возраста
- Диспепсия
- Желудочно-кишечные кровотечения
- Острые боли в животе
- Пищевод
- Желудок и
12-перстная кишка
- Печень
Обязательными тестами для определения Helicobacter pylori являются гистологический и уреазный.
Цитологическое исследование
Для цитологического исследования используются мазки-отпечатки (1-2 и более), полученные при эндоскопии из биоптатов слизистой оболочки (СО) антрального отдела желудка. Биоптат берется прицельно из участков с наиболее выраженными визуальными отклонениями от нормы (гиперемия, отек), но не из дна язв и эрозий. Высушенные мазки окрашиваются.
При изучении в цитологических препаратах можно выделить три степени обсеменённости слизистой оболочки: слабая <+) — до 20. средняя (++) — до 40, высокая (+++) — более 40 микробных тел в поле зрения при увеличении х360.
При обнаружении в мазках-отпечатках Helicobacter pylori выявляется также и клеточная инфильтрация, характеризующаяся наличием лимфоцитов, плазматических клеток, нейтрофилией и эозинофилией.
По преобладанию тех или иных клеточных элементов можно косвенно судить об активности и выраженности воспаления, кроме того, цитологическое исследование позволяет выявить в клетках слизистой оболочки наличие пролиферативных процессов и слепень их выраженности, метаплазии (кишечной в желудке и желудочной в дуоденуме), дисплазии и её степени тяжести, злокачественного новообразования. Однако цитологический метод не дает информации о структуре исследуемой слизистой оболочки.
Уреазный тест
По скорости выявления персистирующей Helicobacter pylori в слизистой оболочке цитологическому не уступает уреазный экспресс-метод, основанный на уреазной активности Helicobacter pylori. Teст состоит из геля-носителя, содержащего мочевину, бактериостатический агент и фенол-рол в качестве индикатора рН. Индикатор меняет цвет от желтого к малиновому, когда под действием уреазы происходит гидролиз мочевины с образованием аммиака, сдвигающего рН среды в щелочную сторону. Биоптат слизистой оболочки, полученный при эндоскопии, помещают в тест, Малиновое окрашивание теста, наступившее вслед за этим, свидетельствует о наличии в биоптате Helicobacter pylori. Изменение цвета среды происходит только в том случае, если в биоптате присутствует уреаза, выделенная Helicobacter pylori. Время изменения окраски теста косвенно свидетельствует о количестве жизнеспособных бактерий. Появление малинового окрашивания в течение первого часа соответствует значительной инфицированности слизистой оболочки Helicobacter pylori (+++), в течение последующих двух часов— умеренной (++), к концу суток - незначительной (+). Если же окрашивание наступает в более поздние сроки — результат считается отрицательным
Ложноотрицательные результаты имеют место у больных при слабой обсемененности слизистой оболочки. Ложные результаты исключаются при правильной обработке эндоскопов и биопсийных щипцов, Для повышения достоверности диагностики геликобактериоза рекомендуется сочетание обоих, гистологического и уреазного, методов, особенно важно их проведение не ранее чем через четыре недели после окончания антибактериального лечения, так как наличие персистирующей инфекции является основанием к проведению повторного курса комбинированной антигеликобактерной терапии.
13 С уреазный дыхательный тест
Метод неинвазивен, абсолютно безопасен, позволяет определять степень колонизации слизистой оболочки желудка Helicobacter pylori и является оптимальным для контроля эрадикационной терапии. Исследование проводится натощак, Вначале в пластиковые пробирки с интервалами в 1 мин берутся две фоновые пробы выдыхаемого воздуха. Затем принимается внутрь легкий пробный завтрак (молоко, сок и др.) и тестовый субстрат (водный раствор мочевины, меченной 13 С ). В последующем в течение часа через 15 мин берутся четыре пробы выдыхаемого воздуха.
Содержание стабилизированного изотопа в выдыхаемом воздухе определяется с помощью масс-спектрометра, В соответствии с этим рассматриваются 4 степени инфицированности Helicobacter pylori: легкая — менее 3.5%, средняя — 3,5-6,4%, тяжелая — 6,5-9.4%, крайне тяжелая — более 9,5%. В норме содержание стабилизированного изотопа 13С не превышает 1% общего количества С0 2 в выдыхаемом воздухе.
Дополнительные методы диагностики Helicobacter pylori
Микробиологический метод.
Материалом исследования для микробиологической диагностики Helicobacter pylori являются биоптаты из слизистой оболочки желудка или двенадцатиперстной кишки, полученной в условиях максимальной стерильности. Инкубация посевов осуществляется я в микроаэрофильных условиях при содержании кислорода не более 5%. Такие условия создаются путем заполнения герметически закрывающихся сосудов газовой смесью (5% кислорода, 10% углекислого газа, 85% азота), при использовании специальных газогенераторных химических пакетов. На кровяной питательной среде геликобактер на 3-5 сут. формирует мелкие круглые, гладкие, прозрачные, росинчатые колонии диаметром 1—3 мм,
В дальнейшем проводится идентификация выделенных культур, определяются их морфологические, тинкториальные свойства, чувствительность к антибиотикам, подвижность и приводятся другие специальные исследования в зависимости от возможностей и задач, стоящих перед исследователем. Воспользоваться этим методом в условиях обычной лаборатории довольно трудно.
Гистологические методы
Гистологические методы получили широкое распространение, так как позволяют быстро обнаружить Helicobacter pylori в биоптатах и одновременно изумить морфологические изменения в слизистой оболочке. Наиболее простым и доступным метолом выявления Helicobacter pylori является окраска по Гимзе без дифференцировки. Helicobacter pylori при этом окрашиваются в темно-синий цвет, они хорошо видны как на поверхности эпителия, так и в глубине ямок. Для оценки состояния слизистой оболочки и обнаружения Helicobacter pylori достаточно двух биоптатов.
Материалом может служить любой участок слизистой оболочки желудка и двенадцатиперстной кишки, но при этом обязательно следует исследовать прицельно взятые биоптаты из антрального отдела в 2—3 см от привратника из участка визуально более выраженного воспаления (гиперемия, отёк). но не из дна эрозии и язвы. Частота выявления Helicobacter pylori с помощью гистологического метода хорошо корригирует с другими методами и составляет не менее 75-80%, Результативность метода зависит от многих факторов, в том числе и от способа приготовления и окраски препарата, В последнее время разработаны новые методы, среди которых наиболее чувствителен им муноцитохимический с применением моноклональных антител и комплекса авидин-биотин-пироксидазы.
Весьма обнадеживающие результаты получены при выявлении Helicobacter pylori методом гибридизации ДНК в обычных парафиновых срезах. Методика не только чувствительна, но и высокоспецифична, с ее помощью можно идентифицировать различные штаммы геликобактера и понять природу повторного обнаружения Helicobacter pylori после успешного лечения (новая ли это инфекция или размножение сохранившихся бактерий).
Иммунологические методы.
У всех больных, инфицированных Helicobacter pylori, в слизистой оболочке желудка и соответственно в двенадцатиперстной кишке образуются антитела. Специфический гуморальный иммунный ответ против антигенов геликобактера отчетливо регистрируется через 3—4 недели после инфицирования. Антитела могут быть определены различными методами (в реакции преципитации и др.), но наибольшее значение имеет метод иммуноферментного анализа (ИФА). Этим тестом выявляются антитела IgG, IgA, IgM классов в сыворотке крови, а также секреторные IgA. IgM в слюне и содержимом желудка. В практике используют ИФА по определению IgG и реже IgA-антител в сыворотке крови.
Этот метод в основном используется с целью выявления инфицированности больных с гастродуоденальной патологией и контроля эффективности антибактериального лечения в отдаленные сроки наблюдения. Преимущество метода состоит в том, что он выявляет факт инфицирования не только при манифестных, но и при субклинических формах, а также в стадии ремиссии заболевания. Следует также иметь в виду, что тест остается положительным еще не менее месяца после успешной ликвидации Helicobacter pylori, а на ранней стадии, в течение 2—3 недель с момента инфицирования, тест оказывается отрицательным.
В настоящее время в практику внедряются более совершенные методы определения Helicobacter pylori: полимеразная цепная реакция (ПЦР), определение антигена в кале и др.

Рисунок 21. Helicobacter pylori в биоптате слизистой оболочки желудка. Окраска по Гимзе, х 1000
Биохимические тесты выявления Helicobacter pylori (HP)
Для ускорения диагностики предлагаютсяинвазивные методики, дающие результат непосредственно во время исследования. Из них можно назвать такие биохимические тесты, как промышленно выпускаемые системы CLO- тест, Кампи-тест, Хелпил-тест и др.
Они основаны на способности Helicobacter pylori разрушать мочевину с образованием аммиака и углекислого газа. При этом в случае внесения биоптата в раствор мочевины с индикатором типа фенолрот меняется окраска раствора. Несмотря на высокую чувствительность, эти тесты могут давать отрицательные результаты в связи с отсутствием Helicobacter pylori в биоптате. В последнее время для повышения чувствительности исследования предложены иммунологические тесты, выполняемые непосредственно на слизистой желудка о время эндоскопии. Во время эндоскопии на слизистую наносят специальные антисыворотки против Helicobacter pylori или раствор мочевины с индикатором и по изменению окраски слизистой судят о наличии микроорганизма.
Значительно более простым и эффективным способом диагностики хеликобактериоза считается использованиенеинвазивных биохимических и иммунологических тестов.
Биохимические методы диагностики хеликобактериоза в настоящее время распространяются повсеместно. Они основаны на способности Helicobacter pylori расщеплять мочевину. Для исследования используется мочевина, меченная изотопами углерода С 13 и С 14 . Это так называемые уреазные дыхательные тесты.
При их проведении пациент после пробного завтрака получает 20,0 воды, содержащей мочевину, меченную изотопом углерода. Спустя 10, 20, 30, 40, 60, 80, 100, 120 минут пациент выдыхает воздух в специальный сосуд, содержащий вещества, связывающие выдыхаемый углекислый газ, или на специальную пластину. В зависимости от количества выделяемого меченного углекислого газа судят о наличии или отсутствии HP на слизистой желудка. Диагностическая чувствительность и специфичность данных тестов превышает 95%. Однако работа с мочевиной, меченной С 13 и С 14 . требует очень дорогого оборудования (до 250000 долларов США), а изотоп С 14 обладает радиоактивностью. Близкие методики предполагают использование мочевины, содержащей изотоп азота N 15 . По выделяемому с мочой меченному азоту в течение 2 часов получают результат исследования. Чувствительность этого метода составляет 96% при 100% специфичности.
В настоящее время в широкую практику входит уреазный дыхательный тест с использованием нерадиоактивной мочевины. В выдыхаемом пациентом воздухе автоматически определяется уровень аммиака, а не радиоактивного азота. Газоанализаторная аппаратура для этого исследования выпускается в нашей стране и отличается низкой ценой при высокой чувствительности и портативности.
Используемая в настоящее время диагностическая система Pronto Dry позволяет выявлять инфицированность Helicobacter pylori непосредственно при выполнении эндоскопического исследования в течение 5 минут. Для этого достаточно нанести на слизистую желудка специальный реактив и по изменению окраски судить о наличии или отсутствии Helicobacter pylori.
Биохимические методики диагностики хеликобактериоза в настоящее время считаются наиболее удобными для скрининг-диагностики и оценки эффективности эрадикации Helicobacter pylori.
ПЦР-диагностика
ПЦР (полимеразная цепная реакция) представляет собой многократно повторяющиеся циклы синтеза (амплификации) специфической области ДНК-мишени в присутствии термостабильной ДНК-полимеразы, дезоксинуклеотидтрифосфатов, соответствующего солевого буфера и олигонуклеотидных затравок-праймеров, которые определяют границы амплифицируемого участка.
Каждый цикл состоит из трех стадий с различными температурными режимами. На первой стадии при +94°C происходит разделение цепей ДНК, затем при +56°С - +60°C - присоединение (отжиг) праймеров к комплементарным последовательностям на ДНК-мишени, и при температуре +72°C протекает синтез новых цепей ДНК путем достраивания цепей праймеров в направлении 5` -3`.
В каждом цикле происходит удвоение числа копий амплифицируемого участка, что позволяет за 25-40 циклов наработать фрагмент ДНК, ограниченный парой выбранных праймеров, в количестве, достаточном для ее детекции с помощью электрофореза или альтернативными ему технологиями.
В мире накоплен обширный клинико-лабораторный опыт по использованию метода ПЦР (полимеразная цепная реакция) для выявления ДНК Н.pylori в биопсийном материале. Высокие показатели чувствительности и специфичности ПЦР делают этот метод во многом революционным в лабораторной диагностике.

Группа компаний "Униконс"
Продвижение и реализация пищевых добавок, антисептиков и другой продукции НПО Альтернатива.

"Бесплатные образцы"
Комплексные пищевые добавки "Униконс".
Для всех отраслей пищевой промышленности!

"Петритест"
Микробиологические экспресс-тесты. Первые результаты уже через 4 часа.
- Вы здесь:
- Библиотека технолога
![]()
- Пиво и напитки
![]()
- Г.С. Качмазов - Дрожжи бродильных производств
4. МЕТОДЫ ОКРАСКИ МИКРООРГАНИЗМОВ И ЦИТОХИМИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ ДРОЖЖЕЙ
4.1. ПРОСТАЯ ОКРАСКА МИКРООРГАНИЗМОВ
Мазок, т. е. каплю эмульсии микроорганизмов, помещенную на предметное стекло, высушивают и фиксируют над пламенем горелки. Подготовленный препарат заливают 1–2 каплями краски (метиленовой синью Леффлера или фуксином Пфейфера), выдерживают 0,5–1 мин и смывают дистиллированной водой.
4.2. ОКРАСКА СПОР ДРОЖЖЕЙ
4.2.1. МЕТОД ВИРТЦА
Фиксированный на пламени препарат заливают 5%-ным водным раствором малахитового зеленого и 3–4 раза прогревают до появления паров (30–60 с). Окраску можно проводить, выдерживая препарат 3–5 мин в растворе малахитового зеленого, подогретого до 80°С. Затем препарат промывают 30 с в проточной воде и докрашивают 30 с 0,5%-ным водным раствором сафранина.
Зрелые аскоспоры окрашиваются в сине-зеленый, а вегетативные клетки – в красный цвета.
Аскоспоры дрожжей родов Hansenula, Schizosaccharomyces могут удерживать оба красителя.
4.2.2. КАРБОЛ-ФУКСИНОВАЯ ОКРАСКА
Вариант 1. Фиксированный на пламени препарат заливают раствором Циля (10 см 3 насыщенного спиртового раствора основного фуксина с 90 см 3 5%-ного фенола) и нагревают 2–5 мин до появления паров. Затем проводят обесцвечивание препарата, погружая его в 2%-ный раствор молочной кислоты или в 95%-ный этанол, содержащий 1 мл концентрированной НСl в 100 см 3 .
Препарат промывают в воде и докрашивают 3–5 мин 1%-ными растворами метиленового синего или нильского голубого.
Зрелые аскоспоры окрашиваются в красный, вегетативные клетки – в синий цвета.
Аскоспоры рода Schizosaccharomyces, а также после набухания аскоспоры дрожжей родов Hansenula и Pichia не обладают кислотоустойчивостью и окрашиваются в синий цвет.
Вариант 2. Фиксированный препарат окрашивают в течение 2–3 мин карболовым фуксином при подогревании над пламенем горелки, затем краску сливают и препарат обесцвечивают соляной кислотой со спиртом (две части 10%-ного раствора соляной кислоты и одна часть 96%-ного спирта) в течение 30 с, промывают водой и окрашивают в течение 1–2 мин метиленовой синью.
Споры окрашиваются в красный цвет, а вегетативные клетки – в синий.
4.3. ОПРЕДЕЛЕНИЕ ГЛИКОГЕНА В КЛЕТКАХ ДРОЖЖЕЙ
Гликоген – одно из резервных веществ дрожжевых клеток. Он накапливается в цитоплазме и окрашивается раствором Люголя в коричневый или красно-бурый цвет. Наблюдения за содержанием гликогена в клетках дрожжей проводят в динамике развития культуры.
Содержание гликогена в клетках
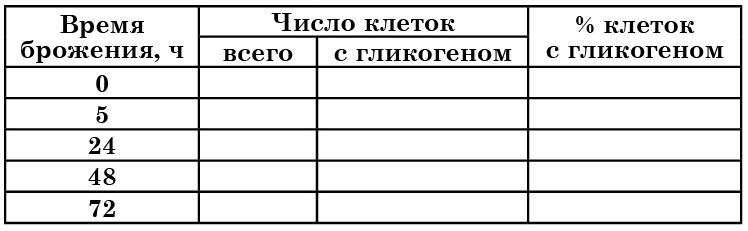
Полученные данные можно регистрировать в предлагаемой таблице 4.
Если препарат нагреть до 60°С, окраска гликогена исчезает, а при охлаждении препарата она вновь восстанавливается.
4.4. ОКРАСКА ВОЛЮТИНА
4.4.1. ПО МЕТОДУ ОМЕЛЯНСКОГО
На предметном стекле готовят тонкий мазок из культуры исследуемых дрожжей, высушивают на воздухе и фиксируют на пламени горелки. Мазок окрашивают карболовым фуксином 30–40 с и промывают водой. Далее мазок дифференцируют, погружая его в склянку с 1%-ным раствором серной кислоты на 20–30 с и немедленно промывают водой. Серная кислота обесцвечивает цитоплазму, а зерна волютина остаются окрашенными фуксином. Препарат докрашивают метиленовым синим (1:40) 20–30 с, промывают водой, высушивают на воздухе и микроскопируют, пользуясь объективом МИ-90.
На препарате зерна волютина окрашены в красный цвет, цитоплазма клетки – в голубой.
4.4.2. ПО МЕТОДУ ЛЕФФЛЕРА
Тонкий фиксированный мазок культуры исследуемых дрожжей окрашивают метиленовым синим Леффлера в течение 3 мин. Мазок промывают водой, не высушивая, покрывают его покровным стеклом и микроскопируют, пользуясь объективом ВИ-60.
На препарате зерна волютина окрашены в красновато-фиолетовый цвет, цитоплазма – в голубой.
Для более ясной дифференциации зерен волютина под покровное стекло полоской фильтровальной бумаги протягивают каплю 1%-ного раствора серной кислоты. При этом зерна волютина сохраняют окраску, а цитоплазма обесцвечивается.
Обратный результат можно получить, добавляя под покровное стекло каплю 5%-ного раствора соды. Волютиновые зерна обесцвечиваются, а цитоплазма клетки сохраняет голубой цвет.
4.5. ОКРАСКА МИКРООРГАНИЗМОВ ПО ГРАМУ
Препарат, фиксированный в пламени горелки или обработанный метиловым спиртом, покрывают раствором генцианвиолета на 1–2 мин, затем обрабатывают в течение 1–2 мин раствором Люголя, промывают водой и быстро опускают в 96%-ный этиловый спирт. В спирте препарат держат до тех пор, пока от него не перестанет отходить краска. После этого препарат вновь промывают водой и окрашивают разбавленным фуксином Пфейфера в течение 0,5–1 мин.
Грамположительные бактерии окрашиваются в темно-фиолетовый цвет, грамотрицательные – в красный.
Метод применяется исключительно для окраски бактерий и не эффективен при окрашивании дрожжей, ввиду принципиальных отличий в строении клеточной стенки.
Метиленовый синий (насыщенный спиртовой раствор). К 100 см 3 96%-ного этилового спирта прибавляют 10 г метиленового синего (в порошке) и оставляют стоять несколько дней (при этом несколько раз встряхивают), затем раствор фильтруют.
Метиленовый синий 1:40.
(насыщенный спиртовый раствор) 1 см 3
Вода дистиллированная. 40 см 3
Метиленовый синий щелочной (синька Леффлера). В 100 см 3 дистиллированной воды растворяют 30 см 3 насыщенного спиртового раствора метиленового синего и 1 см 3
1%-ного раствора едкого кали.
Разбавленная синька (по Финку). Готовят три раствора: 0,09 г фосфорнокислого натрия (N2HPO4) растворяют в 500 см 3 дистиллированной воды; 13,6 г фосфорнокислого калия (KH2PO4) растворяют в 500 см 3 дистиллированной воды; 0,1 г метиленового синего растворяют в 500 см 3 дистиллированной воды.
Для приготовления рабочего раствора синьки смешивают 0,25 см 3 первого раствора с 99,75 см 3 второго и 100 см 3 раствора синьки, рН раствора должно быть 4,6.
Основной фуксин. 2 г сухой краски и 20 см 3 96%-ного этилового спирта встряхивают и оставляют стоять несколько дней, получается насыщенный спиртовой раствор.
Карболовый фуксин (по Цилю). 10 см 3 насыщенного спиртового раствора основного фуксина растворяют в 100 см 3 5%-ного раствора карболовой кислоты (фенола).
Разбавленный фуксин (по Пфейферу). Для окраски микроорганизмов применяют раствор разбавленного в 10 раз карболового фуксина.
Малахитовый зеленый (водный насыщенный раствор).
Малахитовый зеленый. 5 г
Дистиллированная вода. 100 см 3
Для окраски спор лучше брать спиртово-водный раствор.
Малахитовый зеленый. 5 г
Спирт этиловый, 96°. 20 см 3
Дистиллированная вода. 80 см 3
Сафранин (водный раствор).
2,5%-ный раствор сафранина
в 96%-ном этаноле . 10 см 3
Вода дистиллированная. 100 см 3
Насыщенный спиртовой раствор генцианвиолета (для окраски по Граму).
1 г сухой краски растворяют в 10 см 3 96%-ного спирта и смешивают со 100 см 3
5%-ного раствора карболовой кислоты; для достижения прозрачности добавляют несколько капель спирта.
Растворы йода в йодистом калии (по Люголю).
Раствор Люголя для окраски по Граму. Для приготовления раствора Люголя 1 г кристаллического йода растирают в фарфоровой ступке с 2 г йодида калия и порциями (по 5 см 3 ) добавляют дистиллированную воду до полного растворения кристаллического йода в йодиде калия. После полного растворения кристаллов объем доводят до 300 см 3 . Приготовленный раствор Люголя хранят в посуде из темного стекла (на свету раствор Люголя быстро обесцвечивается).
Раствор Люголя для выявления гранулезы.
Кристаллический йод. 1 г
Йодид калия . 2 г
Дистиллированная вода. 100 см 3
Гранулеза в клетках окрашивается в темно-синий цвет.
Раствор Люголя для выявления гликогена.
Кристаллический йод. 7 г
Йодид калия . 20 г
Дистиллированная вода. 100 см 3
Гликоген приобретает красно-бурую окраску.
Техника приготовления растворов для выявления гранулезы и гликогена такая же, как раствора Люголя для окраски по Граму.
Раствор туши.
Жидкая натуральная тушь. 10 см 3
Дистиллированная вода. 90 см 3
Раствор центрифугируют 15–20 мин. Верхний слой отсасывают (пипеткой), переносят в пробирку и автоклавируют 30 мин при 0,05 МПа (температура 110°С).
Можно раствор туши сразу после смешивания автоклавировать 30 мин при давлении 0,05 МПа. После автоклавирования раствор отстаивают две недели, после чего его можно использовать.
Черная тушь. 15 см 3
Раствор тимерсола
в соотношении 1:1000. 30 см 3
На черном фоне капсулы видны как светлый ореол вокруг клетки.
Helicobacter pylori
Многочисленные серологические тесты, основанные на обнаружении иммуноглобулина G (IgG), широко доступны для диагностики H. pylori. Определять IgM и IgA не рекомендуется поскольку. H. pylori является хронической инфекцией.
Диагностическая точность серологических методов диагностики инфекции H. pylori варьируется в зависимости от продолжительности воздействия H. pylori, перекрестной антигенности с другими распространенными антигенно родственными бактериями, такими как Campylobacter, разнообразием штаммов H. pylori в разных регионах, от антигена, используемого в коммерческом наборе, иммунного ответа хозяина, степени гастрита и обсемененности H. pylori [ 50 ].
Серологические тесты часто используются для скрининга в эпидемиологических исследованиях из-за их не дороговизны, быстроты и приемлемы для пациентов. Серологические тесты следует использовать для первичной диагностики H. pylori [22].
Колонизация H. pylori вызывает системный иммунный ответ. Через 3-4 недели после инфицирования в крови больных появляются антитела к H. pylori. Эти антитела определяются путем иммуноферментного анализа (ИФА). Поскольку инфекция является хронической и ее спонтанный клиренс невозможен, то положительные серологические тесты у нелеченых пациентов указывают на наличие текущей инфекции. Специфичность метода 93-94%, чувствительность 59-71% [ 51 ].
Преимуществом серологического метода для первичной диагностики
H. pylori является возможность его использования у лиц, принимающих ИПП и антибиотики [4], а так же после состоявшегося желудочно-кишечного кровотечения и при атрофии слизистой оболочки желудка. Все перечисленные ситуации ассоциированы со снижением бактериальной
Helicobacter pylori
13С-уреазный дыхательный тест ( 13 C-УДТ) для выявления H. pylori впервые был разработан и применен Дэвидом Грэмом в 1987 году [ 53 ]. С 1996 года FDA (Food and Drug Administration) в США и EMA (European Medicines Agency) в Европе разрешили применять 13 С-УДТ в клинических целях. В 2000 году (Маастрихт II-2000) 13 С-УДТ был принят в качестве
Метод 13 С-УДТ основан на способности H. pylori продуцировать фермент уреазу, которая в желудке гидролизует мочевину до NH4+ и HCO3- с последующим образованием диоксида углерода и аммиака. Уреаза является ферментом с абсолютной субстратной специфичностью и способна катализировать превращение только одного вещества, т.е. катализирует гидролиз только мочевины [ 55 ].
13С-УДТ является неинвазивным методом диагностики H. pylori. Основным реагентом в данном тесте является водный раствор мочевины, обогащенной изотопом углерода 13 С, в которой 12 С-атом углерода заменён
на 13 С-изотоп. При наличии в желудке H. pylori продуцируемая бактерией уреаза расщепляет поступившую в желудок 13 С-мочевину на аммиак и 13 С- углекислый газ, который затем всасывается в кровь, попадает в лёгкие и выводится с выдыхаемым воздухом, изменяя в нем соотношение 13 С/ 12 С в сторону увеличения 13 С, которое регистрируется на приборе (Рисунок 6). Если в желудке H. pylori отсутствует, то 13 С-мочевина в неизмененном виде всасывается в кровь и выделяется из организма почками через несколько часов. Таким образом, по появлению в выдыхаемом воздухе 13 С мы с высокой точностью можем определить инфицирован ли пациент H. pylori, а по величине соотношения 13 С/ 12 С можно дать оценку степени инфицированности.
Процедура проведения теста (Рисунок 7). Исходно проводится сбор выдыхаемого пациентом воздуха в специальный герметичный пакет №1. Затем пациент выпивает 200 мл тестового раствора, состоящего из лимонного сока (также может использоваться апельсиновый, грейпрутовый сок) и раствора мочевины меченной изотопом углерода 13 С. Сам раствор мочевины без вкуса и запаха, его прием не сопровождается никакими неприятными ощущениями, аллергических реакций не вызывает. Затем в течение получаса следует находиться в спокойном состоянии, чтобы на результаты исследования не повлиял углекислый газ, выделяющийся при физической нагрузке. Через 30 минут производится забор второй пробы воздуха в пакет №2, который также герметично закрывается. Затем пробы воздуха анализируют на инфракрасном спектрометре, который определяет изотопное соотношение 13 С/ 12 С. Если пациент инфицирован H. pylori, то во второй пробе воздуха появится увеличенное количество 13 СО2 по сравнению с его содержанием в первой (контрольной) пробе.
Прирост меченного CO2 выражается как дельта по сравнению с исходным значением (DOB). Обычно в качестве критерия присутствия инфекции H. pylori используют DOB 2,0‰ более. Было показано, что значение DOB положительно коррелируют с бактериальной нагрузкой H. pylori [ 56 ]. Чувствительность 13 C-УДТ составляет 96%, специфичность - 93%
Были описаны множество вариаций УДТ, в которых была изменена доза, время, состав субстрата, использование адъювантов, тестовые приемы пищи, тип детектора разных производителей и было показано, что все методики эффективны [ 58 ].
Ложноположительные результаты редки, но могут наблюдаться после выполнения ЭГДС с биопсией непосредственно перед тестом, у больных, перенесших резекцию желудка, а также при значительном снижении секреции желудка. Ложноположительные тесты чаще всего вызывают гидролиз мочевины бактериями в ротовой полости или бактериями, содержащими уреазу в желудке [ 60 ]. Это особенно вероятно в присутствии ахлоргидрии или гипохлоргидрии. Небольшое количество ложноотрицательных может быть связано с нарушением методики взятия и хранения проб выдыхаемого воздуха, физической нагрузкой накануне и в процессе выполнения теста. Как и при большинстве других тестов, достоверный результат УДТ может быть получен после 2-недельной отмены ИПП и не ранее, чем через 4 недели после прекращения приема антибиотиков и препаратов висмута. Консенсус Маастрихт V оценивает УДТ с меченой мочевиной как лучший способ диагностики H. pylori с высокой чувствительностью и специфичностью, и отличной производительностью, как для первичной диагностики инфекции, так и для оценки эффективности эрадикации.
Определение антигена Helicobacter pylori в кале
Анализ кала на антиген H. pylori (Helicobacter pylori stool antigen – HpSA-test) - это другой неинвазивный метод диагностики с высокой чувствительностью (94%) и специфичностью (97%) [22]. Для проведения этого исследования необходима небольшая порция стула, причем пробы могут храниться при температуре -20°С неограниченно долго. Существует два варианта исследования: иммуноферментный анализ (ИФА) и иммунохроматографический анализ (ИХА) с использованием поликлональных антител (ПА) или моноклональных антител (МА).
В 1997 году появился первый анализ кала на антиген с поликлональными антителами. В настоящее время для анализа используются моноклональные антитела. Тесты на основе МА более точны, а ИФА обеспечивают более надежные результаты, чем ИХА [ 63 ]. Наряду с 13 С-УДТ моноклональный тест на основе ИФА рекомендован как для первичной диагностики H. pylori, так и для контроля эрадикации [4]. Моноклональный антиген в кале является удобным и эффективным тестом для диагностики H. pylori у детей [ 64 ]. Кроме того, исследование антигена H. pylori можно применять для эпидемиологических исследований и программ скрининга в виду относительно невысокой стоимости исследования и оборудования [29].
Причинами ложноотрицательных результатов могут являться неравномерное распределение антигена в каловых массах, разрушение антигена при замедлении эвакуации каловых масс (запоры), желудочно- кишечное кровотечение. Ложноотрицательные результатов могут быть вызваны низкой колонизацией бактерий в желудке, что приводит к низкой концентрации антигенов H. pylori в фекалиях и неспособности реагировать в тесте [ 65 ].
Диагностическая точность HpSA-теста, особенно чувствительность, снижается при кровотечении из верхних отделов желудочно-кишечного тракта, приеме ингибиторов протонной помпы в течение 2-х недель, антибактериальных препаратов в течение последнего месяца, наличия атрофии и метаплазии желудочного эпителия, а отрицательный результат теста должен подтверждаться дальнейшими диагностическими методами [ 66 ].
Helicobacter pylori
4.1. Методы, рекомендованные для первичной диагностики инфекции Helicobacter pylori
Основными задачами, стоящими перед врачом, являются диагностика
H. pylori, подбор эффективной схемы терапии и, в дальнейшем, оценка эффективности проведенного лечения. При выборе метода тестирования H. pylori необходимо, в первую очередь, учитывать его чувствительность и специфичность. Каждый из этих тестов, если он правильно выполнен, гарантирует высокую точность диагностики, и положительный результат в каждом из этих тестов является показанием к эрадикационной терапии.
БУТ обеспечивает быстрый результат с возможностью начать лечение без задержки; гистологическое обследование обеспечивает оценку состояния слизистой оболочки желудка, которую можно динамически контролировать.
Культуральный метод имеет самую высокую специфичность, но чувствительность метода снижается в виду того что требуется особая осторожность при обращении с образцом слизистой оболочки желудка. Культуральный метод является методом выбора для тестирования чувствительности H. pylori к антибиотикам и имеет решающее значение для выбора адекватной эрадикационной терапии, учитывая высокую устойчивость H. pylori к антибиотикам в настоящее время.
Диагностическая точность серологического метода с определением антител IgG к H. pylori, при правильном проведении, сопоставима с гистологическим методом, неинвазивными тестами, но не позволяет заключить, является ли инфекция H. pylori текущей в настоящее время или была в прошлом.
Все тесты, используемые для обнаружения H. pylori, должны рассматриваться индивидуально, учитывая их преимущества и недостатки в различных клинических ситуациях и их выполнение должно проводиться соответствующим образом. При выборе метода исследования и интерпретации полученных результатов должны учитываться особые состояния, такие как кровотечение при язвенной болезни, атрофический гастрит с или без кишечной метаплазии, влияние лекарств, таких как ИПП, антибиотики и соли висмута.
Прием ИПП ограничивает точность диагностических методов в связи со снижением уреазной активности H. pylori, а также уменьшением количества вегетативных (спиралевидных) форм бактерии. Однако, в одном исследовании сравнивалось подавляющее действие ИПП на H. pylori и было показано, что пантопразол не ингибирует рост и уреазу H. pylori в отличие от омепразола и лансопразола и использование пантопразола в течение 14 дней не влияет на диагностическую точность методов диагностики H. pylori.
Пятидневный прием ИПП в высокой дозе оказывают значительное влияние на активность уреазы (при выполнении БУТ и 13C-УДТ), поэтому необходимо тщательно рассмотреть прием ИПП и его продолжительность. Прием менее пяти дней высокодозных ИПП (например, омепразол 80 мг) не оказывают существенного влияния на активность уреазы, при поведении БУТ или 13C-УДТ[ 67 ].
Каждый из применяемых сегодня методов имеет свои недостатки, и поэтому ограничиваться в практической деятельности только одним из них не желательно.
ЭГДС с биопсией
· Быстрый уреазный тест*
· Антитела к H. pylori IgG
· 13C-уреазный дыхательный тест*
· 14C-уреазный дыхательный тест*
· Антиген моноклональный в стуле*
Примечание: * тест достоверен, если больной более месяца не принимал по любому поводу антибиотики, препараты висмута, более 2 недель – ИПП, H2- блокаторы.
Контроль эффективности эрадикации H. pylori, независимо от используемых тестов, следует проводить не ранее, чем через 30 дней после завершения приема всех препаратов схемы. Несоблюдение этого правила ведет к ложному заключению об эффективности терапии.
Предпочтение следует отдавать неинвазивным методам: 13 С-УДТ и определению антигена H. pylori в кале. Для контроля эрадикации БУТ не рекомендуется. Исключение могут составлять случаи, требующие проведения повторной ЭГДС, при которой может быть получен биоптат для гистологического, цитологического или бактериологического исследования. Вместе с тем, обычно контрольная ЭГДС у больных с обострением язвенной болезни проводится на фоне продолжающегося приема ИПП, что делает невозможным диагностику H. pylori. Проведение ЭГДС через месяц после завершения лечения только с целью выявления инфекции может быть оправдана только при недоступности и невозможности применения неинвазивных методов. При этом не следует использовать БУТ для исключения инфекции [ 68 ]. Методы, которые можно использовать для контроля эффективности терапии (Таблица 4).
ЭГДС с биопсией
· 13C-уреазный дыхательный тест
· 14C-уреазный дыхательный тест
· Антиген моноклональный в стуле
Примечание: * проводится не ранее, чем через 30 дней после завершения эрадикационой терапии, и не ранее чем через 2 недели после завершения приема ИПП.
В клинической практике нередко наблюдается ситуация, когда обращается пациент с симптомами диспепсии, которому ранее не проводилось лечение H. pylori, но в настоящее время он принимает или недавно принимал ИПП, антибактериальные или висмут содержащие препараты. В таком случае для диагностики H. pylori возможно выполнение иммуноферментного анализа крови на антитела к H. pylori класса IgG, остальные методы диагностики будут малоинформативны. Вместе с тем известно, что 28-дневный прием висмута трикалия дицитрата способен в ряде случаев (до 33%) привести к эрадикации H. pylori [ 71 ], поэтому для принятия решения о лечении инфекции следует в плановом порядке провести неинвазивную диагностику (к примеру, 13 С-УДТ) не ранее, чем через 30 дней после проведенной терапии.
Если ранее пациент лечился от H. pylori, и в настоящее время он принимает или принимал ИПП, антибактериальные или висмут содержащие препараты, то достоверная диагностика H. pylori возможна не ранее, чем через 30 дней после завершения приема антибиотиков и препаратов висмута, и не ранее, чем через 2 недели после прекращения приема ИПП. Может быть использован любой тест, за исключением серологического. Если нет показаний для проведения ЭГДС, предпочтительна неинвазивная диагностика.
Лечение инфекции возможно только после ее выявления. После завершения терапии ее успех должен быть доказан. Диагностическая ценность большинства тестов снижается при низкой бактериальной обсемененности, что наблюдается текущем или предшествующем приеме антисекреторных и антибактериальных препаратов, а также при атрофическом гастрите [ 72 ].
Адекватная интерпретация результатов возможна только при условии отмены ИПП за 2 недели, а антибиотиков и препаратов висмута - за 4 недели до проведения теста. Каждый метод имеет свои преимущества, недостатки и ограничения.
Сводная характеристика методов диагностики H. pylori представлена в Таблице 5.
Алгоритм диагностики Н.pylori приведен на Рисунке 8.
Инвазив- ный метод
Неинвазив- ный метод
антибиоти- ков, ИПП, препаратов висмута
первичной диагности- ки
контроля эрадика- ции
Антитела к H. pylori IgG в
Рис.8. Алгоритм диагностики Н.pylori. Адаптировано Malfertheiner P. et al. Gut 2012;61:646-664. Megraud F., Lehours P. Clin microbiol rev. 2007;20(2):280-322.
Хомерики С.Г., Касьяненко В.И., Лабораторная диагностика инфекции H. pylori. СПб, 2011
4.4. Какой метод диагностики Helicobacter pylori выбрать у пациентов с частичной резекцией желудка
Еще одной проблемой является диагностика H. pylori у пациентов с частичной резекцией желудка, этой проблеме уделяется меньше внимания, поскольку эти пациенты представляют собой очень небольшую часть населения в целом.
В метаанализе, сравнивающем три часто используемых теста у пациентов с частичной резекцией желудка, гистология показала лучшие результаты, на втором месте оказался БУТ, в то время как 13С-УДТ имел низкую диагностическую точность. Чувствительность и специфичность гистологического метода, БУТ и 13С-УДТ составляли 93% и 85%; 79% и 94%; 77% и 89% соответственно. Несмотря на то, что 13 C-УДТ является быстрым, безопасным и надежным методом, который способен точно определить инфекцию H. pylori, у пациентов после частичной резекции желудка метод показывает меньшую чувствительность и специфичность. Возможная причина низкой информативности теста может быть обусловлена ускоренной эвакуацией из культи желудка, в результате чего тестовый раствор мочевины недостаточно задерживается по времени в культе желудка для взаимодействия с уреазой, продуцируемой H. pylori, а также низкой бактериальной нагрузкой. Таким образом, гистологический метод будет более предпочтительным, чем остальные для диагностики инфекции H. pylori после частичной гастрэктомии [ 73 ].
Другим альтернативным и надежным методом для выявления H. pylori у пациентов с дистальной резекцией желудка может быть серологический метод. В одном исследовании оценивалась диагностическая точность серологического метода, у пациентов с дистальной гастрэктомией. Чувствительность и специфичность теста выявления антигена H. pylori в кале (HpSA) были 100%, 90,5% соответственно [ 74 ].
Высокая распространенность и этиопатогенетическая связь H. pylori с наиболее значимыми заболеваниями желудка диктует необходимость оптимизации диагностики этой инфекции с учетом чувствительности и специфичности тестов, а также условий их проведения. До назначения терапии инфекция должна быть выявлена, а после лечения – подтвержден его успех. Важно подчеркнуть, что отсутствие оценки эффективности эрадикации H. pylori, с одной стороны, не позволяет документировать достижения цели у конкретного больного, с другой стороны, лишает врача возможности оценить эффективность назначаемых схем лечения в данном регионе. Последнее принципиально важно для критического переосмысления и улучшения клинической практики. Широкий арсенал диагностических тестов при рациональном их применении позволяет успешно решать эти задачи.
Читайте также:



