Му по лабораторной диагностике пастереллезов животных и птиц
Методические указания по лабораторной диагностике пастереллезов животных и птиц
(утв. Главным управлением ветеринарии от 20 августа 1992 г. N 22-7/82)
1. Общие положения
1.1. Пастереллезы - различные по локализации и характеру течения инфекционные болезни сельскохозяйственных, домашних и диких животных, птиц и человека, вызываемые бактериями рода Pasteriolla который включает в себя шесть видов: P.multocida, P.haemolytica, P.ureae, P.pneumotropica, P.aerogenes, P.gallinarum
1.2. Ведущее этиологическое значение в инфекционной патологии животных и птиц принадлежит двум видам: P.muluocide, P.haemolytice.
P.muluocida является возбудителем геморрагической септицемии животных, холеры птиц, а также легочных пастереллезов, осложняющих респираторные инфекции вирусной и микоплазменной этиологии.
P. haemoytica вызывает у крупного рогатого скота и овец всех возрастов пневмонии, а также септицемию новорожденных ягнят.
Кроме перечисленных заболеваний эти два вида могут выделяться у коров и свиноматок при абортах, у овец и коров - при маститах, у телят и ягнят - при артритах и других локальных патологических процессах.
1.3. Краткие сведения о других видах пастерелл.
P. pneumotropica является возбудителем энзоотического заболевания мышей, кроликов и других лабораторных грызунов, которое проявляется поражением органов дыхания и образованием абсцессов.
P. ureae часто выделяют от человека при хроническом атрофическом насморке.
P. gallinarum встречается как комменсал верхних дыхательных путей птиц и иногда крупного и мелкого рогатого скота; имеет низкую вирулентность и чаще ассоциирует с хроническими респираторными инфекциями птиц.
P. aerogenes является постоянным обитателем кишечного тракта свиней.
1.4. Диагноз на пастереллезы устанавливают на основании эпизоотологических данных, клинических признаков, патологоанатомических изменений и результатов лабораторного исследования.
1.5. Лабораторная диагностика пастереллезов включает микроскопию мазков и отпечатков, выделение культур пастерелл и их идентификацию и при необходимости постановку биопроб.
1.6. Для исследования в лабораторию направляют 2-3 трупа мелких животных, от крупных животных - сердце с перевязанными сосудами, части селезенки, печени, почек, экссудат из грудной полости и трубчатую кость. При поражении легких берут также их кусочки (5X5 см) на границе нормального и измененного участков, миндалины, бронхиальные, средостенные и заглоточные лимфатические узлы.
Патологический материал берут от павших (не позднее 3-5 ч после гибели) или убитых животных, не подвергавшихся лечению антибактериальными препаратами.
Для диагностики пастереллеза у птиц в лабораторию направляют, кроме свежих трупов, 5-6 живых птиц с явными признаками болезни. Больную птицу убивают в лаборатории и делают высевы из костного мозга, сердца, печени и селезенки.
1.7. Взятие и доставку материала осуществляют в соответствии с действующими Правилами взятия патологического материала, крови, кормов, и пересылки их для лабораторного исследования.
2. Выделение и идентификация культур
2.1. посевы из патологического материала, перечисленного в п. 1.6, делают в МПБ и на МПА или бульон и агар Хоттингера рН 7,2-7,4 с добавлением 10% нормальной сыворотки крови лошади (см. приложение пп. 1-4) или 5-10% аминопептида-2.
2.1.1. Посев в пробирки с жидкими и твердыми питательными средами проводят пастеровской пипеткой. Пробирки с посевами инкубируют при 37-38 градусов в течение 20-48 часов.
2.1.2. Одновременно с посевами из каждого органа делают мазки-отпечатки, фиксируют 10-15 мин смесью равных объемов этилового спирта и эфира, окрашивают по Леффлеру или Романовскому-Гимза и микроскопируют. В мазках из патологического материала пастереллы выглядят овоиды или короткие палочки с закругленными концами и заметной биполярностью, вокруг которых может быть видна прозрачная капсула.
2.2. В жидких питательных средах рост пастерелл сопровождается сначала слабым помутнением, затем через 24-36 часов возможно просветление среды и выпадение на дно пробирки осадка, поднимающегося при встряхивании в виде косички.
На сывороточном агаре или агаре с аминопептидом-2 пастереллы растут в виде прозрачных, средней (диаметром до 3 мм), округлых с ровными краями колоний слизистой консистенции, серого цвета.
На простых питательных средах без добавления сыворотки крови пастереллы растут не всегда удовлетворительно.
У выделенных культур изучают культуральные, тинкториальные и морфологические свойства. В мазках из культур при окраске по Граму пастереллы имеют вид грамотрицательных овоидов или коккобактерий, расположенных одиночно и попарно.
Идентификацию выделенных культур проводят по ферментативным свойствам и подвижности.
Здесь и далее по тексту нумерация приводится в соответствии с источником
2.3.1. Суточную агаровую культуру высеевают в среды Гисса с глюкозой, маннитам, сахарозой, маннозой, в ПМА, молоко, желатин, на кровяной сывороточной МПА или агар Хоттингера (см. приложение п. 5), в МПБ с 1% нитрата калия, в среду с мочевиной (см. приложение п. 6).
2.3.2. Для определения редукции нитратов исследуемые культуры засевают в МПБ с 1% нитрата калия и выращиванием в течение 48-72 ч.
Затем в пробирку добавляют 1 куб см 2%-ного водного раствора крахмала, 1 куб см 1%-ного раствора йодистого калия и 1-2 капли 5%-ного водного раствора серной кислоты и взбалтывают.
При положительной реакции среда приобретает окраску от темно-синего до коричневого цвета; при отрицательной - цвет среды желтый или слабо синий.
2.3.3. Индол выявляют с помощью индикаторных бумажек или по методу Легаль-Вейла. Индикаторные бумажки готовят из полосок фильтровальной бумаги длиной 10-12 см, пропитывая их горячей щавелевой кислотой, высушивают в термостате и хранят в банке с притертой пробкой.
С целью выявления индола в пробирку с МПБ после засева культуры под ватную пробку помещают полоску индикаторной бумажки с таким расчетом, чтобы нижний ее конец не касался среды, и инкубируют при 37 градусах С 24-72 ч. При выделении индола нижняя часть бумажки приобретает розовую окраску.
Метод Легаль-Вейла. В пробирку с суточной бульонной культурой пастерелл вносят 4-5 капель 5%-ного водного раствора нитропруссида натрия, перемешивают и добавляют вначале такой же объем 40%-ного водного раствора N2OH, а спустя 1-2 мин 4-5 капель ледяной уксусной кислоты. При наличие индола бульонная культура приобретает сине-зеленую окраску.
2.3.4. Для определения уреазы в пробирку, содержащую среду с мочевиной, закапывают 2-3 капли 24-часовой изучаемой бульонной культуры. Посевы культивируют 20-24 ч. при 37 гр. С. При наличии фермента уреазы происходит покраснение среды.
2.3.5. Все виды пастерелл неподвижны, не свертывают молоко, не разжижают желатин, редуцируют нитраты, ферментируют с образованием кислоты без выделения глаза глюкозу, маннозу, сахарозу.
P.agrogenes в отличие от других видов ферментирует углеводы с выделением газа.
На кровяном сывороточном МПА или агаре Хоттингера P.haemolytica образует колонии с отчетливой зоной гемолиза, которая лучше просматривается после снятия колонии со среды. Остальные виды пастерелл гемолиза не вызывает.
2.3.6. Основные дифференцирующие признаки видов рода пастерелла представлены в таблице.
Гемолиз на кровяном агаре
Условные обозначения: + результат положительный
2.4. Дифференциация серовариантов Р.
2.4.1. Изучаемую 18-часовую бульонную культуру бактериологической петлей высевают на чашку Петри со свежеприготовленным 1,5%-ным агаром Хоттингера. Посев проводят, не отрывая петли от поверхности агара, параллельными штрихами на расстоянии 7-10 мм один от другого.
Затем бактериологической петлей одним штрихом по диаметру чашки, перпендикулярно нанесенным штрихам, высевают суточную бульонную культуру Staphylococcus aureus (культура должна обладать хорошей гемолитической активностью, что определяют высевом ее на кровяной сывороточный МПА).
Чашки с посевами инкубируют при 37 градусов С и через 18-24 час учитывают результаты.
Штаммы, образующие вблизи (до 5 мм) от линии роста стафилококка более мелкие колонии, чем на удалении от этой линии, относятся к сероварианту А. Кроме того колонии P. multocida сероварианта А, растущие вблизи стафилококка, при просмотре в проходящем свете имеют окраску в отличие от остальных флуоресцирующих колоний. Размер колоний серовариантов В и Д в данном тесте не изменяются.
2.4.2. Исследуемую бульонную культуру (5-6 куб см) центрифугируют при 3000 об/мин.
Надосадочную жидкость сливают, осадок ресуспензируют в оставшейся в пробирке надосадочной жидкости до получения гомогенной суспензии. К полученной суспензии приливают 0,5 куб см водного свежеприготовленного раствора акрифлавина 1:1000 и тщательно перемешивают.
Штаммы, относящиеся к сероварианту Д, в течении 10-15 мин после добавления раствора акрифлавина образуют крупнохлопчатый неразбивающийся при встряхивании флоккулят. Кроме штаммов P. multocida сероварианта Д, флоккулят могут образовывать диссоциированные культуры других серовариантов, но в этом случае флоккулят мелкохлопчатый и легко разбивается при встряхивании.
Сероварианты Ф и В дают отрицательную реакцию флоккуляции.
2.4.3. Штаммы P multocida, не обладающие указанными выше свойствами, относятся к сероварианту В.
3. Биологическое исследование
3.1. Биологическое исследование проводят для определения патогенности выделенной культуры пастерелл и при необходимости с целью обнаружения возбудителя в патологическом материале.
3.2. Патогенность культур определяют на белых мышах массой 16-18 гр. С этой целью двум белым мышам вводят подкожно по 0,2 куб см 18-24 - часовой бульонной культуры.
Вирулентные штаммы P. multocida, относящиеся в основном к сероварианту В и являющиеся возбудителями геморрагической септицемии, вызывают гибель зараженных белых мышей в течении 24-72 час; слабовирулентные штаммы серовариантов А и Д, участвующие в развитии пневмоний - через более продолжительный срок (до 7 сут.).
P.haemolytica может вызвать гибель белых мышей только при внутрибрюшинном заражении. Остальные виды пастерелл, как правило, для лабораторных животных непатогенны.
3.3. Патогенность культур, выделенных от птиц, проверяют на белых мышах или цыплятах. Суточную бульонную культуру вводят двум белым мышам внутрибрюшинно по 0,2 куб см или двум цыплятам 90-120 - дневного возраста внутримышечно по 1,0 куб см.
3.4. Для обнаружения возбудителя пастереллеза в патологическом материале суспензий из органов (см. п. 1.6) заражают двух белых мышей подкожно в дозе 0,2 куб см. При этом надо учитывать, что не все виды пастерелл, играющие роль в патологии сельскохозяйственных животных, вызывают гибель зараженных белых мышей.
3.5. Культуру считают патогенной, а биопробу положительной при гибели через 24-72 ч хотя бы одного из зараженных животных и выделении от него культуры пастерелл.
3.6. Срок наблюдения за зараженными животными - 7 сут.
4. Диагноз считают установленным в случае:
- выделение из патологического материала культуры со свойствами, характерными для возбудителя пастереллеза, и установления ее патогенности на лабораторных животных;
- гибели хотя бы одного лабораторного животного из двух зараженных исходным материалом и выделения из его органов культуры со свойствами, характерными для возбудителя пастереллеза, если даже в посевах из исходного материала культуры возбудителя не выделено.
С утверждением настоящих методических указаний утрачивает силу. Наставления по лабораторной диагностике пастереллеза птиц, рекомендованные Главным управлением ветеринарии Минсельхоза СССР 20.05.75 г.
Заместитель начальника
Главного управления ветеринарии
Откройте актуальную версию документа прямо сейчас или получите полный доступ к системе ГАРАНТ на 3 дня бесплатно!
Если вы являетесь пользователем интернет-версии системы ГАРАНТ, вы можете открыть этот документ прямо сейчас или запросить по Горячей линии в системе.
Методические указания по лабораторной диагностике пастереллезов животных и птиц (утв. Главным управлением ветеринарии от 20 августа 1992 г. N 22-7/82)
Текст методических указаний официально опубликован не был
1.1. Пастереллезы - различные по локализации и характеру течения инфекционные болезни сельскохозяйственных, домашних и диких животных, птиц и человека, вызываемые бактериями рода Pasteriolla который включает в себя шесть видов: P.multocida, P.haemolytica, P.ureae, P.pneumotropica, P.aerogenes, P.gallinarum.
1.2. Ведущее этиологическое значение в инфекционной патологии животных и птиц принадлежит двум видам: P.muluocide, P.haemolytice.
P.muluocida является возбудителем геморрагической септицемии животных, холеры птиц, а также легочных пастереллезов, осложняющих респираторные инфекции вирусной и микоплазменной этиологии.
P.haemoytica вызывает у крупного рогатого скота и овец всех возрастов пневмонии, а также септицемию новорожденных ягнят.
Кроме перечисленных заболеваний эти два вида могут выделяться у коров и свиноматок при абортах, у овец и коров - при маститах, у телят и ягнят - при артритах и других локальных патологических процессах.
1.3. Краткие сведения о других видах пастерелл.
P.pneumotropica является возбудителем энзоотического заболевания мышей, кроликов и других лабораторных грызунов, которое проявляется поражением органов дыхания и образованием абсцессов.
P.ureae часто выделяют от человека при хроническом атрофическом насморке.
P.gallinarum встречается как комменсал верхних дыхательных путей птиц и иногда крупного и мелкого рогатого скота; имеет низкую вирулентность и чаще ассоциирует с хроническими респираторными инфекциями птиц.
P.aerogenes является постоянным обитателем кишечного тракта свиней.
1.4. Диагноз на пастереллезы устанавливают на основании эпизоотологических данных, клинических признаков, патологоанатомических изменений и результатов лабораторного исследования.
1.5. Лабораторная диагностика пастереллезов включает микроскопию мазков и отпечатков, выделение культур пастерелл и их идентификацию и при необходимости постановку биопроб.
1.6. Для исследования в лабораторию направляют 2 - 3 трупа мелких животных, от крупных животных - сердце с перевязанными сосудами, части селезенки, печени, почек, экссудат из грудной полости и трубчатую кость. При поражении легких берут также их кусочки (5×5 см) на границе нормального и измененного участков, миндалины, бронхиальные, средостенные и заглоточные лимфатические узлы.
Патологический материал берут от павших (не позднее 3 - 5 ч после гибели) или убитых животных, не подвергавшихся лечению антибактериальными препаратами.
Для диагностики пастереллеза у птиц в лабораторию направляют, кроме свежих трупов, 5 - 6 живых птиц с явными признаками болезни. Больную птицу убивают в лаборатории и делают высевы из костного мозга, сердца, печени и селезенки.
1.7. Взятие и доставку материала осуществляют в соответствии с действующими Правилами взятия патологического материала, крови, кормов, и пересылки их для лабораторного исследования.
2.1. посевы из патологического материала, перечисленного в п. 1.6, делают в МПБ и на МПА или бульон и агар Хоттингера рН 7,2 - 7,4 с добавлением 10 % нормальной сыворотки крови лошади (см. приложение пп. 1 - 4) или 5 - 10 % аминопептида-2.
2.1.1. Посев в пробирки с жидкими и твердыми питательными средами проводят пастеровской пипеткой. Пробирки с посевами инкубируют при 37 - 38° в течение 20 - 48 часов.
2.1.2. Одновременно с посевами из каждого органа делают мазки-отпечатки, фиксируют 10 - 15 мин смесью равных объемов этилового спирта и эфира, окрашивают по Леффлеру или Романовскому-Гимза и микроскопируют. В мазках из патологического материала пастереллы выглядят овоиды или короткие палочки с закругленными концами и заметной биполярностью, вокруг которых может быть видна прозрачная капсула.
2.2. В жидких питательных средах рост пастерелл сопровождается сначала слабым помутнением, затем через 24 - 36 часов возможно просветление среды и выпадение на дно пробирки осадка, поднимающегося при встряхивании в виде косички.
На сывороточном агаре или агаре с аминопептидом-2 пастереллы растут в виде прозрачных, средней (диаметром до 3 мм), округлых с ровными краями колоний слизистой консистенции, серого цвета.
На простых питательных средах без добавления сыворотки крови пастереллы растут не всегда удовлетворительно.
У выделенных культур изучают культуральные, тинкториальные и морфологические свойства. В мазках из культур при окраске по Граму пастереллы имеют вид грамотрицательных овоидов или коккобактерий, расположенных одиночно и попарно.
Идентификацию выделенных культур проводят по ферментативным свойствам и подвижности.
2.3.1. Суточную агаровую культуру высеевают в среды Гисса с глюкозой, маннитам, сахарозой, маннозой, в ПМА, молоко, желатин, на кровяной сывороточной МПА или агар Хоттингера (см. приложение п. 5), в МПБ с 1 % нитрата калия, в среду с мочевиной (см. приложение п. 6).
2.3.2. Для определения редукции нитратов исследуемые культуры засевают в МПБ с 1 % нитрата калия и выращиванием в течение 48 - 72 ч.
Затем в пробирку добавляют 1 см 3 2 %-ного водного раствора крахмала, 1 см 3 1 %-ного раствора йодистого калия и 1 - 2 капли 5 %-ного водного раствора серной кислоты и взбалтывают.
При положительной реакции среда приобретает окраску от темно-синего до коричневого цвета; при отрицательной - цвет среды желтый или слабо синий.
2.3.3. Индол выявляют с помощью индикаторных бумажек или по методу Легаль-Вейла. Индикаторные бумажки готовят из полосок фильтровальной бумаги длиной 10 - 12 см, пропитывая их горячей щавелевой кислотой, высушивают в термостате и хранят в банке с притертой пробкой.
С целью выявления индола в пробирку с МПБ после засева культуры под ватную пробку помещают полоску индикаторной бумажки с таким расчетом, чтобы нижний ее конец не касался среды, и инкубируют при 37 °С 24 - 72 ч. При выделении индола нижняя часть бумажки приобретает розовую окраску.
Метод Легаль-Вейла. В пробирку с суточной бульонной культурой пастерелл вносят 4 - 5 капель 5 %-ного водного раствора нитропруссида натрия, перемешивают и добавляют вначале такой же объем 40 %-ного водного раствора N2OH, а спустя 1 - 2 мин 4 - 5 капель ледяной уксусной кислоты. При наличие индола бульонная культура приобретает сине-зеленую окраску.
2.3.4. Для определения уреазы в пробирку, содержащую среду с мочевиной, закапывают 2 - 3 капли 24-часовой изучаемой бульонной культуры. Посевы культивируют 20 - 24 ч. при 37 °С. При наличии фермента уреазы происходит покраснение среды.
2.3.5. Все виды пастерелл неподвижны, не свертывают молоко, не разжижают желатин, редуцируют нитраты, ферментируют с образованием кислоты без выделения глаза глюкозу, маннозу, сахарозу.
P.agrogenes в отличие от других видов ферментирует углеводы с выделением газа.
На кровяном сывороточном МПА или агаре Хоттингера P.haemolytica образует колонии с отчетливой зоной гемолиза, которая лучше просматривается после снятия колонии со среды. Остальные виды пастерелл гемолиза не вызывает.
2.3.6. Основные дифференцирующие признаки видов рода пастерелла представлены в таблице.
Основана на результатах бактериологического исследования.
1. Общие положения
Пастереллёз – болезнь многих сельскохозяйственных, диких животных и птиц, в зависимости от вида возбудителя характер патологии и течение болезни варьирует. Возбудителями пастереллёзов являются различные виды бактерий рода Pasteurella, семейства Pasteurellaceae. Патогенные свойства доказаны не у всех пастерелл, наибольшее значение в патологии животных имеют следующие виды.
P. multocida – серовара –B является первичным возбудителем геморрагической септицемии различных видов жвачных животных. P. multocida серовара D – обуславливает, обычно как вторичный агент, пневмонии и атрофического ринита свиней. P. multocida серовара А – у крупного рогатого скота участвует в развитии синдрома “транспортной лихорадки”, вызывает пневмонию телят и, иногда, маститных коров, у овец этот серовар пастерелл вызывает пневмонию и маститы, у свиней пневмонию (часто как первичный агент), у кроликов – плевропневмонию, “заразный насморк” , генитальные инфекции, у птицы – “холеру” (первичная инфекция). P. multocida серовара Е – является этиологическим агентом эпизоотической геморрагической септицемии крупного рогатого скота и буйволов в Африке. У индеек изолирована P. multocida типа F , но её этиологическая роль до сих пор не выяснена.
P. haemolytica биотипа А является как первичный или вторичный агент пневмоний, участвует в развитии синдрома “транспортной лихорадки” крупного рогатого скота. P. haemolytica биотипа Т вызывает септицемию у ягнят 5-12 месячного возраста.
У свиней в кишечном тракте обитает P. aerogenes , которую иногда выделяют при абортах данного вида животных.
P. anatipestifer рассматривают как возбудитель фибринозного полисерозита в 1-8 – недельных уток.
У лошадей респираторную патологию, включая пневмонию, может обуславливать P. caballi.
Роль в патологии животных у ряда пастерелл на данное время не доказана.
У собак и кошек периодически изолируют P. pneumotropica , P. canis, P. dagmatis, P, stomatis, но их этиологическая роль в патологиях не доказана.
2. Бактериологическое исследование
2.1. Материал для исследования
Характер материала определяется наблюдаемым синдромом болезни. При септических явлениях объектом исследования являются части селезёнки, печени, почек, сердце с перевязанными сосудами, лимфатические узлы, трубчатая кость, трупы мелких животных направляют в лаборатории целиком. В случае поражения лёгких берут фрагменты на границе здоровой и поражённой ткани, экссудат из рудной полости, регионарные лимфатические узлы, миндалины. Прижизненно для исследования берут гной, экссудат, пробы со слизистой носовой полости, молоко от животных с маститом.
2.2. Микроскопическое исследование исходного материала.
Мазки из материала окрашивают по Грамму и одним из методов позволяющих обнаружить капсулу (Романовского-Гимза, Асффлеру и т.д.). В препаратах пастереллы видны как короткие с закругленными краями (овоидные) грамотрицательные палочки, размер 0,3-1,0 х 1-2 мкм окружённые капсулой, располагающиеся одиночно, парами, в виде коротких цепочек. Достаточно характерно биполярное окрашивание клеток пастерелл, но следует иметь ввиду что ряд энтеробактерий также проявляет склонность к биполярной окраске.
2.3. Выделение и идентификация культур пастерелл.
2.3.1. Посев исследуемого материала на питательные среды, культивирование.
Пастереллы – факультативные анаэробы, температурный оптимум 37 о С (диапазон 25-40 о С), птичьи штаммы растут при 42 о С, оптимум рН питательных сред 7,2-7,4. Для первичного культивирования используют обычные МПА, МПБ, бульон и агар Хоттингера, но лучше обогащённые среды: кровяной, сывороточный агар и бульон. Следует отметить, что большинство штаммов P. avium обладают потребностью в НАД и для культивирования этого вида пастерелл необходимо использовать специальные питательные среды. (см. “Гемофильные бактерии”). Для выделения пастерелл из назальных мазков целесообразно использовать элективную среду клиндамицином. P. anatipestifer требует для своего роста обогащённые среды и 5-10% СО2. Инкубирование посевов проводят в течение 24-48 часов, при при отсутствии роста до 4-5 суток.
Цель занятия: изучить методы диагностики и лечения пастереллеза, систему профилактических и оздоровительных мероприятий.
Материалы и оборудование: таблицы, диапозитивы, рисунки, микроскопы, готовые мазки, окрашенные по Романовскому—Гимзе, и биопрепараты, применяемые при пастереллезе животных и птиц.
Место проведения занятия: аудитория кафедры эпизоотологии.
Пастереллез — инфекционная болезнь млекопитающих многих видов и птиц. Возбудитель — бактерия рода Pasteurella.
Методы диагностики. Диагноз на пастереллез устанавливают на основании эпизоотологических данных, клинических признаков, патологоанатомических изменений и результатов лабораторных исследований.
Согласно эпизоотологическим данным болеют домашние и дикие животные всех видов (более восприимчив молодняк) и человек. Болезнь проявляется среди кроликов в виде эпизоотии, у животных других видов — в виде энзоотических вспышек. Для пастереллеза характерно формирование стационарных эпизоотических очагов. Болезнь часто регистрируют осенью и весной. Источник возбудителя инфекции — больные и переболевшие животные — пастереллоносители. У больных животных возбудитель выделяется с истечениями из носа, выдыхаемым воздухом, слюной, фекалиями, молоком.
Клинические признаки болезни зависят от ее течения — сверхострого, острого, подострого и хронического. У больных животных резко повышается температура тела, нарушаются функции дыхательной системы и желудочно-кишечного тракта.
При сверхостром течении клиническая картина не успевает развиться, животное погибает внезапно с признаками нервных и сердечно-сосудистых расстройств. При более затяжном течении наблюдают конъюнктивиты, колиты, поносы, мышечную дрожь. Отмечают серозные, серозно-катаральные риниты, иногда истечения из носовых отверстий с примесью крови, сухой болезненный кашель.
В зависимости от развития патологического процесса различают отечную, грудную, кишечную формы, а в последнее время и менингеальную.
Патологоанатомические изменения зависят от продолжительности и формы болезни. У павших животных обнаруживают геморрагический диатез в большинстве органов. Печень и почки перерождены, с очагами некроза, селезенка слегка опухшая, лимфоузлы увеличены, темно-красного цвета. Легкие отечные, иногда отмечают серозно-фибринозный плеврит. В желудочно-кишечном тракте фибринозно-геморрагическое воспаление.
Лабораторная диагностика включает в себя микроскопию мазков-отпечатков, выделение культур пастерелл и их идентификацию, биопробу.
Для исследования в лабораторию направляют 2…3 трупа мелких животных, от крупных — сердце с перевязанными сосудами, части селезенки, печени, почек, экссудат из грудной полости и трубчатую кость; при поражении легких — кусочки (5х5 см) на границе нормального и измененного участков, миндалины, бронхиальные, средостенные и заглоточные лимфатические узлы. Материал берут от павших (не позднее 3…5 ч после гибели) или убитых с диагностической целью животных, не подвергавшихся лечению антибактериальными препаратами.
Для диагностики пастереллеза у птиц в лабораторию направляют кроме свежих трупов 5…6 живых птиц с явными признаками болезни. Больных птиц убивают в лаборатории и делают высевы из костного мозга, сердца, печени и селезенки.
Мазки-отпечатки из каждого органа фиксируют, окрашивают по Леффлеру или Романовскому—Гимзе и микроскопируют. В мазках из патматериала пастереллы выглядят как овоиды или короткие палочки с закругленными концами и заметной биполярностью, вокруг которых может быть видна прозрачная капсула. В мазках из культур при окраске по Граму бактерии обнаруживают в виде грамотрицательных овоидов или коккобактерий, расположенных одиночно или попарно.
При выделении культур посевы из исходного материала делают в МПБ и на МПА или в бульон и на агар Хоттингера. Выделенные культуры идентифицируют по ферментативным свойствам и подвижности. Основные дифференцирующие признаки видов рода Pasteurella приведены в таблице 6.
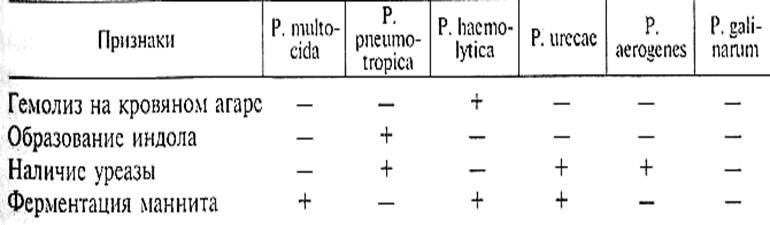
Методом биопробы определяют патогенность выделенной культуры и обнаруживают возбудитель в исходном материале.
Двум белым мышам массой 16…18 г вводят подкожно по 0,2 мл 18…24-часовой бульонной культуры. Вирулентные штаммы Р. multocida, относящиеся в основном к сероварианту В и являющиеся возбудителями геморрагической септицемии, вызывают гибель зараженных белых мышей в течение 24…72 ч; слабовирулентные штаммы серовариантов А и D, участвующие в развитии пневмоний, — через более продолжительный срок (до 7 сут). Р. haemolytica может вызвать гибель белых мышей только при внутрибрюшинном заражении.
Патогенность культур, выделенных от птиц, проверяют на белых мышах или цыплятах. Срок наблюдения за зараженными животными 7 сут.
Диагноз считают установленным в случае:
Выделения из исходного материала культуры со свойствами характерными для возбудителя пастереллеза, и установления ее патогенности на лабораторных животных;
Гибели хотя бы одного лабораторного животного из двух зараженных исходным материалом и выделения из его органов культуры со свойствами, характерными для возбудителя пастереллеза если даже в посевах из исходного материала культуры возбудителя не выделено. Срок исследования до 10 сут.
Профилактические и оздоровительные мероприятия. Чтобы предупредить заболевание животных пастереллезом, поступают следующим образом:
Всех ввозимых в хозяйство животных выдерживают в профилактическом карантине в течение 30 дней;
Комплектуют стадо только животными из хозяйств, благополучных по инфекционным болезням;
Не допускают контакта животных общественного и частного секторов;
На фермах оборудуют санпропускники и обеспечивают обслуживающий персонал сменной одеждой и обувью;
На территориях пастбищ организуют мелиоративные работы, так как возбудитель пастереллеза в заболоченных мелких водоемах может сохраняться до 6 мес;
Систематически проводят дератизацию на территории ферм;
В административных районах, где на фермах или среди отдельных групп животных были зарегистрированы случаи заболевания пастереллезом, всех животных вакцинируют против пастереллеза в течение одного года, руководствуясь наставлением по применению соответствующей вакцины;
Хозяйства, в которых был зарегистрирован пастереллез, в течение одного года комплектуют поголовьем, вакцинированным против пастереллеза в хозяйстве-поставщике либо в период профилактического карантина;
Не разрешают ввозить невакцинированных животных в ранее неблагополучное стадо в течение одного года после его оздоровления.
При установлении диагноза на пастереллез хозяйство объявляют неблагополучным по данной болезни и вводят ограничения.
Чтобы купировать эпизоотический очаг и ликвидировать заболевание: осматривают с термометрией всех животных неблагополучной группы. Больных и подозрительных по заболеванию изолируют и закрепляют за ними обслуживающий персонал, который обеспечивают спецодеждой, обувью, дезсредствами, аптечкой, рукомойником, мылом, полотенцем;
Всем больным и контактировавшим с ними животным вводят поотивопастереллезную сыворотку (в зависимости от вида животного и эпизоотической ситуации используют следующие сыворотки’ против пастереллеза крупного рогатого скота, буйволов, овец свиней; против пастереллеза свиней, кроликов, пушных зверей;
Против пастереллеза, сальмонеллеза, парагриппа-3 и инфекционного ринотрахеита крупного рогатого скота) и один из следующих антибиотиков: террамицин, окситетрациклин, биомицин (хлор-тетрациклин), тетрациклин, стрептомицин, левомицетин, пролонгированные антибиотики (дибиомицин, дитетрациклин, дистрептомидазол, бициллин-3). Антибиотики назначают в дозах, указанных в наставлениях по их применению: их вводят 3 раза в день в течение 3…5 сут, пролонгированные антибиотики — однократно. Назначают также сульфаниламидные препараты, глюкозу и другие симптоматические средства; хорошие результаты дает применение пастереллезного фага или полифага;
Поросятам и ягнятам, находящимся под больными пастереллезом матками, вводят гипериммунную противопастереллезную сыворотку в лечебной дозе и назначают курс антибиотиков тетрациклинового ряда. Телятам до 3-месячного возраста, находящимся на территории неблагополучной фермы, вводят сыворотку и дают молоко только от здоровых коров. Через 14 дней после введения сыворотки всех животных, достигших прививочного возраста, вакцинируют против пастереллеза.
Для иммунизации используют одну из далее указанных вакцин в соответствии с наставлением по их применению:
Крупный рогатый скот и буйволов вакцинируют эмульгированной вакциной против пастереллеза крупного рогатого скота, буйволов и овец;
Мелкий рогатый скот — преципитированной формол-вакциной против пастереллеза овец и свиней или эмульгированной вакциной против пастереллеза крупного рогатого скота, буйволов и овец;
Кроликов — формол-вакциной против пастереллеза кроликов;
Нутрий — сапонинформол-вакциной против пастереллеза нутрий;
Свиней — преципитированной формол-вакциной против пастереллеза овец и свиней или эмульгированной вакциной против пастереллеза свиней. Для вакцинации супоросных свиноматок и поросят в возрасте менее 2 мес используют концентрированную поливалентную формол-квасцовую вакцину против паратифа, пастереллеза и диплококковой септицемии поросят (ППД) или поливалентную инактивированную вакцину против сальмонеллеза ц пастереллеза свиней. В хозяйствах угрожаемой зоны применяют эмульгированную вакцину против пастереллеза свиней.
В хозяйствах, неблагополучных по пастереллезу, обязательны систематические дезинфекция, дератизация, дезинвазия, дезинсекция. Текущая дезинфекция должна быть ежедневной: после утренней уборки помещения, где содержатся больные и подозрительные по заболеванию животные, и все, с чем они соприкасаются, дезинфицируют одним из следующих средств: 10…20%-йвзвесыосве-жегашеной извести или раствором хлорной извести, содержащим 2 % активного хлора, 2%-м раствором гидроксида натрия, 3%-м раствором креолина, 0,5%-м раствором формальдегида.
Трупы животных, павших от пастереллеза, сжигают или перерабатывают на утильзаводах либо обеззараживают в биотермических ямах, шкуры от павших или убитых животных дезинфицируют 1%-м раствором соляной кислоты, разведенной 20%-м раствором поваренной соли.
Спецодежду дезинфицируют текучим паром при экспозиции 1,5ч в паровых камерах, кипячением в 2%-м растворе кальцинированной соды в течение 1 ч или погружением на 2 ч в 1%-й раствор хлорамина при расходовании 5 л раствора на 1 кг вещей. Резиновую и кожаную обувь погружают на 2 ч в 5%-й раствор хлорамина или в 4%-й раствор формальдегида.
Ограничения с хозяйства снимают через 14 дней со дня последнего случая заболевания пастереллезом и после поголовной вакцинации, а также выполнения организационно-хозяйственных и ветеринарно-санитарных мероприятий и заключительной дезинфекции.
После снятия ограничений животных вакцинируют против пастереллеза в течение одного года. Вновь поступившее поголовье иммунизируют в хозяйствах-поставщиках или в период профилактического карантина.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
1. Исследовать под микроскопом готовые мазки из чистой культуры.
2. Разработать схему дифференциальной диагностики пастереллеза.
Читайте также:


