Механизмы иммунитета к чуме
Таксономия: Y.pestisвызывает чуму; отдел Gracilicutes, семейство Enterobacteriaceae, род Yersinia. Возбудитель – Yersinia pestis.
Морфологические свойства: грамотрицательные палочки, овоидной формы, окрашиваются биполярно. Подвижны, имеют капсулу, спор не образуют.
Факультативные анаэробы. Температурный оптимум +25С. Хорошо культивируются на простых питательных средах. Ферментируют большинство углеводов без образования газа. Психофилы - способны менять свой метаболизм в зависимости от температуры и размножаться при низких температурах. Вирулентные штаммы образуют шероховатые (R) колонии, переходные (RS) и сероватые слизистые гладкие авирулентные (S) формы.
Два типа колоний - молодые и зрелые. Молодые с неровными краями. Зрелые колонии крупные, с бурым зернистым центром и неровными краями. На скошенном агаре черед двое суток при +28 С образуют серовато - белый налет, врастающий в среду, на бульоне - нежную поверхностную пленку и хлопковидный осадок.
Биохимические свойства: фенментативная активнсть высокая: ферментация до кислоты ксилозу, синтез плазмокоагулазы, фибринолизина, гемолизина, лецитиназу, сероводород. Рамнозу, мочевину не ферментирует.
Группа белково - полисахаридных и липополисахаридных антигенов: термостабильный соматический О-антиген и термолабильный капсульный V,W антигены. С W-антигеном связывают вирулентность бактерий. Продуцирует факторы патогенности: фибринолизин, плазмокоагулазу, эндотоксин, экзотоксин, капсулу, V,W антигены.
Резистентность: чувствителен к антибиотикам (особенно стрептомицин), нестоек к окружающей среде при высокой температуре.
Обладает патогенным потенциалом, подавляет функции фагоцитарной системы, подавляет окислительный взрыв в фагоцитах и беспрепятственно в них размножается. Факторы патогенности контролируются плазмидами трех классов. В патогенезе выделяют три основных стадии - лимфогенного заноса, бактеремии, генерализованной септицемии. Имеют адгезины и инвазины, низкомолекулярные протеины (ингибируют бактерицидные факторы), энтеротоксин. Часть факторов контролируется плазмидами вирулентности.
Клинические особенности: Инкубационный период – несколько часов до 8 сут. Различают локальные – кожно-бубонная, бубонная; внешне-диссеминированные – первично-легочная, вторично-легочная и кишечная; генерализованная – первично-септическая, вторично-септическая формы чумы. Региональная лимфоаденопатия, энтероколиты, реактивные артриты, спондилит, лихорадка.
Эпидемиология: Чума - классический природноочаговый зооноз диких животных. Основные носители в природе - сурки, суслики, в городских условиях - крысы. В передаче возбудителя - блохи животных, способные заражать человека.
Иммунитет: клеточно-гуморальный, ограничен по длительности и напряженности.
Микробиологическая диагностика:
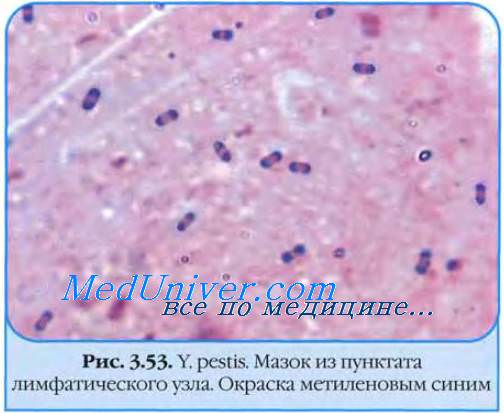
Бактериоскопическое исследование. Из исследуемого материала готовят мазки, окрашивают по Граму и водным раствором метиленового синего. Бактерии чумы представляют собой грамотрицательные палочки овоидной формы Бактериологическое исследование.Исследуемый материал засевают на чашки с питательным агаром. Посевы инкубируют при 25С. Первичное изучение посевов производят через 10ч. К этому сроку появляются колонии, которые образованы вирулентными R-формами. Мало- и авирулентные бактерии формируют S-формы колоний. Идентификацию чистой культуры проводят по морфологии бактериальных клеток, характеру роста, антигенным и биохимическим свойствам, чувствительности к специфическому фагу и биопробе.
На бульоне бактерии образуют пленку; ферментируют многие сахара до кислоты, индола не образуют, желатин не разжижают. Содержат групповой термостабильный соматический антиген и специфический термолабильный капсульный антиген.
Биопроба.Проводится для выделения чистой культуры из материала, загрязненного посторонней микрофлорой. Наиболее чувствительными лабораторными животными являются морские свинки, которым материал вводят подкожно. Внутрибрюшинно материал вводят в том случае, если он не загрязнен другими бактериями. После гибели животных отмечают патологические изменения органов и проводят бактериологическое исследование
Экспресс-методы лабораторной диагностики:
1.Иммунофлюоресцентный метод позволяет обнаружить присутствие возбудителя как в патологическом материале, так и в объектах окружающей среды (вода, воздух), а также в пищевых продуктах и эктопаразитах. С этой целью используют люминесцентную видоспецифическую противочумную сыворотку, люминесцентные противокапсульную и противосоматическую сыворотку.
2.РПГА - для обнаружения антигенов бактерий в материале с помощью стандартной противочумной сыворотки, антитела которой нагружены на эритроциты.
Лечение: антибиотики – стрептомицин, препараты тетрациклинового ряда.
Профилактика: специфическая профилактика - живая ослабленная чумная вакцина EV. Имеется сухая таблетированная вакцина для перорального применения. Для оценки иммунитета к чуме (естественного постинфекционного и вакцинального) может применяться внутрикожная аллергическая проба с пестином.
При всех формах необходима широкая, активная и длительная антибиотикотерапия, которую при тяжелых формах болезни начинают еще до лабораторной верификации диагноза. Эффективно внутривенное применение цефазидима (Cefazidime, Fortum) пo 120 мг/кг/сут или цефтриаксона (Rocephme) по 50-100 мг/кг/сут в сочетании с тетрациклином (Tetracycline) по 3 г/сут в течение 2-3 нед с последующим пероральным приемом доксициклина (Vibramycine) по 200 мг/сут в течение 2-3 мес.
Хорошие результаты получены при парентеральном использовании левомицетина сукцината (Chloramphenicol) по 0,75 г 4 раза в день в течение 30 дней и более, имипенема (Tienam), амоксиклава (Augmentin), азлоциллина (Azlocillin), тикарциллина (Ticarpen), азтреонама (Azactam). Проводятся активная дезинтоксикация и симптоматическая терапия, борьба с потерей массы тела, хирургическое лечение гнойных очагов.
Лечение тяжелых форм проводится в режиме интенсивной терапии.
Профилактика. Основные меры профилактики в эндемических районах осуществляются ветеринарной службой. При завозе инфекции в неэндемические страны главными являются выявление, изоляция и лечение больных, текущая и заключительная дезинфекция в очаге, длительное врачебное наблюдение за переболевшим в связи с возможностью поздних рецидивов. Меры специфической профилактики не разработаны.
Эпидемиологическое значение больных людей неоднозначно. Наиболее опасными являются больные легочной формой чумы. Распространение чумных бактерий воздушно-капельным путем придает инфекции эпидемический характер. Больные другими формами чумы могут представлять значительную опасность при наличии достаточной популяции блох.
В последнее время чума регистрируется в ряде стран Азии (Вьетнам, Китай, Мьянма), Африки (Ангола, Заир, Зимбабве, Кения, Д Р. Конго, Лесото, Ливия, Мадагаскар, Мозамбик, Намибия, Танзания, Уганда, ЮАР) и Америки (Боливия, Бразилия, Перу, США, Эквадор), где ежегодно наблюдались десятки и даже сотни случаев болезни. К концу 80-х годов случаи чумы регистрировались лишь во Вьетнаме, Бразилии, США, Эквадоре, Мадагаскаре. В настоящее время ареал чумы вновь расширился.
Внедрение возбудителя происходит через ранку в месте укуса блохи или через слизистые оболочки желудочно-кишечного тракта, дыхательной системы, глаз. В месте внедрения возбудителя, как правило, изменения отсутствуют, однако возможно возникновение на коже первичного аффекта с воспалением и изъязвлением, накоплением возбудителя (кожная форма). С током лимфы Y. pestis заносятся в ближайшие регионарные лимфатические узлы, где размножаются и накапливаются. Макрофаги лимфатических узлов фагоцитируют возбудитель, но незавершенный фагоцитоз обеспечивает возможность внутриклеточного паразитирования и размножения бактерий.
В лимфатических узлах развивается серозно-геморрагическое воспаление с некрозом лимфоидной ткани, они увеличиваются в размерах, возникает периаденит, узлы образуют воспалительный конгломерат (бубон). Прорьш возбудителя в кровь приводит к бактериемии, эндотокеинемии и диссеминапии в различные органы, лимфатические узлы, удаленные от входных ворот инфекции (полиаденит). Размножение возбудителей во вторичных очагах поддерживает бактериемию и эндотоксинемию. Генерализация инфекции приводит к развитию септической формы с возникновением метастатических очагов практически во всех внутренних органах, включая легкие (вторично-легочная форма). Возможно развитие первичной септической формы, при которой отсутствует заметная реакция регионарных лимфатических узлов на внедрение микроба и заболевание начинается бурно с бактериемии, эндотокеинемии.
При воздушно-капельном заражении может возникнуть первичная легочная форма чумы, которая отличается тяжелым течением, развитием пневмонии с серозно-геморрагическим воспалением и некротическим компонентом.
Эндотоксинемия инициирует каскад реакций, приводящих к инфекционно-токсическому шоку. В патогенезе чумы важное значение придается поражению кровеносных сосудов, развитию диссеминированного внутрисосудистого свертывания крови.
Патологоанатомическое исследование подтверждает признаки геморрагической септицемии. Увеличенные и спаянные лимфатические узлы имеют очаги некроза и кровоизлияний, содержат огромное количество возбудителей чумы. Характерны обширные множественные кровоизлияния в кожу, слизистые и серозные оболочки, поражение кровеносных сосудов, стенки которых инфильтрованы клеточными элементами с серозным пропитыванием и некрозом всех слоев Определяется увеличение селезенки и печени, значительные дистрофические и некробиотические изменения органов.
В легких выявляется лобулярная или сливная бронхопневмония с обильным серозно-геморрагическим экссудатом. Токсическое поражение эндотелия сосудов и сдавление их межальвеолярным экссудатом способствует быстрому развитию некроза легочной ткани. Описанные изменения в легких могут явиться как результатом первичного поражения, так и следствием генерализации процесса при других клинических вариантах чумы (вторично-легочная чума).
Врожденный иммунитет к чуме отсутствует. Перенесенное заболевание оставляет прочный иммунитет, повторные случаи болезни редки.
Краткая клиническая характеристика чумы у животных. Среди основных источников инфекции — грызунов — чума протекает либо в виде бубонов с острым течением, либо с более медленным, хроническим или латентным течением. Бактеремия наблюдается в большинстве случаев.
Как правило, летальность среди грызунов значительная, при возникновении эпизоотии они покидают свои стации и перемещаются на большие расстояния, способствуя диссеминации чумы по территории. У верблюда чума может протекать либо в виде бубонной, либо септической формы.
Основные клинические проявления чумы у человека. Инкубационный период — от нескольких часов до 1 — 2 суток, обычно не более 3—6 суток (при всех формах).
Чума протекает в виде трех основных клинико-патогенетических форм:
а) бубонной,
б) первично-септической и
в) легочной (первичной и вторичной).
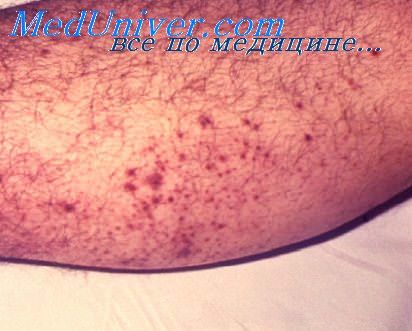
Бубонная чума — наиболее часто встречающаяся форма, преобладают бедренные и паховые бубоны, которые развиваются в течение нескольких дней до размеров куриного яйца. В случае доброкачественного течения бубон нагнаивается, рассасывается или склерозируется. Опасны подмышечные бубоны, дающие септические осложнения.
Заболевание сопровождается высокой температурой, интоксикацией с поражением центральной нервной системы, падением кровяного давления. В 3—4% случаев отмечается первичный аффект на коже. Наиболее частым осложнением бубонной чумы является сепсис со вторичной пневмонией, менингитом. Чумная пневмония дает начало заражениям первично-легочной чумой. Летальность при нелеченной бубонной чуме от 30% до 50% случаев, своевременное лечение снижает этот показатель до 5—6%.
Первично-септическая форма чумы возникает при массивном заражении. Симптомы ее очень бурно развиваются — буйный бред, адинамия и прострация, геморрагическая сыпь, поражение гортани и миндалин. Смерть наступает в 100% случаев на 2—4-й день заболевания. Эта форма встречается очень редко.
Легочная форма чумы (первичная) является результатом аэрозольного заражения. Начало заболевания внезапное. Появляются озноб, боли в пояснице, конечностях, лицо красное, одутловатое, беспокойство, бред, Температура в течение нескольких часов достигает 40— 40,5°.
Отмечаются боли в груди, кашель и выделение вначале слизистой, а затем слизисто-гнойной и геморрагической мокроты во все возрастающих количествах, обычно жидкой консистенции. Перкуторно-аускультативные данные скудны, несмотря на очаги пневмонии. Больные погибают в течение 2—3 дней.
Вторичная легочная форма протекает аналогично первичной, но является осложнением бубонной чумы.
Наиболее эффективны для лечения чумы антибиотики стрептомицинового (стрептомицин, дигидрострептомицин, пасомицин) и тетрациклинового (окситетрациклин, хлортетрациклин) ряда, которые можно применять раздельно или в определенном сочетании. Вводят детоксицирующие средства (растворы глюкозы парентерально), сердечные и сосудистые медикаменты, витамины, кислород.

Картина эпидемии чумы
Иммунитет при чуме. После перенесенной чумы повторные заболевания отмечаются казуистически. Однако в этом надо усмотреть не только напряженность иммунитета, по и крайне редкую случайность повторного заражения человека.
Ведущий механизм иммунитета при чуме представляется как выработка антител и фракции I и антигена комплекса VW. Эти антигены обладают выраженной антифагоцитарной активностью, а образованные по отношению к ним сывороточные антитела (в конце первой и на второй неделе заболевания) облегчают путем опсонизации возбудителя фагоцитоз чумных палочек и внутриклеточную инактивацию микробов полиморфоядерными лейкоцитами.
На высоте иммунитета фагоцитоз носит завершенный характер, при его ослаблении — незавершенный. Последний отмечается при снижении титров антител к указанным антигенам. В то же время у лиц, выздоровевших от чумы, наблюдался относительно низкий уровень антитоксинов (фракция П), в противоположность антикапсульным антителам (фракция I), которые определялись в достаточно высоких титрах на протяжении нескольких месяцев.
Антитела к V-антигену (белковому) обладают протективным свойством, и в экспериментальных условиях защищали мышь при заражении чумными палочками; антитела к липопротеиновому W-антигену таким свойством не обладали.
Антитела к первой фракции и к токсину чумного микроба закономерно нарастают после иммунизации живой ослабленной противочумной вакциной из штамма EV. Однако наибольшее признание получила концепция о роли неспецифических факторов резистентности в формировании противочумного иммунитета, в частности фагоцитоза на уровне лимфатических узлов и местного воспалительного очага (преимущественно идет речь о бубонной чуме).
В целом иммунитет зависит от физиологической активности клеточных элементов мезодермальной ткани.
При чуме описан также феномен сенсибилизации Т-лимфоцитов (на основе иммунизации живой вакциной), наступающий закономерно и выявляемый при помощи кожной пробы с аллергеном-пестином.
Почему лихорадка Эбола пугает обывателей больше чумы и есть ли эффективная вакцина от этой инфекции, рассказал в интервью Forbes.kz глава Казахского научного центра карантинных и зоонозных инфекций им. Масгута Айкимбаева Бахыт Атбашар
Почему гепатит актуальнее чумы
F : Бахыт Бахияулы, центр, который вы возглавляете более 15 лет, является аккредитованным центром ВОЗ по мониторингу и изучению чумы. В средние века эта инфекция убила сотни миллионов людей, но сегодня в новостях обсуждают Эболу и гепатит. Чума побеждена?
- К сожалению, нет. Чума в прямом смысле слова живет рядом с нами, и мы лишь более или менее успешно контролируем ее. В Казахстане чума была всегда, эндемичной территорией инфекции является 40% страны. Обширные пустынные районы на юге, в центре и на западе Казахстана заселяют грызуны, на которых возбудитель чумы и паразитирует. Переносчиками выступают блохи.
F : За последние 15 лет в Казахстане случаи заболевания людей чумой зарегистрированы в 2001, 2002, 2003: 7 больных, 2 летальных исхода. Эпизоотии же выявляются в разных регионах практически ежегодно. Как удается контролировать инфекцию в ситуации, когда мы практически живем в ее природном очаге?
- В Казахстане существует развитая противочумная система. Это достаточно мощная, организованная и структурированная служба по контролю особо опасных инфекций на всей территории страны. Первая противочумная станция начала работу ровно 100 лет назад в Уральске. Наш центр вместе с группой противочумных станций был одной из 6 подобных структур бывшего СССР (остальные 5 расположены в России). Сегодня КНЦКЗИ является известным в мире центром исследований особо опасных инфекций, в том числе вирусных. Мы полностью оснащены всей самой современной техникой, готовим специалистов для всей Центральной Азии, выпускаем более 40 препаратов, которые успешно продаются в разных странах.
Природные очаги у нас отличаются активностью, их надо постоянно обследовать и проводить санитарно-профилактические работы для предупреждение вспышек. Это прежде всего мониторинг всех случаев заболеваний, где картина симтомов напоминает чуму. При малейшем подозрении на территории вводится режим карантина, больной и все, кто с ним контактировал, изолируются. Как показывает практика, чаще всего люди заражаются от больных верблюдов.
Ученые рассчитывают на новую лабораторию
F : Чем чума привлекает исследователей?
- Чумная палочка имеет свои секреты, которые ученые пытаются раскрыть уже более 100 лет. Например, с появлением антибиотиков большую часть заразившихся (но не всех) удается спасти. А вакцины, которая бы гарантировала близкую к 100% защиту от заражения, нет до сих пор. То есть вакцины существуют, одну из них мы производим сами. Наша вакцина из живых микробов снижает заболеваемость в несколько раз, а при заражении ослабляет симптомы болезни. В других странах выпускают вакцины из мертвых бактерий, пытаются разрабатывать препараты на основе новых методов генной инженерии. Но полной защиты, которую дают, например, вакцины против оспы и туляремии, все существующие противочумные вакцины пока обеспечить не могут.
F : Не пытались ли ученые изучить чуму с помощью новейших методов исследования?
Всеми этими проблемами мы в КНЦКЗИ активно занимаемся. Например, выяснилось, что вирулентность (заразность) штамма чумы, распространенного в популяции грызунов на территории Казахстана, прямо зависит от сопротивляемости болезни организма самих грызунов. У сурка, живущего в горах, сопротивляемость чуме выше, и микроб на этой территории более заразен, чем в степи.
Около 15 лет назад наш центр активно включился в международное сотрудничество, мы постоянно работаем с учеными из разных стран, с экспертами ВОЗ. Один из авторов статьи, которая стала поводом для нашей беседы, профессор Нилс Стенсет из Университета Осло, - по основной профессии математик. Другие авторы - профессор Майкл Бегон из Университета Ливерпуля – крупнейший эколог, а профессор Елизабет Карниел сегодня возглавляет департамент микробиологии Института Пастера в Париже. С этими учеными мы провели несколько исследований в Казахстане, по итогам которых создали атлас распостранения особо опасных инфекций на нашей территории. Для его составления, например, была использована даже съемка из космоса. Высокая цитируемость нашей совместной публикации говорит об интересе ученых всего мира к проблеме чумы, которая по-прежнему актуальна.
По межправительственному соглашению между Казахстаном и США в следующем году в Алматы будет открыта новая лаборатория мирового уровня, здание уже строится. Надеемся создать тут один из ведущих мировых центров ислледования инфекций с применением новейших методов генетики и биоинформатики.
F : Если в Казахстане ситуация в целом под контролем, то какова вероятность того, что инфекция может быть завезена из других стран и регионов?
- Это вполне возможно. Чума фиксируется на всех континентах, кроме Австралии. Вспышки случаются и в отсталых странах Азии, и в благополучных США, но большинство случаев заболевания сегодня фиксируется в Африке. Особенно тяжелая ситуация на Мадагаскаре: десятки случаев из года в год. Там чуму переносят крысы, которые приспособились жить в городах, рядом с людьми. Много случаев во Вьетнаме, где крыс употребляют в пищу. У нас, к счастью, для крыс не совсем подходящий климат.
Кроме того, теоретически чумная палочка может мутировать и приобрести новые, опасные для людей свойства. Но вероятность того, что это случится, невелика. Сегодня известно, что все массовые пандемии на протяжении тысячелетий были вызваны одними и теми же штаммами бактерий. К счастью, природными носителями чумы являются грызуны, а не люди. Более заразный микроорганизм уничтожит собственных носителей и в результате погибнет сам.

ИММУНИТЕТ (от лат. immunitas — освобождение от чего-либо), невосприимчивость организма к воздействию болезнетворных агентов, продуктов их жизнедеятельности, а также генетически чужеродных веществ, обладающих антигенными свойствами. И. рассматривается как способность организма отличать чужеродный материал от “своего” (напр., “чужой” белок от “своего”), что жизненно важно для сохранения гомеостаза . И.— проявление естеств. и искусств. отбора, результат длительной эволюции, обусловленной системой наследств. полиморфизма (за счёт [счет] распространения повышающих выживаемость мутантных аллелей) животных, а также изменчивостью организма паразита (см. Резистентность организма ). И. возможен к инфекционным и неинфекционным факторам. Наиболее частое проявление И.— невосприимчивость организма к инфекц. агентам (инфекционный И.).
Инфекционный иммунитет . По происхождению различают естественный, или врождённый [врожденный] , и приобретённый [приобретенный] , или адаптивный, И.
Естественный иммунитет — видовой признак, присущий животному и человеку и передающийся по наследству. Примеры врождённого [врожденного] И.— невосприимчивость кр. рог. скота к чуме свиней или невосприимчивость свиней к чуме кр. рог. скота. Животные невосприимчивы к холере, сифилису человека и др. Врождённый [Врожденный] И. наблюдается у взрослых животных. У новорождённых [новорожденных] часто видовой устойчивости нет, возможно их заражение возбудителями мн. болезней, не свойственных им во взрослом состоянии. Следует учитывать у невосприимчивых организмов возможность скрытой инфекции (напр., носительство вируса чумы свиней и чумы собак у человека, вируса инфекц. энцефаломиелита лошадей у голубей и фазанов). Среди восприимчивых к инфекту видов существуют породы, популяции и линии животных, отличающиеся высокой к нему устойчивостью, напр. устойчивостью алжирских овец к сиб. язве. Наблюдаются также случаи индивидуальной невосприимчивости, когда отдельные особи, находясь в очаге заразной болезни, не заболевают, напр. кр. рог. скот — ящуром, овцы — оспой. Природа естеств. И. недостаточно изучена. Однако установлено, что отсутствие в животном организме даже одного к.-л. важного для микроба вещества (метаболита) защищает организм от заселения его этим микроорганизмом.
Приобретённый [Приобретенный] иммунитет возникает у животного вследствие естеств. переболевания (естественно приобретенный И.) или в результате искусств, иммунизации (искусственно приобретённый [приобретенный] И.). Приобретённый [Приобретенный] И, бывает активный и пассивный. Активный И. вырабатывается либо после перенесённой [перенесенной] инфекции, либо в результате вакцинации . В обоих случаях в организме вырабатываются антитела против возбудителя. Активный И. может быть весьма напряжённым [напряженным] и длительным. Пассивный, или точнее сывороточный, И. (по Мечникову) создаётся [создается] введением в организм иммунной сыворотки, содержащей готовые антитела; наступает через неск. часов, но проявляется непродолжительно (10— 14 сут, реже до 3 нед). Разновидностью пассивного И. является колостральный (молозивный) И., возникающий у новорождённых [новорожденных] организмов при передаче им готовых антител (иммуноглобулинов) с молозивом от матери. Для создания колострального И. в отношении ряда инфектов вакцинируют матерей в последней стадии беременности, напр. для профилактики анаэробной дизентерии ягнят, колибактериоза поросят, телят. При нек-рых болезнях И. связан с персистенцией (присутствием) возбудителя в организме (туберкулёз [туберкулез] , бруцеллёз [бруцеллез] , инфекц. анемия лошадей и др.), такую форму И. наз. нестерильной, или премуницией. Учение о нестерильном И. нашло практич. применение в вакцинации человека и животных живыми вакцинами (из наследственно изменённых [измененных] форм патогенных микробов) против туберкулёза [туберкулеза] , бруцеллёза [бруцеллеза] и др. болезней. И., сохраняющийся при отсутствии в организме возбудителя болезни, наз. стерильным. По характеру действия защитных механизмов на микробы или их продукты различают антимикробный И., при к-ром происходит обезвреживание возбудителя, и антитоксич. И., когда бактерии не разрушаются, но происходит нейтрализация их токсинов (напр., при столбняке, ботулизме). В ряде случаев при иммунизации микробов одного вида развивается устойчивость не только к ним, но и к др. возбудителям. Такого рода И. получил название перекрёстного [перекрестного] , или гетероиммунитета. Так, установлена возможность гетероиммунизации свиней против чумы с помощью вируса диареи кр. рог. скота. Неинфекционный иммунитет . Учение об этом виде И.— важнейшее направление совр. иммунологии (наука об И.), в основе её [ее] лежит концепция о генетич. несовместимости. К. Ландштейнер (1900) впервые установил, что люди различаются по группам крови и что причина тяжёлых [тяжелых] осложнений при переливании крови, связана с несовместимостью введённой [введенной] крови с группой крови реципиента. С проявлением несовместимости связано действие у человека резуса-фактора . Определение группы крови и эритроцитарных антигенов у животных важно для племенной работы и аттестования животных, т. к. антигенные факторы эритроцитов наследуются. Актуальное значение приобрели вопросы трансплантационного И. Несовместимость тканей и органов при трансплантации проявляется в их отторжении через определённый [определенный] период. Проблема преодоления тканевой несовместимости в ветеринарии возникает при осуществлении массовой трансплантации оплодотворённых [оплодотворенных] яйцеклеток в матку приёмной [приемной] матери для воспроизведения высокопродуктивных животных. При нек-рых т. н. аутоиммунных болезнях (ревматизм, инфаркт миокарда, нефрит и др.) наступает распад тканей, сопровождающийся появлением “собственных”, чуждых антигенов (аутоантигенов), на к-рые организм реагирует образованием аутоантител. Установлено, что эмбрион при контакте с чужеродным антигеном не вырабатывает против него антител и во взрослом состоянии организм остаётся [остается] к этому антигену ареактивным. Такое состояние толерантности можно вызвать у взрослых организмов при перегрузке их чуждыми антигенами. К неинфекц. И. относятся иммунные реакции, к-рые бывают причиной аллергии и анафилаксии .
Механизмы иммунитета . В создании И, участвует весь организм как целостная система, защитные механизмы к-рого взаимно связаны и действуют в условиях нейрогуморальной регуляции. Наряду с факторами специфич. иммунной системы (антиген — антитело) действуют многочисленные факторы общей неспецифич. резистентности. В основе иммунологии лежит учение об антигенах и антителах. Судить о каждом из них можно лишь на основании возникшей между ними реакции “антиген — антитело”. Молекула антитела реагирует с антигенными детерминантами при помощи соответствующих т. н. активных центров, расположенных на её [ее] поверхности. В соответствии с оказываемым действием на антигены (микробы и чуждые клетки) различают антитела нейтрализующие, лизирующие, коагулирующие, способствующие фагоцитозу. Помимо этих гуморальных (циркулирующих) антител, существуют клеточные антитела, связанные с поверхностью клетки. При взаимодействии последних с антигеном наступает повреждение соответствующих тканей (при аллергии или иммунопатологич. процессе). Реализация специфич. иммунного ответа на антигенный стимул осуществляется иммунной системой, морфологич. субстратом к-рого являются лимфоидные клетки гл. обр. лимфатич. узлов, селезёнки [селезенки] , костного мозга, миндалин, тимуса, у птиц — фабрициевой сумки. Различают 3 осн. этапа в развитии иммунного процесса — информация органа И. о поступившем антигене, его переработка в органе И. и выдача иммунного ответа. Эти этапы обеспечивают определённые [определенные] категории иммунокомпетентных клеток — лимфоциты, плазматич. клетки и моноциты (макрофаги). Центр. место занимают малые лимфоциты 2 видов: долгоживущие тимусзависимые Т-лимфоциты и короткоживушие В-лимфоциты. Т-лимфоциты, прошедшие через тимус или возникшие в нём [нем] , первоначально распознают чужеродный антиген, а затем становятся хранителями иммунологич. памяти и переносчиками этой информации антителообразующим клеткам. Т-лимфоциты, с др. стороны, участвуют в реакциях отторжения трансплантатов и аллергич. реакциях “замедленного типа”. В-лимфоциты образуются в костном мозге. Будучи активизированы Т-лимфоцитами, они трансформируются в плазматич. клетки, непосредственно образующие антитела против распознанного антигена. Установлено, что лимфоцитами как иммунокомпетентными клетками можно перенести в др. организм мн. свойства иммунного организма — противотканевой (трансплантационный) И., иммунологич. память, аллергич. активность. С помощью Т- и В-лимфоцитов осуществляются иммунологич. надзор и память в отношении данного чуждого антигена. Т. о., различают иммунный ответ на антигенный стимул двух типов: гуморальный (продукция антител) и клеточный (реакция замедленной гиперчувствительности, отторжение клеток трансплантата, аутоиммунные реакции). Реализация гуморального иммунного ответа связана с В-лимфоцитами, клеточного — с Т-лимфоцитами, в обоих случаях — при участии макрофагов.
К общим анатомо-физиологическим факторам И. относятся: 1) кожные, слизистые и лимфатические барьеры, 2) воспаление и фагоцитоз , 3) лизоцим и другие секреты желез органов пищеварения, 4) гуморальные факторы (нормальные антитела, комплемент, пропердин, ингибиторы вирусов), 5) интерферон , 6) повышенное мочевыделение и диарея, помогающие организму освободиться от некоторой части вирусов и патогенных бактерий, 7) изменение обменных процессов и темп-ры тела. Эффективность защитного действия указанных факторов во многом зависит от условий кормления и содержания животных. Отрицательно влияют на формирование И., а также провоцируют скрытую инфекцию различные стрессовые реакции (перегрев, охлаждение, продолжительная инсоляция, переутомление и т. п.). В иммунной защите организма значительна роль гормонов гипофизо-адренокортикальной системы.
Практическое значение И . На учении об И. базируются специфич. диагностика, профилактика и терапия инфекц. болезней животных, являющихся важным звеном в общем комплексе противоэпизоотич. мероприятий. Искусств. иммунизация — по существу направленное изменение защитных сил организма, создание в нём [нем] новых полезных свойств устойчивости. Основа специфич. диагностики — серодиагностика, построена на принципе строгой специфичности соединения антигена и антитела. При помощи заведомо известного антитела можно обнаружить искомый антиген и, наоборот, с помощью антигена найти соответствующее ему антитело (см. Серологические реакции ). С помощью типоспецифич. диагностич. сывороток удаётся [удается] установить тип изучаемого возбудителя (эшерихии, сальмонеллы, лептоспиры и др.). Типирование циркулирующего возбудителя важно для иммунологич. анализа эпизоотич. процесса и отбора соответствующего его типу иммунного препарата. В вет.-сан. экспертизе серологич. методами определяют в мясных продуктах (колбаса и др.) примесь мяса определённых [определенных] видов животных. Широко применяется в ветеринарии аллергическая диагностика (бруцеллёз [бруцеллез] , туберкулёз [туберкулез] и др.).
Лит.: 3дродовский П. Ф., Проблемы инфекции, иммунитета и аллергии, 3 изд., М., 1969; Герберт У. Дж., Ветеринарная иммунология, пер. с англ., М., 1974; Коляков Я. Е., Иммунитет животных, М., 1975.
Читайте также:



