Лабораторная диагностика бруцеллеза гост 33675-2015
| Статус документа: | Введен впервые |
| Дата начала действия: | 01 янв. 2017 г. |
| Количество страниц: | 20 стр. |
| Когда и где опубликован: | Бюллетень нормативных актов федеральных органов исполнительной власти от 20 апреля 2009 г. N 16 |
| Страна-разработчик: | Российская Федерация |
| Разработан: |
|
| Издан: |
|
| Утвержден: |
|
| Содержание: | 1 Область применения 2 Нормативные ссылки 3 Термины, определения и сокращения 4 Условия выполнения исследований и требования безопасности 5 Средства измерений, оборудование, питательные среды, реактивы, посуда, животные и материалы 6 Отбор проб 7 Бактериоскопический метод 8 Культуральный метод 9 Идентификация выделенных культур 10 Биологический метод 11 Молекулярно-генетический метод исследований Приложение А (справочное) Дифференциальные свойства видов и биоваров рода Brucella |
| Ссылки в документе: |
|
| Разделы классификатора: |
|
Отзывы
Нет отзывов, пока еще.
ГОСТ 33675-2015 Животные. Лабораторная диагностика бруцеллеза. Бактериологические методы
Стандарт распространяется на все виды млекопитающих животных и устанавливает бактериологические методы лабораторной диагностики бруцеллеза.
Возбудители бруцеллеза (Brucella melitensis, Brucella abortus, Brucella suis и Brucella canis) высоко контагиозны и работа с ними проводится в специализированных лабораториях особо опасных инфекций. Постановку серологических реакций и аллергических проб для диагностики бруцеллеза производят соответственно в обычных микробиологических лабораториях и больничных условиях.
Главным резервуаром бруцелл являются домашние сельскохозяйственные животные, а также другие виды животных, от которых человек заражается преимущественно контактным или контактно-бытовым, реже алиментарным путем. Клинические проявления бруцеллеза многообразны, поражаются лимфатическая, сосудистая, гепато-лиенальная системы и особенно опорно-двигательный аппарат Методы микробиологической диагностики бруцеллеза представлены в схеме 7.
Схема 7. Микробиологическая диагностика бруцеллеза
|
|
Серологический метод- постановка РА с сывороткой крови больного (реакция Райта, ставят в начале 2-й недели болезни, диагностический титр 1:200 и выше), ускоренной РА на стекле (реакция Хеддльсона), РСК и ИФА.
Диагностикумом в реакции Райта и Хеддльсона является взвесь убитых бруцелл с красителем генциановым фиолетовым или метиловым фиолетовым.
Реакцию агглютинации Хеддльсона ставят на стеклянной пластинке, на которую наносят микропипеткой неразведенную исследуемую сыворотку в количествах 0,08; 0,04; 0,02; 0,01 и 0,02 мл, добавляют по 0,03 мл бруцеллезного диагностикума, кроме последней дозы, в которую вносят 0,03 мл ФР (контроль сыворотки). Контролем диагностикума является смесь из 0,03 мл антигена и 0,03 мл ФР. Все капли перемешивают стеклянной палочкой или бактериологической петлей и после легкого покачивания стекла наблюдают за появлением мелкозернистого окрашенного агглютината. Отсутствие агглютинации во всех пробах сыворотки оценивается как отрицательная реакция, наличие агглютинации в 1-й пробе (0,08 мл сыворотки) - сомнительная, во 2-й (0,04 мл) - слабоположительная, в 3-й или 4-й пробах (0,02-0,01 мл) - положительная, во всех пробах - резко положительная реакция. Поскольку реакция агглютинации Хеддльсона иногда бывает положительной у здоровых людей за счет нормальных антител, она обязательно подтверждается реакцией Райта.
РИФ, РНГА, РСК и особенно ИФА более чувствительны, чем реакция агглютинации. Для ранней диагностики бруцеллеза особую ценность имеет ИФА, позволяющий выявить в сыворотке больных антибруцеллезные антитела класса IgM,которыев отличие от IgG появляются в ранние сроки болезни, свидетельствуя о свежем инфицировании.
Аллергический метод –постановка внутрикожной аллергической пробы Бюрне с 15-20 дня заболевания. Учет реакции проводится через 24-48 часов, положительной считается реакция в случае появления на месте введения аллергена (бруцеллина) болезненности, гиперемии и инфильтрации кожи диаметром 3 см и более. Положительная аллергическая реакция на бруцеллин сохраняется в течение длительного времени после перенесенного бруцеллеза, а также после прививки.
Бактериологический метод- посев крови для выделения гемокультуры в 2 флакона с 50 мл печеночного или асцитического бульона (рН 7,1-7,2) или МПБ с добавлением 1 % глюкозы, 2 % глицерина и антифаговой сыворотки (для инактивации бруцеллезного бактериофага) в первые дни болезни при наличии лихорадки. При отрицательных результатах исследование повторяют, т.к. бактериемия наблюдается в течение 1 года и более.
Один флакон выращивают в обычных аэробных условиях, другой — в герметично закрытом сосуде с 10 % углекислого газа (или СО2-инкубаторе) при температуре 37 0 С до 1 месяца, делая пересевы на скошенный печеночный агар или эритрит-агар каждые 4-5 дней. На жидких средах бруцеллы растут с образованием легкого помутнения и небольшого слизистого осадка, на плотных средах в виде округлых, диаметром до 5 мм, серовато-белых, блестящих, прозрачных с янтарным оттенком в проходящем свете колоний. Типичные колонии пересевают на скошенный агар и идентифицируют выделенную культуру до уровня вида.
Выполняются также посевы исследуемого материала в желток свежего куриного яйца или в желточный мешок куриного эмбриона с последующей их инкубацией в течение 5 дней при 37 0 С и пересевом содержимого желточного мешка на плотные и жидкие питательные среды для выделения чистой культуры бруцелл.
Бруцеллы идентифицируют на основании изучения морфологических (рис. 13 - грамотрицательные коккобактерии), культуральных, биохимических (они не ферментируют уг-
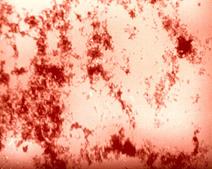
Рис. 13. Возбудитель бруцеллеза (Brucella melitensis). Окраска по Граму. Мелкие грамотрицательные коккобактерии.
леводы, не свертывают молоко и не разжижают желатину, выделяют сероводород), антигенных свойств (постановка РА с моноспецифическими сыворотками против антигеновА, М, R), чувствительности к специфическому бактериофагу и бактериостатическому действию анилиновых красителей (табл. 8).
Таблица 8.Дифференциация основных видов бруцелл
| Признак | Вид бруцелл | ||
| Br. melitensis | Br. abortus | Br. suis | |
| Условия культивирования | аэробные | 10% СО2 | аэробные |
| Рост на средах с красителями: | |||
| фуксином 1:50000 | + | + | - |
| тионином 1:25000 | + | - | + |
| пиронином 1:200000 | + | + | - |
| Образование Н2S | - | ± | ± |
| РА с монорецепторными сыворотками | |||
| А | ± | ± | + |
| М | ± | ± | ± |
| Чувствительность к бруцеллезному фагу | - | + | ± |
– Олег Дмитриевич, чем продиктовано принятие нового ГОСТа?
– Если быть точным, то в действие введен ГОСТ 34105-2017 (Межгосударственный стандарт. Животные. Лабораторная диагностика бруцеллеза. Серологические методы). Его появление обусловлено не только внедрением в российскую ветеринарную диагностическую практику новых серологических тестов, в частности, реакции непрямой гемагглютинации, вариантов иммуноферментного и иммунохроматографического анализа, но и целесообразностью совершенствования диагностики – прежде всего повышения ее оперативности и специфичности.
Разрабатывать этот ГОСТ начинали одновременно с подготовкой по распоряжению Минсельхоза России новых Ветеринарных правил осуществления профилактических, диагностических, ограничительных и иных мероприятий, установления ограничений, направленных на предотвращение возникновения, распространения и ликвидацию очагов бруцеллеза животных в России (далее – новые правила). Сейчас проект правил проходит стадию согласования различными ведомствами.
Разумеется, оценка диагностических титров серологических реакций при диагностике бруцеллеза в ГОСТе и новых правилах будет одинаковой. Поэтому считаю, что до выхода в свет этих правил ветеринарные диагностические лаборатории не должны переходить на работу по ГОСТ 34105-2017.
– Потому что между ГОСТом и действующими в настоящее время Ветеринарными правилами по борьбе с бруцеллезом (ВП 13.3.1302-96) сохраняются существенные различия.
– На какие положения стандарта вы хотели бы обратить внимание специалистов в первую очередь?
– К сожалению, несмотря на то, что ГОСТ34105-2017 согласовывался специалистами стран Евразийского экономического союза, в нем сохраняются недочеты.
– Одним из таких недочетов является предписание проводить дополнительное исследование образцов сыворотки в РИД и ИФА с ОПС-антигеном в случае выявления в группах животных, иммунизированных и не иммунизированных против бруцеллеза и положительно реагирующих по результатам серологических исследований в ряде реакций. Такое требование предусмотрено пп. 8.2, 8.3 и 8.4 данного ГОСТа в целях уточнения диагноза.
– Если речь идет об уточнении диагноза, то почему вы называете это недочетом?
– Дело в том, что, по состоянию на сегодняшний день, диагностические тест-системы для иммуноферментного анализа в рамках госзаказа выделяются в ограниченном количестве. Представители большей части ветеринарных диагностических лабораторий утверждают, что им такие тест-системы будут недоступны. Соответственно, непроведение серологического тестирования в ИФА, согласно ГОСТу, будет расценено представителями надзорных учреждений как нарушение.
С учетом разницы в диагностической чувствительности между РИД с ОПС-антигеном и ИФА с ОПС-антигеном исследование последним методом является принципиальным. В противном случае при выполнении серологического исследования только в РИД с ОПС-антигеном объективность его результатов может быть сомнительной.
Не буду вдаваться в подробности других имеющих принципиальное значение недочетов, отмечу лишь, что после их обсуждения и согласования с диагностическими ветеринарными лабораториями должно быть инициировано внесение изменений в ГОСТ 34105-2017.
– Какие ошибки чаще всего допускают при лабораторной диагностике бруцеллеза?
– О существенных ошибках мне неизвестно. К тому же мы не контролируем работу лабораторий. Однако, когда специалисты ряда лабораторий обращаются к нам, чтобы обсудить спорные результаты исследований, кажется, что некоторые из них не знакомы со всеми документами, регламентирующими диагностику болезни. Впрочем, большинство специалистов проявляют инициативу и демонстрируют познания, достаточные для диагностики болезни. Не менее важно и то, что они заинтересованы в получении объективных результатов.
– Какова сегодня эпизоотическая ситуация по бруцеллезу среди крупного и мелкого рогатого скота на территории России?
В период с 2013 по 2017 годы количество неблагополучных по бруцеллезу мелкого рогатого скота пунктов, остававшихся на конец года, составляло 30, 28, 22, 17 и 14. Число заболевших животных – 1,9; 2,5; 2,2; 1,22 и 1,01 тыс. голов.
– Можно утверждать, что динамика положительная?
– Система контроля бруцеллеза животных в стране несовершенна?
– Сложившуюся систему контроля бруцеллеза животных в Российской Федерации можно считать удовлетворительной. Однако это не исключает необходимости ее совершенствования. Прежде всего в части сокращения временных затрат при установлении диагноза за счет более широкого применения средств дифференциальной диагностики болезни, а именно реакции иммунодиффузии и иммуноферментного анализа с ОПС-антигеном, возможно, за счет сочетания средств диагностики.
Важным представляется проведение исследований и установление возможных, максимально ранних сроков серологического исследования вакцинированных животных, особенно мелкого рогатого скота, иммунизированного агглютиногенными вакцинами. В настоящее время этим никто не занимается.
Не стоит забывать, что самый эффективный способ оздоровления неблагополучного хозяйства предусматривает ликвидацию всего поголовья в таком хозяйстве. Однако данный способ не слишком широко применяется в нашей стране. (Должен отметить, что в проекте новых правил его применение регламентировано в большем количестве случаев, нежели в Ветеринарных правилах 13.3.1302-96.) Поэтому перед проведением вакцинации животных в рамках оздоровления путем вакцинации и последующих периодических серологических исследований особенно важно максимально полно удалять инфицированных особей из групп животных.
– В нынешних условиях это реально?
– Я бы сказал, что это возможно за счет введения животным неблагополучных по бруцеллезу хозяйств провоцирующих неагглютиногенных антигенов, в отличие от применяющихся вакцин, с последующим серологическим исследованием и удалением выявленных больных животных.
При этом не могу не отметить, что организации-производители, планировавшие выпускать такие антигены, зарегистрированные ими ранее в Российской Федерации, пока не справляются со своими планами и не понятно, справятся ли.
– Что препятствует повышению эффективности системы контроля бруцеллеза?
– На мой взгляд, совершенствование этой системы не представляется возможным без решения целого ряда задач. Во-первых, нужно создавать в регионах, неблагополучных по бруцеллезу, мясокомбинаты и бойни, обеспечивающие убой больных животных, что решает проблему неполного, несвоевременного и антисанитарного убоя. При этом следует компенсировать владельцам убыток. К сожалению, он неизбежен при изъятии больных животных, прежде всего в условиях ведения отгонного животноводства.
Во-вторых, следует запретить введение нетелей и ярок в стада и отары взрослых животных. В-третьих, нужно ограничить концентрацию поголовья в хозяйствах молочного направления, которые находятся на территориях, неблагополучных по бруцеллезу. В-четвертых, необходимо оперативно завершать реализуемую в стране программу идентификации (мечения) животных.
– Несложно предположить, что для решения этих задач требуются немалые финансовые вложения.
– Конечно, но если эти задачи не решить, то искоренить бруцеллез на территории нашей страны не получится.
– Лаборатория качества и стандартизации бактерийных лекарственных средств ВГНКИ как структурное подразделение Россельхознадзора разрабатывает образцы сыворотки, которая применяется для диагностики бруцеллёза. Соответствует ли она эталонным стандартам МЭБ?
– Более 30 лет тому назад в лаборатории была разработана Национальная стандартная сыворотка анти-Бруцелла абортус, активность которой составляет 1000МЕ агглютинирующих антител/см 3 . Сыворотка предназначена для стандартизации антигена для реакции агглютинации (РА), применяемой при серологической диагностике бруцеллеза. Периодически с интервалом в пять-семь лет лаборатория готовит очередную серию сыворотки взамен предыдущей. Каждая серия стандартизуется по международной эталонной сыворотке с использованием международного стандарта антигена, предоставляемых Международным эпизоотическим бюро.
Национальная стандартная сыворотка используется и для оценки активности антигенов для других серологических реакций. Но в этой части с учетом современных требований и рекомендаций МЭБ она нуждается в совершенствовании и в изменении ее статуса.
– В заключение расскажите, пожалуйста, о приоритетных задачах вашей лаборатории.
– Традиционно лаборатория выполняет регистрационные и сертификационные испытания, осуществляет инспекционный контроль сертифицированной продукции, а также лекарственный мониторинг и выборочный контроль качества образцов средств специфической профилактики и диагностики бруцеллеза животных. Наряду с этим предполагается выполнение научно-исследовательской работы, цель которой – разработка национальных стандартных образцов сыворотки anti-Brucella abortus для стандартизации антигенов для реакции агглютинации, реакции связывания комплемента, кольцевой реакции с молоком, метода поляризации флуоресценции и иммуноферментного анализа. В частности, речь идет о трех образцах сыворотки anti-Brucella abortus для непрямого ИФА, конкурентного ИФА и поляризации флуоресценции ИФА, стандартизированных по международным стандартным сывороткам с использованием международных стандартных антигенов бруцелл.
Разработка и применение национальных стандартных образцов сыворотки анти-бруцелла абортус для стандартизации бруцеллезных антигенов, используемых в разных серологических тестах, обеспечивает объективную оценку результатов диагностики бруцеллеза в стране, а также международную гармонизацию диагностического тестирования болезни.
К одним из популярных методов относится реакция Брюне. Она основана на введении внутрикожно бруцеллин. Если есть бруцеллез, то на месте укола начинается покраснение и небольшая пастозность. Именно этот участок и оценивается как аллергологическая проба Бюрне. Пятно измеряют и делают заключение: если пятно превышает 6 сантиметров, то реакция считается положительной. Такая проба действительна, когда бруцеллез находится в хронической форме. Также необходимо учитывать еще и тот факт, что положительная реакция может возникнуть у людей, которые проходили вакцинирование по профилактике бруцеллеза.
Серологические реакции и аллергическая кожная проба по своему диагностическому значению в различные периоды заболевания не равноценны, вследствие чего не могут заменить друг друга. Это обусловливает необходимость применения комплексного серологического метода, являющегося наиболее надежным способом диагностики бруцеллеза.
Бруцеллез (синонимы болезни: болезнь Банга, болезнь Брюса, мальтийская лихорадка , средиземноморская лихорадка) - инфекционная болезнь из группы бактериальных зоонозов, которую вызывают бруцеллы. Передается алиментарным и контактным путем. Бруцеллез является инфекционно-аллергическим системным заболеванием со склонностью к хроническому рецидивирующему течению с преимущественным поражением органов движения и опоры, нервной и мочеполовой систем организма.
Сравнивая значимость различных методов исследования можео сделать выводы:
1.В настоящее время для специфической индикации бруцелл используют бактериологический, иммунологические, физико-химические и молекулярно-биологические методы исследования. Наиболее чувствительным и достоверным является бактериологический метод, позволяющий выявлять в различных объектах единичные живые бактерии. При незначительной концентрации бруцелл, загрязнении проб посторонней микрофлорой, когда прямые высевы не дают положительных результатов, используют биологическую пробу. Однако эти методы не удовлетворяют требованиям, предъявляемым к методам индикации, из-за длительного срока получения ответа (1-2) мес. В связи с этим ведущее значение приобретают иммунологические и молекулярно-биологические тесты, в том числе, основанные на использовании иммуноглобулинов, меченых флуорохромами, ферментами, радиоактивными изотопами.
2.Культуральный метод,он дает практически 100% достоверный результат. Однако этот метод отличается тяжестью и длительностью.Несмотря на большой процент достоверности результата, лучше воспользоваться другими методами, потому что за время ожидания может наступить ухудшение.
3.Серологический-Это самый популярный анализ для определения бруцеллеза. Результаты можно узнать уже после недели болезни. Этот анализ обладает положительной чертой в том плане, что можно использовать абсолютно любую биологическую ткань пациента.
Анализ статистических данных
Летальность при бруцеллезе, по данным советских авторов, колеблется в пределах 2—3,6% (Н.Н. Даркшевич, Г. М. Фрейдович, А. П. Выговский и др.). Средняя продолжительность болезни, по данным Г. А. Пандико-ва, для 150 больных равнялась 10 мес, причем длительность до 3 мес. составила 12%, от 3 до 6 мес— 26%, от 6 до 12 мес— 40,7%, от 1 до 2 лет — 17,3% , от 2 до 4 лет 2%, свыше 4лет—2%. Инвалидность больных в среднем длится не меньше 5—6 мес, а иногда может затягиваться на годы (Н. Н. Даркшевич, Г. А. Пандиков).
Клиническая диагностика бруцеллеза не встречает затруднений лишь при типичных формах болезни. Лабораторные методы исследования дают возможность во всех случаях поставить диагноз. К этим методам относятся: выделение возбудителя с помощью гемо- или миелокультур, реакция агглютинации по Райту, ускоренная агглютинация по Хеддльсону, реакция связывания комплемента, опсоно-фагоцитарная реакция и аллергическая внутрикожная проба, по Бюрне.
Бруцеллез может поражать лиц всех возрастов, но преобладающий процент заболеваний приходится на молодой и средний возраст. Так, по данным А. А. Уварова, в овцеводческих хозяйствах восточных районов по возрасту заболеваемость бруцеллезом распределялась след. образом: до 10 лет— 1,2%, 11—19 лет —9,3%, 20—29 лет— 20,8%, 30—39 лет—36,1%, 40 лет и старше— 32,6%. Преобладающая заболеваемость лиц молодого и среднего возраста объясняется наибольшим контактом с источниками инфекции работников этого возраста в животноводческих хозяйствах.
Пол не имеет значения при заболевании бруцеллезом, хотя по статистике разных стран бруцеллез встречаются чаще среди мужчин, чем среди женщин. Заболевания мужчин в среднем исчисляются в пределах от 65 до 78% к числу всех заболевших. Разница эта объясняется тем, что мужчины по характеру своей работы в животноводстве могли в прошлом чаще контактировать с источниками инфекции.
Список использованной литературы
4. ГОСТ 34105— 2017 ЛАБОРАТОРНАЯ ДИАГНОСТИКА БРУЦЕЛЛЕЗА. Серологический метод.
5. ГОСТ 33675-2015 Лабораторная диагностика бруцеллеза. Бактериологический метод.
6. Санитарные правила "Условия транспортировки и хранения медицинских иммунобиологических препаратов. СП 3.3.2.028-95"
7. Атласова Х.В. Эпидемиологические аспекты бруцеллеза. Ретроспективный анализ заболевания бруцеллеза в РФ и РС(Я)./ Атласова Х.В./ National Youth Medical Forum. 2016
8. "Бруцеллез. Методические рекомендации по диагностике, лечению и реабилитации больных", 1987. Приложение ДИФФЕРЕНЦИАЛЬНЫЕ СВОЙСТВА ВИДОВ И БИОВАРОВ РОДА BRUCELLA
9. Вышелесский, С.Н. Аллергическая реакция в диагностике бруцеллеза домашних животных / Вышелесский С.Н. //Советская ветеринария. 1934.
10. Вершилова, П.А. Биохимическая и серологическая дифференциация группы бруцелла и ее значение в эпидемиологии / Вершилова Г1.А. // Архив биологических наук. 1934.
Морфологические и культуральные свойства на печеночном агаре возбудителя бруцеллеза:


Биологический метод (исправить бактериол
– Олег Дмитриевич, чем продиктовано принятие нового ГОСТа?
– Если быть точным, то в действие введен ГОСТ 34105-2017 (Межгосударственный стандарт. Животные. Лабораторная диагностика бруцеллеза. Серологические методы). Его появление обусловлено не только внедрением в российскую ветеринарную диагностическую практику новых серологических тестов, в частности, реакции непрямой гемагглютинации, вариантов иммуноферментного и иммунохроматографического анализа, но и целесообразностью совершенствования диагностики – прежде всего повышения ее оперативности и специфичности.
Разрабатывать этот ГОСТ начинали одновременно с подготовкой по распоряжению Минсельхоза России новых Ветеринарных правил осуществления профилактических, диагностических, ограничительных и иных мероприятий, установления ограничений, направленных на предотвращение возникновения, распространения и ликвидацию очагов бруцеллеза животных в России (далее – новые правила). Сейчас проект правил проходит стадию согласования различными ведомствами.
Разумеется, оценка диагностических титров серологических реакций при диагностике бруцеллеза в ГОСТе и новых правилах будет одинаковой. Поэтому считаю, что до выхода в свет этих правил ветеринарные диагностические лаборатории не должны переходить на работу по ГОСТ 34105-2017.
– Потому что между ГОСТом и действующими в настоящее время Ветеринарными правилами по борьбе с бруцеллезом (ВП 13.3.1302-96) сохраняются существенные различия.
– На какие положения стандарта вы хотели бы обратить внимание специалистов в первую очередь?
– К сожалению, несмотря на то, что ГОСТ34105-2017 согласовывался специалистами стран Евразийского экономического союза, в нем сохраняются недочеты.
– Одним из таких недочетов является предписание проводить дополнительное исследование образцов сыворотки в РИД и ИФА с ОПС-антигеном в случае выявления в группах животных, иммунизированных и не иммунизированных против бруцеллеза и положительно реагирующих по результатам серологических исследований в ряде реакций. Такое требование предусмотрено пп. 8.2, 8.3 и 8.4 данного ГОСТа в целях уточнения диагноза.
– Если речь идет об уточнении диагноза, то почему вы называете это недочетом?
– Дело в том, что, по состоянию на сегодняшний день, диагностические тест-системы для иммуноферментного анализа в рамках госзаказа выделяются в ограниченном количестве. Представители большей части ветеринарных диагностических лабораторий утверждают, что им такие тест-системы будут недоступны. Соответственно, непроведение серологического тестирования в ИФА, согласно ГОСТу, будет расценено представителями надзорных учреждений как нарушение.
С учетом разницы в диагностической чувствительности между РИД с ОПС-антигеном и ИФА с ОПС-антигеном исследование последним методом является принципиальным. В противном случае при выполнении серологического исследования только в РИД с ОПС-антигеном объективность его результатов может быть сомнительной.
Не буду вдаваться в подробности других имеющих принципиальное значение недочетов, отмечу лишь, что после их обсуждения и согласования с диагностическими ветеринарными лабораториями должно быть инициировано внесение изменений в ГОСТ 34105-2017.
– Какие ошибки чаще всего допускают при лабораторной диагностике бруцеллеза?
– О существенных ошибках мне неизвестно. К тому же мы не контролируем работу лабораторий. Однако, когда специалисты ряда лабораторий обращаются к нам, чтобы обсудить спорные результаты исследований, кажется, что некоторые из них не знакомы со всеми документами, регламентирующими диагностику болезни. Впрочем, большинство специалистов проявляют инициативу и демонстрируют познания, достаточные для диагностики болезни. Не менее важно и то, что они заинтересованы в получении объективных результатов.
– Какова сегодня эпизоотическая ситуация по бруцеллезу среди крупного и мелкого рогатого скота на территории России?
В период с 2013 по 2017 годы количество неблагополучных по бруцеллезу мелкого рогатого скота пунктов, остававшихся на конец года, составляло 30, 28, 22, 17 и 14. Число заболевших животных – 1,9; 2,5; 2,2; 1,22 и 1,01 тыс. голов.
– Можно утверждать, что динамика положительная?
– Система контроля бруцеллеза животных в стране несовершенна?
– Сложившуюся систему контроля бруцеллеза животных в Российской Федерации можно считать удовлетворительной. Однако это не исключает необходимости ее совершенствования. Прежде всего в части сокращения временных затрат при установлении диагноза за счет более широкого применения средств дифференциальной диагностики болезни, а именно реакции иммунодиффузии и иммуноферментного анализа с ОПС-антигеном, возможно, за счет сочетания средств диагностики.
Важным представляется проведение исследований и установление возможных, максимально ранних сроков серологического исследования вакцинированных животных, особенно мелкого рогатого скота, иммунизированного агглютиногенными вакцинами. В настоящее время этим никто не занимается.
Не стоит забывать, что самый эффективный способ оздоровления неблагополучного хозяйства предусматривает ликвидацию всего поголовья в таком хозяйстве. Однако данный способ не слишком широко применяется в нашей стране. (Должен отметить, что в проекте новых правил его применение регламентировано в большем количестве случаев, нежели в Ветеринарных правилах 13.3.1302-96.) Поэтому перед проведением вакцинации животных в рамках оздоровления путем вакцинации и последующих периодических серологических исследований особенно важно максимально полно удалять инфицированных особей из групп животных.
– В нынешних условиях это реально?
– Я бы сказал, что это возможно за счет введения животным неблагополучных по бруцеллезу хозяйств провоцирующих неагглютиногенных антигенов, в отличие от применяющихся вакцин, с последующим серологическим исследованием и удалением выявленных больных животных.
При этом не могу не отметить, что организации-производители, планировавшие выпускать такие антигены, зарегистрированные ими ранее в Российской Федерации, пока не справляются со своими планами и не понятно, справятся ли.
– Что препятствует повышению эффективности системы контроля бруцеллеза?
– На мой взгляд, совершенствование этой системы не представляется возможным без решения целого ряда задач. Во-первых, нужно создавать в регионах, неблагополучных по бруцеллезу, мясокомбинаты и бойни, обеспечивающие убой больных животных, что решает проблему неполного, несвоевременного и антисанитарного убоя. При этом следует компенсировать владельцам убыток. К сожалению, он неизбежен при изъятии больных животных, прежде всего в условиях ведения отгонного животноводства.
Во-вторых, следует запретить введение нетелей и ярок в стада и отары взрослых животных. В-третьих, нужно ограничить концентрацию поголовья в хозяйствах молочного направления, которые находятся на территориях, неблагополучных по бруцеллезу. В-четвертых, необходимо оперативно завершать реализуемую в стране программу идентификации (мечения) животных.
– Несложно предположить, что для решения этих задач требуются немалые финансовые вложения.
– Конечно, но если эти задачи не решить, то искоренить бруцеллез на территории нашей страны не получится.
– Лаборатория качества и стандартизации бактерийных лекарственных средств ВГНКИ как структурное подразделение Россельхознадзора разрабатывает образцы сыворотки, которая применяется для диагностики бруцеллёза. Соответствует ли она эталонным стандартам МЭБ?
– Более 30 лет тому назад в лаборатории была разработана Национальная стандартная сыворотка анти-Бруцелла абортус, активность которой составляет 1000МЕ агглютинирующих антител/см 3 . Сыворотка предназначена для стандартизации антигена для реакции агглютинации (РА), применяемой при серологической диагностике бруцеллеза. Периодически с интервалом в пять-семь лет лаборатория готовит очередную серию сыворотки взамен предыдущей. Каждая серия стандартизуется по международной эталонной сыворотке с использованием международного стандарта антигена, предоставляемых Международным эпизоотическим бюро.
Национальная стандартная сыворотка используется и для оценки активности антигенов для других серологических реакций. Но в этой части с учетом современных требований и рекомендаций МЭБ она нуждается в совершенствовании и в изменении ее статуса.
– В заключение расскажите, пожалуйста, о приоритетных задачах вашей лаборатории.
– Традиционно лаборатория выполняет регистрационные и сертификационные испытания, осуществляет инспекционный контроль сертифицированной продукции, а также лекарственный мониторинг и выборочный контроль качества образцов средств специфической профилактики и диагностики бруцеллеза животных. Наряду с этим предполагается выполнение научно-исследовательской работы, цель которой – разработка национальных стандартных образцов сыворотки anti-Brucella abortus для стандартизации антигенов для реакции агглютинации, реакции связывания комплемента, кольцевой реакции с молоком, метода поляризации флуоресценции и иммуноферментного анализа. В частности, речь идет о трех образцах сыворотки anti-Brucella abortus для непрямого ИФА, конкурентного ИФА и поляризации флуоресценции ИФА, стандартизированных по международным стандартным сывороткам с использованием международных стандартных антигенов бруцелл.
Разработка и применение национальных стандартных образцов сыворотки анти-бруцелла абортус для стандартизации бруцеллезных антигенов, используемых в разных серологических тестах, обеспечивает объективную оценку результатов диагностики бруцеллеза в стране, а также международную гармонизацию диагностического тестирования болезни.
Читайте также:


