Как вакцинировать бруцеллез у крс
Бруцеллез (Brucellosis) — инфекционная, хронически протекающая болезнь домашних, некоторые виды диких животных и человека, характеризующаяся поражением многих систем жизнеобеспечения, нарушением функций сосудистой, пищеварительной, мочеполовой систем и системы воспроизводства.
Изучая причины мальтийской лихорадки, английский врач Д. Брюс в 1886 – 1887 гг. установил, что виновником ее является специфический микрококк, названный им Micrococcus melitensis. Дальнейшие исследования показали, что источником возбудителя мальтийской лихорадки являются козы, пораженные инфекцией, а причиной заражения людей — потребление молока от таких коз. Несколько позже Micrococcus melitensis был выделен у овец.
В1897 г. датские ученые Банг и Стриболд установили, что массовые аборты у коров вызывает микроорганизм, названные B. abortus bovis. В 1914 г. Траум обнаружил очень сходный микроорганизм, названный Br. abortus suis, при массовых абортах у свиней.
Для диагностики бруцеллеза в 1897 г. Райтом была предложена серологическая реакция агглютинации, а в 1922 г. Берне разработал внутрикожную аллергическую пробу, облегчающую распознавание болезни.
Долгое время мальтийская лихорадка у людей и массовые аборты у домашних животных считались самостоятельными заболеваниями. В 1918 – 1920 гг. Ивенс, Мейер и Фезье, изучая биологические свойства возбудителя мальтийской лихорадки и массовых абортов у крупного рогатого скота, обнаружили их чрезвычайную близость. Эти исследования явились основанием объединить указанных возбудителей, в том числе и возбудителя массовых абортов у свиней, в одну родовую группу под наименованием Brucella (в честь Брюса), а вызываемые ими заболевания именовать бруцеллезом.
В России начало изучения бруцеллеза было положено работами Е. И. Марциновского (1911), но детальному изучению заболевание подверглось в различных местностях СССР лишь с 1935 г. Большой вклад в изучение бруцеллеза сельскохозяйственных животных внесли отечественные ученые: С. Н. Вышелесский, П. Ф. Здродовский, П. А. Вершилова, М. К. Юсковец, Е. С. Орлов, Р. А. Цион, А. П. Бессонов и др. Были всесторонне изучены биологические свойства возбудителя, усовершенствованы методы диагностики, показаны значение в борьбе с бруцеллезом вакцинальной профилактики и пути ее совершенствования.
Клинические признаки бруцеллеза у крупного рогатого скота
Длительность инкубационного периода 2 – 3 недели. Первым показателем развившегося инфекционного процесса служит появление в крови инфицированных животных агглютининов в постепенно нарастающих титрах.
У коров основным клиническим признаком бруцеллеза является аборт и реже рождение нежизнеспособного приплода. Коровы, заразившиеся до покрытия, в большинстве случаев приносят нормальный приплод. Аборт чаще всего происходит на 5 – 8-м месяце. За 1 – 2 дня до наступления аборта у коров отмечается припухание наружных половых органов, выделение из влагалища бесцветной или буроватой жидкости и набухание вымени. После аборта происходит задержка последа и развивается эндометрит, сопровождающийся обильными слизисто-гнойными или гнойно-фибринозными выделениями. При тяжело протекающем эндометрите повышается температура тела, снижаются удои, отмечается потеря веса, убыстряется СОЭ; умеренный лейкоцитоз. Эндометритам нередко сопутствуют серозные или серозно-катаральные маститы. В процессе могут вовлекаться яичники и фаллопиевы трубы, что приводит к нарушению полового цикла и временному или стойкому бесплодию.
У отдельных животных в связи с абортом или независимо от него можно наблюдать развитие серозных бурситов или серофибринозных артритов. Последние в большинстве случаев возникают в суставах передних конечностей — запястном, путовом, коленном, локтевом. У быков бруцеллез, хотя и редко, сопровождается развитием орхитов и эпидидимитов.
Лабораторная диагностика бруцеллеза основана на результатах бактериологического и серологического исследований. Бактериологическое исследование в основном применяют при первичной постановке диагноза на бруцеллез в ранее благополучных хозяйствах.
В лабораторию направляются пробы крови (сыворотки) для серологического исследования, абортивный плод с плодными оболочками, околоплодную жидкость, истечения из родовых путей или желудок плода, кусочки печени, селезенки, пробы молока (последние порции). При убое животных берут паренхиматозные органы, лимфатические узлы, пораженные суставы, у самцов — семенники. Объектом исследования могут быть молочные продукты (брынза, сыр, масло), объекты внешней среды.
При массовых диагностических исследованиях ставят пробирочную РА, роз бенгал пробу (РА на стекле), РСК, РДСК, кольцевую реакцию с молоком (КР). Диагностикумы для этих исследований, а также бруцеллин ВИЭВ для аллергической диагностики готовятся на Щелковском биокомбинате.
По данным К. В. Шумилова до 1952 года борьба с бруцеллезом крупного рогатого скота в нашей стране сводилась к проведению диагностических исследований и удалению из стад больных животных, без применения противобруцеллезных вакцин. В связи с осложнением эпизоотической ситуации в 1953 году в систему противобруцеллезных мероприятий была включена иммунизация животных вакциной из штамма B. abortus 19.
Вакцину из штамма B. abortus 19 применяли до 1970 года. За 20 лет применения вакцины многие хозяйства, даже области, были оздоровлены от болезни. Однако в регионах с широким распространением бруцеллеза эффективность оздоровительных мероприятий оказалась низкой. В первую очередь, это было обусловлено высокой агглютиногенностью вакцины. Агглютинины и комплементсвязывающие антитела, вырабатывающиеся в ответ на введение вакцины, сохраняются в организме животных до 5 – 8 лет и затрудняют дифференциацию иммунизированных животных от больных бруцеллезом.
С 1971 по 1974 год вакцину из штамма B. abortus 19 использовали только на телках 5 – 8 месячного возраста. С 1974 года и по настоящее время в России в комплексе противобруцеллезных мероприятий применяются вакцины из штаммов B. abortus 82 и 19. Живая сухая вакцина против бруцеллеза из слабоагглютиногенного штамма № 82 отличается от вакцины из штамма 19 слабым серологическим ответом с быстрым снижением уровня гуморальных антител, что позволяет при помощи серологических реакций дифференцировать вакцинированных животных.
За 30 лет работы с применением вакцины из штамма B. abortus 82 и смены пяти поколений коров к 2004 году (К. В. Шумилов) количество неблагополучных по бруцеллезу пунктов и заболевших животных значительно сократилось.
Сухая живая вакцина против бруцеллеза крупного рогатого скота из штамма B. abortus 75/79-АВ разработана сотрудниками ВГНКИ и Алтайской НИВС с использованием культуры штамма 75/79, выделенного от коровы, ранее иммунизированной вакциной из штамма B. abortus 82. После многократных пассажей выделенного штамма через организм морских свинок и телок и целенаправленной селекции на питательных средах, был получен новый вакцинный штамм 75/79-АВ. Вакцины не обладает абортогенными свойствами, что дает возможность проводить иммунизацию маточного поголовья независимо от сроков стельности. Вакцина является слабоагглютиногенной; агглютинины и комплементсвязывающие антитела регистрируются у привитых животных в течение трех месяцев после иммунизации, что делает возможным их исследование по истечении указанного срока. У животных, иммунизированных вакциной, выраженный иммунитет сохраняется в течение года, что позволяет за указанный срок оздоравливать неблагополучные хозяйства от бруцеллеза.
Штамм B. abortus КВ 17/100, находящийся в R-форме, получен путем целенаправленной селекции по культуральным, морфологическим, биохимическим и антигенным свойствам из вакцинного штамма B. abortus 104М, находящегося в S-форме. Адъювант-вакцина не индуцирует синтез S-бруцеллезных антител в диагностических титрах у животных, не сенсибилизированных бруцеллами. Адъювант-вакцина индуцирует синтез S-бруцеллезных антител у крупного рогатого скота с латентной формой бруцеллеза, что позволяет за счет быстрого удаления из стад таких животных, ускорить оздоровление хозяйств, неблагополучных по бруцеллезу.
Адъювант-вакцина не абортогенна и может быть использована для иммунизации маточного поголовья крупного рогатого скота независимо от сроков стельности.
Вакцина предназначена для профилактики бруцеллеза крупного рогатого скота. Вакцина содержит в качестве антигена инактивированную с гидратом окиси алюминия бактериальную массу штамма B.abortus ВГНКИ N КВ 17/100. Вакцина содержит также неполный адьювант Фрейнда и физиологический раствор. Использование новой вакцины в ветеринарной практике позволяет в 1,5 - 2 раза повысить эффективность противобруцеллезных мероприятий за счет повышения иммуногености и снижения агглютиногенности вакцины. 2 табл.
Изобретение относится к биотехнологии, в частности к вакцине для профилактики бруцеллеза крупного рогатого скота.
Бруцеллез крупного рогатого скота - хроническое зооантропонозное заболевание, распространенное во многих странах мира, наносящее большой экономический ущерб скотоводству и представляющее серьезную опасность здоровью людей.
Основным средством борьбы с бруцеллезом крупного рогатого скота, особенно в зонах его широкого распространения, является вакцинация всего поголовья и своевременное удаление из стада больных животных.
Известна вакцина против бруцеллеза крупного рогатого скота, содержащая антиген из штамма Brucella abortus 19 и сахарозо-желатиновый стабилизатор [1].
Недостатками данной вакцины являются высокая агглютиногенность, так как в крови животных, иммунизированных данной вакциной в течение нескольких месяцев, а иногда и нескольких лет обнаруживают антитела в принятых для диагностики бруцеллеза серологических реакциях, что препятствует выявлению больных животных в вакцинированном стаде. Вакцину нельзя применять для иммунизации стельных коров, так как она вызывает аборты у отдельных животных.
Известна также вакцина против бруцеллеза сельскохозяйственных животных, преимущественно крупного рогатого скота, содержащая инактивированный антиген из штамма Brucella melitensis N "Невский-13", неполный адъювант Фрейнда и физиологический раствор [2].
Недостатком данной вакцины является то, что в крови иммунизированных животных до 90-120 дней сохраняются агглютинирующие и комплеменсвязывающие антитела, улавливаемые в принятых для диагностики бруцеллеза серологических реакциях, которые препятствуют своевременному выявлению и удалению из стада больных бруцеллезом коров.
Целью изобретения является разработка высокоиммуногенной вакцины против бруцеллеза крупного рогатого скота с низкой антигенной активностью.
Цель достигается тем, что вакцина в качестве антигена содержит инактивированную с гидратом окиси алюминия бактериальную массу штамма B.abortus ВГНКИ N КВ 17/100 с концентрацией 300-400х10 9 бактерий в 1 см 3 , при следующем соотношении компонентов вакцины, об.%: инактивированная с гидратом окиси алюминия бактериальная масса штамма B.abortus N КВ 17/100 с концентрацией 300х10 9 -400х10 9 микробных клеток в 1 см 3 40-45,0; неполный адъювант Фрейда 50,0-55,0; физиологический раствор остальное.
Для изготовления вакцины используют штамм Brucella abortus ВГНКИ N КВ 17/100.
Штамм B. abortus N КВ 17/100 получен путем целенаправленной селекции по антигенности и иммуногенной активности.
Штамм B. abortus депонирован в коллекции микроорганизмов Всероссийского государственного научно-исследовательского института контроля, стандартизации и сертификации ветеринарных препаратов, регистрационный номер КВ 17/100 ДЕП.
Штамм B. abortus N КВ 17/100 характеризуется следующими признаками и свойствами.
Бруцеллы штамма - короткие грамотрицательные палочки с закругленными концами, расположенные изолированно, попарно и реже в виде коротких цепочек. Без капсулы, спор не образуют. Размер 1,3-1,5 х 0,6-0,8 мкм.
Культура штамма хорошо растет в аэробных условиях на плотных и жидких питательных средах, предназначенных для культивирования бруцелл. На плотных питательных средах (4-5 сут инкубирования при 37-38 o С) растет в виде круглых, плоских, с нечетко контурированным краем, матовых колоний с диаметром 2,5-3,0 мм. При окрашивании раствором кристаллического фиолетового 1/2000 (по Уайт-Вилсону) 100% колоний окрашиваются как R-форма: фиолетовый центр и светлофиолетовый широкий ободок.
На жидких питательных средах на 2-4 сут инкубирования: легкая опалесценция и узкое пристеночное голубоватое кольцо на границе среды.
Культура штамма растет на средах содержащих фуксин, тионин в концентрации 1: 50000, бис-трифенилангидрокарбинола оксалат в концентрации 1:100000 (маркер), пенициллин 5ЕД/см 3 и не растет на среде, содержащей стрептомицина сульфат 5 мкг/см 3 . Продуцирует Н2S (6-8 мм). Лизируется фагом Тб.
Культура штамма агглютинируется R-антибруцеллезной сывороткой и не агглютинируется S-антибруцеллезной сывороткой. Штамм не обладает типоспецифической агглютинабельностью и не агглютинируется А и М монорецепторными сыворотками.
Штамм безвреден для человека и сельскохозяйственных животных.
Остаточная вирулентность: ИД для мышей линии С57 - Блек/6 - 5500 микробных клеток, что соответствует уровню аттенуированных вакцинных штаммов.
Культура штамма защищает от заражения не менее 50% иммунизированных животных.
Пример 1. Штамм Brucella abortus ВГНКИ N КВ 17/100 культивируют на плотной питательной среде или в ферментере на жидкой питательной среде при 37-38 o С в течение 72 ч.
Выращенную культуру с плотной питательной среды смывают физиологическим раствором, добавляют 0,3-0,5% формалина и 0,3-0,5% гидрата окиси алюминия, формалин и гидрат окиси алюминия вносят в ферментер сразу после окончания культивирования.
После инактивации бактериальную массу отстаивают, декантируют надосадочную жидкость и устанавливают концентрацию бактериальной массы, равную 300-400х10 9 микробных клеток в 1 см 3 . Инактивированную с гидратом окиси алюминия бактериальную массу штамма B.abortus ВГНКИ N КВ 17/100 в количестве 40-45% от объема смешивают с неполным адъювантом Фрейнда в количестве 45-55% от объема с доведением до 100% физиологическим раствором.
Вакцину расфасовывают во флаконы при включенной мешалке. Флаконы закрывают резиновыми пробками, обкатывают металлическими колпачками и этикетируют.
Расфасованную вакцину проверяют на стерильность, безвредность и иммуногенность.
Готовая вакцина представляет собой однородную водно-масляную эмульсию белого цвета с коричневым или серым оттенком. При длительном хранении возможно незначительное отслоение адъюванта над эмульсией, что не влияет на качество вакцины.
Получают 3 серии вакцины, приведенные в табл. 1.
Пример 2. Определяют антигенную активность адъювант-вакцины.
Морских свинок (10-14 голов в группе) иммунизируют адъювант-вакциной из штамма B.abortus ВГНКИ N КВ 17/100 (серии N 1, 2, 3), полученной по примеру 1; адъювант-вакциной из штамма B.melitensis N Н-13, экспериментальной адъювант-вакциной из штамма B.abortus N 16/4 (штамм в R-форме) и живой противобруцеллезной вакциной из штамма B.abortus N 19.
Адъювант-вакцины вводят в дозе 0,2 см 3 , живую - 1 млрд. микробных клеток в объеме 1 см 3 под кожу в область паха. Через 15, 30 и 60 дней после иммунизации у животных берут кровь и исследуют в РА с единым бруцеллезным антигеном (S-антиген). Результаты исследований приведены в табл. 2.
Из табл. 2 следует, что все серии предложенной адъювантвакцины из штамма B. abortus ВГНКИ N КВ 17/100 не индуцируют образования агглютининов в сыворотке крови животных и в отличие от адъювант-вакцин из штаммов B.melitensis N "Невский-13", В. abortus N 16/4 и живой вакцины из штамма В.abortus N 19 являются неагглютиногенными, что дает возможность быстро и своевременно выявлять больных вакцинированных животных в случае их заражения. В то же время среднее количество агглютининов в сыворотке крови морских свинок через 15 дней после иммунизации адъювант-вакцинами из штаммов B.melitensis N "Невский-13" - 83,0, B. abortus N 16/4 - 38,3 МЕ/см 3 , а живой вакциной из штамма B. abortus N 19 - 160,0 ME/cм 3 , и в случае заражения больные бруцеллезом животные не могут быть дифференцированы по крайней мере в течение 60 дней от иммунных - незаразившихся, создавая угрозу перезаражения.
Таким образом установлено, что адъювант-вакцина из штамма В.abortus ВГНКИ N КВ 17/100 не индуцирует синтез S-антител в количестве, улавливаемом реакцией агглютинации с единым бруцеллезным антигеном.
Пример 3. Иммуногенную активность новой адъювант-вакцины, полученной по примеру 1 из штамма B.abortus ВГНКИ N 17/100, сравнивают с вакцинами из штаммов B.melitensis N "Невский-13", B.abortus N 16/4 и живой вакциной из штамма B. abortus N 19. Опыт проводят на морских свинках, привитых аналогично примеру 2.
Через 3 мес после прививки морских свинок заражают стандартной культурой контрольного вирулентного штамма В.abortus N 54М/ВГНКИ в дозе 80 микробных клеток (15 ИД50). Спустя 32-35 дней животных убивают и проводят бактериологическое исследование селезенки, печени, костного мозга и лимфатических узлов (всего 10 объектов). Определяют наличие бруцелл вирулентного штамма в лимфатических узлах и внутренних органах животных. Рассчитывают процент защиты (количество незаразившихся животных в процентах от общего их количества в группе) и индекс инфицированности (процентное отношение количества объектов, из которых выделена культура вирулентного штамма, к общему количеству исследованных объектов по группе животных). Результаты исследований приведены в табл. 3.
Таким образом установлено, что адъювант-вакцина из штамма B.abortus ВГНКИ N RD 17/100 всех серий превосходит по иммуногенной активности адъювант-вакцины из штаммов B. melitensis N "Невский-13", B.abortus N 16/4 и не уступает живой вакцине из штамма B.abortus N 19.
Пример 4. Определяют реактогенность адъювант-вакцины из штамма B.abortus ВГНКИ N КВ 17/100 (серия N 1) в опыте на телках трех-четырех месячного возраста в сравнении с адъювант-вакциной из штамма B.meliitensis N "Невский-13". Каждую вакцину вводят 10 телкам под кожу в область подгрудка в дозе 3 см 3 . У вакцинированных животных ежедневно в течение 10 дней измеряют температуру тела и площадь припухлости в месте введения вакцины.
У животных, иммунизированных адъювант-вакциной из штамма B.abortus ВГНКИ N КВ 17/100, температура тела повышается на 0,8-1,0 o С и нормализуется к 5-6 дню после вакцинации, отек в месте введения вакцины не превышает 80 см 2 и начинает уменьшаться с 8-10 дня. В группе животных, иммунизированных адъювант-вакциной из штамма B.melitensis N "Невский-13", температура тела повышалась в среднем на 1,2-1,5 o С и приходила в норму к 7-9 дню. Отек тканей в месте введения вакцины в среднем 100-120 см 3 . Заметное уменьшение величины отека отмечают через 15-20 дней после иммунизации.
Таким образом, испытанную вакцину из штамма B.abortus ВГНКИ N КВ 17/100 можно отнести к слабореактогенным масляным адъювантвакцинам.
Пример 5. Определяют антигенные свойства адъювант-вакцины из штамма B. abortus ВГНКИ N КВ 17/100 (серия 2) в опыте на телках трех-четырех месячного возраста. Вакцину вводят под кожу в область подгрудка в дозе 3 см 3 42 телкам. Через 15 и 30 дней после иммунизации у животных берут кровь и исследуют в РА и РСК с единым бруцеллезным антигеном (S-антиген).
Все животные иммунизированные адъювант-вакциной не реагируют на бруцеллез. Пример 6. Определяют антигенные свойства адъювант-вакцины из штамма B. abortus ВГНКИ N КВ 17/100 (серия 3) в опыте на телках 14-17-месячного возраста, ранее иммунизированных живой слабоагглютиногенной вакциной из штамма B.abortus N 82. Адъювант-вакцину в дозе 3 см 3 вводят под кожу в область подгрудка 70 телкам. Через 15 и 30 дней после иммунизации у животных берут кровь и исследуют на бруцеллез в РА и РСК с единым бруцеллезным антигеном.
Все животные ревакцинированные адъювант-вакциной не реагируют на бруцеллез.
Пример 7. Определяют эффективность адъювант-вакцины из штамма B.abortus ВГНКИ N КВ 17/100 для профилактики бруцеллеза крупного рогатого скота в условиях контролируемого эпизоотологического опыта.
Телок трех-четырех месячного возраста (пример 5) и 14-17-месячного возраста (пример 6), иммунизированных адъювант-вакциной из штамма B.abortus ВГНКИ N КВ 17/100, содержат в условиях хозяйства неблагополучного по бруцеллезу рогатого скота, обеспечивающих контакт с 21 коровой больной бруцеллезом.
Иммунизированные адъювант-вакциной животные не заболевают бруцеллезом в течение шести месяцев, что указывает на высокую эффективность препарата.
Пример 8. Определяют возможность использования адъювант-вакцины из штамма B.abortus ВГНКИ N КВ 17/100 для провокации синтеза специфических антител у больных бруцеллезом коров, не реагирующих в серологических реакциях, принятых для диагностики бруцеллеза. Коров, ранее реагировавших на бруцеллез (в РА и РСК) и утративших титры в серологических реакциях, принятых для диагностики бруцеллеза, иммунизируют адъювант-вакциной из штамма B.abortus КВ 17/100 в дозе 3 см 3 . Вакцину вводят под кожу в область подгрудка. Через 15 и 3 дней после иммунизации у животных берут кровь и исследую сыворотку в РА и РСК.
После иммунизации животные с хронической формой бруцеллеза положительно реагируют в серологических реакциях в диагностических титрах и идентифицируются как больные.
Таким образом, адъювант-вакцина из штамма B.abortus КВ 17/100 провоцирует появление положительных серологических реакций у нереагирующих на бруцеллез больных животных, что способствует скорейшему выздоровлению больных бруцеллезом животных.
Использование адъювант-вакцины на основе нового штамма B.abortus ВГНКИ N КВ 17/00 в ветеринарной практике позволит повысить эффективность мероприятий по борьбе с бруцеллезом крупного рогатого скота.

Практически каждому фермеру известны случаи заражения коров опасными вирусами, которые вызывали эпидемию во всём стаде. Нередко возбудители этих болезней несут опасность и для человека. Об одной разновидности патогенных микроорганизмов — бруцеллах — расскажем в этой статье.
Что это за болезнь
Бруцеллёз — это опасное заболевание, переносчиками которого является крупный рогатый домашний скот (реже — козы и собаки), его патогенные организмы поражают нервную систему, опорно-двигательный аппарат и половую систему животных.
Как происходит заражение
Чаще всего источником заражения является больная корова, которая была допущена в стадо без предварительного ветеринарного осмотра. Распространение бактерий происходит через мочу, кал, околоплодные воды, кровь, а также сперму животных. 
Бруцеллы проникают внутрь организма через раны, слизистые оболочки, а также после употребления ими заражённой воды или корма. Следует заметить, что если корова обладает сильным иммунитетом, а доза патогенных микроорганизмов небольшая, то организм животного избавляется от вируса без каких-либо последствий.
После окончания острой стадии заболевания бруцеллы сосредотачиваются в лимфоузлах (наибольшее количество находится в тазовых лимфоузлах), матке, вымени и селезёнке.
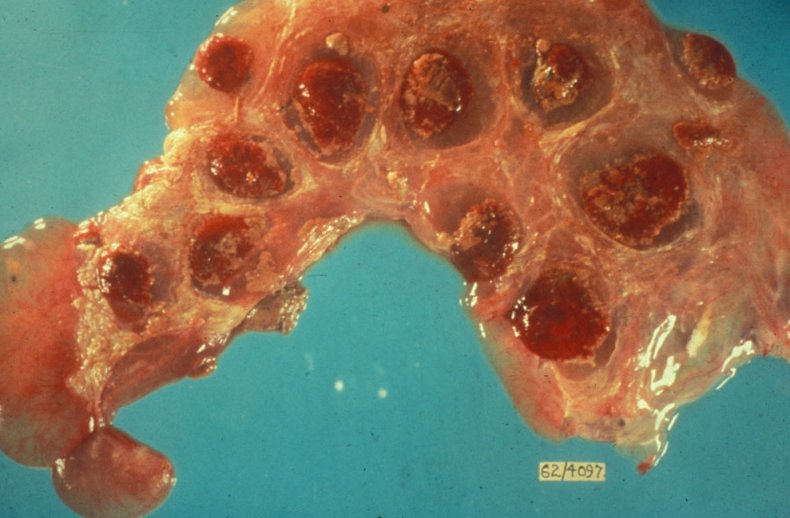
Стадии и симптомы
Эта болезнь чаще всего имеет скрытые симптомы, которые сложно диагностировать на ранних сроках. Каждого животновода должны насторожить повторные аборты у коров и рождение нежизнеспособных телят.
Появление таких признаков должно быть поводом для обращения в ветеринарную клинику с обязательным направлением на обследование последа, абортированного плода или проб молозива.
При этом у заболевших коров наблюдается потеря аппетита, вялость, резкое повышение температуры тела, боли в конечностях и воспалительные процессы в суставах — образуются бурситы и артриты. 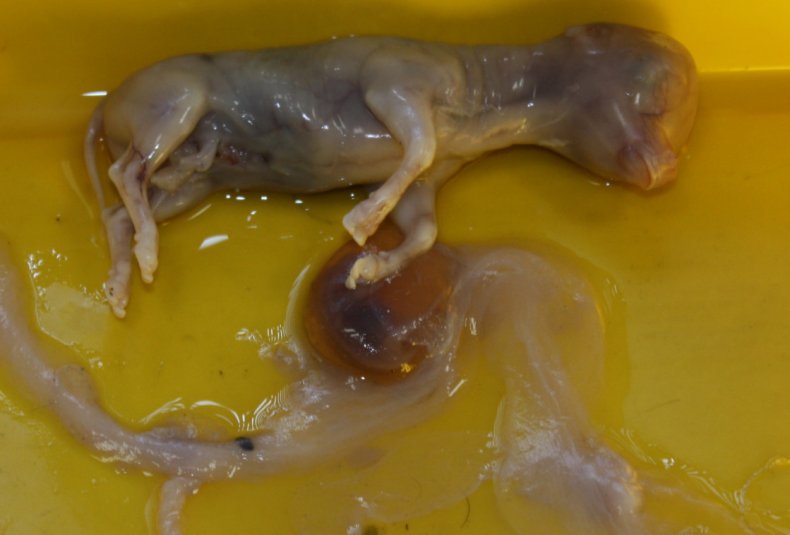
Через некоторое время у коров диагностируют тендовагинит и гигромы, а у быков — опухание семенников, многочисленные воспалительные процессы в предстательной железе и придатках, а также подкожные абсцессы с признаками некроза.
Этот период длится 30–60 дней. Для него характерно резкое повышение температуры тела. Внешние проявления бруцеллёза на этой стадии сложно заметить невооружённым глазом, однако при обследовании внутренних органов ветеринар может заметить увеличение печени и селезёнки.
В конце острой стадии могут быть заметны увеличенные лимфоузлы, особенно тазовые, а также начинаются воспалительные процессы в половых органах. Если у животного сильная иммунная система, то инфицирование может протекать совсем незаметно, а бруцеллы через некоторое время бесследно исчезают из их крови. 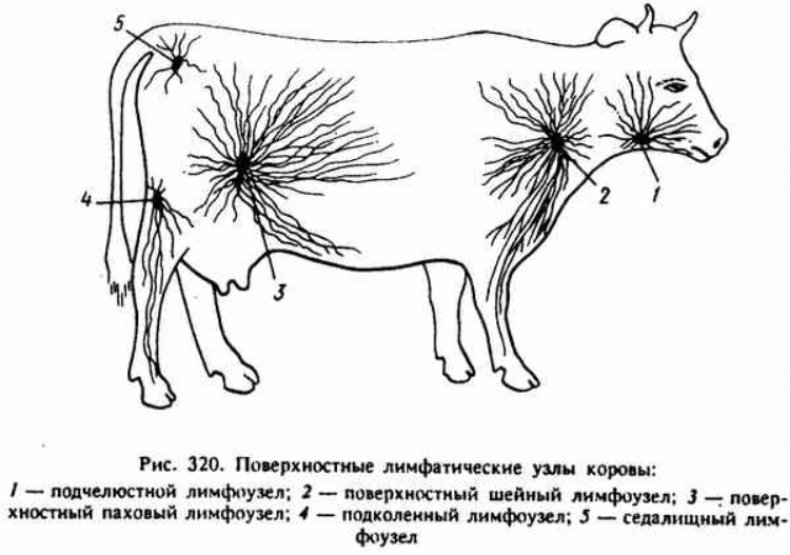
Подострая стадия имеет более длительный период — 60–90 дней. Для неё характерны волнообразные проявления заболевания — резкое ухудшение самочувствия животных сменяется улучшением. Но, несмотря на это, уже можно диагностировать внешние проявления бруцеллёза — воспаления суставов, подкожные абсцессы и выделения из половых органов бурого цвета.
Эта стадия бруцеллёза характерна проявлением внешних признаков болезни на протяжении трёх и более месяцев. Заболевшие животные теряют аппетит, становятся вялыми, нервными. Невооружённым глазом становятся заметны симптомы болезни — воспаления суставов, кровяные выделения из половых органов, подкожные опухоли. Постоянные боли в конечностях делают коров беспокойными.
Диагностика
Диагностика бруцеллёза проводится с помощью серологических и бактериальных исследований, которые выполняются в лабораторных условиях. Наиболее распространёнными способами обнаружения бруцелл в крови животных считаются реакция Райта и аллергическая проба Бюрне. 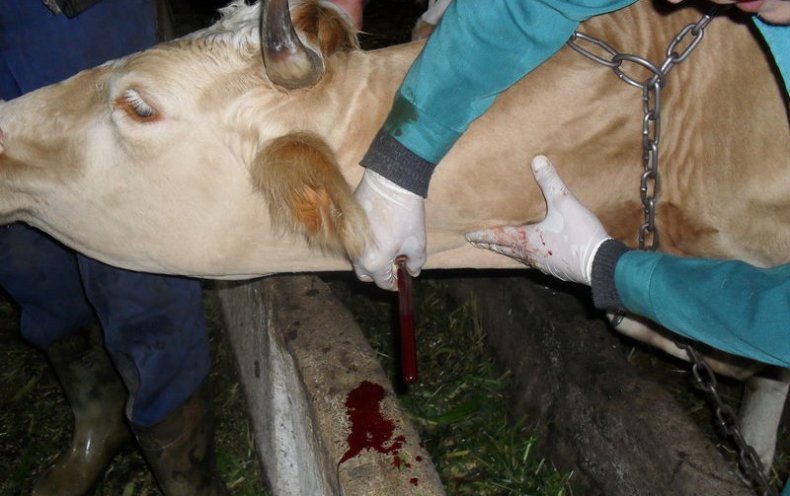
Реакция Райта — это официальный метод диагностики бруцеллёза у человека и животных, который применяется во всём мире. Особенность заключается в том, что с его помощью можно диагностировать это заболевание как в самом начале, так и через несколько лет после заражения, то есть когда бруцеллёз переходит в хроническую стадию.
Положительным результатом считается выпадение осадка, появление хлопьев и комочков в пробирках с биоматериалом, причём интенсивность образования взвеси оценивается согласно специальной шкале оценки реакции агглютинации. 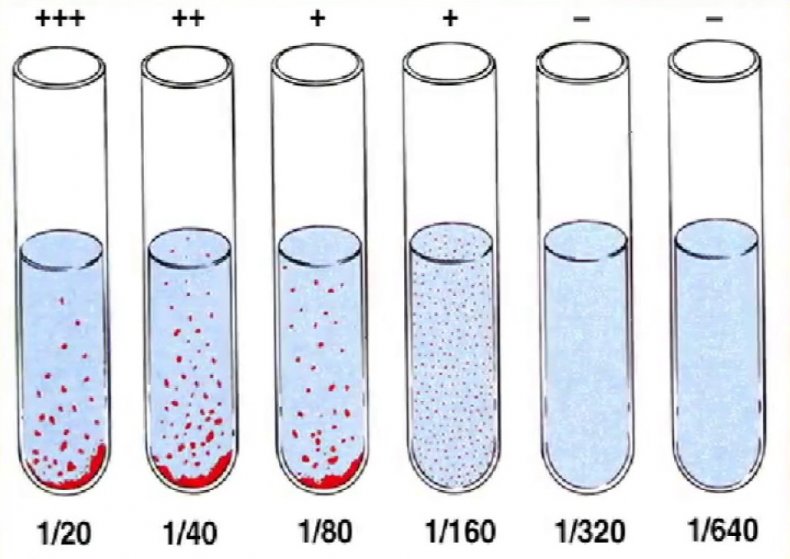
Такой метод диагностики используют в случаях, когда результаты серологических исследований на наличие антител к бруцеллам в организме коровы являются отрицательными или их достоверность ставится под сомнение. Аллергическая проба проводится следующим образом:
- В область лопатки животного вводится 0,1 мл протеинового экстракта, выделенного из бактерий бруцеллы.
- На вторые сутки после проведения пробы уже можно наблюдать реакцию — положительной считается покраснение в месте укола, образование уплотнения и выделение инфильтрата.
Из-за того что этот вид диагностики бруцеллёза часто показывает положительный результат у привитых коров, окончательный диагноз ставится только после повторных серологических исследований. 
Можно ли вылечить
Если лабораторная диагностика подтвердила наличие бруцелл в крови животных, то следует незамедлительно начать антибиотикотерапию, чаще всего ветеринары назначают антибиотики тетрациклиновой группы и препараты, содержащие хлорамфеникол.
Также обязательно назначаются различные иммуностимуляторы и иммуномодуляторы. Смертельный исход болезни возможен, если корова истощена, её рацион скуден и однообразен, а санитарные условия в стойле нарушены.
Такие радикальные методы обусловлены, прежде всего, высокой стоимостью лекарственных препаратов, а также огромным риском заражения всего стада от одной больной особи. 
В чём кроется опасность для человека
Не только животные могут быть поражены бруцеллами. При употреблении заражённого молока, мяса и сыров в организм человека попадают патогенные микроорганизмы, которые поражают его внутренние органы.
Вероятность заражения бруцеллами значительно выше у работников животноводческих ферм, которые контактируют с больными животными.
При появлении таких симптомов важно своевременно обратиться к врачу для проведения клинических исследований на предмет обнаружения антител к бруцеллёзу. 
Боль в суставах может быть симптомом бруцеллеза
Профилактика и вакцина против бруцеллёза КРС
Обезопасить свою ферму от заражения бруцеллёзом можно, выполняя следующие требования:
- Регулярная вакцинация крупного рогатого скота. Прививка не является стопроцентной гарантией формирования устойчивого к бруцеллам иммунитета, однако с её помощью вы сможете не допустить эпидемии среди всего стада.
- Соблюдение санитарных норм содержания животных, в которые входят обязательная уборка в стойлах и регулярная дезинфекция помещений.
- Регулярный осмотр животных ветеринаром. Кроме этого, заболевшую корову следует немедленно изолировать от других животных до её полного выздоровления.
- При контакте с животными всем работникам хозяйства следует обязательно использовать спецодежду — одноразовые перчатки, халаты и резиновые сапоги.
- После аборта или выкидыша следует немедленно продезинфицировать помещение, а послед и абортивный биоматериал уничтожается или направляется в ветеринарную лабораторию для проведения необходимых исследований.
- Приобретение молодняка или новых животных в стадо — только у проверенных заводчиков. Перед знакомством с остальными членами стада животное должно побыть в карантине на протяжении 7–14 дней.
Видео: бруцеллёз
Отзывы

Заболевание бруцеллезом считают установленным при выделении культуры бруцелл из биоматериала, положительной биопробе или при положительных результатах следующих серологических исследований невакцинированных животных: крупного рогатого скота (буйволов, яков, зебу), верблюдов и лошадей — одновременно в РИД и РА с титром антител 200 МЕ/мл и выше; овец и коз — в РА с титром антител 100 МЕ/мл и выше; оленей (маралов) и собак—в РА с титром антител 50 МЕ/мл и выше; животных всех видов — в РСК в разведении сыворотки 1 : 5 и выше.
При положительных результатах серологических исследований невакцинированных животных: крупного рогатого скота (буйволов, яков, зебу), верблюдов, лошадей — только в РА с титром антител 50…100 МЕ/мл; овец, коз, оленей (маралов) в РА с титром антител 25…50 МЕ/мл — обследуют повторно через 15…30 дней. При повышении титров заболевание считают установленным;
Если титры остались прежними, прибегают к дополнительным исследованиям (согласно утвержденным Правилам).
Заболевание считают установленным, если в неблагополучных по бруцеллезу стадах крупного рогатого скота выявлены ранее не вакцинированные животные, положительно реагирующие в РА с титром антител 100 МЕ/мл и выше или (и) в РСК (РДСК) в разведении 1 : 5 и выше.
Читайте также:


