Иммунохроматографический анализ при бруцеллезе

Используемые в настоящее время методы диагностики инфекционных заболеваний направлены в основном на определение возбудителя заболевания и его антигенов либо на выявление иммунного ответа инфицированного организма на антигены возбудителя. К последнему типу относятся методы серодиагностики – определения специфических антител в крови. Несмотря на то, что современные аналитические методы обеспечивают крайне низкий предел обнаружения, в ряде случаев серодиагностический подход оказывается предпочтительным. Гуморальный иммунный ответ всегда сопровождается значительным повышением концентрации специфических антител в крови, делая сыворотку крови универсальным материалом для диагностики разнообразных инфекционных заболеваний [1].
Серодиагностический подход наиболее оправдан при первичных обследованиях, а поскольку для массового скрининга решающее значение имеет скорость получения результата, представляется перспективным сочетание серодиагностики с таким простым и экспрессным методом, как иммунохроматографический анализ (ИХА). Результат ИХА может быть получен за 10–15 мин непосредственно на месте отбора пробы, без дополнительного оборудования и привлечения высококвалифицированного персонала.
Существенным ограничением для применения иммунохроматографии в серодиагностике является необходимость без разделения реагентов выявлять специфические антитела на фоне многократного избытка неспецифических антител. В настоящей работе на примере тест-системы для определения специфических антител против липополисахарида (ЛПС) Brucella abortus рассматривается подход, позволяющий обойти данное ограничение.
Материалы и методы
3. Получение коллоидного золота [6]. К 97,5 мл воды добавляли 1,0 мл 1 %-ного раствора золотохлористоводородной кислоты. Смесь доводили до кипения и при перемешивании добавляли 1,5 мл 1 %-ного раствора цитрата натрия. Кипятили 30 мин, затем охлаждали до комнатной температуры.
Для формирования аналитической зоны использовали препарат ЛПС Br. abortus. На 1 см полосы наносили 2 мкл препарата (1,0 мг/мл в дистиллированной воде).
5. Изготовление иммунохроматографических тест-систем [4, 5]. Полученные подложки и рабочие мембраны сушили на воздухе при 20–22 °C не менее 20 ч. Собирали мультимембранный композит, из которого получали полоски шириной 3,5 мм, используя автоматический гильотинный нарезчик Index Cutter-1 (“A-Point Technologies”, США). Тест-полоски помещали в пластиковые кассеты и герметично упаковывали в пакеты из ламинированной алюминиевой фольги с силикагелем в качестве осушителя с помощью запаивателя с миниконвейером FR-900 (“Wenzhou dingli packing machinery”, Китай).
Результаты и обсуждение
Традиционная схема иммунохроматографического анализа, применяемая для серодиагностики, предполагает взаимодействие всех антител, содержащихся в пробе, с конъюгатом коллоидного золота и реагента для связывания антител (обычно в качестве такового реагента используют антивидовые антитела, белок А Staphylococcus aureus или белок G Streptococcus spp.). После связывания части иммуноглобулинов в пробе конъюгат диффундирует по тест-полоске, и в аналитической зоне небольшая часть связанных иммуноглобулинов, специфичных к патогену, взаимодействует с иммобилизованным в аналитической зоне антигеном. Таким образом, сигнал ИХА (степень связывания окрашенной метки в аналитической зоне) в этом случае зависит не только от концентрации специфических антител, но и от общего содержания иммуноглобулинов в пробе, что не является диагностически значимым параметром и негативно сказывается на достоверности диагностики. Этот принцип лежит в основе разработанных на сегодняшний день ИХА тестов для серодиагностики бруцеллеза [2, 3].
В настоящей работе использован альтернативный подход, основанный на применении поливалентности антител. В данном формате ИХА коллоидное золото конъюгируется с тем же антигеном, который иммобилизован в аналитической зоне. Специфические антитела взаимодействуют разными валентностями с молекулами антигена, иммобилизованными на разных поверхностях: коллоидного золота и рабочей мембраны. В таком случае во взаимодействии принимают участие только специфические антитела.
В качестве антигена был использован ЛПС Br. abortus. Для определения предела обнаружения иммунохроматографических тестов использовали моноклональные антитела против ЛПС Brucella abortus. Чувствительность тестов составила 5 мкг/мл антител – как в буферном растворе, так и в сыворотке крупного рогатого скота, несмотря на то, что сыворотка содержит более 5 мг/мл общих иммуноглобулинов (рис. 1). Таким образом, предложенная тест-система позволяет выявлять менее 0,1 % специфических антител в пробе.
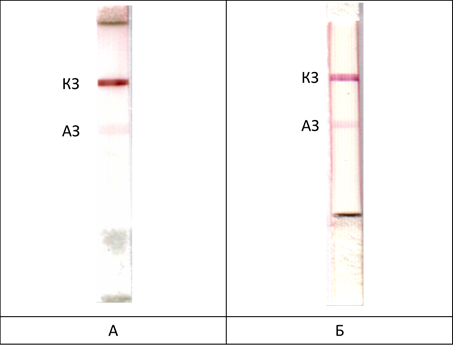
Рис. 1. Иммунохроматографическое выявление специфических антител (5 мкг/мл): А – в фосфатном буфере (pH 7,4); Б – в сыворотке крови крупного рогатого скота. АЗ – аналитическая зона, КЗ – контрольная зона
Разработанный тест был испытан на выборке из 39 коров, больных бруцеллезом. Данные иммунохроматографического тестирования сравнивали с данными иммуноферментного анализа (ИФА). В качестве унифицированной характеристики количества специфических антител в сыворотке использовали величину ее разведения, которая на асимптотической кривой титрования в ИФА соответствует оптической плотности 0,7. Полученные результаты приведены в табл. 1. Как видим, данные, полученные двумя методами, хорошо согласуются друг с другом.
Таблица 1. Результаты тестирования сывороток коров методами ИФА и ИХА

Иммуноферментный анализ (ИФА) — метод лабораторной диагностики, позволяющий обнаруживать специфические антитела и антигены при самых разных патологиях.
ИФА — один из самых распространенных и точных методов для выявления инфекций, передающихся половым путем, в частности ВИЧ, ВПЧ, гепатита В.

Для того чтобы результаты анализов были максимально достоверными, необходимо правильно подготовиться к их сдаче.

Спецпредложения, скидки и акции помогут существенно сэкономить на медицинском обследовании.
Контроль качества лабораторных исследований, осуществляемый по международным стандартам, — дополнительная гарантия точности результатов анализов.
Современная диагностика в медицине немыслима без высокочувствительных лабораторных анализов. Прежде для установления причин тех или иных симптомов врачи были вынуждены ориентироваться на косвенные признаки болезни, а также проводить многоступенчатые микроскопические исследования в попытке обнаружить возбудителя инфекции. Сегодня достаточно одного-единственного теста — такого как иммуноферментный анализ — чтобы подтвердить или опровергнуть первоначальный диагноз.
Основные понятия и принцип метода иммуноферментного анализа
Существует несколько разновидностей антител, каждая из которых вступает в действие на определенном этапе иммунного ответа. Так, первыми в ответ на проникновение антигена в организм синтезируются иммуноглобулины класса М (IgM). Содержание этих антител наиболее высоко в первые дни инфекционного процесса.
Следом за ними иммунная система выбрасывает в кровь иммуноглобулины класса G (IgG), которые помогают уничтожать антигены до полной победы над инфекцией, а также продолжают циркулировать по сосудам в дальнейшем, обеспечивая иммунитет к повторному заражению. На этом явлении основана вакцинация: благодаря прививкам, содержащим ослабленные антигены микробов и вирусов, в нашей крови появляется большое количество IgG, которые при контакте с реальной угрозой быстро подавляют инфекцию — до того, как она нанесет вред здоровью.
Как узнать, какие именно антигены или антитела присутствуют в организме человека? Когда врач предполагает, что причиной заболевания является определенная инфекция, или желает измерить концентрацию определенного гормона, он назначает пациенту иммуноферментный анализ.
ИФА бывает качественным и количественным. В первом случае подразумевается однозначный ответ: искомое вещество или найдено, или не найдено в образце. В случае с количественным анализом более сложная цепь реакций дает возможность оценить концентрацию антител в крови человека, что в сравнении с результатами предыдущих тестов даст ответ на вопрос о том, как развивается инфекционный процесс.
Бесспорные преимущества ИФА — высокая чувствительность и специфичность метода. Чувствительность — это возможность распознать искомое вещество, даже если его концентрация в образце невысока. Специфичность же подразумевает безошибочность диагностики: если результат положительный, значит, найдены именно те антитело или антиген, которые предполагались, а не какие-то другие.
Высокая степень технологичности проведения иммуноферментного анализа минимизирует влияние человеческого фактора, что снижает вероятность ошибки. Большинство используемых в современных лабораториях тест-систем и реактивов для ИФА выпускаются в промышленных условиях, что гарантирует точный результат.
В случае диагностики инфекционных заболеваний иммуноферментный анализ не может найти возбудителя и определить его специфичные свойства: он лишь указывает на наличие антител в крови у больного, косвенно свидетельствующих о присутствии чужеродного микроорганизма в теле человека.
ИФА — крайне точный, но не дешевый метод, поэтому обращаться к нему нужно с умом, а интерпретацией результатов должен заниматься квалифицированный врач.
Невозможно охватить полный список показаний к проведению ИФА. Вот наиболее распространенные цели анализа:
- Диагностика острых и хронических инфекционных заболеваний:
- IgM и IgG к вирусным гепатитам А, B, C, E, а также антигенов гепатитов В и С;
- IgG к ВИЧ;
- Ig M и IgG к цитомегаловирусной инфекции;
- Ig M и IgG к вирусу Эпштейна-Барр;
- Ig M и IgG к герпетическим инфекциям;
- Ig M и IgG к токсоплазмозу;
- Ig M и IgG к кори, краснухе, сальмонеллезу, дизентерии, клещевому энцефалиту и другим заболеваниям;
- IgG к паразитарным заболеваниям;
- Ig M и IgG к инфекциям, передающимся половым путем;
- IgG к хеликобактерной инфекции.
- Общая оценка показателей иммунитета человека и маркёров некоторых аутоиммунных заболеваний.
- Выявление онкологических маркёров (фактора некроза опухоли, простатспецифического антигена, раково-эмбрионального антигена и других).
- Определение содержания гормонов в сыворотке крови (прогестерона, пролактина, тестостерона, тиреотропного гормона и других).
Основной биоматериал для проведения ИФА — это сыворотка крови: в лаборатории у пациента берут образец крови из вены, из которого в дальнейшем удаляют форменные элементы, затрудняющие проведение анализа. В некоторых других случаях для анализа используется спинномозговая жидкость, околоплодные воды, мазки слизистых оболочек и т.д.
Для того чтобы избежать искажений в результатах, рекомендуется сдавать кровь натощак, а за две недели до исследования (если целью является диагностика хронических, скрыто протекающих инфекционных заболеваний) необходимо отказаться от приема антибиотиков и противовирусных препаратов.
При наличии необходимых реактивов и хорошей организации работы лаборатории результат анализа вы получите в течение 1–2 суток после забора крови. В некоторых случаях, при необходимости получения экстренного ответа, этот срок может быть сокращен до 2–3 часов.
- IgM — наличие этого класса иммуноглобулинов говорит об остром инфекционном процессе в организме. Отсутствие IgM может говорить как об отсутствии конкретного возбудителя в организме, так и о переходе инфекции в хроническую стадию.
- IgA при отрицательном результате теста на IgM чаще всего свидетельствует о хронической или скрыто протекающей инфекции.
- IgM и IgA (совместное присутствие) — два положительных результата говорят о разгаре острой фазы заболевания.
- IgG говорит либо о хронизации заболевания либо о выздоровлении и выработке иммунитета к инфекционному агенту.
В зависимости от содержания анализа в бланке могут быть представлены данные в виде таблицы с перечислением всех антител или антигенов с пометками об отрицательной или положительной реакции, либо будет указано количественное значение результата (отрицательный, слабоположительный, положительный или резко положительный). Последний вариант определяет, сколько антител содержится в анализируемом образце.
Еще один количественный показатель — индекс авидности антител, выраженный в процентах. Он указывает, сколько времени прошло от начала инфекционного процесса (чем выше индекс — тем больше).
Сегодня выпускаются тысячи видов тест-систем ИФА, позволяющих обнаруживать специфические антитела и антигены при самых разных патологиях. Поэтому этот анализ используется практически во всех медицинских отраслях. Диагноз, поставленный с помощью ИФА, — это гарантия назначения адекватной терапии и эффективного лечения заболевания.
Информативность ИФА делает этот анализ важным инструментом в работе многих медицинских центров. Но можно ли доверять такую диагностику государственным лабораториям или лучше самим выбрать, где провести такое исследование?

Цена:
Авторы работы:
Научный журнал:
Год выхода:
ПРИКЛАДНАЯ БИОХИМИЯ И МИКРОБИОЛОГИЯ, 2012, том 48, № 6, с. 653-661
РАЗРАБОТКА ИММУНОХРОМАТОГРАФИЧЕСКОЙ ТЕСТ-СИСТЕМЫ
ДЛЯ ЭКСПРЕССНОЙ ДЕТЕКЦИИ ЛИПОПОЛИСАХАРИДНОГО АНТИГЕНА И КЛЕТОК ВОЗБУДИТЕЛЯ БРУЦЕЛЛЕЗА КРУПНОГО РОГАТОГО СКОТА
Разработан экспресс-метод детекции поверхностного липополисахаридного антигена и клеток возбудителя бруцеллеза крупного рогатого скота, представляющий собой иммунохроматографический анализ в "сэндвич"-формате. Контакт пробы и тест-полоски с нанесенными иммунореагентами инициирует движение жидкости по мембранным компонентам тест-полоски, иммунохимические взаимодействия и формирование окрашенных зон. Показано, что данный метод позволяет за 10 мин определять липополисахаридный антиген клеточной стенки возбудителя бруцеллеза в концентрациях до 10 нг/мл и клетки Brucella abortus в концентрациях до 106 кл./мл (5 х 104 кл. в пробе). Подтверждена специфичность иммунодетекции. Разработанная тест-система может быть использована при внелабораторной экспресс-диагностике бруцеллеза крупного рогатого скота.
Во многих странах бруцеллез наносит значительный экономический ущерб, обусловленный заражением сельскохозяйственных животных и частыми случаями инфицирования людей [1, 2]. Высока актуальность этой проблемы, в частности, для России и Казахстана [3—6].
Одним из основных направлений в борьбе с бруцеллезом является своевременное выявление очагов инфекции, эффективность которого связана с достоверной, оперативной и информативной лабораторной диагностикой заболевания. Для диагностики бруцеллеза в настоящее время используют бактериологические, биологические, молекулярные и серологические методы, каждый из которых обладает своими достоинствами и ограничениями [7].
Бактериологический метод при положительном результате обеспечивает наиболее достоверную лабораторную диагностику бруцеллеза. Дополнительное преимущество метода заключается в возможности идентификации возбудителя до биовара, что позволяет установить источник инфекции и наметить наиболее эффективные противоэпидемические и профилактические мероприятия. Вместе с тем недостатками метода являются длительность получения результатов, трудоемкость и опасность для персонала, низкая производительность и другие факторы [7, 8].
Биологический метод основан на избирательном накоплении возбудителя бруцеллеза в организме восприимчивых к нему лабораторных животных при парентеральном введении исследуемого материала, в том числе загрязнен-
ного посторонней микрофлорой. Метод несколько более чувствителен, чем бактериологический, при работе с высоковирулентными штаммами бру-целл, но малопригоден при исследовании материала, содержащего возбудитель с ослабленной вирулентностью. В остальном биологический метод сохраняет недостатки бактериологического.
Для детекции и идентификации бруцелл и лабораторного подтверждения диагноза используют также метод полимеразной цепной реакции, позволяющий в течение 5—6 ч определить наличие специфической последовательности ДНК бруцелл в пробах [9]. К ограничениям метода следует отнести длительность, повышенные требования к условиям проведения лабораторного тестирования и квалификации персонала.
Серологические методы позволяют фиксировать наличие антигенсодержащего материала или антител к нему, не прибегая к изоляции болезнетворного агента. В отличие от бактериологического и биологического методов, достоверность которых вытекает из факта выделения бруцелл, серологические тесты представляют доказательства присутствия в исследуемом материале искомого агента на основе специфического взаимодействия антиген—антитело. Важным преимуществом этих методов перед первыми является возможность детекции не только корпускулярных, но и субкорпускулярных и растворимых антигенов (т.е. циркулирующих в организме или выводимых из него фрагментов возбудителя). К настоящему времени предложены и используются разнообразные серологические тесты, позволяю-
щие выявлять как антигены бруцелл, так и специфические антитела: реакция агглютинации [10, 11], реакция связывания комплемента [12], имму-нодиффузия [10], иммунофлуоресцентный анализ [13], иммуноэлектрофорез [14], радиоиммунный анализ [15], иммуноферментный анализ (ИФА) [16—18], дот-иммуноанализ [19]. Многообразие серологических методов обусловлено, главным образом, стремлением повысить их достоверность и информативность. Исходя из этого, обычно используют не один серологический тест, а несколько дополняющих друг друга тестов [20].
Выбор оптимального формата иммуноанализа основывается прежде всего на его экспрессности и пределе детекции. Исходя из этих критериев, несомненными преимуществами обладают активно разрабатываемые в последнее время имму-нохроматографические методы анализа [21]. При проведении иммунохроматографии контакт пробы с тест-полоской инициирует движение реагентов по мембранам тест-полоски и все происходящие при этом специфические реакции. Вызываемое окрашивание определенных зон тест-полоски позволяет сделать вывод о результатах тестирования, в том числе исходя из визуальной оценки интенсивности окрашивания. Таким образом, иммунохроматография обеспечивает возможность проведения быстрого (5—15 мин) и нетрудоемкого анализа, который может быть реализован непосредственно на месте отбора пробы [22]. Для документирования результатов иммуно-хроматографии и при необходимости их последующей количественной оценки могут быть дополнительно использованы различные портативные средства видеорегистрации — как специализированные устройства, так и серийные сканеры и мобильные телефоны [23, 24].
Цель исследования — разработка и характеристика экспрессного иммунохроматографическо-го анализа (ИХА) для диагностики бруцеллеза крупного рогатого скота (КРС), основанного на определении в биоматериале клеток возбудителя бруцеллеза Brucella abortus и его специфического антигена — липополисахарида (ЛПС) клеточной стенки.
Реактивы. В работе применяли антитела козы (GAMIss), кролика (RAMIss) и овцы (SAMIss) против IgG мыши и антитела овцы (SARIss) против IgG кролика ("Имтек", Россия), антитела козы (GAMI) против IgG мыши ("Arista Biologicals", США), конъюгат антител быка против IgG мыши с пероксидазой ("Медгамал", Россия), трис, Тритон Х-100, дигидрохлорид 3,3',5,5'-тетраметил-бензидина, N-гидроксисукцинимидный эфир биотина, цитрат натрия, азид натрия, фетальную сыворотку КРС ("Sigma", США), золотохлори-
стоводородную кислоту ("Fluka", Германия), ди-метилсульфоксид (ДМСО), Твин-20, БСА ("MP Biomedicals", Великобритания). Все вспомогательные реагенты (соли, кислоты, щелочи, органические растворители) были аналитической или химической чистоты.
Растворы для получения коллоидного золота (КЗ) и его конъюгатов готовили на деионизиро-ванной воде (18.2 Mfi cm при 25°С, система Simplicity, "Millipore", США).
ИФА проводили в 96-луночных прозрачных полистироловых микропланшетах Costar 9018 ("Corning Costar", США). Для изготовления им-мунохроматографических тест-полосок использовали наборы mdi Easypack ("Advanced Microdevices", Индия), включающие рабочую мембрану, закрепленную на твердой основе, подложку для коллоидного конъюгата, мембрану для нанесения пробы, конечную адсорбирующую мембрану и ламинирующую защитную пленку.
В работе также использовали коммерческий препарат единого бруцеллезного антигена Brucella abortus 19 производства НПО "Антиген" Алма-ты, Казахстан (концентрация клеток 1010 кл./мл).
Выращивание культуры клеток B. abortus 19.
Культуру клеток B. abortus 19 выращивали на эритрит-агаре при 37°С в течение 3—4 сут. Клетки смывали стерильным физиологическим раствором, рН 7.0—7.2, фильтровали и прогревали при 80°С в течение 1 ч для инактивации бруцелл. Для отделения бактериальной массы взвесь центрифугировали при 3000 g в течение 10—15 мин. На-досадочную жидкость отделяли, а осадок использовали для получения ЛПС клеточной стенки бруцелл.
Получение бактериальных препаратов. При характеристике специфичности тест-систем были использованы клетки B. suis, Yersinia enterocolitica O:9 R, O:9 S и 287, Francisella tularensis, Vibrio chol-erae Inaba, Salmonella enteritidisyena, S. typhimurium TA 100, Escherichia coli 565, E. coli 113-3, Shigella sonne, S. flexneri, Staphylococcus aureus, Citrobacter freundii в концентрациях 109—1010 кл./мл, подвергнутые термообработке при 80°С в течение 1 ч.
Выделение ЛПС антигена B. abortus. ЛПС бруцелл получали методом водно-фенольной экстракции. Инактивированную клеточную массу B. abortus 19 экстрагировали водно-фенольной смесью (объемное соотношение вода—фенол = 1 : 1) 15 мин при 70°С, после охлаждения центрифугировали при 1100 g в течение 1 ч. Отделяли феноль-ный слой, повторяли экстракцию в таком же режиме, объединяли фенольные фазы и диализова-ли их против воды. Содержание углеводов определяли фенольно-серным методом [25], а затем концентрировали препарат до 1 мг/мл. К полученному препарату антигена добавляли азид
натрия до конечной концентрации 0.1% и хранили при 2—4°С.
Получение моноклональных антител. Иммунизация включала 5 внутрибрюшинных инъекций препарата ЛПС B. abortus 54 мышам BALB/c (первая — в смеси с полным адъювантом Фрейнда и 4 последующих — в 50 мМ К-фосфатном буфере, рН 7.4, с 0.1 М NaCl, ФБС). Дозы иммуногена на животное составляли 100 мкг. Титр специфических антител определяли методом ИФА. Для получения иммунных спленоцитов использовали мышей с максимальным титром.
Через 3 сут после последней иммунизации выделяли спленоциты и смешивали их с миеломными клетками линии X63-Ag-8.653. Селекцию гибридом проводили в среде, содержащей гипоксантин, аминоптерин и тимидин. Для культивирования клеток использовали среду RPMI-1640 с добавлением 10% фетальной сыворотки плода КРС.
Начиная с 10 сут после слияния клеток, суп
Для дальнейшего прочтения статьи необходимо приобрести полный текст. Статьи высылаются в формате PDF на указанную при оплате почту. Время доставки составляет менее 10 минут. Стоимость одной статьи — 150 рублей.
ЖЕЛУДКОВ М.М., ЦИРЕЛЬСОН Л.Е. — 2010 г.
БЫЗОВА Н.А., ДЗАНТИЕВ Б.Б., ЖЕРДЕВ А.В., САДЫХОВ Э.Г., СВЕШНИКОВ П.Г. — 2015 г.
АТАБЕКОВ И.Г., БЛИНЦОВ А.Н., БЫЗОВА Н.А., ДЗАНТИЕВ Б.Б., ЖЕРДЕВ А.В., САФЕНКОВА И.В., ЧИРКОВ С.Н. — 2009 г.
БУРАКОВСКИЙ А.И., БЫЗОВА Н.А., ДЗАНТИЕВ Б.Б., ЖЕРДЕВ А.В., ЛУХВЕРЧИК Л.Н., ПИВЕНЬ Н.В. — 2013 г.
Что представляет собой иммунохроматографический анализ (ИХА)? Разберемся подробнее в этом вопросе.
ИХА – иммунохимический способ анализа, который основан на методе тонкослойной хроматографии. Он включает реакцию между соответствующим антителом и антигеном в биологических материалах. Осуществляется посредством особых тест-полосок, тест-кассет или панелей. ИХА – это экспресс-тест.
Сущность данного метода исследования
Действие его основывается на том, что при погружении в биологическую жидкость (либо другой жидкий образец) теста она начинает двигаться вдоль полоски по методу тонкослойной хроматографии. Движутся вместе с ней нанесенные на нее специфические меченые антитела, которые связываются аффинно с анализируемым компонентом.
Различаются два формата анализа: прямой и конкурентный метод.
Прямой метод
В формате сэндвичного (прямого) иммунохроматографического анализа крови используется конъюгат антитела-метки, который наносится для конъюгата на мембрану. Иммобилизованные антитела на полоске, обладающие конкретным аналитом, на контрольной линии – антитела антивидовые, специфические к антителам первичным.

Прямой ИХА применяется для определения возбудителей инфекционных патологий, вирусов – высокомолекулярных соединений, включая разные гормоны, ВИЧ.
Конкурентный метод исследования
Способ конкурентного иммунохроматографического анализа применяется для установления низкомолекулярных соединений. Основан он на конкуренции иммобилизованного конъюгата аналит и аналита: носитель-белок за ограниченное число центров связывания периферических антител, которые содержатся в конъюгате Ат-метка. Когда наносится образец, содержащий аналит, то последний связывается на мембране с конъюгатом с конъюгатом Ат-метка. Иммунокомплекс в дальнейшем проходит через тестовую зону, в которой иммобилизуется конъюгат аналит, то есть белок-носитель.
С этим конъюгатом не может связаться иммунокомплекс из-за стерических сложностей: низкомолекулярные соединения чаще всего обладают одной антигенной детерминантой, таким образом, у иммуноглобулинов есть один центр связи с антигеном, который уже занят до этого аналитом. Иммунный комплекс впоследствии связывается антивидовыми иммуноглобулинами, которые находятся на контрольной линии. Если в тестовой области отсутствует окрашенная полоса и есть окраска в контрольной зоне, это говорит о том, что содержание определяемого компонента в исследуемом образце выше порогового значения для такого теста. Если в аналите отсутствует анализируемое вещество в образце, то происходит связь конъюгата Ат-метка с конъюгатом Аг: носитель-белок, иммобилизованный в области тестовой линии. Ат-метка свободный конъюгат попадает в сферу контрольной линии, где связывается с антивидовыми антителами. Если есть две окрашенные линии (контрольная и тестовая), то можно говорить об отрицательном результате теста.

Метод конкурентного ИХА применяется для определения низкомолекулярных соединений, включая тканевые экстракты.
Преимущество такого способа – легкость и быстрота использования, возможность применения неприборных методов ИХА с оценкой результата визуально. Не требуется дополнительное оборудование, и анализ может провести человек без медицинского образования в любое время.
Какие применяются метки в ИХА?
В иммунохроматографическом анализе в качестве меток применяются разные частицы и вещества.
- Красители (частицы крашеного латекса, или наночастицы углерода, или коллоидного золота). Такой вариант позволяет визуально отслеживать результат или определить колориметрическим прибором. Применение красящих меток, которые присоединяются к носителю, позволяет делать мультианализ, где разноцветные линии соответствуют разным аналитам. Используемой меткой чаще всего выступают наночастицы золота коллоидного.

- Связанные ковалентно с латексными частицами биолюминесцентные, фосфоресцентные и флуоресцентные метки. Применяются лишь в приборных способах ИХА, в которых регистрируется результат особым ридером. Наиболее распространенными являются флуоресцентные метки.
- Парамагнитные метки, закрепленные на латексных частицах. Метод применяется в ИХА с использованием приборов, которые регистрируют силу магнитного поля.
- Липосомы, используемые в качестве носителей разных меток (электроактивных, ферментативных, флуоресцентных, красящих и т. д.) Это новое направление среди разновидностей анализа.
- Ферментные метки, применяемые по принципу ИФА. Регистрация реакции проводится посредством окрашивания субстратов. В итоге получается визуальный результат, либо считывается ридером.
Преимущества данного метода исследования
Главными преимуществами применения метода иммунохроматографического анализа становятся:
- Удобство и простота – позволяет получить результат (первичное представление и анализ причины болезни) без специальных навыков и оборудования.
- Надежность – достоверность тестов достигает 99,8 %, каждый тест при этом имеет внутренний встроенный контроль.
- Анонимность – это особенно важно при определении болезней, передаваемых половым путем, прочих инфекционных болезней, а также установлении употребления наркотических веществ.
- Экономичность – приобрести тест может каждый, экономится время на проведение анализа.
- Независимость – не нуждается в предварительной консультации и рецепте врача.

Тест на наркотики как проводится: особенности и недостатки ИХА-метода
Самой популярной услугой становится анализ мочи на наркотики посредством метода иммунохроматографического анализа. Это позволяет исследовать мочу на 14 видов нарковеществ.
Иммунохроматографический анализ на наркотики также считается экспресс-методом диагностики. Результат теста можно узнать спустя 15 минут. Для проведения данного исследования используют особые тест-полоски, которые пропитаны веществами-индикаторами. Если в моче имеются следы наркотического вещества, цвет полоски меняется. Основной недостаток такого анализа – невозможность определить, какова концентрация вещества и степень наркотического опьянения, таким образом, результаты иммунохроматографического анализа в качестве доказательства в суде использовать не получится.
Каков результат такого анализа?
Если на индикаторах появились две розовые полосы, то делается заключение, что в моче не содержится наркотик, или же его концентрация недостаточна для определения иммунохроматографическим методом. При возникновении одной розовой полосы можно говорить о наличии наркотического вещества: марихуаны, производных эфедрона, опиатов, производных барбитуровой кислоты, амфетаминов, кокаина, фенциклидина, бензодиазепинов, экстази.

Какие можно сделать выводы?
Иммунохроматографический анализ (экспресс-тест) является эффективным средством диагностики, он позволяет визуально на протяжении нескольких минут выявить и оценить концентрацию антигенов, гормонов, антител и других диагностически важных компонентов в человеческом организме. Экспресс-тесты имеют высокую степень точности и чувствительности, обнаруживается более ста видов болезней, а также весь спектр наркотических веществ, и достоверность анализа очень высокая.
Читайте также:


