Иммунная терапия при сепсисе
Резюме
Несмотря на многочисленные усилия проникнуть в суть воспалительных реакций, лежащих в основе патогенеза сепсиса, ряд клинических исследований по модулированию иммунного ответа с использованием антиэндотоксиновых антител, антител к фактору некроза опухоли-α (ФНО-α) и растворимых ФНО-рецепторов не смогли продемонстрировать клинические преимущества. Аналогичные результаты наблюдали при использовании гидрокортизона или интенсивном контроле уровня глюкозы путем постоянной инфузии инсулина.
Иммуномодулирующий эффект макролидов был продемонстрирован у больных хроническими легочными заболеваниями - диффузным панбронхиолитом и муковисцидозом. Благоприятные клинические исходы внебольничной пневмонии при лечении β-лактамными антибиотиками в комбинации с макролидами также объясняются иммуномодулирующим действием последних. Эффективность макролидов в отношении грамотрицательных микроорганизмов в экспериментальных моделях сепсиса послужила основанием для инициации клинического исследования иммуномодулирующего действия кларитромицина у 200 больных вентилятор-ассоциированной пневмонией и сепсисом.
Сепсис занимает 10-е место в списке ведущих причин смерти в США. Сепсис развивается у 11-12% больных отделений интенсивной терапии (ОИТ) с показателями смертности 48,4-55,2% (в ОИТ и госпитальной). Несмотря на своевременную постановку диагноза и раннее начало антибиотикотерапии, смертность у больных сепсисом по-прежнему высока. Очевидно, это объясняется вовлечением других механизмов, в частности избыточного иммунного ответа, которые приводят к развитию полиорганной недостаточности (ПОН) с неблагоприятным исходом для больного. Поэтому одним из ключевых направлений в лечении сепсиса является воздействие на иммунный ответ.
Индукторами септической реакции считаются определенные компоненты/метаболиты микробной клетки - эндотоксины (липополисахарид - ЛПС), липотейхоевая кислота, зимозан и бактериальная ДНК, которые активируют моноциты, прикрепляясь к толл-рецепторам клеточной стенки, и таким образом стимулируют внутриклеточные сигнальные пути. Это приводит к активации ядерного фактора NF-κΒ, генной экспрессии про- и противовоспалительных цитокинов, среди которых наиболее изученными являются ФНО-α и интерлейкины (ИЛ) - ИЛ-1β, ИЛ-6, ИЛ-8, ИЛ-10. Гиперпродукция этих цитокинов может привести к развитию ПОН, синдрому диссеминированного внутрисосудистого свертывания и гипергликемии.
Можно предположить, что подавление некоторых компонентов этого воспалительного каскада позволит улучшить клинический исход. Были предприняты попытки подавления: 1) ЛПС - антиэндотоксиновыми антителами; 2) ФНО-α - антителами и растворимыми рецепторами; 3) гиперкоагуляции - дротрекогином-α (Зигрис); 4) гипергликемии - интенсивной инсулинотерапией; 5) надпочечниковой недостаточности - введением малых доз гидрокортизона. Проведено 11 рандомизированных исследований эффективности антиэндотоксиновых и анти-ФНО-α антител и растворимых рецепторов (этанерцепт, ленерцепт) с участием 3000 пациентов, но с однотипным заключением об отсутствии у этих препаратов каких-либо преимуществ перед плацебо в улучшении показателя 28-дневной выживаемости.
Интерес к теме возобновился после публикации результатов исследования PROWESS с участием 1690 пациентов с симптомами недостаточности одного и более органов, в котором 4-дневная инфузия дротрекогина-α (человеческого рекомбинантного активированного С-протеина) улучшила показатели 28-дневной выживаемости по сравнению с плацебо, особенно в группе с исходным значением APACHE II >25. Впрочем, этот результат не удалось воспроизвести у больных тяжелым сепсисом (APACHE II Учитывая гетерогенность септических больных по инфекционному возбудителю и отсутствие четких данных об эффективности антибактериальной терапии в проведенных исследованиях, было решено обратиться к антибактериальным препаратам с иммуномодулирующим эффектом. Макролиды были выбраны в силу демонстрируемой ими в течение 20 лет эффективности при воспалительных заболеваниях легких, в частности, макролиды значительно увеличивают продолжительность жизни у больных диффузным панбронхиолитом 1 . В 4 исследованиях показана эффективность азитромицина у больных муковисцидозом, в том числе за счет снижения продукции слизи респираторным эпителием, подавления quorum sensing P. aeruginosa, стимуляции фагоцитоза альвеолярными макрофагами и снижения воспаления за счет подавления продукции провоспалительных цитокинов клетками респираторного эпителия. Эти эффекты наблюдались у пациентов с хроническим воспалением.
В эксперименте показано подавление кларитромицином высвобождения ИЛ-8 клеточной культурой человеческих моноцитов после их предварительной стимуляции клеточными лизатами P. aeruginosa и Escherichia coli благодаря ингибированию транскрипции ядерного фактора NF-κΒ и активатора протеина 1. Иммуномодулирующее действие макролидов при остром воспалении подтверждается данными ретроспективного анализа результатов лечения внебольничной пневмонии у 1518 больных в Испании: смертность 6,9% - при лечении комбинацией β-лактама и макролида, 13,3%- при лечении только β-лактамом. Анализ 409 случаев пневмонии, вызванной S.pneumoniae, показал снижение макролидами риска смерти в 2,5 раза, исключив влияние макролидов на исход за счет подавления атипичных патогенов. Эти данные подтвердились в ретроспективном анализе 2349 больных пневмонией.
Предпочтение кларитромицину отдано в силу того, что азитромицин не обеспечивает достаточные сывороточные концентрации, необходимые для подавления продукции провоспалительных цитокинов моноцитами. В экспериментальной модели сепсиса, вызванного полирезистентными штаммами P. aeruginosa, Klebsiella pneumoniae и E. coli (не относящимися к спектру активности кларитромицина), кларитромицин вводили внутривенно одновременно с инокуляцией бактерий либо уже после появления симптомов сепсиса (для максимального приближения к клиническим условиям). При отсутствии подавления роста бактерий кларитромицин в значительной мере ослабил воспалительную реакцию, что подтверждалось меньшей инфильтрацией тканей нейтрофилами и лимфоцитами, снижением сывороточной концентрации ФНО-α и сывороточного оксидантного стресса, а также повысил выживаемость. Максимальные сывороточные концентрации кларитромицина в этом исследовании варьировали в диапазоне 5-10 мкг/мл и достигались через 30 мин после введения.
Клиническая эффективность кларитромицина у больных сепсисом и вентилятор-ассоциированной пневмонией (ВАП)
Двести больных ВАП, осложненной нозокомиальным сепсисом, были рандомизированы в группы лечения кларитромицином и плацебо (100 пациентов в каждой группе), кларитромицин вводили в дозе 1 г/сут в виде внутривенной 1-часовой инфузии в течение 3 дней подряд с намерением достичь сывороточных концентраций 5-10 мкг/мл. Дополнительная антибактериальная терапия назначалась по усмотрению лечащего врача. В исследовании использовались международные критерии сепсиса, тяжелого сепсиса и септического шока.
Группы кларитромицина и плацебо были сопоставимы по возрасту, половой принадлежности, сопутствующим заболеваниям, тяжести сепсиса и степени органной недостаточности у пациентов, равно как и степени респираторной дисфункции (значению отношения парциального давления кислорода к фракции вдыхаемого кислорода -рО2/FiO2) и спектру используемых дополнительно иммуномодулирующих препаратов (низких доз гидрокортизона и инфузии инсулина для поддержания уровня глюкозы в пределах 80-110 мг/дл).
Этиологию сепсиса определяли посевом трахеобронхиального секрета с последующим бактериологическим исследованием до начала лечения кларитромицином, а затем на 5 и 10-е сутки. В группах плацебо и кларитромицина культуры грамотрицательных патогенов (10 5 КОЕ) выделены у 68 и 66% пациентов соответственно (разница статистически незначима), в том числе Acinetibacter baumannii (63,2%), P. aeruginosa (17,6%), K. pneumoniae (8,8%). Частота выделения указанных возбудителей в группе кларитромицина составила 54,5, 25,8 и 7,6% соответственно.
Для исключения влияния других антибактериальных препаратов на интерпретацию эффектов кларитромицина и клинических исходов среди выделенных патогенов определили пропорцию чувствительных микроорганизмов к одному или более используемым в группе антибиотикам. Таковых оказалось 62,5% в группе плацебо и 75,4% - в группе кларитромицина (р=0,44). Эрадикация патогена к 5-му дню была достигнута у 37,3% пациентов из группы плацебо и 42,6% пациентов из группы кларитромицина (р=0,31), а к 10-му дню - у 41,4 и 46,2% соответственно (р=0,82).
Обе группы сравнивали по следующим клиническим исходам/параметрам: резолюция ВАП, время до отключения от аппарата искусственной вентиляции легких (ИВЛ) (экстубации), риск смерти. Среднее время резолюции ВАП составило 15,5 сут в группе плацебо и 10,0 сут в группе кларитромицина (р=0,011). Средний период времени до экстубации составил 22,5 и 16,0 сут соответственно (р=0,047). Полученные данные согласовались с результатами оценки по шкале легочной инфекции CPIS (Clinical Pulmonary Infection Score): исходные значения составили 7,92 и 7,62 балла в группах плацебо и кларитромицина соответственно (р=0,29), на 5-е сутки - 6,10 и 5,23 балла, на 10-е - 5,88 и 5,09 (р=0,032).
Показатель выживаемости зависел от развития у пациентов септического шока в сочетании с ПОН -основной причины смерти. В группе плацебо относительный риск смерти ввиду указанных причин составил 19,0, а в группе кларитромицина он был снижен до 3,78 (р=0,043).
В целом, ПОН развилась у 22 пациентов, не имевших симптомов органной недостаточности на момент включения в исследование. Средний период времени до проявления симптомов органной недостаточности составил 3,38 сут в группе плацебо и 5,78 - в группе кларитромицина (р=0,006).
В группе кларитромицина не выявили риска развития каких-либо серьезных побочных эффектов в связи с введением препарата.
Полученные результаты могут послужить основанием для назначения кларитромицина внутривенно больным сепсисом и ВАП. Предлагаемые показания к применению кларитромицина: 1) ВАП - ввиду обеспечения кларитромицином более раннего разрешения пневмонии и более раннего отключения от ИВЛ; 2) септический шок с ПОН -ввиду существенного снижения риска смерти.
Могут рассматриваться разные гипотезы о механизме действия кларитромицина. Исходя из накопленных данных (у больных с хроническими воспалительными заболеваниями дыхательных путей и в модели экспериментального сепсиса), механизм действия кларитромицина включает модулирование иммунного ответа хозяина и инструмента общения бактерий - quоrum sensing, о чем свидетельствует пролонгирование кларитромицином промежутка времени до развития ПОН у септических больных.
Заключение
Сепсис и септический шок остаются одной из основных причин гибели больных в ОИТ. Попытки использовать ряд препаратов с разным механизмом действия с целью модулирования иммунного ответа хозяина практически не изменили показатели смертности у этой категории больных (см. рисунок).
Наблюдаемые в двойном слепом рандомизированном клиническом исследовании эффекты внутривенного лечения кларитромицином больных ВАП и сепсисом позволяют смотреть в будущее с оптимизмом. Необходимы дополнительные клинические исследования для четкого определения показаний к применению кларитромицина в качестве иммуномодулятора при сепсисе.
В. Б. Белобородов
Российская медицинская академия последипломного образования, Москва
Статья опубликована в журнале "Вестник интенсивной терапии", 2010 г, №4. Сепсис
Клиническое значение тяжелого сепсиса определяется его распространенностью и высокой летальностью. Несмотря на существенные достижения в развитии медицинских технологий, в частности, расширение диагностических и терапевтических возможностей, существенного снижения летальности не достигнуто. В значительной степени это связано с недостаточной изученностью механизмов иммунологических нарушений, возникающих в процессе развития инфекции и полиорганной недостаточности, и отсутствием эффективных методов их коррекции.
К настоящему времени в качестве иммунной коррекции в лечении сепсиса клиническими исследованиями доказана эффективность только заместительной терапии иммуноглобулинами (lg) для внутривенного введения. Показано снижение летальности при применении иммуноглобулинов, содержащих в своем составе иммуноглобулины классов G, М и A (IgGMA), в отличие от иммуноглобулинов класса G (IgG) и специфических моноклональных антител против фактора некроза опухолей (ФНО-α) и растворимых рецепторов интерлейкина-1 (ИЛ-1). В современных рекомендациях имеются показания только для IgGMA.
Клеточные повреждения, связанные с медиаторами воспаления
Около 30 лет назад были проведены первые экспериментальные и клинические исследования, показавшие ключевую роль медиаторов в процессе развития сепсиса. Грамположительные и грамотрицательные бактерии способны быть причиной синтеза и выделения провоспалительных медиаторов (в том числе, цитокинов). Цитокины играют важнейшую роль в развитии сепсиса и септического шока. Компонентами клеточной стенки, которые способствуют образованию цитокинов, являются липополисахарид (ЛПС - грамотрицательные бактерии), пептидогликан (грамположительные и грамотрицательные бактерии) и липотейхоевая кислота (грамположительные бактерии). Кроме того, грамположительные бактерии способны к секреции суперантигена — белковой субстанции, которая связывается напрямую с рецепторами главного комплекса гистосовместимости и Т-рецепторами, что приводит к массивной продукции цитокинов.
На начальных этапах активации врожденного иммунитета происходит синтез небольших пептидов (провоспалительных цитокинов), которые являются активаторами многих типов клеток: от иммунных эффекторных клеток до клеток гладкой мускулатуры сосудов и клеток паренхимы различных органов.
Некоторые цитокины (фактор некроза опухолей — ФНО-α и интерлейкин-1 — ИЛ-1) сами являются стимуляторами выделения других цитокинов. ФНО-α и ИЛ-1 способствуют ограничению распространения инфекции, однако в случае ее генерализации их эффект может становиться негативным.
Уровень другого провоспалительного цитокина (ИЛ-6) коррелирует с исходом генерализованной инфекции. Высокий уровень ИЛ-6 связан с высокой летальностью, однако до настоящего времени не ясно, принимает ли он участие в танатогенезе?
ИЛ-8 является важным регулятором функции нейтрофилов, синтезируется и выделяется в процессе развития сепсиса. Его активацию связывают с поражением легких и дисфункцией других органов.
Некоторые хемокины (хемоаттрактантный белок-1 моноцитов) регулируют процесс миграции лейкоцитов. Менее важную роль в процессе генерализованного воспаления играют другие цитокины (ИЛ-10, ИЛ-12, фактор ингибирования миграции макрофагов, гранулоцит-колониестимулирущий фактор).
Активация системы комплемента ответственна за клиренс возбудителей. В условиях высокой концентрации циркулирующей ЛПС в крови и связывания его компонента — липида А с эндотелием сосудов, на поверхности эндотелия формируется множество мембранатакующих комплексов комплемента (МАК). Это приводит к образованию пор на поверхности эндотелиальных клеток и их повреждению. Одновременное поражение обширных полей эндотелиальных клеток приводит к образованию тромбов на их поверхности и нарушению трансмембранного обмена, что является причиной снижения или прекращения доставки кислорода и нутриентов клеткам органов, кровоснабжаемых этими сосудами. Другой стороной активации системы комплемента является выделение брадикинина, который участвует в индукции выделения оксида азота. Последний играет важнейшую роль в гемодинамических нарушениях, характерных для септического шока, которые вначале имеют гипердинамический характер.
Нейтрофилы при сепсисе являются важнейшей системой, ограничивающей распространение возбудителей инфекции в органах и тканях. Их роль заключается в поиске и разрушении живых возбудителей с помощью механизма фагоцитоза. С другой стороны, переваренные и выброшенные во внешнюю среду фрагменты бактерий являются, по своей сути, дополнительной нагрузкой, т.к. представляют собой липополисахариды, липотейхоевые кислоты и пептидогликан, которые способствуют дальнейшей активации макрофагов и усилению генерализованного воспаления, способствуют повреждению тканей и органной дисфункции.
Кроме того, при сепсисе происходит выделение других биологически активных веществ: липидных медиаторов (эйкозаноидов), фактора активации тромбоцитов, фосфолипазы А2, однако их роль в патогенезе сепсиса остается недостаточно установленной.
Тканевые повреждения в результате активации системы свертывания
Дисбаланс гомеостатических механизмов в результате генерализованного воспаления приводит к диссеминированному внутрисосудистому свертыванию и возникновению тромбов в микрососудах, что является причиной органной дисфункции, полиорганной недостаточности и гибели пациентов. Активаторы воспаления способны приводить к прямому повреждению сосудистого эндотелия и выделению из эндотелиальных клеток тканевого фактора, который запускает коагуляционный каскад и усиливает продукцию тромбина, который превращает растворимый фибриноген в фибрин, который вместе с агрегированными тромбоцитами образуют внутрисосудистые тромбы.
Провоспалительные цитокины (ИЛ-1, ФНО-α) активируют тканевой фактор и запускают процесс коагуляции. Этот феномен при сепсисе подтверждается наличием высокого уровня комлексов тромбин-антитромбин, наличием D-димеров в плазме, что указывает на активацию системы свертывания и фибринолиза. Появление тканевого активатора плазминогена приводит к превращению плазминогена в плазмин, который является мощным фибринолитиком.
Эндотоксин увеличивает активность ингибиторов фибринолиза за счет активатора ингибитора плазминогена-1 и ингибитора фибринолиза активированного тромбином. Уровень протеина С и эндогенно активированного протеина С при сепсисе снижается. Эндогенный активированный протеин С является мощным протеолитическим ингибитором коагуляции. Тромбин посредством тромбомодулина активирует протеин С, который работает в качестве антитромболитика в микрососудах. Эндогенный активированный протеин С повышает фибринолиз, нейтрализуя активатор ингибитора плазминогена-1 и усиливая лизис сгустков. Дисбаланс между воспалением, коагуляцией и фибринолизом приводит к распространенной коагулопатии, тромбозу в микрососудистом ложе и подавлению фибринолиза — основным причинам, приводящим к полиорганной дисфункции и гибели пациентов.
Тканевые повреждения в результате других причин
Очень трудно представить совокупность причин тканевых повреждений у конкретного пациента в определенный момент течения сепсиса. Синдром полиорганной недостаточности связан с распространенным поражением эндотелиальных и паренхиматозных клеток. Нарушение микроциркуляции и обширные тромбозы на поверхности поврежденного эндотелия нарушают доставку кислорода и метаболитов, создавая условия для формирования органной дисфункции. Выделение атомарного кислорода, литических ферментов, вазоактивных веществ (оксид азота) и факторов роста эндотелиальных клеток создают условия для формирования микроциркуляторных повреждений и нарушения нормальной циркуляции эритроцитов.
Эндотоксин, ФНО-α и оксид азота могут обладать прямым цитоксическим эффектом, быть причиной повреждения транспорта электронов в митохондриях и нарушениях энергетического метаболизма. Этот процесс называют цитопатической или гистотоксической аноксией, когда даже при наличии кислорода нарушается его утилизация.
Апоптоз (программированная клеточная смерть) является важным механизмом нормальной элиминации клеток, имеющих функциональные нарушения. Провоспалительные цитокины способны тормозить апоптоз активированных макрофагов и нейтрофилов. Однако в других тканях, таких как эпителий кишечника, процессы апоптоза могут усиливаться. Поэтому нарушения регуляции апоптоза рассматриваются как важный механизм тканевых повреждений у пациентов с сепсисом.
Клинические рекомендации по иммунотерапии сепсиса
Обоснованность клинических рекомендаций.
Метаанализ клинических исследований считается одним из доказательств наиболее высокого уровня целесообразности применения препаратов или методов лечения. Самый последний метаанализ, посвященный эффективности применения иммуноглобулинов для внутривенного введения (ИГВВ), был опубликован в 2007 году [2]. В него были включены 14 рандомизированных клинических исследований (РКИ), опубликованных с 1988 по 2006 год. Большинство из них не являются крупными, в которых применялись низкие дозы ИГВВ, большинство пациентов имели хирургические инфекции, вызванные грамотрицательной флорой. Основным результатом метаанализа было достоверное снижение летальности, связанной с применением IgGAM с отношением рисков 0,66 (95% CI 0,53-0,83; р 2 = 0,009), что подтверждалось уровнем L² (53,8%). При оценке только исследований высокого качества, отношение рисков летальности составило 0,96 (95% confidence interval 0,71-1,3; р = 0,78), т.е. отсутствовало достоверное снижение летальности.
При проведении систематического обзора литературы отмечается достоверное снижение летальности у взрослых пациентов в критическом состоянии с тяжелым сепсисом и септическим шоком, которым применяли поликлональные IgGAM. Это заключение основано на результатах 14 опубликованных и неопубликованных рандомизированных клинических исследований, которые различались по качеству методического проведения.
Достоверная гетерогенность исследований была связана только с одним исследованием высокого качества, кроме того в метаанализе были использованы неопубликованные ранее исследования, которые также оказывали достоверное влияние на результаты в целом. Данные регрессионного анализа показали, что на гетерогенность оказывают влияние такие показатели, как год публикации, качество исследования и общая доза ИГВВ.
При графическом сравнении результатов исследований была выявлена асимметрия показателей, обычно такая асимметрия не бывает связанной с одной причиной [3]. Ее причинами могут быть гетерогенность и небольшое количество пациентов, включенных в исследования. Имеются подтверждения того, что почти всегда исследования, включенные в метаанализ, обладают определенной гетерогенностью [4]. Гетерогенность данного исследования была подтверждена статистически с помощью исследования L² Это свидетельствует о том, что реальное влияние ИГВВ на летальность может быть различным в разных популяциях пациентов с разными источниками инфекции, разными возбудителями или разной степенью иммунных нарушений. Кроме того, свой вклад в гетерогенность могут вносить различия в определении тяжелого сепсиса. Риск летального исхода, связанный с хронической патологией, также может оказывать эффект и модифицировать результаты лечения, однако провести точную оценку таких влияний очень сложно [5].
Другой проблемой исследований является качество методической мощности клинического исследования. Имеются общепринятые правила оценки мощности исследований, однако они не описывают все аспекты проведения рандомизированных клинических исследований, что может оказывать влияние на надежность полученных результатов [6]. Некоторые работы, включенные в метаанализ, хотя и считаются исследованиями высокого качества, однако включали неопубликованные исследования с коротким периодом последующего наблюдения (9 суток), что затрудняет оценку их доказательности [7, 8]. При выделении исследований только высокого качества не было получено достоверного эффекта применения ИГВВ, что в определенном плане противоречит выявленному снижению летальности, связанной с применением ИГВВ в этой группе. Данные метаанализа описывают определенную популяцию пациентов, и в целом его результаты соответствуют описанным в предшествующих обзорах 9.
Публикация рекомендаций по лечению тяжелого сепсиса и септического шока, основанных на принципах доказательной медицины, резко повысила интерес к доказательствам высокого уровня, одним из которых является метаанализ 20. Широко известные рекомендации включают разделы, касающиеся применения кортикостероидов, инсулина, ранней целенаправленной терапии, активированного протеина С на основании результатов однократно проведенных исследований 22. ИГВВ обладают сходным, если не сказать, более высоким эффектом в отношении исхода тяжелого сепсиса и септического шока, десятилетиями доказана безопасность их применения при различных заболеваниях [26]. Сегодня выглядит аномальным, что в широко распространенных международных рекомендациях недостаточно обсуждается применение ИГВВ, поэтому они редко включаются в национальные рекомендации и, следовательно, применяется во многих странах для лечения пациентов с тяжелым сепсисом и септическим шоком [19, 26].
Метаанализ сам по себе не направлен на оценку качества РКИ. Появление информации о сложностях, которые испытали исследователи при проведении методически несложных исследований (SAFE и CRASH), посвященных важным проблемам интенсивной терапии, становится понятным, что и метаанализ может не дать надежных рекомендаций 27. Для окончательного решения об эффективности ИГВВ в лечении сепсиса и септического шока было бы хорошо иметь результаты статистически мощного, хорошо спланированного прозрачного клинического исследования у взрослых.
Таким образом, метаанализ выявил общее снижение летальности при применении ИГВВ в качестве дополнительного метода лечения тяжелого сепсиса и септического шока у взрослых. Однако ввиду определенной гетерогенности включенных в него исследований не получено статистического подтверждения снижения летальности в подгруппе исследований высокого качества. Эффективность ИГВВ существенно повышалась при увеличении дозы препарата (> 1 г/кг) и при сравнении препарата с плацебо.
Заключение
Тяжелый сепсис и, особенно, септический шок до настоящего времени остаются одной из актуальных проблем медицины критических состояний. Принятие согласительной классификации сепсиса в 1991 году и ее быстрое клиническое внедрение оказало существенное влияние на возможности получения актуальных данных по эпидемиологии, этиологической структуре, летальности и экономическим затратам. Описательная классификация способна только в общих чертах создать портрет пациента с сепсисом и не способствует индивидуализации лечения. Дополнительную информацию состояния пациентов могут давать системы балльной оценки (APACHE и SAPS). Однако ни один из этих методов не предполагает оценки иммунологического состояния пациента. Широко бытует мнение о том, что в основе сепсиса лежат иммунологические проблемы, однако степень доказательств таких утверждений не очень высока. Это связано с тем, что иммунная система при сепсисе испытывает те же самые влияния, что и другие системы и органы, и умирает вместе с ними. Поэтому степень обратимости иммунологических нарушений на разных стадиях септического процесса еще предстоит выяснить.
Однако методы получения доказательств далеки от совершенства. Невозможно встать на формальную точку зрения и применять в интенсивной терапии только те препараты и методы, которые имеют высокую доказательную базу, т.к. таковых до настоящего времени крайне недостаточно.
Согласно современным концепциям этиологии инфекционного процесса, при нарушении специфического защитного механизма возникает инфекция, тип которой зависит от природы иммунного дефекта. Если ранее иммунная недостаточность рассматривалась как редкое событие, то сейчас считается, что она встречается довольно часто: в неонатальном периоде, при недостатке белка или витаминов в пище при различного рода интоксикациях, злокачественных опухолях и в процессе их лечения, при различного рода стрессах, нарушениях обмена и др. Существуют и генетические поздно проявляющиеся дефекты.
Реализм сменил эйфорию, продолжавшуюся несколько десятилетий и связанную с успешным применением антибиотиков. Возникли проблемы, связанные с инфекциями микроорганизмами, являющимися частью нормальной микрофлоры, с которыми больной еще несколько дней назад поддерживал мирное сосуществование. При нарушении иммунной защиты происходят быстрый рост и распространение безвредной в норме микрофлоры дыхательных путей, кожи, желудочно-кишечного тракта, мочевыводящих путей.
Сепсис представляет собой тяжелейшую форму генерализованной инфекции, являющуюся следствием несостоятельности защитных реакций. В механизмах его возникновения и патогенезе в определенные периоды на первый план могут выступать различные факторы: снижение фагоцитоза, обусловленное недостаточностью или потреблением антител, появление в крови блокирующих субстанций и вторичный иммунный дефицит, смена или присоединение другого возбудителя, интоксикация и поражение внутренних органов, нарушение в свертывающей системе крови и др.
Нарушение иммунной защиты при сепсисе. В системе противоинфекционной защиты организма существуют три функциональных уровня. Первый — это барьеры на пути инвазии. Они включают кожу, слизистые оболочки, секрет, который нередко оказывает бактерицидное или бактериостатическое действие, механически выводит микроорганизмы или стимулирует рост одних микробов, препятствующих размножению других. В большинстве случаев клиническим проявлениям сепсиса предшествуют механические, физические или трофические нарушения целости кожных покровов или слизистых оболочек. Входными воротами инфекции могут быть локальные очаги воспаления, места инъекций, введения катетера и др. Тщательно собранный анамнез и клиническое обследование в большинстве случаев позволяют выявить места повреждения.
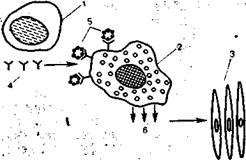
Рис. 9.1.Аллергическая атоническая реакция с участием клеток иммунной системы, гуморальных факторов и клеток-мишеней (схема).
1 — Ig Е — образующая клетка; 2 — лаброцит; 3 — клетки-мишени; 4 — lg Е-антитела; 5 — аллергены; 6 — медиаторы.
Кроме антител, главным опсонином является комплемент, особенно его третий компонент — С3b. Например, антитела к пневмококку типа 7 не инициируют фагоцитоз нейтрофильными гранулоцитами, выделенными из крови человека. Только после того, как С3b фиксируется на стенке бактерий, происходит иммунное прилипание и фагоцитоз становится эффективным. Инкапсулированные стафилококки могут быть опсонизированы как антителами, так и С3b-компонентом комплемента. В ряде случаев опсонизация может быть нарушена и ничто не сдерживает лавинообразного нарастания концентрации патогенного фактора и продуктов его метаболизма. Сказанное можно проиллюстрировать следующими примерами.
1. При изучении плевральной жидкости у больных тяжелым гнойным плевритом определялись продукты расщепления IgG. Протеазы Streptococcus pneumoniae разрушают иммуноглобулины (антитела) у человека. Аналогичным образом могут действовать и протеазы Pseudomonas aeruginosa [Doring G. et al, 1984].
3. Процесс фагоцитоза может быть нарушен в самом начале и привести к непредсказуемым осложнениям. Так, циркулирующие антитела класса IgA, не активирующие систему комплемента и не инициирующие фагоцитоз, могут своим присутствием на бактериальной стенке блокировать начальный период иммунного эффекторного механизма фагоцитоза, что может привести к генерализации инфекции. Такой опосредованный IgA-ингибирующий эффект может представлять большую опасность при менингите. Этим феноменом объясняются слабая опсонизация менингококка и нередкий летальный исход при менингите.
В то же время свободно циркулирующие в крови иммунные комплексы независимо от их природы могут блокировать рецепторы к Fc IgG на поверхности фагоцитов и снижать их бактерицидную активность. Эта ситуация нередко встречается при уже развившейся инфекции. При уточнении анамнеза в таких случаях выясняется, что сепсису предшествовало заболевание, протекавшее с повышением температуры и клиническими проявлениями нарушения функций легких, кишечника или мочеполовых органов.
Диагностика иммунной недостаточности. Современная лаборатория клинической иммунологии имеет довольно широкий набор диагностических тестов. Существуют тесты общего порядка: Т- и В-лимфоциты, бласттрансформация, уровень иммуноглобулинов в сыворотке крови. При необходимости выполняются дополнительные исследования [Зимин Ю. И. и др., 1982].
У детей, родившихся преждевременно (срок беременности: 30—37 нед), обнаруживается выраженная гипогаммаглобулинемия. Она является следствием незрелости плаценты и ее неспособности транспортировать IgG, а также отсутствия синтеза антител у плода. У детей, рожденных в срок, сохраняется довольно высокий уровень IgG в сыворотке. Однако данный белок имеет материнское происхождение и концентрация его понижается в течение первых недель жизни. Частота тяжелых генерализованных инфекций у новорожденных составляет от 0,2 до 1,5%. Следует помнить, что в 35% случаев смерть в течение первого года жизни является следствием сепсиса или септической пневмонии. Иммунологическая незрелость плода является важнейшим фактором возникновения перинатальных инфекций. Даже в настоящее время, несмотря на антибиотики, летальность новорожденных при сепсисе очень высока.
По мере инволюции органов иммунной системы у лиц пожилого или старческого возраста первичный иммунный ответ может существенно не изменяться. Однако снижение разнообразия иммуноглобулинов (антитела) прогрессирует. Их концентрация в сыворотке может оставаться нормальной, а за счет избыточной моноклональной пролиферации даже увеличиваться.
Врожденная недостаточность антител проявляется как аномальная подверженность инфекциям, особенно рецидивирующим инфекциям респираторного или желудочно-кишечного тракта. Нередко начало септицемии связано с локальным воспалительным процессом. Врожденные нарушения проявляются клинически в раннем детском возрасте или позже, особенно в 20—30 лет. Диагностика этой формы недостаточности антител основывается обычно на определении иммуноглобулинов сыворотки крови. Происходит снижение уровня всех иммуноглобулинов или отдельных классов, или субклассов. Селективный врожденный дефект, проявляющийся отсутствием или снижением синтеза одного из субклассов IgG или отсутствием антител определенной специфичности, возможен и при нормальном уровне иммуноглобулинов.
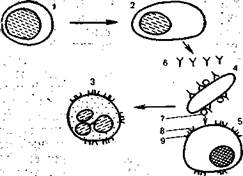
Рис. 9.2. Клеточный и гуморальный иммунные ответы (схема).
1 — В-лимфоцит; 2 — плазматическая клетка: 3— нейтрофильный гранулодит; 4 — бактерия; 5 — звездчатый ретику-лоэндотелиоцит; 6 — иммуноглобулины (антитела); 7 — С3b-компонент комплемента; 8 —рецептор к С3b; 9 —рецептор к Fc иммуноглобулина.
Приобретенный (симптоматический) синдром недостаточности антител встречается довольно часто при многих заболеваниях. Не всегда можно установить, является недостаточность антител вторичной для данного заболевания или она была причиной и вызвала его. Нарушения этого типа наиболее характерны при опухолях лимфоретикулярных тканей, особенно имеющих В-клеточную природу: хроническом лимфолейкозе, лимфомах, доброкачественной и злокачественной парапротеинемии и др. Происходит уменьшение числа или полное исчезновение нормальных поликлональных, секретирующих иммуноглобулины плазматических клеток в костном мозге и лимфоидной ткани. Нормальные клетки замещаются злокачественными, внешне имеющими интактную структуру. В некоторых случаях ткани, участвующие в формировании иммуноглобулинов, могут быть разрушены лимфотропным вирусом (в частности, при инфекционном мононуклеозе).
В большинстве случаев при сепсисе изменяются многие иммунологические показатели. Характеризуя состояние иммунной системы при сепсисе в целом, можно говорить о глубоком иммунном дефиците, который, несомненно, является причинным и осложняющим фактором в течении заболевания. Сепсис, начавшись на фоне иммунной недостаточности, усугубляет ее, нередко до фатального состояния. Этим можно объяснить присоединение другой инфекции, смену возбудителя, появление аллергических процессов, нарушение регенерации.
На рис. 9.3 в виде радиусов в системе полярных координат отложены иммунологические показатели, конкретных людей в процентах к норме (группа из 25 здоровых людей), представленной в виде окружности. Результаты отдельных тестов, характеризующих функционирование иммунной системы, представлены в виде векторов: лимфоциты в 1 мм 3 крови (Лф), Т-лимфоциты в абсолютных значениях на 1 мм 3 крови и в процентах (Т, Т%), вспомогательные клетки (Т4 и Т4%), супрессорные Т-клетки (Т8 и Т8%), реакция бласттрансформации in vitro под влиянием КонА (Is), IgM, IgA, IgG, IgE —иммуноглобулины в сыворотке крови, В-лимфоциты (В), фагоцитоз (Фг), соотношение к- и А,-цепей иммуноглобулинов в сыворотке. Иммунологические показатели интактного донора (см. рис. 9.3) отличаются не более чем на 10% от средних значений нормы. Площадь многоугольника, в определенной степени характеризующая иммунный статус человека, приближается к площади круга (норма).
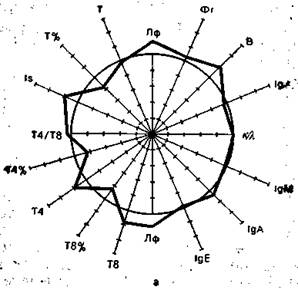
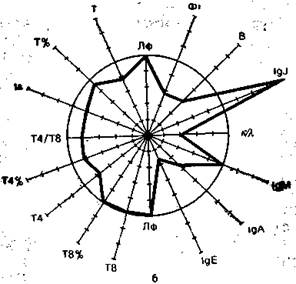
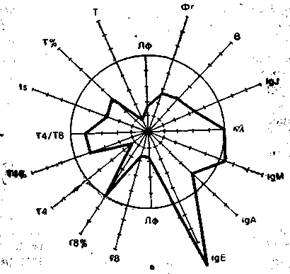
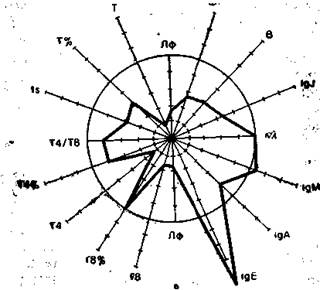
Рис. 9.3. Иммунный статус интактного донора (а), больного в предсептиче-ском состоянии (б) и при сепсисе (в). Объяснение в тексте.
Принципы профилактики и терапии септических состояний. Адекватная терапия заболеваний, вызывающих недостаточность иммунитета, компенсация сопутствующих нарушений микроциркуляции, водно-солевого баланса, потери белка, а также хирургическая санация абсцесса, флегмоны или эмпиемы, детоксицирующая терапия и др. являются важными моментами эффективной профилактики и терапии сепсиса.
К основным принципам терапии и профилактики сепсиса необходимо отнести: уход, применение антибиотиков, выведение ингибирующих факторов (плазмаферез, гемосорбция, гемодиализ, селективная плазмафильтрация), заместительную терапию (препараты иммуноглобулинов для внутривенного введения, тимопептиды, свежезамороженная плазма, гипериммунная сыворотка, лейкоцитная масса), стимуляцию эффекторного звена клеточного иммунитета.
Независимо от природы иммунной недостаточности (гипопротеинемия, облучение, интоксикация, кровопотеря и др.) у больных выявляется повышенная чувствительность к инфекции. В соответствии с этим и строится режим. В особо тяжелых случаях (агаммаглобулинемия, агранулоцитоз) больного помещают в палату, где обеспечивается стерильное содержание.
Антибиотики были и остаются эффективным средством лечения инфекционных осложнений при иммунной недостаточности. Следует указать на два важных аспекта. Во-первых, антибиотики эффективны только при сохранившихся иммунных реакциях. Многолетний опыт лечения больных с врожденным иммунодефицитом свидетельствует, что без иммунного ответа не удается достигнуть положительных результатов. Во-вторых, при нарушении фагоцитоза рекомендуется использовать антибиотики, избирательно накапливающиеся в макрофагах (например, рифампицин). Некоторые микроорганизмы способны выживать в фагоцитах и даже размножаться в них, следствием чего нередко бывает хроническая инфекция. Антибиотики, накапливающиеся в фагоцитах, усиливают функцию инактивирования бактерий.
Успех лечения антибиотиками зависит от ряда факторов: 1) идентификации возбудителя, что является крайне сложной задачей, если лечение сепсиса уже начато; 2) чувствительности микроорганизма к антибиотику; 3) транспорта антибиотика к месту инфекции в достаточной терапевтической концентрации.
Опыт показывает, что необходимы дополнительные знания, касающиеся взаимоотношений между организмом, антибиотиком и микробом. Антибиотики сами по себе недостаточно эффективны при лечении септических состояний. В лучшем случае они помогают выиграть время для проявления защитных реакций и для иммунологической ликвидации инфекции. В тех нередких случаях, когда защитные системы организма не работают, ан-тибиотикотерапия безуспешна.
При многих септических состояниях в сыворотке крови появляются блокирующие факторы макромолекулярной природы, препятствующие нормальному течению иммунных реакций. Это могут быть иммунные комплексы, продукты жизнедеятельности микроорганизмов, эндо- и экзотоксины, разного рода протеазы, продукты распада тканей. Применение плазмафереза, гемосорбции или гемодиализа может способствовать восстановлению иммунного реагирования (рис. 9.3). На фоне детоксикационной терапии, достигаемой экстракорпоральными методами, повышается эффективность всех последующих вмешательств.
Классическим показанием к заместительной терапии препаратами иммуноглобулинов для внутривенного введения является гуморальная иммунная недостаточность. Этот вид лечения рекомендуется при тяжелых бактериальных или вирусных инфекциях у больных со сниженным или нормальным уровнем иммуноглобулинов в сыворотке. При назначении препаратов этой группы исходят из того, что в основе тяжелых инфекций лежит либо первичная, либо вторичная недостаточность (потребление) антител. Поливалентные препараты иммуноглобулинов (иммуноглобулин внутривенный, гипериммунная сыворотка) содержат по крайней мере 10 млн различных типов антител.
Стимуляция эффекторного механизма клеточного иммунитета позволяет усилить, иммунный ответ при профилактике бактериальных и вирусных инфекций. Результат зависит от дозы и времени применения, а также от возраста больного и генетических факторов. Препараты иммуноглобулинов эффективны при хронических рецидивирующих инфекциях и при вспомогательной терапии у больных различными видами опухолей. Их используют с целью компенсации иммунодепрессии, вызванной облучением, химио- или стероидной терапией, а также при различного рода стрессах. К стимуляторам эффекторного механизма иммунных реакций относят левамизол, диуцифон, цимети-дин, интерферон и его индукторы.
Таким образом, достижения клинической иммунологии и иммунофармакологии и накопленный в последние годы опыт коррекции иммунодефицитных состояний позволяют сделать вывод, что современная клиническая медицина располагает средствами диагностики, профилактики и лечения иммунной недостаточности, предшествующей сепсису или усугубляющейся на фоне era течения.
Читайте также:


