Ифа тест-системы для дифтерия
Для решения задачи эпиднадзора за дифтерийной инфекцией необходим качественно новый подход к лабораторной диагностике дифтерии - сокращение сроков исследования, применение более надежных и специфических методов исследования.
Совершенно очевидно, что для сокращения сроков диагностики дифтерийной инфекции необходимо подходить не с позиции выявления коринебактерий дифтерии (токсигенных и нетоксигенных), а с позиций индикации патогенного агента возбудителя дифтерии - дифтерийного токсина.
При определении дифтерийного токсина методом ИФА применяется твердофазнй вариант. Далее приводится описание метода с использованием моноклональных антитоксических противодифтерийных антител (МкАт), полученных к COOH-концевому участку В-фрагмента дифтерийного токсина, ответственного за биологическое связывание с клетками макроорганизма, и иммобилизированных на полистироле. Используются также поликлональные антитоксические противодифтерийные антитела (ПкАт), меченые ферментом пероксидазой хрена. Сорбированные на поверхности полистироловых планшетов МкАт связывают находящиеся в исследуемых пробах молекулы дифтерийного токсина (анатоксина) и не связывают никаких других продуктов микробного или иного происхождения, обеспечивая тем самым исключительно высокую специфичность метода. Свободные антигенные детерминанты молекулы токсина взаимодействуют с ПкАт, конъюгированными с пероксидазой хрена. При наличии в анализируемых пробах токсина образовавшийся комплекс моноклональные антитела - дифтерийный токсин - поликлональный конъюгат с пероксидазой проявляются индикаторной субстратной смесью перекиси водорода с 5-аминосалициловой кислотой (рисунок 2).
Схема проведения иммуноферментного анализа (ИФА) для выявления





























Ат Аг Ат Аг Ат Е




































Ат Аг Ат Ат Е Е
 |
 |


















ИЗМЕРЕНИЕ





ПРОДУКТА СУБСТРАТ Е Ат Аг Ат





РЕАКЦИИ



отмывка Ат
Условные обозначения:АТ - иммобилизированные антитоксические противодифтерийные антитела; АГ - определяемый антиген (дифтерийный токсин); АтЕ - конъюгат (антитоксические антитела - фермент)
РНГА - двухкомпонентная реакция, предполагает использование диагностикума эритроцитарного дифтерийного антительного, действующим началом которого являются связанные с эритроцитами очищенные специфической сорбцией поликлональные антитоксические противодифтерийные антитела, вступающие во взаимодействие лишь с дифтерийным токсином - анатоксином. Учитывая возможность появления неспецифической агглютинации в первых лунках планшетов за счет высокой концентрации белка, при постановке РНГА все исследуемые пробы анализируются в серийных разведениях. При наличии в исследуемой пробе токсина, образуется специфический комплекс дифтерийный токсин - сенсибилизированные эритроциты - антитоксические антитела, формирующий осадок в виде агглютината эритроцитов. Чувствительность практически не уступает ИФА.
Сравнительное испытание методов - реакции преципитации в агаре (метод традиционной бактериологии), РНАт, ИФА, РНГА показало преимущество ИФА и РНГА по чувствительности, специфичности, времени проведения анализа. ИФА и РНГА позволяют выдать ответ о наличии токсина или его отсутствии в исследуемом материале на 1-3 суток раньше традиционных методов. Чувствительность ИФА и РНГА зависит от условий культивирования исследуемого материала. Использование жидкой питательной среды позволяет выявить токсин у слаботоксигенных штаммов, продукцию которого уловить на плотной питательной среде, при постановке менее чувствительной реакции иммуно-преципитации в агаре, не всегда представляется возможным.
ИФА и РНГА могут быть применены для ускоренного выявления токсина в материале от больных дифтерией, носителей токсигенных коринебактерий дифтерии; от лиц, обследуемых с профилактической целью или по эпидемическим показаниям; а также - в культурах, выделенных на разных этапах бактериологического исследования. Кроме того, они позволяют изучить уровень токсинообразования штаммов коринебактерий дифтерии. Эти методы могут быть реализованы в бактериологических , диагностических лабораториях СЭО.
Для проведения исследований необходимы:
n пипеточные дозаторы или автоматические пипетки на 100 мкл или 200 мкл (импортные или отечественного производства);
n термостат 37 0 С ;
n мерная посуда (химически чистая);
n фильтровальная бумага;
n дистиллированная вода;
n 0,85% раствор хлорида натрия, pH 7,2;
n 4% раствор гидроксида натрия (NaOH);
n 3% раствор перекиси водорода (H2O2);
n в случае необходимости инструментального учета - вертикальный фотометр для оценки иммуноферментных реакций в 96-луночных планшетах с фильтром 450 нм.
1) моноклональные антитела для адсорбции на планшетах;
2) конъюгат антитоксический поликлональный - меченные пероксидазой хрена ПкАт;
3) положительный контроль - анатоксин дифтерийный, 300 Lf/мл;
4) отрицательный контроль - среда культивирования контрольного нетоксигенного штамма коринебактерии дифтерии;
5) 5-АС - 5-аминосалициловая кислота (индикатор);
6) твин-20 - детергент для приготовления промывающего раствора;
7) планшеты полистироловые (обязательно плоскодонные в случае инструментального учета результата) для иммуноферментных реакций одноразового пользования.
Некоторые считают дифтерию проблемой из прошлого, болезнью-рудиментом, с которой повсеместно удалось успешно справиться. Но расслабляться еще рано. До сих пор регистрируются случаи этого заболевания, среди детей и взрослых циркулируют бактерии дифтерии. Поэтому о том, когда и какие анализы нужно сдавать на дифтерию, должен знать каждый.
Характеристика заболевания и особенности диагностики дифтерии
Дифтерия — это инфекционная болезнь, которой можно заразиться только от человека. Однако опасным может быть не только заболевший, но и носитель токсигенного (то есть производящего токсины) штамма. Такое носительство протекает без каких-либо признаков, и его можно обнаружить только с помощью лабораторного обследования.
Бактерии дифтерии — бациллы Леффлера — могут передаваться по воздуху с мельчайшими частичками влаги или пыли. Также бактерии могут передаваться при контакте с зараженными предметами обихода и изредка через зараженную еду.
При контакте с заболевшим или с носителем токсичного штамма вероятность заболеть примерно 15–20% [1] . Первые симптомы появляются через 2–10 дней. Повышается температура до 38–39°С, появляется боль в горле, становится сложно глотать. Признаки дифтерии сходны с ангиной, но при этом возникают и специфические симптомы.
Главная отличительная особенность — это тип поражения миндалин. На них образуется налет в виде плотных пленок. Свежие пленки снимаются достаточно легко, но они быстро утолщаются и становятся плотными. Если такую пленку с силой снять с миндалины, то под ней чаще всего образуется кровоточащая эрозия.
Такая типичная клиническая картина с высокой температурой, выраженной интоксикацией, ознобами, головной болью и бледностью кожи развивается у непривитых и имеющих слабый противодифтерийный иммунитет людей. При более высоком уровне иммунитета вместо пленок может образовываться рыхлый налет, а само заболевание протекает менее остро. Поэтому атипичные формы дифтерии легко можно спутать с обычной ангиной [2] .
Однако дифтерия страшна не только сама по себе, но и своими осложнениями.
Среди них выделяют:
- инфекционно-токсический шок;
- миокардит — поражение сердечной мышцы;
- полинейропатию — поражение периферических нервов;
- нефрозы — дистрофические процессы в почках;
- ДВС-синдром — нарушение свертываемости крови;
- круп — осложненное стенозом гортани воспаление дыхательных путей [3] .
Еще в середине XX века дифтерия была распространенной проблемой, вызывавшей осложнения, связанные с риском для жизни, у каждого пятого взрослого пациента и у каждого десятого заболевшего ребенка [4] .
В 1955 году в СССР было официально зарегистрировано около 321 000 случаев дифтерии [5] . В 2015 году, 60 лет спустя, на всей территории России было зарегистрировано только 2 заболевших [6] . То есть заболеваемость снизилась практически в 160 000 раз.
Так как в России регистрируются только единичные случаи дифтерии, далеко не все молодые врачи за свою практику сталкивались с этим заболеванием. Тем более что она может протекать в стертой или бессимптомной форме, маскируясь под ангину и менее опасные заболевания. Поэтому своевременная лабораторная диагностика играет значительную роль в выявлении этого заболевания.
Кроме обследования пациентов с подозрением на дифтерию проводится регулярный серомониторинг — определение уровня иммунитета среди группы населения. Например, среди детей 3–4 лет, 16–17 лет и взрослых. Это помогает оценить коллективный иммунитет, вероятность возникновения вспышек и распространения заболевания [7] .
Для диагностики дифтерии используются несколько методов — бактериологический, серологический и ПЦР-анализ, а также клинический анализ крови.
Основным методом, который позволяет установить диагноз, является микробиологическая диагностика дифтерии. Ее проводят при ангине с характерным выпотом на миндалинах, при подозрении на инфекционный мононуклеоз, паратонзиллярный абсцесс или ларинготрахеит. Это позволяет на самом раннем этапе исключить дифтерию.
С профилактической целью бактериологическое исследование проводят для поступающих на лечение или на работу в психоневрологические стационары, противотуберкулезные учреждения, дома ребенка. Такое обследование проводится, чтобы предотвратить вспышки инфекции в закрытом учреждении [9] .
Для проведения бактериологического исследования с пораженной поверхности забирают мазок и помещают его в транспортную питательную среду. Примерно через 5–7 дней из лаборатории приходит ответ, есть ли в биоматериале рост дифтерийной палочки и обнаружены ли у нее токсигенные свойства. В норме роста быть не должно. Если в результатах исследования указан нетоксигенный штамм, это тоже в большинстве случаев не страшно. Достаточно провести профилактику по назначенной врачом схеме. А вот если выявлен токсигенный штамм, придется пройти полный курс лечения и обследовать всех контактировавших с пациентом лиц.
Как дополнение к бактериологическому методу могут использовать ПЦР-диагностику . Показания к ее проведению те же, что и для бактериологического метода. Но для установления диагноза она уже не является обязательной. Материал для ПЦР-исследования забирают из очага поражения и помещают в специальную среду. В лаборатории выделяют гены дифтерийной бактерии, в том числе отвечающие за ее токсичность. Интерпретируют результат так же, как и при бактериологическом методе: в лучшем случае следы присутствия бактерии не должны обнаружить. Если же выявлен токсигенный штамм, придется срочно проходить лечение.
Еще один вспомогательный метод — клинический анализ крови. С его помощью нельзя отличить, например, дифтерию от ангины, но можно сказать, что воспаление вызвано бактериальной инфекцией. Для проведения этого анализа также берут кровь из вены. Этот анализ занимает всего 1–2 рабочих дня. При бактериальной инфекции повышается уровень СОЭ, количество лейкоцитов и нейтрофилов.
Анализы на дифтерию можно сдать как в государственных клиниках, так и в частных лабораториях. Анализ крови можно сдать в любой лаборатории и, чаще всего, для этого даже не нужно будет направление врача. А вот специфические анализы на дифтерию проводят уже не все, поэтому лучше заранее уточнить этот момент.
Забор материала лучше сдавать в клинике с собственной лабораторией, особенно это касается бактериологического и ПЦР-исследования. Результаты этих анализов во многом зависят от того, насколько точно соблюдали правила забора мазков, хранения и транспортировки материала. При нарушении на любом из этих этапов можно получить ложный отрицательный результат.
В государственном учреждении по направлению все эти исследования можно пройти бесплатно. В частной лаборатории придется заплатить как за само исследование, так и за взятие биоматериала. Но и уровень сервиса при этом обычно выше. Например, некоторые лаборатории высылают результаты исследований на электронный адрес или публикуют их в личном электронном кабинете пациента, так что возвращаться за бланками уже не нужно. Их можно распечатать самостоятельно в любой момент.
1.1. В методических рекомендациях (далее - МР) представлена рациональная и эффективная тактика использования серологических методов диагностики и мониторинга иммунитета к дифтерийной инфекции.
1.2. В настоящих МР описаны используемые в последние годы международные и отечественные методы определения противодифтерийных антител, а также предложен наиболее надежный и перспективный метод иммуноферментного анализа (далее - ИФА) для определения суммарных и высокоавидных антител, его стандартное применение, в том числе предложены надежные критерии оценки защитных уровней, необходимые для выявления среди детей и взрослых групп повышенного риска и оценки напряженности индивидуального и коллективного иммунитета к дифтерийной инфекции.
1.3. Настоящие МР предназначены для врачей-эпидемиологов и микробиологов и носят рекомендательный характер.
2.1. Несмотря на высокие показатели привитости населения от дифтерии в разных регионах России периодически регистрируются случаи заболевания дифтерией или носительства Corynebacterium diphtheria, особенно среди лиц в закрытых коллективах [3, 4, 8].
2.2. В настоящее время, спустя 15 лет после прошедшей эпидемии дифтерии, повсеместно отмечается снижение внимания клиницистов к этой инфекции. Профилактические и диагностические обследования проводятся, но не в полном объеме [12].
2.3. Как известно, защищенность от дифтерии в нашей стране определяется с помощью реакции прямой гемагглютинации (РПГА) [13]. Однако результат реакции, выражаемый в титрах, не позволяет точно определить количество антитоксических антител (АТ-АТ), а, значит, и оценить состояние иммунитета против дифтерии. Разработка и повсеместное внедрение в практику оценочной шкалы защищенности от дифтерии на основании определения количества АТ-АТ позволили контролировать качество вакцинации 1 [14]. Однако информация о количестве вырабатываемых противодифтерийных антител не всегда дает достоверный ответ на вопрос о степени защищенности от дифтерии. Это было продемонстрировано во время последней эпидемии дифтерии в России и после нее, когда у заболевших (до 40 % случаев) находили в крови АТ-АТ зашитых уровней [9, 10]. Проведенными исследованиями установлена определяющая роль высокоавидных АТ-АТ в защите от дифтерии, которые могут быть определены наряду с количеством суммарных АТ-АТ в иммуноферментном анализе [2, 5, 6, 16]. При этом была показана динамика формирования и утраты АТ-АТ, равно как и показателя их авидности, изучены особенности специфического иммунитета к дифтерии среди различных групп населения [1, 7, 11, 15]. Тем не менее, отсутствие программ и схем исследования при диагностике дифтерии и изучении напряженности иммунитета у населения, содержащих новые аргументированные данные, не позволяют полноценно и качественно проводить бактериологический и иммунологический контроль в отношении защищенности к дифтерии на местах.
0,01 МЕ/мл - минимальная степень защиты,
0,01 - 0,09 МЕ/мл - некоторая степень защиты,
0,1 - 0,9 МЕ/мл - защитный уровень антител,
1,0 и > МЕ/мл - стойкая длительная невосприимчивость к дифтерии.
3.2. Список оборудования и материалов, необходимых для проведения исследования, представлен в прилож. 1.
4.1. Серологический контроль состояния иммунитета
у детей и подростков
4.1.1. Серологический контроль иммунитета в различных группах позволяет представить иммунологическую структуру населения и выявить группы повышенного риска, определить состояние вакцинального иммунитета как в ранние, так и в отдаленные сроки после вакцинации.
4.1.2. Серологический контроль состояния и длительности сохранения вакцинального иммунитета необходимо осуществлять систематически методом выборочного серологического обследования (мониторинга) различных групп населения в городах и сельских районах каждой области, края.
4.1.3. Обследованию подлежат привитые против дифтерии дети и подростки от 3 до 18 лет каждой возрастной группы (3 года, 4 года, 5 лет и т.д., особое внимание следует обратить на детей 9 - 13 лет).
4.1.4. Серологический контроль следует проводить, начиная с групп детей 3 лет не ранее, чем через 6 месяцев после последней прививки. К этому возрасту должен быть закончен первичный вакцинальный комплекс против дифтерии, включающий вакцинацию и первичную ревакцинацию (V и RV).
4.1.5. В случае отсутствия материально-технических возможностей обследования каждой возрастной группы детей и подростков можно отобрать возрастные группы, подлежащие очередной ревакцинации (4 - 5 лет, 9 - 10 лет, 14 - 15 лет).
4.1.6. При получении неудовлетворительных иммунологических показателей в этих группах контроль за иммунитетом следует провести в каждой возрастной группе.
4.2. Серологический контроль состояния иммунитета у взрослых
4.2.2. Особое внимание должно уделяться лицам в закрытых коллективах.
5.1. Реакция пассивной гемагглютинации (РПГА)
Для постановки реакции используется диагностикум дифтерийный эритроцитарный антигенный. Поскольку срок годности эритроцитарных диагностикумов составляет 1 год, необходимо перед каждым проведением серологического исследования сывороток проверять активность препарата. Проверка проводится с контрольным антитоксином, приложенным к комплекту, либо используется национальный препарат дифтерийного антитоксина, очищенного ферментолизом и специфической сорбцией, диагностический сухой. Допускается исследование контрольной сыворотки (лабораторный образец) с известным титром дифтерийных антител. Если диагностикум выявляет в сыворотке антитела в концентрации на 2 - 3 разведения ниже, чем они в ней содержатся, то такой препарат не пригоден для дальнейшего исследования.
РПГА ставят в два этапа согласно инструкции, прилагаемой к препарату: 1-й - подготовка к реакции; 2-й - основной опыт. Ответ может быть получен на 2-е сутки с момента получения исследуемого материала лабораторией.
Однако ряд зарубежных исследователей отмечает возможность получения ложноположительных данных и несовпадение результатов, полученных в реакции нейтрализации in vivo и методах in vitro. По данным ряда авторов коэффициент корреляции между результатами, полученными в РПГА и PH, составляет всего 0,6.
5.2. Реакция нейтрализации (PH) в культуре клеток Vero
Поэтому в качестве второго стандарта была принята реакция нейтрализации (PH) в культуре клеток Vero, поскольку она лишена недостатков биологического теста, более стандартна и наглядна. Коэффициент корреляции результатов, полученных в PH в культуре клеток Vero, с результатами, полученными в классическом методе (на лабораторных животных), составляет 0,98. Этот метод гораздо экономичнее, быстрее и проще в постановке. Однако достоверность результатов PH во многом определяется стандартностью культуры клеток и всех контролей (токсинов и антитоксинов).
В реакции используется цветная проба, основанная на способности токсина изменять метаболическую активность зараженных клеток, что определяют по цвету индикатора, содержащегося в питательной среде. В не пораженных токсином культурах клеток под влиянием выделяющихся продуктов клеточного метаболизма pH питательной среды сдвигается в кислую сторону, вызывая изменение цвета индикатора. В пораженных токсином культурах в результате дегенерации клеток их метаболическая активность подавляется, и цвет фенолового красного не изменяется или изменяется частично.
В реакции используется токсин 0,0002 Lf/мл и антитоксин 0,032 МЕ/мл (National Collection of Type Cultures Diphtheriae Reference Laboratory, Central Health Laboratory (CPHL), London, UK). При постановке реакций применяют культуру клеток Vero, получаемую из лаборатории детских вирусных инфекций НИИЭМ им. Пастера, в концентрации 2,5 ⋅ 10 5 клеток/мл. Содержание антитоксических антител определяют от 0,000125 МЕ/мл и выше,
5.3. Иммуноферментный анализ (ИФА)
Тест-система для ИФА представляет собой набор, предназначенный для определения суммарных антитоксических антител, и включает следующие реагенты: иммуносорбент 1-96-луночный полистироловый или хлорвиниловый планшет для иммунологических реакций, в лунках которого сорбирован анатоксин дифтерийный очищенный; конъюгат - иммуноглобулины (F(аb')2-фрагменты) диагностические против IgG человека, аффинноочищенные, меченные пероксидазой; контрольный положительный образец (К+) - сыворотка или плазма крови человека с известным титром дифтерийных антител; контрольный отрицательный образец (К-) - сыворотка или плазма крови человека, не содержащая дифтерийных антител; концентрат фосфатно-солевого буферного раствора с твином (ФСБ-Т×25); блокатор - белково-солевой раствор (Б); цитратно-фосфатный буферный раствор с перекисью водорода (ЦФБР); хромоген - тетраметилбензидин (ТМБ); стоп-реагент (СР) - 5 %-ый раствор серной кислоты. Специальная компьютерная программа, прилагаемая к набору, дает возможность производить перерасчет показателей оптической плотности в показатели антитоксических международных единиц.
Для определения индекса авидности противодифтерийных антитоксических антител в сыворотке (плазме) крови человека разработано дополнение к набору, которое включает в себя следующие ингредиенты: контрольный положительный образец высокоавидных антител (КА+) - сыворотка крови человека с известным индексом авидности противодифтерийных антитоксических антител (индекс авидности сыворотки указан на этикетке флакона); контрольный отрицательный образец низ-коавидных антител (КА-) - сыворотка крови человека, содержащая противодифтерийные антитоксические антитела низкой авидности; фосфатно-солевой буфер, содержащий 3М калия роданистого для определения авидности противодифтерийных антитоксических антител (ФСБ-3МКрод). Набор рассчитан на исследование 29 образцов сыворотки (плазмы) крови для определения индекса авидности противодифтерийных антитоксических антител.
Тест-система укомплектована национальным стандартом антитоксина, измеряемым в МЕ/мл. Расчет концентрации АТ проводится с учетом коэффициента по калибровочной кривой, что делает результаты более достоверными. Сравнительный анализ нейтрализующего эффекта испытуемых сывороток людей в клеточной культуре Vero и других линиях показал хорошую корреляцию (r = 0,91) с результатами, полученными в модифицированных вариантах ИФА, что подтверждает адекватность применения ИФА для измерения уровня антитоксического иммунитета к дифтерии у здоровых людей.
5.3.1. Определение уровня противодифтерийных АТ
с помощью тест-системы ИФА
1. Приготовить разведения исследуемых сывороток 1:20, 1:200, 1:2000 на буферном растворе № 1 (содержимое флакона концентрата ФСБ-Т×25 развести в 600 мл дистиллированной вода, содержимое флакона с блокатором растворить в 5,0 мл дистиллированной воды, полученный раствор добавить в емкость с раствором ФСБ-Т и тщательно перемешать) в макропланшете непосредственно перед использованием.
2. Приготовить непосредственно перед использованием рабочие разведения: отрицательной сыворотки - 1:20, добавляя в содержимое флакона (0,2 мл) 3,8 мл буферного раствора; положительной сыворотки - 1:200 (отмерить 0,01 мл растворенного К+ и добавить 2,0 мл раствора № 1), из которого затем приготовить отдельно каждое разведение - 1:2, 1:4, 1:8 и 1:16 (в итоге получить пять разведений К+ - 1:200, 1:400, 1:800, 1:1 600 и 1:3200).
3. Полистироловые планшеты с иммунобилгоированным антитоксином трижды отмыть буферным раствором (в объеме 0,3 мл в каждую лунку), удалить буферный раствор, постукивая по сложенной в несколько слоев фильтровальной бумаге, помещенной на поддон.
7. Удалить жидкость из лунок, планшеты промыть, как указано в пункте 5.
8. Внести в каждую лунку планшета по 0,2 мл раствора ТМБ (готовят непосредственно перед внесением в лунки планшетов). Для этого содержимое флакона с ТМБ перенести во флакон с ЦФБР и тщательно перемешать. Раствор готовить в защищенном от прямых солнечных лучей месте. Планшет выдержать при температуре (20 ± 2) °С в течение 20 мин в защищенном от света месте.
9. Реакцию остановить добавлением в каждую лунку по 0,1 мл стоп-реагента (СР).
5.3.2. Определение индекса авидности противодифтерийных
антитоксических антител
1. Внести контрольные и исследуемые образцы. После внесения контролем К+, К- и раствора № 1 добавить КА+, КА- и все испытуемые сыворотки в двух повторностях (одну повторность КА+, КА- и рабочие сыворотки промыть раствором № 1, а вторую - 3М раствором калия роданистого). Планшет герметично закрыть и выдержать (60 ± 5) мин при температуре (37 ± 1) °С. следуя инструкции к набору дата ИФА. Затем содержимое лунок собрать в сосуд с дезинфицирующим раствором (5 - 6 % раствор монохлорамина).
2. Первая промывка планшета.
Контроли К+, К- и первую повторность КА+, КА- и рабочих сывороток промыть 5 раз раствором № 1, вторую повторность КА+, КА- и рабочих сывороток промыть 4 раза 3МКрод, а 5-й раз - раствором № 1.
3. Далее все этапы реакции выполнить согласно основной инструкции к набору.
Регистрация и оценка результатов
Результаты ИФА регистрируют на спектрофотометре при двух длинах волн 450/620 нм.
Индекс авидности (ИА) рассчитывают по формуле:
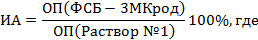
ОП(ФСБ - 3МКрод) - оптическая плотность в лунках, обработанных раствором детергента (ФСБ-3МКрод), ОП(Раствор № 1) - оптическая плотность в лунке, обработанной обычным промывочным раствором, используемым в тест-системе (раствор № 1).
КА+ должен содержать высокоавидные противодифтерийные антитоксические антитела с индексом авидности не менее 90 %. КА- должен содержать низкоавидные противодифтерийные антитоксические антитела с индексом авидности не более 10 %.
Индекс авидности рабочих сывороток более 30 % соответствует вероятности защиты от заболевания дифтерией на 95 %, а индекс авидности 10 % является показателем критического уровня, ниже которого вероятность заболевания возрастает до 99 %.
1. Показатель ОП рабочей сыворотки в лунке, обработанной ФСБ-3МКрод, равен 0,24, а в лунке, обработанной раствором № 1, равен 0,37. Индекс авидности, рассчитанный по приведенной формуле, равен 65 %, что соответствует высокой степени защиты от дифтерии (более 30 %).
2. Показатель ОП рабочей сыворотки в лунке, обработанной ФСБ-3МКрод, равен 0,05, а в лунке, обработанной раствором № 1, равен 0,62. Индекс авидности, рассчитанный по приведенной формуле, равен 8 %, что соответствует низкой степени защиты от дифтерии (менее 10 %).
6.1. Оценка индивидуальной защищенности
от дифтерийной инфекции
Этап 1. Отобрать кровь у обследуемого в пробирку с активатором свертывания. Внести в систему баз данных информацию об обследуемом по форме (табл. 1).
Профессия или учебное заведение
Наличие хронического или острого заболевания
Есть или нет подозрение на дифтерию
Этап 2. Определить с помощью ИФА тест-системы и 3М роданистого калия количество противодифтерийных антитоксических антител, выраженное в МЕ/мл, и индекс авидности антител, выраженный в %. Количество антител рассчитать по данным оптической плотности в лунках планшета с помощью компьютерной программы, входящей в качестве приложения к тест-системе. Индекс авидности (ИА) антител рассчитать по формуле;
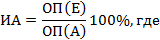
ОП(Е) - оптическая плотность в лунке, обработанной детергентом, ОП(А) - оптическая плотность в лунке, обработанной обычным промывочным раствором, используемым в тест-системе.
Этап 3. Сделать прогноз защищенности обследуемого на будущее. Поскольку авидность антител, защищающая от заболевания дифтерией, снижается быстрее, чем количественный показатель суммарных антител, то в прогнозе необходимо ориентироваться на индекс авидности антител. Для этого найти на графике (рис. 1) значение, наиболее приближенное к полученному индексу авидности антител (с учетом прошлой вакцинации, если она была проведена в ближайший год), и определить по графику, через сколько месяцев индекс авидности снизится до критической отметки (10 %). Очередную ревакцинацию (или повторное исследование) рекомендуется пройти до этой даты.
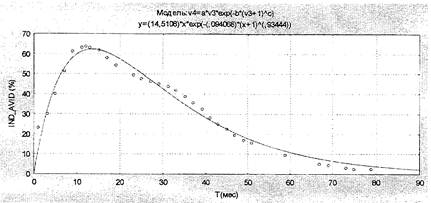
Рис. 1. Математическая модель из исходных данных
о динамике индексов авидности после ревакцинации
Примечания. IND_AVID (%) - индексы авидности (%), Т (мес.) - время после ревакцинации (месяцы). Средняя погрешность модели = 5 %.
6.2. Оценка коллективной защищенности
от дифтерийной инфекции
Этап 1. Определить контингент для изучения напряженности иммунитета к дифтерии с учетом групп риска. Исследование лучше проводить спустя 3 - 5 лет после очередной ревакцинации. Отобрать кровь для исследования. Заполнить индивидуальную информацию в базе данных для каждого обследуемого
Этап 2. Определить индивидуальные показатели защищенности от дифтерии и рассчитать вероятность заболевания на момент обследования. Затем определить средние показатели для всей группы обследованных.
Этап 3. Определить прогноз для всего коллектива в отношении динамики авидности антитоксических антител. Рассчитать сроки очередного обследования или вакцинации.
Все рекомендуемые мероприятия не идут в разрез с нормативными документами по вакцинопрофилактике и контролю иммунитета, а предполагают индивидуальный подход ко всем обследуемым лицам и повышенное внимание к представителям из групп риска.
1. Стандартное оборудование клинических лабораторий для взятия крови.
2. Стандартное оборудование для проведения серологических реакций.
3. Ламинарный или настольный бокс, ТУ 9452003-215-04087-5.
4. Фотометр микропланшетный (ридер).
1. Алексеева Е.А. Оптимизация мониторинга противодифтерийного иммунитета детей в Вологодской области/Е.А. Алексеева, Д.А. Краева, Г.Я. Ценева, Г.И. Беспалова//Материалы X Съезда ВНПОЭМП, Инфекция и иммунитет. Москва, 2012. № 2. С. 77 - 78.
2. Алексеева Е.А. Эффективность высокоавидных антитоксических антител в оценке невосприимчивости к дифтерийной инфекции/Е.А. Алексеева, Л.А. Краева. Г.Я. Ценева, А.М. Николаева//Профилактическая и клиническая медицина. 2011. № 1. С. 38.
4. Краева Л.А. Качественные показатели антитоксических антител в оценке противодифтерийного иммунитета/Л.А. Краева, Ф.С. Носков, Г.Я. Ценева//Ж. мед. иммунол. С.-Пб., 2005. Т. 7. № 2 - 3. С. 274.
7. Краева Л.А. Роль высокоавидных антитоксических антител в оценке невосприимчивости к дифтерийной инфекции/Л.А. Краева, Г.Я. Ценева, А.М. Николаева, Е.А. Алексеева//Эпидемиология и инфекционные болезни. 2011. № 4. С. 20 - 24.
12. Ценева Г.Я. Уровень антитоксического противодифтерийного иммунитета у населения Северо-Западного окрута РФ и пути оптимизации мониторинга инфекции/Г.Я. Ценева, Л.А. Краева, Е.Е. Щедеркина//Эпидемиология и вакцинопрофилактика. 2010. № 5 (54). С. 51 - 54.
14. Efsltatiou A., Maple Р.А.С. Manual for the laboratory diagnosis of diphtheria. Copenhagen//The Expanded Programme on Immunization in the European Region of WHO. 1994 (ICP/EPI038).
Читайте также:


