Генетические особенности возбудителя бруцеллеза
Глава 29. Возбудители бруцеллеза
В 1886 г. Д. Брюс в селезенке больного, погибшего от мальтийской лихорадки, обнаружил маленькую коккобактерию, которую выделил в чистой культуре и назвал Micrococcus.
В 1896 г. Б. Банг из околоплодной жидкости при аборте коров также выделил коккобактерии. В 1914 г. Ж. Траум выделил подобную палочку от больных свиней. А в 1916 г. Ивенс, изучив все выделенные микроорганизмы, определила их схожесть и в честь Брюса они были названы бруцеллами. В дальнейшем (1953, 1957, 1966) были открыты и другие виды бруцелл. Все они объединены в род Brucella.
В настоящее время бруцеллы подразделяют на виды по признаку их основного хозяина: В. melitensis - болеет мелкий рогатый скот (овцы, козы); В. abortus - болеет крупный рогатый скот; В. suis - болеют свиньи и т. д.
Каждый вид бруцелл подразделяют на биовары: В. melitensis включает 3 биовара; В. abortus - 9 биоваров; В. suis - 5 биоваров. Наиболее патогенным для человека является В. melitensis. B. abortus редко вызывают клиническое проявление заболевания у человека.
Морфология. Возбудители бруцеллеза мелкие 0,6-0,8 × 0,3-0,5 мкм бактерии палочковидной или овоидной формы. Неподвижны. Спор не имеют. Образуют нежную капсулу. Грамотрицательны. В мазке располагаются беспорядочно.
Культивирование. Бруцеллы - аэробы. Прихотливы к питательным средам. Характеризуются замедленным ростом (2-3 нед). Выращивают их на специальных питательных средах: сывороточно-декстрозном агаре, на агаре из картофельного настоя с сывороткой и кровяным агаром (5% овечьей крови), среде "Д", печеночном агаре МПА и МПБ. Растут они при температуре 37° С и рН 6,8-7,2. Некоторые штаммы требуют для роста 5-10% СО2, особенно при первоначальном выделении. На плотных питательных средах вырастают нежные, мелкие, бесцветные, выпуклые с перламутровым блеском колонии в S-форме. Под влиянием некоторых факторов они могут диссоциировать в R-форму. Под действием антибиотиков у них возникают L-формы. В жидких питательных средах бруцеллы дают равномерную муть. Бруцеллы можно культивировать в желточном мешке куриного эмбриона.
Дифференцируют виды бруцелл на основании их способности образовывать сероводород и расти на средах с красителями - основным фуксином и тионином (табл. 44).
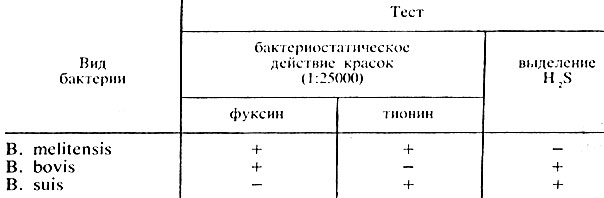
Таблица 44. Биологические свойства бруцелл
Ферментативные свойства. Бруцеллы расщепляют D-рибозу, D-галактозу, аланин, аспарагин. Некоторые штаммы гидролизуют аминокислоты с образованием аммиака.
Бруцеллы образуют гиалуронидазу, каталазу, пероксидазу, липазу, фосфатазу и др. Бруцеллы обладают выраженными инвазивными и агрессивными свойствами.
Токсинообразование. Патогенное действие бруцелл определяется, по-видимому, наличием эндотоксина. Кроме того, они обладают аллергенными свойствами.
Антигенная структура. Бруцеллы содержат два соматических антигена А и М. Эти антигены являются видоспецифичными. Они всегда входят в состав микробной клетки, но в разных соотношениях. У В. melitensis преобладает антиген М, у В. abortus и В. suis - антиген А. Кроме того, у них выявлен термолабильный Vi-антиген.
Устойчивость к факторам окружающей среды. При 100° С бруцеллы погибают мгновенно. При температуре 80-85° С - через 5 мин, при 60° С - через 30 мин. К низким температурам они очень устойчивы. Прямые солнечные лучи действуют на них губительно. Во влажной среде бруцеллы сохраняются длительно - 3-4 мес. В молочных продуктах - до 40-45 дней, замороженном мясе - до 5 мес, почве и воде - до 3-5 мес.
Восприимчивость животных. Бруцеллезом болеют в основном сельскохозяйственные животные: мелкий и крупный рогатый скот, свиньи, олени и др. Каждый вид бруцелл поражает определенный вид животного. Но бруцеллы могут мигрировать, т. е. переходить от одного вида животного другому. Например, В. abortus могут поражать мелкий рогатый скот.
Основными признаками заболевания являются: у самок - аборты, у самцов - орхиты. Кроме того, у них бывает поражение суставов, похудание, выпадение шерсти и т. д. Но бруцеллез у животных может протекать в скрытой форме, что способствует распространению инфекции.
Из экспериментальных животных к бруцеллам чувствительны белые мыши и морские свинки. После заражения они абортируют, резко худеют, у них выпадает шерсть. У мышей иногда развивается септицемия.
Источники инфекции. Основным источником заболевания бруцеллезом людей являются мелкий и крупный рогатый скот. Роль человека в передаче бруцеллезной инфекции эпидемиологического значения не имеет.
Пути передачи. Пищевой, контактно-бытовой, воздушно-капельный.
Контактный путь - при работе с животными: в процессе ухода за животными, на предприятиях, перерабатывающих сырье и продукты животного происхождения; при соприкосновении с выделениями больных животных, плодом, в процессе убоя, разделки туши и т. д.
Аэрогенным путем бруцеллы проникают в кожу и неповрежденные слизистые оболочки.
Пищевой путь - употребление зараженных пищевых продуктов. Наиболее опасны молочные продукты - молоко, брынза и т. д.
Патогенез. Попав в организм, бруцеллы по лимфатическим путям проникают в лимфатические узлы, кровь, костный мозг, паренхиматозные органы и локализуются внутри клеток. При обострении процесса бруцеллы из клеток вновь попадают в кровь и возникает рецидив. Заболевание характеризуется воспалением суставов, невралгией и естественными абортами.
Иммунитет - обусловливается клеточными (фагоцитоз) и гуморальными факторами - агглютининами, комплементсвязывающими антителами и др. Иммунитет сочетается с состоянием аллергии. В опытах на морских свинках было показано, что устойчивость к повторному заражению у них сочеталась с положительной реакцией к бруцеллину.
Профилактика. Плановые обследования в животноводческих хозяйствах, на пастбищах, в убойных пунктах, на мясных и молочных комбинатах.
Специфическая профилактика. Вакцинация живой вакциной В. abortus (штамм 19-ВА). Прививки проводят накожным методом однократно, ревакцинируют через 8-12 мес.
Лечение. Антибиотики: левомицетин, эритромицин. Для предупреждения рецидивов используют также бруцеллезный иммуноглобулин.
1. Какие Вы знаете виды бруцелл и какой из них патогенен для человека?
2. На каких средах культивируют бруцеллы и чем характеризуется их рост на средах?
3. С чем связано патогенное действие бруцелл?
Цель исследования: выявление возбудителя бруцеллеза.
Работу с бруцеллами проводят в строго режимных условиях.
2. Спинномозговая жидкость.
5. Грудное молоко.
6. Секционный материал.

Способы сбора материала

Ход исследования

Ход исследования
1. В каких условиях проводят работу с материалом, полученным от больного бруцеллезом?
2. Какой материал служит для диагностического исследования?
3. Перечислите основные методы исследования.
4. На каких животных ставят биологическую пробу?
Сывороточно-декстрозный агар. Основой этой среды является питательный агар, который готовят следующим образом: к 835 мл дистиллированной воды добавляют 15 г агар-агара, 10 г пептона, 5 г х. ч. хлорида натрия и 165 мл мясной воды. Все ингредиенты вводят в сосуд и подвергают обработке текучим паром в течение часа. Устанавливают рН 7,8. Затем сосуд ставят в автоклав, при 2 атм, температуре 120° С выпадают фосфаты. Среду фильтрют через бумажные фильтры, устанавливают рН 7,4, разливают в мерную посуду и стерилизуют при температуре 116° С в течение 15 мин. Заготовленный таким образом агар по мере надобности расплавляют на водяной бане и охлаждают до 50° С. Затем к нему добавляют нормальную инактивированную (при 56° С 30 мин) лошадиную или бычью сыворотку и раствор декстрозы, простерилизованный путем фильтрации через фильтр Зейтца. Окончательная концентрация сыворотки должна быть 5% и декстразы - 1%.
Кровяной агар. См. главу 7.
Среда "Д": а) бульон "Д" - к 100 мл холодной дистиллированной воды добавляют 2,5 г порошка стандартного бульона "Д", прогревают и тщательно размешивают до полного его растворения; затем бульон фильтруют, разливают в необходимую посуду и стерилизуют при 120° С в течение 20 мин (рН среды 7,1-7,2); б) агар "Д" - к 100 мл холодной дистиллированной воды добавляют 20 г порошка стандартного агара "Д", прогревают при помешивании до полного растворения порошка, не допуская его подгорания, затем фильтруют, разливают в необходимую посуду и стерилизуют при 120° С в течение 20 мин (рН среды 7,2). Среды готовит Институт эпидемиологии и микробиологии имени Н. Ф. Гамалея АМН СССР.
Бруцеллез – инфекционная болезнь, вызываемая бактериями рода Brucella, характеризующаяся длительной лихорадкой, поражением опорно-двигательного аппарата, нервной, сердечно-сосудистой и мочеполовой систем. Название рода связано с именем Д.Брюса, открывшего в 1886 г. возбудителя бруцеллеза.
Таксономия. Основные возбудители бруцеллеза – Brucella melitensis, В. abortus, В. suis, относятся к отделу Gracilicutes, роду Brucella.
Морфология и тинкториальные свойства. Бруцеллы – мелкие грамотрицательные палочки овоидной формы длиной 0,6. 1,5 мкм, шириной 0,5.0,7 мкм. Не образуют спор, не имеют жгутиков и капсулы.
Культивирование. Бруцеллы – облигатные аэробы; В. abortus для роста нуждается в присутствии 5-10 % углекислого газа. Оптимальная температура для роста 37ºС, оптимальное значение рН среды 6,8.7,2. Бруцеллы требовательны к питательным средам и растут на специальных средах (печеночных и др.). Их особенностью является медленный (в течение 2-3 нед) рост.
Ферментативная активность. Биохимическая активность бруцелл сравнительно невысока.
Антигенная структура. Бруцеллы имеют 2 разновидности О-антигена – А и М. Эти антигены видоспецифичны; у В. melitensis в большем количестве содержится М-антиген, у В. abortus и В. suis преобладает А-антиген. По биохимическим, антигенным свойствам, способности расти на средах с красителями фуксином и тионином внутри видов различают биовары.
Факторы патогенности. Бруцеллы образуют эндотоксин, обладающий высокой инвазивной способностью, а также продуцируют один из ферментов агрессии – гиалуронидазу. Их адгезивные свойства связаны с белками наружной мембраны.
Резистентность. Бруцеллы очень быстро погибают при кипячении, действии дезинфицирующих средств, но довольно устойчивы к низким температурам (в замороженном мясе сохраняются до 5 мес, в молочных продуктах до 1½ мес).
Восприимчивость животных. К бруцеллам очень чувствительны морские свинки, кролики, белые мыши.
Эпидемиология. Бруцеллез – зоонозная инфекция; источником инфекции являются крупный и мелкий рогатый скот, свиньи, реже олени, лошади, собаки, кошки и другие животные. В России основной источник бруцеллеза – овцы, выделяющие В. melitensis, но могут быть и коровы (B.abortus). Больные люди не являются источником инфекции. Заражение бруцеллезом происходит при употреблении молочных продуктов, мяса. Нередко заболевают люди, имеющие контакты с больными животными, например доярки, пастухи. Бруцеллез встречается в разных странах. Наблюдаются как спорадические случаи, так и вспышки заболевания в основном в животноводческих районах.
Патогенез. Бруцеллы проникают в организм через слизистые оболочки и кожу, попадают в регионарные лимфатические узлы, затем в кровь. Током крови бактерии разносятся по всему организму и внедряются в органы ретикулоэндотелиальной системы (печень, селезенку, костный мозг). Там они могут длительное время сохраняться и вновь попадать в кровь. При гибели бруцелл освобождается эндотоксин, вызывающий интоксикацию организма. В патогенезе заболеваний играет также роль сенсибилизация организма бруцеллами.
Клиническая картина. Инкубационный период составляет от 1 до 3 нед. Симптоматика развивающегося заболевания очень разнообразна. Бруцеллез характеризуется длительной лихорадкой, ознобами, потливостью, болями в суставах в результате их поражения. Нередко возникают радикулиты и миозиты. В патологический процесс вовлекаются также сердечно-сосудистая, мочеполовая и другие системы. Болезнь имеет затяжной характер.
Иммунитет. После перенесенного заболевания формируется непрочный и непродолжительный иммунитет, он сохраняется в течение 6-9 мес. Нередко люди, перенесшие бруцеллез, вновь заболевают этой инфекцией.
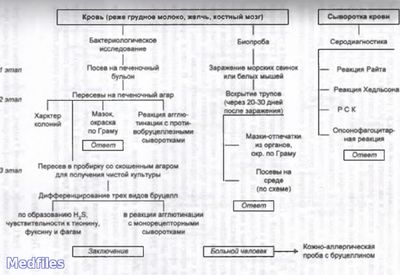
Микробиологическая диагностика. В качестве материала для исследования используют кровь, мочу, костный мозг. Основной метод диагностики – бактериологический, позволяющий определить не только род возбудителя, что важно для постановки диагноза, но и вид, установление которого производят для выявления источника инфекции. Применяют также серологический метод (реакции агглютинации Райта и Хеддльсона, РНГА, РСК и др.), кожные аллергические пробы (проба Бюрне с бруцеллином).
Лечение. Основное лечение – антибиотикотерапия. Очень редко используют для вакцинотерапии убитую вакцину.
Профилактика. Основная роль в профилактике бруцеллеза принадлежит санитарно-гигиеническим мероприятиям (в том числе пастеризации молока). Кроме того, применяют по эпидемическим показаниям живую бруцеллезную вакцину.
Бруцеллез – зоонозное инфекционно-аллергическое заболевание, характеризующееся длительной лихорадкой, поражением опорно-двигательного аппарата, нервной, сердечно-сосудистой, мочеполовой и других систем организма со склонностью к затяжному, хроническому течению.
Виды – наиболее патогенные для человека – В. melitensis, B. abortus, B. suis.
Мелкие кокковидные палочки размерами 0,5-0,7×0,6-1,5 мкм, грамотрицательные, в мазках располагаются беспорядочно, неподвижны, спор не образуют, свежевыделенные штаммы могут образовывать нежную капсулу.
Строгие аэробы. Оптимальные условия культивирования: температура – 37 0 С, рН – 6,8-7,2. Особенностью бруцелл бычьего типа является их потребность в повышенном содержании в атмосфере углекислого газа (5-10% СО 2 ). Характерен медленный рост бруцелл – первые генерации появляются через 1-3 недели и более. При пересеве лабораторных культур рост наблюдается через 1-2 дня. Требовательны к питательным средам: хорошо растут на печеночном, сывороточном или кровяном агаре. В жидкой среде наблюдается рост в виде диффузного помутнения. На плотных питательных средах бруцеллы образуют перламутровые мелкие выпуклые гладкие колонии с нежной зернистостью (S-форы). Возможна диссоциация в R-формы.
Биохимическая активность.
Выражена слабо. Ферментируют глюкозу и арабинозу до кислоты без газа. Восстанавливают нитраты, разлагают белки с образованием Н 2 S, индол не образуют.
Разделение на виды основано на биохимических и культуральных различиях
Рост на средах с красителями
Потребность в СО 2
У бруцелл выявлено до 15 антигенных фракций: родовые и видовые поверхностные антигены.
1. Выделяют два соматических антигена – А и М, причем М-антиген доминирует у В. melitensis, А-антиген преобладает у B. abortus и B. suis.
2. Третий – L(Vi)-антиген – поверхностно расположенный капсульный антиген вирулентности, термолабильный, имеет сходство с Vi-антигеном сальмонелл.
Токсины. Бруцеллы обладают эндотоксином (ЛПС КС), имеющим высокую инвазивную способность.
Ферменты – гиалуронидаза и нейроминидаза.
Структурные и химические компоненты клетки: пили I порядка и белки клеточной стенки (адгезивные свойства), капсула.
Считают, что бруцеллы обладают высокой инвазивностью: могут проникать в организм человека через неповрежденные кожные и слизистые покровы.
Также являются факультативными внутриклеточными паразитами.
Бруцеллы довольно устойчивы во внешней среде:
- В воде и влажной почве – они могут сохраняться до 5 месяцев;
- В молоке – 9 месяцев;
- В сыре – до 1 года;
- Они устойчивы к низким температурам и в замороженном мясе выживают до 5 месяцев.
Чувствительны к повышенной температуре (до 60 0 С – погибают за 30 минут, кипячение – мгновенно), действию дезинфиктантов (3% раствор хлорной извести, 1% хлорамин, 2% формалин убивают их за 5 минут), антибиотикам (стрептомицину, тетрациклину, рифампицину).
Основной резервуар и источник инфекции – больные домашние животные: овцы, козы, свиньи, КРС.
- Фекально-оральный (путь – алиментарный – большую опасность представляет сырое молоко и молочные продукты, не подвергающиеся в процессе приготовления тепловой обработке, например, сыр, брынза);
- Контактный (путь – прямой контактный – при попадании возбудителя на поврежденные кожные или слизистые покровы при уходе за больными животными);
- Аэрогенный (путь – воздушно-пылевой – описан при вдыхании воздушно-пылевой смеси, содержащей инфицированные частицы шерсти, навоза, земли во время уборки помещения).
Для бруцеллеза свойственен выраженный профессиональный характер заболевания!
Инкубационный период – 1-4 недели (может длиться до 2-3месяцев).
Патогенез и клинические особенности.
Бруцеллы проникают в организм человека через слизистые оболочки или кожные покровы, не оставляя никаких изменений в области входных ворот. Лимфогенным путем возбудители заносятся в региональные лимфоузлы и подвергаются незавершенному фагоцитозу. С макрофагами возбудители проникают в кровоток и диссеминируют в печень, селезенку, почки, костный мозг, суставы, эндокард. В пораженных органах образуются очаги некроза, окруженные инфильтратами. Появляются признаки очаговых поражений со стороны опорно-двигательного аппарата, нервной, сердечно-сосудистой, мочеполовой и других систем. Внутри фагоцитов бруцеллы способны формировать L-формы и длительно персистировать в организме. Переход в исходные формы обуславливает рецидив болезни.
Постинфекционный иммунитет – гуморальный (образуются неполные антитела) и клеточный, нестойкий, нестерильный. Формируется ГЗТ.
Бруцеллы могут быть выявлены непосредственно в патологическом материале и объектах внешней среды с помощью прямой или непрямой реакции иммунофлюоресценции.Ее используют также для идентификации выделенной культуры.
Бруцеллы в острую фазу болезни выделяют из крови при посеве на питательный бульон. Кроме того, делают посевы пунктатов костного мозга и лимфатического узла, а также стерильно взятой мочи. Выделенную культуру идентифицируют по типичной морфологии бактерий и колоний, положительной реакции агглютинации на стекле с поливалентной бруцеллезной сывороткой. Для видовой идентификации используют признаки видов и биоваров бруцелл. Серодиагностику проводят в развернутой реакции агглютинации (р. Райта) и пластинчатой реакции агглютинации (р. Хедльсона), реже ставят РНГА, а также р. Кумбса для выявления
Кожно-аллергическую пробу (по Бюрне) применяют для выявления ГЗТ к бруцеллам. Положительная реакция наблюдается как у больных, так и у привитых живой бруцеллезной вакциной
Проводят вакцинацию по эпидпоказаниям живой вакциной из аттенуированного штамма B. abortus.
Специфическое лечение – противобруцеллезный иммуноглобулин, для лечения хронических форм заболевания применяется убитая бруцеллезная вакцина.
Возбудителем бруцеллеза является короткая палочка Бруцелла, которая была названа в честь ученного, открывшего ее в 1886 году.
Возбудителем бруцеллеза выступают мелкие бактерии рода Brucella, относящиеся к различным видам. Род Brucella представляет собой компактную, достаточно обособленную генетическую группу.
Род Brucella по систематике Берги относится к родам с неясным систематическим положением. Род включает шесть видов: Brmelitensis, Br.abortus, Br.suis, Br.ovis, Br.neotomae и Br.canis, которые различаются, в основном, по культуралышм и биохимическим свойствам.
Морфология, тинкториальные и культуральные свойства бруцелл.
По морфологическим признакам различные виды и биотипы бруцелл неотличимы друг от друга. Это очень мелкие микроорганизмы со свойственным им полиморфизмом. В микроскопических препаратах они могут встречаться одновременно в шаровидной, овоидной и палочковидной формах.Н. Н. Островская (1961г.) отмечает, что у бактерий Вr. abortus и Вr. suis преобладают удлиненные, а у Вr. тelitensis - кокковидная формы. Чаще всего в препарате наблюдается беспорядочное расположение одиночных бактерий, но иногда они располагаются в виде цепочки или попарно. Размер клеток колеблется от 0,3 до 0,6 мк для кокковых и от 0,6 до 1,5 мк для удлиненных форм.
Бруцеллы не обладают подвижностью, не образуют спор. При некоторых условиях у них может появляться капсула (Нuddleson, 1943г.; Н.Д. Анина-Радченко, 1954г.; Н.Н. Островская и Э.Н. Князева, 1957г.). Бруцеллы сходны между собой по субмикроскопическому строению клеточной стенки, цитоплазматической мембраны, цитоплазмы и нуклеоида и не имеют принципиальных отличий в этом отношении от других грамотрицательных бактерий (Н.Н. Островская, 1972г.).
Бруцеллы окрашиваются всеми анилиновыми красителями: при окраске по Романовскому приобретают нежно-фиолетовый цвет; по Граму не красятся. Предложены дифференциальные способы окраски бруцелл, которые основаны на свойстве этих бактерий сохранять первичную окраску при переокрашивании препарата другими контрастными красителями. Большое распространение получил простой способ дифференциальной окраски по Е.В. Козловскому (1936г.).
Техника окраски по этому способу сводится к следующему. Высушенные на воздухе препараты фиксируют на пламени и окрашивают 2-процентным водным раствором сафранина с подогреванием до появления пузырьков; затем препарат промывают водой и дополнительно окрашивают 0,75-1-процентным водным раствором малахитовой зелени в течение 0,5-1 мин. Бруцеллы сохраняют красный цвет, а другие бактерии и тканевые клетки окрашиваются в зеленый цвет.
Выращивание культуры бруцелл удается на обычных, применяемых для культивирования бактерий питательных средах, имеющих нейтральную или слабощелочную реакцию (рН 6,8-7,2). Рост получают в аэробных условиях при температуре 37°. Некоторые виды и биотипы бруцелл для своего роста, особенно в первых генерациях при выделении от естественно больных животных, требуют повышенной концентрации (5-10%) СО2 в атмосферном воздухе.
По сравнению с другими гетеротрофными бактериями бруцеллы более требовательны к питательным средам. Поэтому для первичного выделения и дальнейшего культивирования этих бактерий рекомендованы специальные питательные среды. С этой целью успешно используются печеночные и мясо-печеночные среды, особенно с добавлением глицерина (2%) и глюкозы (1%). С несомненным успехом применяется разработанная Н.В. Плоскиревым сухая среда "Д", основу которой составляют рыбный и дрожжевой гидролизаты. По данным автора и других исследователей (Н.Н. Островская и А.А. Голубева, 1958г.), среда "Д" имеет некоторые преимущества перед печеночной средой. Хорошие результаты получали при культивировании бруцелл на картофельной среде (Нuddleson, 1943г.; В.Е. Корнеева, 1949 г.и другие) и на среде Альбими.
Объединенный Комитет экспертов ФАО/ВОЗ по бруцеллезу (1970г.) для первичного выделения и для дальнейших пересевов культур бруцелл рекомендует такие основные среды: сывороточно-декстрозный агар; картофельный агар плюс сыворотка; триптикозно-соевый и триптозный агар; кровяной агар (5% овечьей крови в агаре основной среды).
Для выделения культур бруцелл из загрязненных посторонней микрофлорой материалов рекомендуется пользоваться этими же средами после добавления к ним не мешающих росту бруцелл антибиотиков: полимиксина, бацитрацина, циклогексамида, актидиона.
Изготовленная питательная среда может быть признана пригодной только в том случае, если на ней наблюдается рост большинства штаммов бруцелл при малом (5-10 микробных клеток) инокуляте.
Некоторые исследователи изучали потребность бруцелл в источнике азота и дополнительных факторах роста. О.В. Кондратьева и В.М. Степанов (1968, 1969г.) сделали вывод, что рост бруцелл обеспечивается при наличии в среде только 6 аминокислот: глютаминовой, L-аланина, лизина, метионина, гистидина, цистеина. Важнейшим источником азота, по их мнению, являются глютаминовая кислота и цистеин. Подчеркивается также потребность бруцелл в комплексе витаминов группы В (В1 В2, В6) и в никотиновой кислоте. Витамин А необходим для роста только некоторых штаммов бруцелл.
Для бруцелл характерен замедленный рост, особенно первых генераций культуры. Поэтому посевы материалов, взятых от естественно зараженных животных, следует выдерживать в термостате до 4-5 недель, если не получен рост в более ранние сроки. На хорошо подобранной среде лабораторные штаммы бруцелл дают обильный рост через 24-48 часов.
При посеве бруцелл из густой взвеси бактерий на скошенный агар образуется нежный с маслянистым блеском прозрачный слой, который постепенно грубеет, мутнеет, становится менее прозрачным и приобретает серый с голубоватым оттенком цвет. Почти такие же изменения наблюдаются при посеве бруцелл штрихом.
В посевах на бульон наблюдается постепенное равномерное помутнение среды. При длительном пребывании бульонной культуры в термостате на дне сосуда образуется рыхлый осадок, а на поверхности среды медленно образуется пристеночное кольцо или кольцо и пленка.При разреженном посеве на агаровые пластинки в чашках Петри бруцеллы обычно растут в виде круглых, выпуклых, слегка прозрачных колоний с ровным краем. Поверхность колоний гладкая, с маслянистым блеском. При удлинении периода роста колонии становятся менее прозрачными.
Неnrу (1933г.), Нuddleson (1952г.), Раrnas и Сhodkowski (1959г.), П.Н. Жованик (1972г.) изучали колонии бруцелл под микроскопом при боковом освещении (техника этого исследования приводится в главе "Изменчивость бруцелл"). При этом освещении удалось обнаружить, что культуры бруцелл нередко бывают неоднородными (гетерогенными) по составу клеток. Клетки S-формы образуют круглые выпуклые колонии с ровными краями. При боковом освещении они имеют гладкую или нежно-зернистую поверхность и серо-голубое с зеленым оттенком свечение. На этом фоне выделяется небольшой красновато-желтый центр колонии. Спонтанно возникающие в процессе популяционной изменчивости клетки R-, М - или иной формы образуют колонии, которые резко отличаются от колоний S-формы, особенно по характеру свечения.
Культуры бруцелл хорошо сохраняются на твердых питательных средах при пересеве их через каждые 30-45 дней. Лучше хранить эти культуры в высушенном виде. При высушивании используют среду, содержащую 1,5% желатины и 10% сахарозы, растворенных в дистиллированной воде. Хранят высушенную культуру в хорошо запаянных ампулах без доступа воздуха при температуре 7°.
Патогенность и вирулентность бруцелл.
В организме зараженных животных бруцеллы живут и размножаются главным образом внутри клеток ретикуло-эндотелиальной системы. Это дает основание относить их к числу внутриклеточных паразитов, хотя иногда они могут находиться и внеклеточно. Проникнув в организм животного, бруцеллы обычно задерживаются в лимфоидных тканях и обуславливают развитие патоморфологических изменений в виде ретикуло-эндотелиальных пролифератов и некробиотических очагов. Эти патологические изменения зависят от степени вирулентности данной культуры.
Вирулентность каждого штамма культуры бруцелл является его индивидуальным свойством и в известной мере количественным выражением патогенности. Ее измеряют обычно величиной минимальной инфицирующей дозы (ИД), способной вызвать заражение всех или большинства опытных животных.
Как среди лабораторных, так и среди свежевыделенных культур бруцелл могут встречаться штаммы с весьма различной степенью вирулентности. В опытах на морских свинках высоковирулентные штаммы всех трех классических видов бруцелл вызывают развитие генерализованной инфекции уже в дозе 5-10 микробных тел (м. т.). По данным многих авторов и результатам наших собственных исследований, развитие генерализованной инфекции после такого заражения наступает обычно в течение 4-5 недель.
Для многих вирулентных штаммов бруцелл одна ИД составляет 25-50 м. т., а иногда и больше. Существуют слабовирулентные и авирулентные штаммы бруцелл. Культуры таких штаммов плохо приживаются в организме животных.
Исследователи определяли минимальную инфицирующую дозу бруцелл и в опытах на сельскохозяйственных животных. Нuddleson (1943г.) приводит результаты опытов Мак Ивена с соавторами и Хатчинга, в которых исследователи подвергли конъюнктивальному заражению осемененных телок разными дозами культуры Вr. abortus.
Хаддлсон подчеркивает, что для коров средней чувствительности минимальная инфицирующая доза культуры Вr. abortus составляла около 1 миллиона бактерий (м. т.) и что в опытах Хатчинга значительно меньшая доза и в более короткий срок вызывала появление первого доказательства инфекции в виде положительной реакции агглютинации. При подкожном заражении овец высоковирулентной культурой Вr. abortus доза 5-25 тыс. бруцелл вызывала лишь регионарную инфекцию (П.А. Вершилова, 1961г.). Развитие генерализованной инфекции регулярно получали после введения такой культуры в дозе 100 тыс. микробных клеток. При нанесении культуры на конъюнктиву или слизистую влагалища в дозе не менее 1-500 миллионов бруцелл наблюдали регулярное заражение овец.
У бруцелл нередко наблюдается спонтанное понижение вирулентности. Это может быть связано с популяционной изменчивостью культуры. Появляющиеся в культуре штамма измененные клетки вследствие свойственному им селективному преимуществу постепенно увеличиваются в количестве и начинают преобладать в популяции клеток, придавая культуре новые измененные свойства. Ослабленную вирулентность можно вновь повысить. Для этого, используя действие закона естественного отбора, культуры подвергают многократным пассажам через организм высокочувствительных к бруцеллезу морских свинок или каких-либо других чувствительных к бруцеллезной инфекции животных.
В сравнимых условиях опыта на морских свинках сопоставляли Вr. abortus и Вr. melitensis (П.Ф. Здродовский и П.В. Воскресенский, 1930), а также Br. Abortus и Вr. suis (Харди и др., 1931г.) с целью обнаружения различий в патогенности у разных видов бруцелл. Результаты исследований были противоречивы, поэтому выделить тот или иной вид бруцелл, как наиболее патогенный для морских свинок, не представилось возможным.
Делались попытки по оценке вирулентности бруцелл на основе их ферментативной активности и особенностей обмена веществ. Нuddleson (1943), изучив у всех трех классических видов бруцелл активность фермента каталазы, полагал, что высокой степени вирулентности соответствует более высокая каталазная активность штамма. Е.А. Драновская (1968г) отмечает, что слабовирулентные штаммы Br. abortus и Вr. melitensis отличались от вирулентных штаммов более высокой активностью некоторых дегидрогеназных систем, участвующих в энергетическом обмене.
Антигенная структура бруцелл. Естественное заражение бруцеллезом, как и искусственное введение культуры бруцелл, обычно сопровождается образованием в организме животного специфических антител. Это явление давно используется для диагностики болезни и серологической дифференциации различных видов и типов бруцелл.
Еще в 1932 г. Wilson и Miles установили, что клетки всех трех классических видов бруцелл, находящихся в обычной для них гладкой S-форме, содержат два серологически отличимых антигена А и М и что каждый из этих антигенов у различных видов бруцелл содержится в неодинаковом количестве. Несколько позже Мiles (1939г.) уточнил, что у Br. melitensis количественное соотношение между антигенами А и М может быть выражено примерно как отношение 1: 20, а у Вr. abortus и Вr. suis - как 20:
1. Это открытие дало основание для использования адсорбированных сывороток при отнесении исследуемой культуры бруцелл либо к виду Br. melitensis, либо в группу двух других видов. Клетки Br. suis имеют несколько большее количество антигена М, чем клетки Br. abortus. Но эта разница не столь значительна, чтобы ею можно было воспользоваться для серологической дифференциации этих видов бруцелл. Впоследствии накапливалось все больше фактов, которые свидетельствовали, что существенные количественные различия в содержании А и М антигенов наблюдается не только в культурах, принадлежащих к разным видам, но и у разных штаммов одного и того же вида. Все более частые случаи выявления серологических вариантов внутри того или иного вида бруцелл значительно затрудняли использование метода абсорбции агглютининов для целей межвидовой серологической дифференциации этих бактерий. Результат такой дифференциации был очень условным и относительным (П.Ф. Здродовский, 1953г.). В конце концов все это привело к признанию, что дифференциация бруцелл по РА с моноспецифической сывороткой имеет значение в основном только при идентификации биотипов внутри каждого из трех классических видов бруцелл.
Используя разные способы экстрагирования, из культуры бруцелл удается выделить липоидно-полисахаридно-белковый комплекс, который обладает специфическими антигенными и токсическими свойствами. При исследовании этого антигенного комплекса с помощью метода преципитации в геле установлено, что с гомологической сывороткой он дает до 6 линий преципитации. Иными словами, в экстрактах из бруцелл с помощью реакции преципитации в геле удается обнаружить до б различных антигенов. Метод иммуноэлектрофореза дает возможность выявить у бруцелл значительно большее количество антигенных компонентов.
С помощью метода преципитации в геле было показано также, что у бруцелл имеются поверхностные и глубинные антигены.
И.И. Дубровская (1950-1968г.) установила, что антигенные комплексы у бруцелл состоят из двух антигенов. Один из них - это антиген типа Буавена, содержащий полисахариды, липиды и белок, а другой, так называемый четвертый компонент, также содержит специфический полисахарид, но другой природы, белковое вещество и дезоксирибонуклеиновую кислоту. У разных видов бруцелл эти антигены содержатся в неодинаковом количестве. В отличие от всего антигенного комплекса четвертый его компонент, проявляя серо-логическую активность и аллергенные свойства, не обладает токсичностью.
Исследуя культуры бруцелл S - и R-формы, И.И. Дубровская обнаружила, что химический состав их антигенных комплексов был совершенно различным. Антигенные вещества из R-культур содержали мало белка и не имели ДНК содержащего компонента. Анти-генный комплекс из культуры бруцелл К-формы отличался от антигенов из S-культур и по качественному составу полисахаридов.
В реакции преципитации в геле антигены из R-формы, показали значительно меньшую активность, чем антигены S-формы, и давали с гомологичной сывороткой только одну линию преципитации.
Шероховатые формы всех видов бруцелл имеют общий для них К-антиген и не содержат специфических антигенов А и М. Серологическим методом их нельзя дифференцировать (Лембке и Кернлайн, 1950).
Выживаемость бруцелл во внешней среде и в продуктах животноводства.
Литературные данные о выживаемости бруцелл в различных объектах внешней среды неоднородны. В опытах 3.А. Кучеренко (1934г.) в поверхностных слоях почвы бруцеллы сохраняли жизнеспособность до 40 дней, на глубине 5-8 см - до 60, а в унавоженной почве - до 100 дней. По данным М.Е. Авакумова (1934г.), в почве и навозе при низкой температуре бруцеллы выживали до 4,5 месяца. П.А. Вершилова и А.А. Голубева (1972г.) указывают, что летом в почве бруцеллы сохраняют жизнеспособность в течение 3 месяцев, а зимой - до 4,5 месяца, в буртах навоза при температуре 50 - 67° - в течение 25 дней и более длительное время при температуре в буртах 37-42°.
В воде при интенсивном заражении бруцеллы могут сохраняться жизнеспособными от 45-90 до 150 дней (П.Ф. Здродовскии, 1953г.). В наших опытах при интенсивном заражении (10е м. т. в 1 мл воды) проб стерильной водопроводной воды (которую перед стерилизацией смешивали с садовой почвой) бруцеллы выживали значительно более продолжительное время. В опытах было использовано два штамма Вr. abortus, пробы хранили при комнатной температуре в шкафу. При периодических отсевах (через каждые 2 - 3 недели) на МППБ и МППА один штамм (2738) перестал давать рост через 7 месяцев, а другой (1410) - более чем через 15 месяцев.
О выживаемости бруцелл в продуктах животноводства П.А. Вершилова и А.А. Голубева (1972г.) приводят такие данные: в молоке бруцеллы выживали в течение 10-273 дней, в масле-' 10-142 дней, в сыре - от 25 дней до года, в брынзе - до 45 дней, в кислом молоке-2-30 дней, в кефире-до 11 дней, в замороженном мясе - более 320 дней, в соленом масле - 30-113 дней, в шерсти - 14-90 дней, в шкурках ягнят - до 2 месяцев.
В виде культуры на твердой питательной среде в хорошо закрытых или еще лучше в залитых парафином пробирках бруцеллы сохраняются жизнеспособными в течение многих недель, а в виде лиофильно высушенной культуры - годами.
Сравнительно высокую чувствительность бруцеллы проявляют к действию нагревания, солнечных лучей и различных средств химической дезинфекции, В жидкой культуре при температуре 60° бруцеллы погибают через 30 мин, при температуре 70° - через 10 мин, а при кипячении - почти мгновенно.
рямой солнечный свет в зависимости от интенсивности инсоляции убивает бруцелл в течение от нескольких минут до 3-4 часов (Е.С. Орлов, 1974г.), рассеянный свет убивает их через 7-8 дней. Действие употребляемых средств химической дезинфекции характеризуется такими данными: 2-процентный раствор фенола, 1-процентный креолин, 0,5-процентный лизол, 1-процентная хлорная известь, 1-2-процентный формалин, 0,01-процентный хлорамин, 1-процентный раствор НС1 в 8-процентном растворе NaС1 убивают бруцелл в течение нескольких минут (П.Ф. Здродовский).
Для дезинфекции животноводческих помещений наиболее часто применяются: осветленный раствор хлорной извести, содержащей 2% активного хлора, 2-процентный раствор едкого натра, 20-про-центная взвесь свежегашеной извести, 2-процентный раствор формальдегида, 4-процентная горячая эмульсия дезинфекционного креолина, 5-процентная эмульсия нафтализола, 5-процентный горячий раствор кальцинированной соды. Пастеризацию молока производят при температуре 70° в течение 30 мин или при температуре 85-90° в течение 20 секунд.
Читайте также:


