Диагностический титр при туляремии для рпга
Особенности лабораторной диагностики туляремии
Организм человека восприимчив к туляремии. У человека туляремия - лихорадочное заболевание с относительно доброкачественным течением, не представляющее опасности заражения для окружающих. Летальность при туляремии в России ниже 0,5 % (без лечения). Для диагностики туляремии у больного вполне достаточно применение двух реакций, кожной пробы и реакции агглютинации. Другие иммунологические реакции технически более сложны (например, реакция связывания комплемента).
Выделение от больного культуры возбудителя доступно лишь специально оснащенным лабораториям и применяются в основном с исследовательскими целями. Для обнаружения туляремийных бактерий в органах животных и объектах внешней среды в лабораторной практике чаще всего используют бактериологические методы исследования материала. Грызунов, кровососущих членистоногих доставляют в лабораторию для исследования с соблюдением предосторожностей, предусмотренных правилами работы с особо опасными инфекциями.
Бактериологический метод для диагностики заболевания у человека по сравнению с биологическим методом малоэффективен, так как в организме больного человека туляремийные микробы содержаться в скудном количестве. Для выращивания туляремийных бактерий используют специальные среды, так как на простых питательных средах (мясопептонном агаре, бульоне) этот микроб не растет, обычно применяется свернутая желточная среда, рыбно-глюкозо-цистиновый агар и агар с добавлением крови. При массивном обсеменении органов рост культуры туляремийных бактерий появляется через 18-24 ч в виде нежного синего налета на поверхности среды.
Бактериоскопия ввиду очень мелких размеров туляремийного микроба он может быть с достоверностью обнаружен в мазках-отпечатках из патологического материала только при обильном обсеменении последнего. При изготовлении мазков-отпечатков используют окраску по Романовскому-Гимза. Путем бактериоскопии (в сочетании с реакцией преципитации) может быть получен быстрый (через 2-3 ч) положительный ответ при исследовании доставленных грызунов. Однако он является лишь предварительным, так как положительные результаты бактериоскопического исследования должны быть подтверждены выделением культуры.
Серологические исследования - из серологических методов исследования применяют реакцию агглютинации по общепринятой методике с использованием туляремийного диагноста. Диагностическим считается титр 1 : 100 и выше. Более чувствительной является реакция непрямой гемагглютинации, применяемая как для ранней, так и для ретроспективной диагностики. В качестве антигена используют туляремийный эритроцитарный диагностикум.
Ускоренный метод серологической диагностики туляремии. Для этой цели применяют кровяно-капельную реакцию на стекле. В качестве антигена используют обычный туляремийный диагностикум. В положительных случаях при наличии у больного титра сыворотки 1 : 100 и выше агглютинация на стекле наступает немедленно после смешения крови с антигеном. Для ускоренной диагностики туляремии у людей может быть использована также микросерореакция. Для ее постановки на предметное стекло наносят не каплю крови, а каплю сыворотки крови обследуемого больного и к ней добавляют столько же антигена. Положительная микрореакция на стекле может служить для предварительной ориентации в диагнозе.
Проба с тулярином
Аллергическая реакция строго специфична, у больных туляремией людей она становиться положительной при всех химических формах туляремии и, как правило, опережает реакцию агглютинации. Проба состоит во введении внутрикожно в область предплечья, передней поверхности 0,1 мл тулярина (взвесь убитых туляремийных микробов). Оценку пробы производят через 24, 48 и 72 ч. Проба является положительной при появлении отека или инфильтрата. Гиперемия без отека, исчезающая через сутки, диагностического значения не имеет. Внутрикожную пробу применяют и для ретроспективной диагностики туляремии. Надо иметь в виду, что проба с тулярином бывает положительной у лиц, подвергшихся прививкам туляремийной вакциной. Вместо внутрикожной пробы пользуются накожной пробой: нанесением двух капель антигена на ладонную поверхность предплечья с последующими поверхностными насечками и легким втиранием антигена. В положительных случаях через 24-36 ч появляются гиперемия и отечность, сохраняющихся 2-3 дня.
Биологический метод является самым чувствительным способом обнаружения туляремийных бактерий в любом исследуемом материале. Биологический метод исследования заключается в заражении лабораторных животных (морская свинка, белая мышь) результатом бубонов, взятым до 14-20-го дня болезни; соскобом со дна язвы, смешанным с физиологическим раствором, полученным до 8-12-го дня, отделяемым конъюнктивы, взятым до 15-17-го дня болезни; кровью 5-6 мл, взятой до 6го дня болезни. Исследуемый материал вводят подопытным животным подкожно или внутрибрюшно. Зараженные животные погибают от туляремии в течении 4-14 дней. Кусочки печени, селезенки, лимфатического узла и кровь засевают на желточную среду для выделения возбудителя.
Организм человека восприимчив к туляремии. У человека туляремия — лихорадочное заболевание с относительно доброкачественным течением, не представляющее опасности заражения для окружающих. Летальность при туляремии в России ниже 0,5% (без лечения). Для диагностики туляремии у больного вполне достаточно применения 2 реакций, кожной пробы и реакции агглютинации. Другие иммунологические реакции технически более сложны (например, реакция связывания комплемента).
Выделение от больного культуры возбудителя доступно лишь специально оснащенным лабораториям и применяется в основном с исследовательскими целями. Для обнаружения туля-ремийных бактерий в органах животных и объектах внешней среды в лабораторной практике чаще всего используют бактериологические методы исследования материала. Грызунов, кровососущих членистоногих доставляют в лабораторию для исследования с соблюдением предосторожностей, предусмотренных правилами работы с особо опасными инфекциями.
Бактериологический метод для диагностики заболевания у человека по сравнению с биологическим методом малоэффективен, так как в организме больного человека туляремийные микробы содержатся в скудном количестве. Для выращивания туляремийных бактерий используют специальные среды, так как на простых питательных средах (мясо-пептонном агаре, бульоне) этот микроб не растет, обычно применяется свернутая желточная среда, рыбно-глюкозо-цистиновый агар и агар с добавлением крови. При массивном обсеменении органов рост культуры туляремийных бактерий появляется через 18—24 ч в виде нежного синего налета на поверхности среды.
Бактериоскопия
ввиду очень мелких размеров туляремийного микроба он может быть с достоверностью обнаружен в мазках-отпечатках из патологического материала только при обильном обсеменении последнего. При изготовлении мазков-отпечатков используют окраску по Романовскому-Гимзе. Путем бактериоскопии (в сочетании с реакцией преципитации) может быть получен быстрый (через 2—3 ч) положительный ответ при исследовании доставленных грызунов. Однако он является лишь предварительным, так как положительные результаты бакте-риоскопического исследования должны быть подтверждены выделением культуры.
Серологические исследования
из серологических методов исследования применяют реакцию агглютинации по общепринятой методике с использованием туляремийного диагноста. Диагностическим считается титр 1 : 100 и выше. Более чувствительной является реакция непрямой гемагглютинации, применяемая как для ранней, так и для ретроспективной диагностики. В качестве антигена используют туляремийный эритроцитарный диагностикум.
Ускоренный метод серологической диагностики туляремии.
Для той цели применяют кровяно-капельную реакцию на стекле. В качестве антигена используют обычный туляремийный диагностикум. В положительных случаях при наличии у больного титра сыворотки 1 : 100 и выше агглютинация на стекле наступает немедленно после смешения крови с антигеном. Для ускоренной диагностики туляремии у людей может быть использована также микросерореакция. Для ее постановки на предметное стекло наносят не каплю крови, а каплю сыворотки крови обследуемого больного и к ней добавляют столько же антигена. Положительная микрореакция на стекле может служить для предварительной ориентации в диагнозе.
Аллергическая реакция
строго специфична, у больных туляремией людей она становится положительной при всех химических формах туляремии и, как правило, опережает реакцию агглютинации. Проба состоит во введении внутрикожно в область предплечья, передней поверхности 0,1 мл тулярина (взвесь убитых туляремийных микробов). Оценку пробы производят через 24, 48 и 72 ч. Проба является положительной при появлении отека или инфильтрата. Гиперемия без отека, исчезающая через сутки, диагностического значения не имеет. Внутрикож-ную пробу применяют и для ретроспективной диагностики туляремии. Надо иметь в виду, что проба с тулярином бывает положительной у лиц, подвергшихся прививкам туляремийной вакциной. Вместо внутрикожной пробы пользуются накожной пробой: нанесением двух капель антигена на ладонную поверхность предплечья с последующими поверхностными насечками и легким втиранием антигена. В положительных случаях через 24—36 ч появляются гиперемия и отечность, сохраняющиеся 2—3 дня.
Биологический метод
является самым чувствительным способом обнаружения туляремийных бактерий в любом исследуемом материале. Биологический метод исследования заключается в заражении лабораторных животных (морская свинка, белая мышь) результатом бубонов, взятым до 14—20-го дня болезни; соскобом со дна язвы, смешанным с физиологическим раствором, полученным до 8—12-го дня, отделяемым конъюнктивы, взятым до 15—17-го дня болезни; кровью 5—6 мл, взятой до 6-го дня болезни. Исследуемый материал вводят подопытным животным подкожно или внугрибрюшно. Зараженные животные погибают от туляремии в течение 4—14 дней. Кусочки печени, селезенки, лимфатического узла и кровь засевают на желточную среду для выделения возбудителя.
а) Наиболее распространенным и вместе с тем вполне точным методом серологической диагностики туляремии является реакция агглютинации (РА). Она служит для установления диагноза у больного или переболевшего (ретроспективный диагноз) и может быть использована при изучении иммунологического состояния привитых против туляремии. Обнаружение агглютининов у больного туляремией обычно отмечается через 10-15 дней, при этом агглютинационный титр сыворотки в этот период составляет 1:50-1:100, но далее быстро нарастает и на 4-6-й неделе болезни достигает 1:400-1:800, реже 1:1600 и выше.
По достижении максимальных показателей агглютинационный титр сыворотки затем медленно снижается и через 6-12 месяцев составляет 1:100-1:400, а позднее падает до 1:10-1:50 и на этом уровне может удерживаться в течение многих лет. Длительность сохранения агглютининов делает возможным использование РА для ретроспективного диагноза.
У привитых против туляремии агглютинины обнаруживаются через 2-3 нед., достигают через 4-6 нед. максимальных титров 1:160-1:320, реже выше, затем снижаются до 1:10-1:40 и обычно выявляются в течение 5-7 лет после вакцинации.
Антигеном для РА служит туляремийный диагностикум, представляющий собой убитую формалином взвесь туляремийных бактерий вакцинного штамма. В 1 мл препарата содержится 25 млрд, туляремийных бактерий. Для постановки РА туляремийный диагностикум предварительно разводят 0,9%-ным раствором хлорида натрия (pH 7,0-7,2) в 5 раз до концентрации 5 млрд, туляремийных бактерий в 1 мл.
Учет результатов РА производят через 18-24 ч невооруженным глазом. Оценку реакции осуществляют на основании степени прозрачности надосадочной жидкости в пробирках, количества и характера осадка микробной массы (агглютината).
Агглютинационный титр сыворотки учитывают по последнему разведению, которое дало вполне четкую реакцию (не менее трех плюсов).
При серологической диагностике туляремии у человека диагностическим считается титр 1:100 и выше, однако обязательно должно быть прослежено его нарастание. При отрицательной или сомнительной реакции, а также при положительной реакции в низких разведениях сыворотки у подозрительных на туляремию больных рекомендуют повторить исследование сыворотки через 7-10 дней. Нарастание титра сыворотки в 2-4 раза и выше свидетельствует о свежем случае туляремии и подтверждает диагноз.
Реакцию агглютинации можно ставить в микрообъемах, используя для этого сыворотку или плазму крови, взятую из пальца руки. Диагностикум для реакции микроагглютинации готовят из убитой культуры вакцинного штамма туляремийного микроба, которую окрашивают гематоксилином. Реакцию микроагглютинации ставят в полистироловых пластинах микротитратора Такачи. Для этого в ряд лунок полистироловой пластины микротитратора Такачи вносят 50 мкл физиологического раствора (pH 7,0-7,2).
Титры реакции микроаттлютинации, как правило, совпадают или на одно разведение ниже титров РА, выполненной макрометодом.
б) Реакция непрямой гемагглютинации (РНГА) является чувствительным методом серологической диагностики и используется как для ранней, так и ретроспективной диагностики, а также для определения иммунологического состояния привитых. У больных туляремией гемагглютинины обычно обнаруживаются в конце первой или на второй неделе заболевания. Через 1—1,5 мес. титры РНГА достигают максимальных показателей (1:10 000-1:20 000, реже выше), после чего снижаются и на уровне 1:100-1:200 сохраняются длительное время.
У привитых антитела также обнаруживаются постоянно, однако, в более низких титрах, не превышающих 1:2000-1:5000 через 1-1,5 мес. после вакцинации, и сохраняются в течение нескольких лет на низком уровне 1:20-1:80. Обычно гемагглютинационный титр сыворотки превышает таковой агглютинационный. Особенно это выражено у больных в острый период болезни или у привитых в короткие сроки после вакцинации. При ретроспективном обследовании переболевших и привитых в отдаленные сроки резких различий в титрах РА и РИГА не отмечается.
Антигеном для постановки РИГА служит туляремийный эритроцитарный диагностикум (антигенный). Препарат представляет собой формал и визированные эритроциты барана, сенсибилизированные туляремийным антигеном; выпускается в жидком и сухом виде. Жидкий препарат — 10% взвесь эритроцитов в 10%-ном растворе формалина. Сухой лиофилизированный препарат — высушенная в вакууме 10% взвесь эритроцитов без консерванта. Перед употреблением его разводят в соответствии с указаниями на этикетке. Для постановки реакции в полистироловых пластинах оба препарата применяют в 2,5%-ной концентрации, а при постановке реакции в микрообъемах — в 0,5%-ной концентрации. Гемагглютинационный титр сыворотки учитывают по последнему ее разведению, которое дало вполне четкую реакцию (не менее трех плюсов).
Диагностическим титром считается разведение 1:100 и выше, однако, так же как и в случае РА, необходимо проследить за его нарастанием.
РНГА при туляремии является достаточно специфичной и обнаруживает некоторые перекрестные реакции только с бруцеллезными сыворотками. Дифференциальная диагностика возможна по высоте титров в РНГА, которые значительно выше с гомологичным антигеном.
РНГА может быть выполнена в микрообъемах при помощи микротитратора типа Такачи, который позволяет осуществлять титрование материала в объемах 25 и 50 мкл. Техника постановки реакций, последовательность всех операций такая же, как и при исследовании в полистироловых пластинах. Следует, однако, иметь ввиду, что чувствительность микрометода обычно на одно разведение (т.е. в 2 раза) ниже, чем макрометода.
Специфичность положительного результата, полученного в РНГА, может быть проверена при помощи трехкомпонентной реакции — реакции торможения пассивной гемагглютинации (РТНГА). Эту реакцию ставят для подтверждения специфичности положительного результата РНГА, когда он вызывает сомнение или представляет особый эпидемиологический интерес. Механизм реакции заключается в специфическом торможении гемагглютинации при добавлении к испытуемой сыворотке взвеси убитых туляремийных бактерий. В реакции взаимодействуют три компонента: испытуемая сыворотка, специфический туляремийный антиген и антигенный эритроцитарный диагностикум.
в) Иммуноферментный анализ на твердом носителе используют для диагностики туляремии у больных и переболевших людей, определения наличия иммунитета у вакцинированных против туляремии. У больных туляремией специфические антитела обнаруживаются в И ФА в промежутке между 6-10-м днями, достигают максимальных показателей к 4-7-й неделе, затем уровень их снижается, но они продолжают выявляться длительное время (более 10 лет после переболевания). ИФА обеспечивает более раннюю (по сравнению с РА и РИГА) и эффективную иммунологическую диагностику. Титры антител у больных и вакцинированных колеблются в значительных пределах от 1:400 до 1:40 000 и выше и, как правило, в 10-20 раз превышают таковые в РА и РНГА.
Для постановки ИФА используют диагностическую тест-систему иммуноферментную для определения туляремийных антител. Выявление туляремийных антител в сыворотках людей происходит за счет специфического взаимодействия антигена возбудителя туляремии, адсорбированного на планшете, с туляремийными антителами в исследуемой сыворотке. Образовавшийся комплекс антиген — антитело определяют при помощи антител против иммуноглобулинов человека, меченных иероксидазой.
В соответствии с назначением тест-система представляет собой набор ингредиентов для проведения иммуноферментного анализа на твердофазном носителе и включает в себя: туляремийный липонолисахарид; антитела против иммуноглобулинов человека, меченных иероксидазой; контрольную положительную сыворотку; контрольную отрицательную сыворотку; набор солей, необходимых для приготовления буферных растворов; субстрат — О-фенилендиамин (ОФД); твин-20; бычий сывороточный альбумин (БСА); планшеты для ИФА однократного применения.
Сыворотки рекомендуется первоначально исследовать параллельно в двух лунках в разведении 1:200 с последующей раститровкой положительных, сывороток, для определения титра антител, используя двукратные разведения. Диагностическим титром в ИФА считают разведение сыворотки 1:400 и выше.
В последние годы для диагностики туляремии разработаны и некоторые другие методы, в частности основанные на использовании синтетических носителей для сенсибилизации антигена, с успехом используемые в отдельных регионах и учреждениях.
г) Непрямой иммунофлуоресцентный метод. Для обнаружения туляремийных антител готовят мазки из 1-2-суточной агаровой культуры возбудителя (взвесь 1 млрд клеток/мл). При этом на одном предметном стекле делают 8 мазков, фиксируют их в этиловом спирте в течение 30 мин, не обжигая высушивают на воздухе и помещают во влажную камеру. Исследуемую сыворотку разводят двукратно до разведений от 1:10 до 1:640-1:1280 и наносят пастеровской пипеткой на мазки, начиная с большего разведения. Влажную камеру с препаратом помещают в термостат при 37°С на 30 мин. Мазок отмывают от несвязавшихся антител и после подсыхания его вновь помещают во влажную камеру, докрашивая антивидовой люминесцирующей сывороткой в рабочем разведении. После просмотра препарата устанавливают титр антител в исследуемой сыворотке.
Контролем служат препараты, в которых туляремийные бактерии обработаны туляремийной сывороткой (положительный контроль) и сывороткой, не содержащей антитела к возбудителю туляремии (отрицательный контроль). При исследовании сыворотки больного с подозрением на туляремию диагностическим считается титр не менее 1:40.
Редактор: Искандер Милевски. Дата публикации: 30.1.2020
· РА с сывороткой крови больного туляремией и туляремийным диагностикумом (демонстрация, диагностический титр 1:100).
· РНГА с сывороткой крови больного туляремией и эритроцитарным туляремийным диагностикумом (демонстрация, диагностический титр 1:1280).
· ИФА с сывороткой крови больного туляремией (демонстрация, диагностический титр 1:100).
3. Специфическая профилактика туляремии: живая вакцина (высушенная живая культура вакцинного штамма туляремии).
Микробиологическая диагностика сибирской язвы
Основным источником инфекции являются больные травоядные животные, от которых человек заражается при непосредственном контакте, алиментарным, аэрогенным или трансмиссивным путями. Чаще всего возникает кожная форма инфекции с образованием характерного сибиреязвенного карбункула в виде уголька (anthrax), реже – кишечная, легочная, септическая формы. Методы микробиологической диагностики сибирской язвы отражены в схеме 6.
Схема 6. Микробиологическая диагностика сибирской язвы
|
|
| |
|
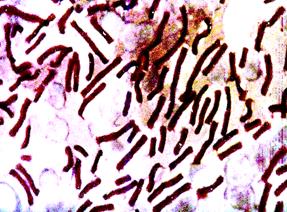
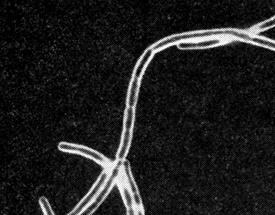
Микроскопический метод.Мазки из исследуемого материала окрашивают по Граму, Романовскому-Гимзе, Ребитеру (капсула), а также люминесцирующей сибиреязвенной сывороткой. Обнаружение в препаратах окруженных капсулой крупных грамположительных бацилл в виде цепочек дает возможность поставить предварительный диагноз сибирской язвы (рис.11 а). В качестве экспресс-метода диагностики применяется РИФ, с помощью которой выявляют характерные сибиреязвенные бациллы в виде палочек со светящимся желто-зеленым ободком (рис. 11 б.).
Капсулообразование можно выявить путем биопробы или при посевах в бульон Хоттингера, на специальную среду, содержащую раствор Хенкса и 40 % стерильной сыворотки крупного рогатого скота, МПА с 0,7 % бикарбоната натрия, среду Буза (3%голодный агар с 15% дефибринированной крови барана), а также в дефибринированную лошадиную кровь. Посевы выращивают в течение 18-24 часов при температуре 37 0 С в атмосфере 5-7% СО2.
А б
Рис. 11. Возбудитель сибирской язвы(Bacillus anthracis). а - окраска по Граму, б – РИФ. х630
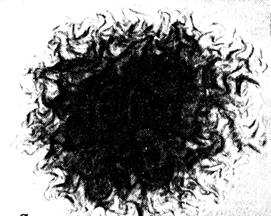
Рис. 12. Колония Bacillus anthracis. х56
Идентификацию выделенной культуры Bacillus anthracis (3-й день исследования) и ее дифференциацию от сходных непатогенных бацилл проводят путем посева уколом в желатину (разжижение в виде елочки, перевернутой вершиной вниз), изучения биохимических свойств, фаголизабельности и заражения животных. Определяют также чувствительность культуры к антибиотикам.
Биологические свойства возбудителя сибирской язвы и сходных с ним бацилл отражены в табл. 7.
Наличие сибиреязвенного антигенав разложившемся трупе животного, коже (свежей, сухой, выделанной) и изделиях из нее, шкурках, мехе, шерсти определяют с помощью реакциитермопреципитациипо Асколи.Исследуемый материал измельчают, заливают 10 —20-кратным объемом физиологического раствора, кипятят в течение 10-45 мин., после чего фильтруют. Полученный экстракт осторожно наслаивают на преципитирующую сибиреязвенную сыворотку в узкой преципитационной пробирке. На границе экстракта и преципитирующей сыворотки в течение 1- 5 мин в случае положительной реакции появляется кольцо белого цвета (преципитат). Контроли включают постановку реакций с заведомо положительной и отрицательной сывороткой, нормальной сывороткой и т.д.
Биопроба.Исследуемымматериалом подкожно заражают двух белых мышей., которые погибают через 24-48 ч после заражения. В мазках из внутренних органов и крови обнаруживают типичные капсульные бациллы. Проводится бактериологическое исследование трупа белой мыши с целью выделения чистой культуры сибиреязвенных бацилл.
Таблица 7. Дифференциально-диагностические признаки сибиреязвенной и других бацилл
| Признак | Вид микроорганизмов | |||||
| Bacillus anthracis | Bacillus cereus | Bacillus mycoides | Bacillus thuringiensis | Bacillus subtilis | Bacillus Megaterium | |
| Капсула | + | - | - | - | - | - |
| Подвижность | - | + | - | + | + | + |
| Гемолиз | - | + | - | + | - | + |
| Рост в анаэробных условиях | + | + | + | + | - | - |
| Лецитиназа | + | + | + | + | - | - |
| Аргининдегидролаза | - | V | V | + | - | - |
| Нитpaтpeдyктaзa | + | + | + | + | + | - |
| Патогенность для мышей | + | - | - | - | - | - |
| Ферментация до кислоты: | ||||||
| глицерина | - | V | + | + | + | + |
| маннита | - | - | - | - | + | + |
| салицина | - | V | + | + | + | + |
Серологический методвыполняетсяв тех случаях, когда не удается обнаружить возбудителя в материале. Для определения антител в сыворотке крови больного используют реакции латекс-агглютинации и РНГА с протективным сибиреязвенным антигеном.
Аллергический метод – постановка внутрикожной аллергической пробы с аллергеном сибиреязвенной бациллы - антраксином. Результаты учитывают через 24 ч. Пробу считают положительной при наличии гиперемии и инфильтрата диаметром более 15 мм.
Самостоятельная работа студентов
1. Микроскопия демонстрационных микропрепаратов возбудителя сибирской язвы (Bacillus anthracis, окраска по Граму). Бациллы сибирской язвы - крупные спорообразующие, капсульные грамположительные палочки, располагающиеся цепочками, напоминая бамбуковую палку.
Для оценки загрязненности сырья (шерсть, шкуры животных) возбудителем сибирской язвы используется реакция кольцепреципатации по Асколи. Поставить реакцию по Асколи. Ингредиенты: преципитирующая сибиреязвенная сыворотка, термостабильный антиген из исследуемого материала, физиологический раствор. Схема постановки реакции Асколи: в препиптационную пробирку наливают 0,5 мл преципитирующей сыворотки, пастеровской пипеткой сверху осторожно наслаивают антиген. В положительном случае на границе сыворотки и антигена появляется преципитат в виде кольца. В контрольную пробирку вместо антигена вносят физиологический раствор.
3. Серологическая диагностика сибирской язвы. Учесть реакцию непрямой гемагглютинации с сывороткой крови больного и эритроцитарным сибиреязвенным диагностикумом.
4. Аллергический метод диагностики сибирской язвы. Для постановки кожной аллергической пробы у больных сибирской язвой используется сибиреязвенный аллерген - антраксин (белково-полисахаридно-нуклеиновый комплекс, полученный при гидролизебацилл сибирской язвы).
5. Специфическая профилактика сибирской язвы:живая вакцина СТИ (высушенная взвесь живых спор вакцинного штамма - варианта сибиреязвенных бацилл, названа в честь Санитарно-технического института, в котором она была разработана).
6. Специфическое лечение сибирской язвы: противосибиреязвенныйиммуноглобулин (гамма-глобулиновая фракция сыворотки крови лошадей, гипериммунизированных живой вакциной и вирулентным штаммом В.anthracis).
После изучения темы студент должен знать:таксономию, морфологические и биологические свойства возбудителей основных бактериальных зоонозных инфекций (чумы, туляремии, сибирской язвы), а также патогенез, эпидемиологию, основные клинические проявления и иммунитет; основные методы диагностики, специфической профилактики и лечения этих инфекций.
Изучив тему, студент должен уметь:уметь ставить серологические реакции при туляремии, трактовать результаты микробиологических анализов при чуме,туляремии, сибирской язве.
Педиатрические аспекты темы
1. Дети в возрасте от 1 до 2 лет прививаются противочумной вакциной только при неблагоприятной эпидемической ситуации, при этом дети до 7 лет прививаются накожно, а с 7 лет - накожно и подкожно.
2. В неблагополучной по туляремии местности прививкам живой вакциной подвергают все население с 7-летнего возраста. По эпидемическим показаниям вакцинируют детей старше 2 лет.
Тема 4. ВОЗБУДИТЕЛИ БАКТЕРИАЛЬНЫХ ЗООНОЗНЫХ ИНФЕКЦИЙ: БРУЦЕЛЛЕЗА, ЛЕПТОСПИРОЗА, БОРРЕЛИОЗОВ, ЛИСТЕРИОЗА
Цель занятия:изучение биологических свойств возбудителей бактериальных зоонозных инфекций - бруцеллеза, лептоспироза, клещевого боррелиоза, листериоза и методов их лабораторной диагностики, профилактики и лечения.
Последнее изменение этой страницы: 2016-04-23; Нарушение авторского права страницы
Таксономия: отдел Gracilicutes, род Francisella. Возбудитель – Francisella tularensis.
Морфология: мелкие кокковидные полиморфные палочки, неподвижные, грамотрицательные, не образующие спор, могут образовывать капсулу.
Культуральные свойства: Факультативный аэроб, оптим. температура+37С. На простые питательных средах не растет. Культивируется на желточных средах, на средах с добавлением крови и цистеина. Рост медленный. Образуют мелкие колонии, круглые с ровным краем, выпуклые, блестящие.
Биохимические свойства: слабо ферментируют до кислоты без газа глюкозу, мальтозу, левулезу, маннозу, образуют сероводород. Туляремийный микроб по вирулентности разделен на подвиды: голарктическую (не ферментирует глицерин, цитруллин), неарктическую (ферментирует глицерин, не ферментирует цитруллин; среднеазиатскую (ферментирует глицерин и цитруллин, мало вирулентен).
Антигенные свойства: Содержит соматический О-и поверхностный Vi- антигены. Имеют антигенную близость с бруцеллами. В R- форме теряют Vi- антиген, а вместе с ним вирулентность и иммуногенность.
Факторы патогенности: неарктический подвид – высокая патогенность для человека при кожном заражении, голарктический и среднеазиатский подвиды – умеренно патогенны. Вирулентными являются S-формы колоний. Патогенные свойства связаны с оболоченным антигенным комплексом и токсическими веществами типа эндотоксина. Вирулентность обусловлена:капсулой, угнетающей фагоцитоз; нейраминидазой, способствующей адгезии; эндотоксином (интоксикация); аллергенными свойствами клеточной стенки;
Эпидемиология: природно-очаговое заболевание. Источник инфекции – грызуны. Множественность механизмов передачи. Передача возбудителя через клещей, комаров. Человек заражается контактным, алиментарным, трансмиссивными путями.
Резистентность: в окружающей среде сохраняется долго, нестоек к высокой температуре, чувствителен к антибиотикам (тетрациклин, левомицетин).
Патогенез: На месте внедрения возбудителя (кожа, слизистые оболочки глаз, дыхательных путей, желудочно-кишечного тракта) развивается первичный воспалительный очаг, откуда возбудитель распространяется по лимфатическим сосудам и узлам, поражая их с образованием первичных бубонов; в различных органах формируются гранулемы. Микроб и его токсины проникают в кровь, что приводит к бактериемии и генерализации процесса, метастазированию и развитию вторичных туляремийных бубонов.
Клиника. Инкубационный период 3—7 дней. Болезнь начинается остро, внезапно с повышения температуры тела. Различают бубонную, язвенно-бубонную, глазо-бубонную, абдоминальную, легочную и генерализованную(септическую) клинические формы туляремии.
Иммунитет. После перенесенной инфекции иммунитет сохраняется длительно, иногда пожизненно; развивается аллергизация организма к антигенам возбудителя.
Микробиологическая диагностика:
Бактериоскопическое исследование:Из исследуемого материала готовят мазки, окрашивают по Грамму. В чистой культуре - мелкие кокки. В мазках из органов преобладают палочковидные формы. Спор не образуют, грамотрицательные, иногда выражена биполярная окраска.
Бактериологическое исследование и биопроба.Применяются для выделения чистой культуры бактерий туляремии. Наиболее чувствительными животными являются мыши и морские свинки, которые погибают даже при подкожном введении единичных бактерий. Выделение бактерий туляремии проводят на свернутой яично-желточной среде, глюкозоцистиновом кровяном агаре. Вирулентные штаммы образуют S-формы колоний — мелкие, гладкие, беловатого цвета с голубоватым оттенком.
Идентификацию чистой культуры проводят по морфологии бактериальных клеток, характеру роста, биохимическим и антигенным свойствам. Биохимические свойства этих бактерий выявляются на специальной плотной среде с ограниченным содержанием белка. Бактерии туляремии содержат оболочечный антиген, с которым связаны их вирулентные и иммуногенные свойства, и О-соматический антиген. По антигенным свойствам близки к бруцеллам.
Серодиагностика.Ставится реакция агглютинации с туляремийным диагностикумом. Относительно позднее появление агглютининов в крови (на 2-й неделе болезни) затрудняет применение этой реакции для ранней диагностики, однако их длительное сохранение делает возможной ретроспективную диагностику. Обязательно прослеживается нарастание титра агглютинации. Наиболее чувствительным методом серодиагностики туляремии является РПГА.
Для экспресс-диагностики применяется кровяно-капельная реакция: кровь из пальца наносят на стекло, добавляют каплю дистиллированной воды (для лизиса эритроцитов), вносят каплю диагностикума и смешивают стеклянной палочкой. При наличии в крови агглютининов в диагностическом титре (1:100 и выше) в капле немедленно наступает агглютинация диагностикума; при титрах ниже диагностических агглютинация происходит через 2—3 мин.
Кожно-аллергическая проба.Выпускаются два вида тулярина: для внутрикожной пробы и для надкожной. Проба высокочувствительна и дает положительные результаты у больных, начиная с 3—5-го дня болезни, но также и у переболевших и вакцинированных, поэтому оценка реакции должна проводиться с осторожностью.
Лечение: антибиотики стрептомицинового и тетрациклинового ряда. В случае затяжного течения – комбинированная антибиотикотерапия с использованием убитой лечебной сыворотки.
Профилактика: специфическая профилактика - применяют живую туляремийную вакцину. Иммунитет длительный, проверяется с помощью пробы с тулярином.
Туляремийный диагностикум –взвесь убитых бактерий туляремии, применяется в случае постановки реакции агглютинации при серодиагностике.
Тулярин– взвесь туляремийных бактерий (вакцинного штамма), убитых нагреванием, для постановки кожно-аллергической пробы.
Туляремийная живая сухая накожная вакцина –высушенная живая культура вакцинного штамма, для профилактики.
Читайте также:


