Чем забирают материал из зева при легочной форме чумы
↑ Забор материала. Микроскопическое исследование
Чума является чрезвычайно контагиозной, поэтому взятие материала от больного (особенно легочной формы) производится с соблюдением мер предосторожности. Работа в очаге проводится в полном противочумном костюме. В лабораторию могут быть доставлены следующие материалы:
- содержимое бубона (легочная форма чумы);
- отделяемые язвы или пунктет из карбункула (кожная форма чумы);
- материал из зева, взятый тампоном и мокрота (легочная форма чумы);
- секционный материал (кусочки органов трупа, кровь);
- живые грызуны;
- трупы грызунов;
- блохи грызунов;
- вода;
- пищевые продукты.
Материал необходимо брать до назначения лечения. Значение микробиологического диагноза огромно, особенно для выявления первых случаев чумы. Предварительный диагноз устанавливают на основании микроскопического исследования материала, окончательный - на основании выделения и идентификации культуры.
Микроскопическое исследование - мазки фиксируют погружением полностью в жидкость Инпифорова на 20 мин. Окраска по Граму обязательна во всех случаях. Одновременно окрашивают мазок метиленовым синим Лефлера, так как этот метод лучше выявляет биполярность.
Бактериологическое исследование - посевы исследуемого материала производят на агар добавлением стимуляторов роста (кровь, сульфит натрия). При исследовании материала, обильно загрязненного посторонней микрофлорой (загнившие трупы, мокрота) к агару добавляют генциановый фиолетовый 1 : 100 000. В случаях подозрения на наличие бактериофага посевы обрабатывают антифаговой сывороткой. Инкубацию посевов проводят при 28 °С. В положительных случаях через 12 ч появляются колонии в виде характерных "кружевных платочков".
Когда чистая культура выделена путем прямого посева она подлежит идентификации на основании следующих данных:
- внешний вид колонии на агаре;
- характерный рост на бульоне;
- типичная морфология микробов в мазках и отрицательная окраска по Граму;
- типичная патологоанатомическая у лабораторных животных при заражении их чистой культурой;
- агглютинация со специфической сывороткой;
- отношение к специфическому бактериофагу.
Исследование ферментативных свойств, подвижности и т. п., производят лишь в специальных случаях для дифференциального диагноза с родственными видами бактерий. Проба с фагом осуществляется на твердых средах путем нанесения капли фага на свежий посев культуры и на жидких путем добавления в бульонную культуру фага в количестве 1/10 объема культуры. Окончательное заключение делают на основании изучения комплекса признаков исследуемой культуры. При этом не следует забывать явлении изменчивости.
Биологическая проба обязательна при исследовании; наиболее чувствительными из лабораторных животных являются морские свинки и белые мыши. Для постановки биологической пробы животных заражают внутрибрюшинно, подкожно или внутрикожно, а в случае загрязнения материала посторонней микрофлорой - втиранием в скарифицированную кожу.
В зависимости от способа заражения и степени чувствительности к возбудителю животные погибают от чумы на 3-9-й день после инфицирования изменения во внутренних органах в виде геморрагического воспаления, кровоизлияния: в мазках-отпечатках из органов - множество чумных микроорганизмов; посевы инфицированных органов и крови дают обильный рост возбудителя.
Ускоренные методы бактериологического исследования. Метод ускоренного обнаружения возбудителя чумы с помощью бактериофага, внесенного в исследуемый материал, используют для исследования объектов, имеющих основное практическое значение: материал от больного, от трупа, из внешней среды.
Исследуемый материал наносят на 3 агаровые пластины с гемолизированной кровью и генциановым фиолетовым. На первой и второй агаровой пластине в исследуемый материал сразу же вносят чумной бактериофаг (разведенный в 10 раз). На третью чашку бактериофаг не добавляют (контроль).
Результаты начинают читать через 2,5 -- 3 ч после помещения их в термостат. При наличии значительного количества микробов чумы в исследуемом материале уже через 2 ч на фоне начального роста чумного микроба видны мелкие палочки бактериофага. Метод ускоренной диагностики чумы основан на свойстве чумного бактериофага быстро (30-40 мин) размножаться в присутствии микроба чумы.
Большого внимания заслуживает люминесцентно-серологическй метод, с помощью которого можно обнаружить возбудитель чумы в воздухе, воде, пищевых продуктах. Реакция нарастания титра фага (в качестве индикаторного фага предложен чумной бактериофаг, выпускаемый институтом "Микроб" в качестве эталонной культуры). Применение реакции нарастания титра фага для индикации чумных микробов основано на экспериментальном исследовании; пользуясь реакцией нарастания титра фага, за 3-31/2 ч удается обнаружить 1 млн. палочек чумы.
В качестве исследуемого материала могут быть использованы вода, кровь, отпечатки из органов, выделения из бубона. Материал сначала подращивают на средах, затем прибавляют генциан фиолетовый (1 мл 0,1 %-ный водно-спиртовой раствор на 100 мл среды), для подавления посторонней микрофлоры, а затем добавляют в пробирки разные концентрации фага.
↑ Лабораторная диагностика чумы
Серологические реакции в практике нашли широкое применение. Они используются при подозрительных на чуму заболеваниях для ретроспективного диагноза, при обследования природных источников чумы. С этой целью применяют иммуноферментную агглютинацию, реакцию пассивной гемагглютинации, реакции непрямой агглютинации. Экспресс-методом является люминесцентно-серологический, позволяющий обнаружить возбудителя в исследуемом материале через 2 ч.
1. Правила забора материала от больного с подозрением на легочную форму чумы (Санитарные правила 3.4./4.2.19-30-2005 «Профилактика заболевания людей чумой.
4.Классификация медотходов (Санитарные правила и нормы 2.1.7.14-20-2005
5.Меры безопасности при работе с дезинфицирующими средствами (приказ МЗ РБ
__________________________________________________________________________
1.Исследованию подлежит: при легочной - мокрота, при ее отсутствии - мазок из
зева, кровь из вены, моча. Мокроту собирают в широкогорлые банки с притертой пробкой. Слизь из зева берут стерильным ватным тампоном по общепринятой методике. Кровь забирают из локтевой вены в количестве 10 мл.
2.Азопирамовая проба.
1.Приготовление исходного раствора. Для приготовления 1 л раствора азопирама отвешивают 100 г амидопирина и 1,0-1,5 г солянокислого анилина, смешивают их в сухой мерной посуде и доводят до объема 1 л (дм 3 ) 95% этиловым спиртом. Смесь тщательно перемешивают до полного растворения ингредиентов.
Исходный раствор азопирама следует хранить в плотно закрытом флаконе в темноте. Допустимый срок хранения при температуре 4"С (в холодильнике) - 2 месяца; при комнатной температуре (20±2°С) - не более 1 месяца.
2.Приготовление реактива азопирам. Перед постановкой пробы готовят реактив азопирам, смешивая равные объемные количества исходного раствора азопирама и 3% раствора перекиси водорода. Реактив азопирам хранить не более 2 часов. При температуре выше +25°С раствор розовеет быстрее, поэтому его необходимо использовать в течение 30-40 мин.
Методика постановки пробы: наносят 2-3 капли реактива на изделие с помощью пипетки.
Качество очистки катетеров и других полых изделий оценивают путем введения реактива внутрь изделия с помощью чистого шприца или пипетки. Реактив оставляют внутри изделия на 1 мин, после чего сливают на марлевую салфетку. Количество реактива, вносимого внутрь изделия, зависит от его величины
При положительной азопирамовой пробе в присутствии следов крови немедленно или не позднее, чем через 1 мин появляется вначале фиолетовое, затем быстро, в течение нескольких секунд, переходящее в розово-сиреневое или буроватое окрашивание реактива.
Азопирам, кроме гемоглобина, выявляет наличие на изделиях остаточных количеств:
пероксидаз растительного происхождения; окислителей (хлорамина, стирального порошка с отбеливателем и др.); - ржавчины (окислов и солей железа). При наличии на исследуемых изделиях ржавчины и указанных окислителей наблюдается бурое окрашивание реактива, в остальных случаях происходит окрашивание в розово-сиреневый цвет.
При постановке азопирамовой пробы окрашивание реактива, наступившее позже, чем через 1 мин после постановки пробы, не учитывается.
3. Питание в больничных организациях здравоохранения должно соответствовать следующим требованиям:
при составлении меню-раскладок должны учитываться основные принципы составления меню диет; должно быть разнообразным;
должно соответствовать утвержденным нормам среднесуточного набора продуктов питания для одного пациента;
должно соответствовать лечебным показаниям по химическому составу, пищевой ценности, набору продуктов, режиму питания.
Ежедневно на кухне должен осуществляться отбор суточных проб каждого приготовленного блюда.
Отбор суточных проб приготовленных блюд должен проводиться ответственным лицом (заведующий производством, шеф-повар) в продезинфицированные емкости с крышками. Каждое приготовленное блюдо должно отбираться в отдельную емкость объемом 200 – 250 миллилитров. Супы, напитки (сладкие блюда), гарниры (каши, творожное, яичное блюда) отбирают в объеме не менее 100 миллилитров, мясные, рыбные блюда, холодные закуски (салаты) – в объеме не менее 70 – 100 граммов. Допускается не отбирать суточные пробы приготовленных блюд от партии менее 30 порций. Суточные пробы приготовленных блюд могут отбираться в уменьшенном объеме, но не менее чем 50 граммов, если это предусмотрено выходом блюда.
Суточные пробы приготовленных блюд должны храниться в холодильнике для готовой продукции в течение 24 часов при температуре +2 о – +6 о С.
По истечении срока хранения суточные пробы приготовленных блюд должны утилизироваться, емкости должны тщательно мыться с применением моющих средств и дезинфицироваться.
Выдача готовой пищи должна осуществляться после снятия пробы.
Оценку органолептических показателей и качества блюд должна проводить бракеражная комиссия, назначенная администрацией больничной организации здравоохранения.
При неудовлетворительных результатах бракеража блюдо к выдаче не допускается.
Транспортировка готовой пищи в буфетные помещения отделений должна производиться в условиях, исключающих ее загрязнение, с соблюдением температурного режима.
Хлеб должен транспортироваться в условиях, исключающих его загрязнение.
Доставка пищи к палатам должна проводиться с использованием специально выделенных тележек.
При хранении пищевых продуктов в холодильниках отделения и тумбочках пациентов должны соблюдаться правила и сроки годности (хранения) пищевых продуктов. Хранение пищевых продуктов с истекшим сроком годности (хранения), без указания фамилии пациента при хранении в общем холодильнике отделения, а также имеющих признаки порчи запрещается.
4. разделяются на четыре группы:
Группа А - неопасные отходы (коммунальные).
А1 - вторичные материальные ресурсы;
А2 - органические отходы;
АЗ - другие неопасные отходы.
Группа Б - медицинские отходы, требующие особого внимания.
Б1 – анатомические отходы;
Б2 - острые предметы;
БЗ - фармацевтические отходы (кроме цитостатических фармацевтических препаратов);
Б4 - отходы, загрязненные кровью или биологическими жидкостями не инфицирующими;
Б5 – инфицирующие отходы;
Б6 - цитостатические фармацевтические препараты.
Группа В - чрезвычайно инфицирующие отходы.
Группа Г - другие опасные отходы, подобные отходам производства.
5.. К работе с дезсредствами допускаются лица не моложе 18 лет, не имеющие противопоказании к работе с ними по результатам предварительного медицинского обследования и прошедшие вводный и первичный инструктаж на рабочем месте по безопасным приемам и методам работы с препаратами. К работе не допускаются беременные и кормящие женщины.
Вводный инструктаж, первичный и периодический на рабочем месте по безопасным приемам и методам работы, применению СИЗ, мерам профилактики отравлений при работе со средствами дезинфекции и стерилизации, а также ТБ при работе с дезинфекционной и стерилизационной аппаратурой фиксируется в журналах установленной формы. Подписи инструктируемого и инструктирующего в журнале обязательны. Инструктаж на рабочем месте завершается устным опросом и проверкой приобретенных навыков безопасных способов работы.
Все работающие обеспечиваются нанимателем санитарной одеждой, а также мылом, полотенцами и средствами для смягчения кожи. Все виды работ, связанные с дезсредствами, проводятся обязательно в спецодежде и с использованием СИЗ, а также соблюдением мер предосторожности. Все дезсредства хранятся в специально отведенном, хорошо вентилируемом помещении, запирающемся на замок, в плотно укупоренной таре с обозначением наименования дезинфектанта, сроков его изготовления и годности. На каждый препарат необходимо иметь инструкцию по применению.
Для лабораторной диагностики чумы используют бактериоскопический, бактериологический, биологический, серологические и молекулярно-генетические методы.
Диагноз чумы у человека ставится на основании выявления у него возбудителя – выделение и идентификация культуры, обнаружения специфического для чумного микроба антигена FI и специфических антител к антигену FI в сыворотках больных и переболевших.
В качестве экспресс-методов используют иммунофлюоресцентный анализ (обнаружение микроба с помощью флюоресцирующих иммуноглобулинов), ПЦР (обнаружение микроба по наличию искомого участка ДНК в результате его многократного копирования), иммуносуспензионные методы – система 2-3 компонентных реакций с эритроцитарными диагностикумами или иммуноферментный анализ для обнаружения специфических антигенов чумного микроба. С этой же целью применяют и другие варианты иммуносуспензионных методов: дот-иммуноферментный анализ, радиоиммунный анализ. Все экспресс-методы выполняют после обеззараживания материала.
Обязательному лабораторному исследованию подлежит материал:
- от больных людей с симптомами болезни, сходными с клиническими проявлениями всех форм чумы;
- лиц, контактировавших с больными легочной чумой;
- лиц, участвовавших (без защитной одежды) во вскрытии трупов людей и верблюдов, погибших от чумы;
- лиц, участвовавших в прирезке и разделке туши больного чумой верблюда и других животных, обработке мяса в процессе приготовления пищи, употреблявших в пищу мясо больных чумой животных;
- лиц, совершивших аварию с разбрызгиванием заразного материала при работе с возбудителем чумы.
Материал от больных, как правило, целесообразно брать сразу при поступлении в лечебное учреждение и спустя 3 дня после окончания специфического лечения антибиотиками с интервалами между очередными исследованиями 24 ч до получения трех отрицательных результатов. Материал от лиц, контактировавших с больными или контаминированными объектами – при поступлении в изолятор и по окончании профилактического лечения, перед выпиской.
Исследованию подлежит: при легочной форме чумы – мокрота, при её отсутствии – мазок из зева, кровь из вены, моча; при септической форме – кровь, моча; при бубонной форме – пунктат бубона, кровь, моча; при кожной форме – отделяемое язвы, кровь, моча; при кишечной форме – кал, кровь, моча; при менингиальных явлениях – спинномозговая жидкость.
У лиц, контактировавших с больным легочной формой чумы, а также в других случаях, если есть подозрение, что заражение произошло аэрогенным путем, исследуют мазок из зева. В остальных случаях у контактных исследования не проводят.
Забор материала на исследование у больных с подозрением на чуму следует, как правило, проводить в условиях стационара до начала специфического лечения обученным квалифицированным медицинским персоналом под наблюдением специалиста противочумного учреждения или специалиста по особо опасным инфекциям ЦГиЭ субъекта Российской Федерации. В случае невозможности забрать материал в первые 2 ч после возникновения подозрения, лечение начинают по клиническим показаниям до забора материала.
Забор материала у лиц, контактировавших с больными чумой и совершивших аварию, производят в изоляторе до начала профилактического лечения.
Исследование материала проводят специалисты территориальных противочумных учреждений на своей базе, а также на базе лабораторий отделов особо опасных инфекций ФГУЗ ЦГиЭ субъекта Российской Федерации, если они соответствуют требованиям действующих "Санитарных правил безопасности работы с микроорганизмами I-II групп патогенности". Специалисты отделов особо опасных инфекций проводят исследование обеззараженного материала экспресс-методами. Ведущим методом является люминесцентно-серологический. Определение антигена у больного возможно только при осложненной клинике в спинномозговой жидкости, в пунктате бубона – при тяжелом течении болезни, в моче – при всех формах болезни, начиная с 3-4 дня заболевания в низких титрах.
Методы забора материала – в приложении 8.
Запрещается давать окончательный (отрицательный или положительный) ответ на основании результатов экспресс-методов.
Исследование материала от больного чумой.
- приготовление мазков, окраска фиксированных мазков анилиновыми красителями, чумными флюоресцирующими иммуноглобулинами;
- полимеразная цепная реакция;
- посев на жидкие и плотные питательные среды со стимуляторами роста чумного микроба (кровь, моча, спинномозговая жидкость, пунктат бубона);
- посев на плотные питательные среды со стимулятором роста чумного микроба и ингибиторами посторонней флоры (мокрота, мазок из зева, субстрат из вскрывшегося бубона, отделяемое язвы, моча, испражнения);
- проба с диагностическими бактериофагами нативного материала на соответствующей плотной среде;
- проба на чувствительность к антибиотикам с нативным материалом на плотной среде методом дисков;
- поиск антигена FI иммуносуспензионными методами: реакция непрямой гемагглютинации, реакция нейтрализации антител, иммуноферментный анализ, дот-иммуноферментный анализ, радиоиммунный анализ (моча, спинномозговая жидкость, пунктат бубона); параллельно в качестве контроля ставят те же реакции с диагностикумами на другие инфекции (туляремия, бруцеллёз, холера и др.);
- заражение лабораторных животных (морские свинки, белые мыши) внутрибрюшинно и подкожно (кровь, пунктат бубона, спинномозговая жидкость), подкожно и накожно (мокрота, мазок из зева, вскрывшийся бубон, отделяемое язвы, моча, испражнения).
II этап (2-5 ч от начала исследования):
- выдача предварительного положительного ответа на основании наличия в мазках биополярно окрашенных грамотрицательных овоидных палочек, их специфического свечения при окраске мазка флюоресцирующими чумными иммуноглобулинами, положительной ПЦР, положительных иммуносуспензионных реакций при отрицательных контролях.
III этап (24-48 ч):
- выдача подтверждения предварительного положительного ответа на основании наличия характерного роста на жидких и плотных питательных средах, наличия в мазках из этих сред грамотрицательных овоидных палочек с биполярным окрашиванием, положительной пробой с бактериофагами (лизис культуры чумными бактериофагами Покровской и Л-413С).
Высев культуры для дальнейшей идентификации на питательный агар и агар с содержанием дефибринированной крови (5 %) для определения продукции FI после инкубации при 37° С. Одновременно выдача предварительного ответа о чувствительности выделенной культуры к антибиотикам. Посев культуры на среды Гисса с рамнозой, глицерином, сахарозой, арабинозой, ЦДС или среду Ленской для определения уреазной активности (после накопления чистой культуры).
IV этап (3-7-е сутки):
- выдача окончательного положительного ответа на основании выделения чистой культуры чумного микроба из посевов нативного материала, его идентификации по морфологическим, культуральным, биохимическим признакам, чувствительности к диагностическим бактериофагам, наличию специфических плазмид, а также на основании подтверждения диагноза выделением идентичных культур от павших или забитых лабораторных животных.
V этап (5-8-е сутки):
- выдача отрицательного ответа на основании отсутствия специфического роста на питательных средах при посеве нативного материала и органов забитых биопробных животных, отрицательной ПЦР, отрицательных иммуносуспензионных реакций с нативным материалом и органами забитых или павших биологических проб, отсутствия патологоанатомических изменений у последних, отсутствия в парных сыворотках больного специфических антител к чумному микробу.
Исследование материала от лиц, контактировавших с больными легочной формой чумы, а также лиц, присутствовавших при аварии с разбрызгиванием заразного материала.
Исследуемый материал – мазок из зева.
- приготовление мазков, окраска анилиновыми красителями, флюоресцирующими чумными иммуноглобулинами;
- полимеразная цепная реакция;
- посев на плотные селективные среды;
- заражение лабораторных животных подкожно и накожно.
- выдача предварительного положительного ответа на основании обнаружения специфически светящихся клеток в люминесцентном микроскопе, положительной ПЦР.
- выдача подтверждения предварительного положительного ответа на основании наличия характерных по морфологии колоний в посевах на плотной среде;
- пересев колоний на питательный слабощелочной агар, на селективный агар и на агар с кровью для дальнейшей идентификации (последний посев ставят в термостат с 37° С для последующего определения F1);
- при достаточном количестве колоний постановка пробы на чувствительность с диагностическими бактериофагами на плотной среде и пробы на чувствительность к антибиотикам методом дисков.
IV этап (3-4-е сутки):
- выдача положительного ответа на основании выделения типичной по морфологии культуры, лизирующейся диагностическими бактериофагами;
- положительных иммуносуспензионных реакций на наличие антигена F1;
- дальнейшая идентификация выделенной культуры.
V этап (5-8-е сутки):
- вскрытие забитых биопроб, их исследование бактериологически и серологически;
- выдача окончательного положительного ответа на основании выделения и идентификации культуры чумного микроба, типичной по морфологическим, культуральным, биохимическим свойствам, фаголизабельности, наличию специфических плазмид, подтверждения диагноза выделением идентичной культуры от павших или забитых биопробных животных (схема идентификации выделенных культур – в приложении 9;
- выдача отрицательного ответа на основании отсутствия специфически светящихся клеток в мазках, окрашенных люминесцирующими чумными иммуноглобулинами, отрицательной ПЦР, отсутствия роста характерных по морфологии колоний на плотной среде, отсутствия характерных для чумы изменений в органах у биопробных животных и отсутствия специфического роста на плотной среде из посевов отпечатков их органов.
Исследование материала от трупа человека, погибшего от чумы.
Исследованию подлежат: кусочки паренхиматозных органов, легких из мест, где есть характерные для чумы изменения, лимфатические узлы, как регионарные к первичному аффекту, так и другие, увеличенные и имеющие изменения, сгустки крови из сердца и крупных сосудов, сыворотка крови, полученная из сгустков при их сокращении, участки любой ткани, имеющие изменения септического характера, спинномозговая жидкость, моча, содержимое кишечника, в случае наличия признаков загнивания трупа исследуют спинной и головной мозг.
Исследования ведут по этапам, как исследование материала от больного чумой человека.
Положительный предварительный диагноз может быть поставлен на любом этапе, так как при гибели от чумы все органы и ткани содержат большое количество возбудителя и его антигенов, в том числе FI. Поэтому весьма вероятен первый положительный ответ уже через 2 ч после исследования на основании наличия грамотрицательных биполярно окрашенных палочек, специфически светящихся в люминесцентном микроскопе при обработке мазков-отпечатков флюоресцирующим чумным иммуноглобулином, положительной ПЦР, высокого титра антигена FI в тканях и органах, наличия противочумных антител в сыворотке.
Высокая вероятность подтверждения диагноза через 24-48 ч после начала исследования на основании обнаружения типичных по морфологии колоний чумного микроба, положительной пробы с бактериофагом, которую следует ставить на селективном агаре во избежании зарастания пятна лизиса культуры посторонней флорой и отрицательного ответа в 2-5 часов исследований
Окончательный положительный ответ может быть поставлен через 48 ч – 6 сут. по результатам идентификации культуры чумного микроба и подтверждения ее выделением идентичной культуры от биопробного животного.
Окончательный отрицательный диагноз дают на 5-8 сутки, как и при исследовании материала от больного.
Запрещается выдавать отрицательный ответ по результатам ускоренного исследования и на основании результатов экспресс-методов.
Дата добавления: 2015-09-15 ; просмотров: 3836 . Нарушение авторских прав
ВНИМАНИЕ! САЙТ ЛЕКЦИИ.ОРГ проводит недельный опрос. ПРИМИТЕ УЧАСТИЕ. ВСЕГО 1 МИНУТА.
Микробиологическая диагностика чумы и туляремии
Перечень бактериологических лабораторий, проводящих исследования с особо опасными возбудителями заболеваний
1. Лаборатория отдела особо опасных инфекций центра ГосСанЭпидНадзора СПб. (Санкт-Петербург, Лиговский пр., 29)
2. Лаборатория особо опасных и вирусологических исследований (СПб, ул. Оборонная, д.35, лит.А).
3. Лаборатория особо опасных инфекций центр Гигиены и Эпидемиологии в Ленинградской области (Санкт-Петербург, ул. Ольминского, 27)
Перечень субъектов Российской Федерации, граничащих со странами,
на территории которых имеются активные природные очаги чумы – Республика Казахстан, Китайская Народная Республика, Монголия
| Субъект Российской Федерации | Страна, из которой существует угроза заноса чумы |
| Алтайский край Астраханская область Волгоградская область Курганская область Новосибирская область Омская область Оренбургская область Республика Алтай Самарская область Саратовская область Тюменская область Челябинская область | Республика Казахстан |
| Забайкальский край Республика Алтай Республика Бурятия Республика Тыва | Монголия |
| Амурская область Еврейская автономная область Забайкальский край Приморский край Хабаровский край | Китайская Народная Республика |
Правила взятия материала от больного с подозрением на чуму
Пунктат из бубона (везикул, пустул, карбункулов) берут шприцем емкостью не менее 5 мл. Кожу на участке, намеченном для прокола, обрабатывают 70 0 -ным спиртом, а затем смазывают 5%-ным раствором йода и вновь протирают 70 0 -ным спиртом. Иглу вводят с таким расчетом, чтобы ее острие достигло центральной части бубона, после чего, оттянув до отказа поршень, медленно вытягивают иглу. Так как экссудат в чумном бубоне расположен между плотными тканями, количество его, попадающее в шприц, как правило, незначительно и часто заполняет только просвет иглы. После извлечения иглы из бубона через нее набирают в шприц 0,5 мл стерильного питательного бульона (рН 7,2), содержимое выливают в стерильную пробирку и закрывают стерильной резиновой пробкой. Бульон можно набрать в шприц и до начала пункции. В качестве метода, повышающего возможность выделения культуры чумного микроба, и в случае невозможности получить материал, в бубон вводят 0,3-0,5 мл стерильного изотонического раствора натрия хлорида или питательного бульона. При вскрывшемся бубоне забирают материал отдельно из периферической плотной части и отделяемое свища. Обе порции исследуют раздельно.
При кожных поражениях иглу шприца вводят у края везикулы (пустулы) и затем продвигают к середине. У карбункулов и язв пунктируют плотный край.
Мокроту собирают в широкогорлые банки с притертой пробкой. Слизь из зева берут стерильным ватным тампоном по общепринятой методике.
Кровь забирают из локтевой вены в количестве 10 мл разовым шприцем и в нем доставляют кровь в лабораторию.
У больных чумой с локализацией первичных бубонов в области головы и шеи дополнительно забирают на исследование слизистое отделяемое ротовой полости и глотки стерильным ватным тампоном.
К каждой пробе прикладывают направление с указанием сведений о материале (Ф.,И.,О. больного, наименование пробы, дата и час забора материала), а также сопроводительный документ, в котором содержатся сведения о больном (Ф.,И.,О., предполагаемый диагноз, получал ли больной до взятия материала антибиотики, какие и в каком количестве, какой материал направляется на исследование).
Время от момента взятия материала до начала исследования не должно превышать 5-6 ч, если нет условий для его хранения на холоде.
Материал для исследования:
· при легочной форме чумы - мокрота, при ее отсутствии - мазок из зева, кровь из вены, моча;
· при септической форме - кровь, моча;
· при бубонной форме - пунктат бубона, кровь, моча;
· при кожной форме - отделяемое язвы, кровь, моча;
· при кишечной форме - кал, кровь, моча;
· при менингиальных явлениях - спинномозговая жидкость.
· секционный материал (кусочки органов трупа, кровь);
· живые грызуны; трупы грызунов; блохи грызунов;
· вода, воздух, загрязненные вещи, посуда, белье и так далее.
Задача:В лабораторию поступил материал от пациентов со схожими симптомами – главным из которых, был - наличие бубонов в шейной области. Материал из бубонов обоих пациентов был доставлен в лабораторию особо опасных инфекций.
Й этап
| Образец 1 | Образец 2 |
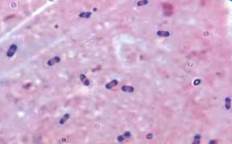 | 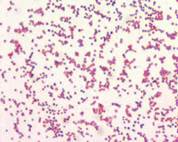 |
| Опишите морфологию возбудителя. Окраска по Граму, х100 | Опишите морфологию возбудителя. Окраска по Граму, х100 |
| Морфология клеток Y.pestis вакцинный штамм EV, УТС, ув.х80000 | |
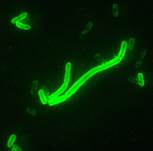 | 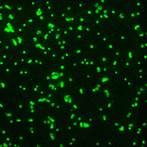 |
| Диагностикум с флюоресцирующими АТ к Y.pestis. Результат РИФ: | Диагностикум с флюоресцирующими АТ к Francisella tularensis. Результат РИФ: |
 Контроль(+) Образец 1 Образец2 | |
| Оцените результат реакции ПЦР |
Предположительный диагноз_________________________________________________
2 этап (2-5 часов от начала исследования):
выдача предварительного положительного ответана Y.pestis на основании наличия в мазках биполярно окрашенных грамотрицательных овоидных палочек, их специфического свечения при окраске мазка флюоресцирующими иммуноглобулинами, положительной ПЦР.
Исследование Образца 1 (подозрение на Y.pestis)
 |  |
| Оцените посев на кровяной агар | Оцените характер роста на сердечно-мозговом бульоне |
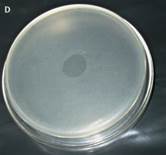 |  Образец Контроль(-) |
| Оцените результат пробы нативного материала с диагностическим бактериофагом Покровской и/или Л-413С к Y.pestis | Оцените результат латекс-агглютинационной тест-системы для выявления капсульного антигена F1 Y. pestis (при температуре 30 о С и выше Y.pestis синтезирует капсульный гликопротеид - фракцию 1 (антиген F1)). |
  Контроль (-) Образец | |
| Оцените результат биопрбы на животных (заражение внутрибрюшинно, подкожно и/или накожно). |
В качестве стимуляторов роста Y.pestis используют сульфит натрия в концентрации 1:4000 (1 мл 2,5 % раствора на 100 мл агара), гемолизированную кровь в концентрации 0,01-1 %, стимулятор роста чумного микроба из сарцин (стимулятор Карпузиди) согласно инструкции по применению препарата. В очагах, где циркулируют тиаминзависимые штаммы, в качестве стимулятора роста используют витамин B1 в концентрации 0,0001 мг на 100 мл среды или синтетическую среду 199 (3 мл на 100 мл среды).
Для подавления роста посторонней микрофлоры используют генцианвиолет в концентрации 1:100000-1:800000. Рабочую дозу определяют для каждой серии препарата перед обследовательским сезоном и указывают в паспорте на рабочий раствор генцианвиолета.
Помимо этого, для ингибирования посторонней флоры могут быть использованы теллурит калия в концентрации 1 300000, дезоксихолат натрия - 1 мг %, фосфомицин 50-100 мкг/мл.
3 этап (24-48 часов от начала исследования):
выдача подтверждения предварительного положительного ответа на основании наличия характерного роста на жидких и плотных питательных средах, наличия в мазках из этих сред грамотрицательных овоидных палочек с биполярным окрашиванием, положительной пробой с бактериофагами (лизис культуры чумными бактериофагами Покровской и Л-413С).
Читайте также:


