Ц реактивный белок при сепсисе

Многие белки млекопитающих гликозилированы и являются гликопротеинами (ГП). Развитие ряда патологических состояний сопровождается нарушением процессов гликозилирования, изменением конфигурации углеводной части гликоконъюгатов [9]. Характер таких изменений зависит от типа и стадии конкретного заболевания. В связи с этим возникли принципиально новые подходы к дифференциальной диагностике заболеваний, которые основаны на выявлении гликоформ ГП. В настоящее время наметилось два пути для выявления углеводного профиля ГП – это использование моноклональных антител к углеводным детерминантам и углевод-связывающих белков – лектинов, способных обратимо и избирательно связываться с определенными углеводными структурами.
Воспалительный ответ представляет собой последовательность клеточных и молекулярных событий, которые происходят как реакция на различные стимулы, такие как инфекция и повреждение ткани. Воспаление сопровождается продукцией белков острой фазы, определение которых может говорить о наличии воспаления и степени его тяжести. Изменение гликозилирования ГП во время воспаления продемонстрировано на животных моделях и в некоторых белках острой фазы человека [10].
С-реактивный белок (СРБ) – наиболее характерный представитель семейства острофазных белков. Известно, что концентрация СРБ в сыворотке крови резко возрастает при воспалительном ответе в 10–100 раз [1]. Долгое время считалось, что СРБ не гликозилирован, хотя показано, что у животных в отличие от человека этот острофазный белок содержит углеводные цепи [8]. В 2003 г. впервые появилась работа, в которой представлены данные о гликозилировании СРБ у людей с различным типом патологий, таких как туберкулез, лейкемия, саркома [11]. Позднее этими же авторами показано наличие углеводов в образцах СРБ пациентов с воспалительными заболеваниями, такими как менингит, острый аппендицит, ревматоидный артрит и некоторых других [6]. Нами было показано гликозилирование образцов СРБ в сыворотках крови пациентов с неспецифическим язвенным колитом [2] и ишемической болезнью сердца [4].
Вот уже несколько десятилетий сепсис и тяжелые инфекции остаются одной из актуальных проблем современной медицины в силу неуклонной тенденции к росту числа больных и стабильно высокой летальности, несмотря на использование новых принципов и методов лечения. Целью данной работы является исследование степени гликозилирования суммарных ГП сыворотки крови, а также СРБ у пациентов с сепсисом.
Материал и методы исследования
Сыворотки крови были получены в Медицинском объединении ДВО РАН и Краевой клинической больнице № 1 г. Владивостока. В работе использовали лектины, выделенные нами из морских беспозвоночных: Gal/GalNАc-специфичный лектин из мидии Crenomytilus grayanus (CGL), GlcNАc – специфичный (DTL) и GlcNАc/GalNАc-специфичный (DTL-A) лектины из асцидии Didemnum ternatanum и муцин – специфичный лектин из красной водоросли Tichocarpus crinitus (TCL) [3, 14], а также коммерчески доступные лектины Glc/Man-специфичный из канавалии мечевидной Canavalia ensiformis (Con A) и GlcNАc-специфичный из бобовника альпийского Laburnum alpinum (LAA) (Sigma, USA). Концентрацию СРБ в сыворотках крови определяли методом иммуноферментного анализа (ИФА) с помощью наборов СРБ-ИФА-БЕСТ (высокочувствительный) (Вектор-Бест, Россия). Конъюгаты лектинов с ферментом получали перйодатным методом Накане [13].
Гликозилирование ГП исследовали методом твердофазного лектин-ферментного анализа (ТЛФА). Вкратце, на планшет адсорбировали в трипликатах сыворотки больных и здоровых доноров, свободные места связывания блокировали альбумином, а затем в лунки планшета добавляли лектины, меченные пероксидазой хрена. После добавления субстрата определяли оптическую плотность каждого образца сыворотки на планшетном спектрофотометре μQuant (Bio-Tek Instruments, USA). Результаты обсчитывали в программе Excel. Данные представлены в виде средних значений ± стандартное отклонение (SD).
SDS-электрофорез образцов сыворотки крови проводили по методу Лэммли на установке Jim-X (Китай). В качестве стандартов использовали набор окрашенных рекомбинантных высокоочищенных белков фирмы Thermo Sscientific (США). По окончании электрофореза белки переносили на поливинилиденфторидную (PVDF) мембрану, используя установку для полусухого переноса Jim-X (Китай). Для идентификации полос, соответствующих СРБ, мембрану обрабатывали иммуноглобулинами против СРБ, меченными пероксидазой хрена. Полосы, соответствующие СРБ (без добавления антител), вырезали. Для накопления достаточного для анализа количества СРБ эксперимент повторяли несколько раз. Образцы СРБ гидролизовали 2,5 М ТФУ. Определение нейтральных и аминосахаров проводили методом ГЖХ в виде ацетатов полиолов, как описано ранее [15].
Результаты исследования и их обсуждение
Для определения степени гликозилирования суммарных ГП сыворотки крови были исследованы образцы сывороток пациентов с острым сепсисом различной этиологии (n = 14). Уровень СРБ во всех образцах находился в пределах 133,20–235,02 мкг/мл, что в несколько раз превышало уровень нормальных значений – 0,5 мкг/мл. Методом ТЛФА было изучено взаимодействие ГП с различными лектинами. В качестве контроля использовали сыворотки здоровых доноров (n = 18).
Как видно из рис. 1, связывание лектина Con A с сыворотками пациентов с сепсисом на 26,6 % выше по сравнению с сыворотками доноров. Известно, что при воспалительных процессах в ГП возрастает количество 2-антенных структур по отношению к 3- и 4-антенным [10]. Очевидно, при сепсисе происходит уменьшение разветвленности углеводных структур гликоконъюгатов, что выражается в усилении связывания их с лектином Con A, который избирательно взаимодействует с биантенными структурами.
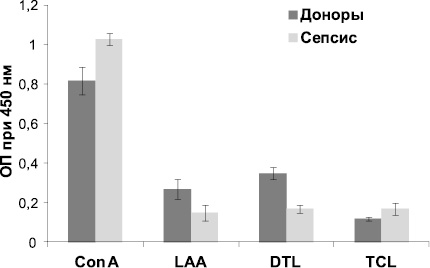
Рис. 1. Взаимодействие лектинов, меченных ферментной меткой, с сыворотками, адсорбированными на полистирольном планшете. Результаты представлены в виде среднего значения оптической плотности ± SD
Известно, что при онкопатологии наблюдается увеличение доли О-гликозилированной структуры типа муцина [7]. Подобное перегликозилирование углеводных цепей, вероятно, происходит и при воспалительном процессе, чем и объясняется способность муцин-специфичного лектина TCL на 41,6 % сильнее связываться с сыворотками больных по сравнению с сыворотками доноров. Заметное уменьшение связывания обнаружено при взаимодействии с GlcNAc-специфичными лектинами DTL и LAA. Показано, что углеводные структуры, в которых присутствует бисектный GlcNAc, составляют примерно 6 % от общего числа гликанов при сепсисе, в то время как в пуле сывороток доноров их содержание достигает 10 % [5]. Ранее было показано, что DTL проявляет сродство именно к биссектному GlcNАc [12], что, вероятно, и приводит к уменьшению связывания на 48,6 % по сравнению с донорскими сыворотками. LAA проявляет сродство к хитобиозным структурам. При сепсисе увеличивается фукозилирование внешних цепей олигосахаридов на 50 % [5], при этом, вероятно, происходит экранирование хитобиозных цепей, что выражается в уменьшении связывания с LAA на 55,6 %. При исследовании взаимодействия лектинов CGL и DTL-A с сыворотками доноров и больных существенного различия не было выявлено. Вероятно, при воспалительных процессах содержание концевых остатков Gal и GalNAс, к которым данные лектины проявляют сродство, в гликоконъюгатах изменяется незначительно.
Для определения степени гликозилирования СРБ у пациентов с сепсисом был использован оригинальный подход, который позволил, не выделяя СРБ в индивидуальном состоянии, определить содержание углеводов и провести их сравнительный анализ. Образцы сывороток больных разделяли электрофоретически, затем методом электроблоттинга белки переносили на PVDF мембрану. Для идентификации полос, соответствующих СРБ, мембрану обрабатывали иммуноглобулинами против СРБ (рис. 2). Определив местоположение полос, соответствующих СРБ, эти полосы вырезали и гидролизовали. Полученные гидролизаты анализировали методами ГЖХ на присутствие нейтральных сахаров и гексозаминов. Сыворотки здоровых доноров не могли быть исследованы в такой постановке, поскольку низкое содержание СРБ в них не позволило провести его идентификацию после электроблоттинга.
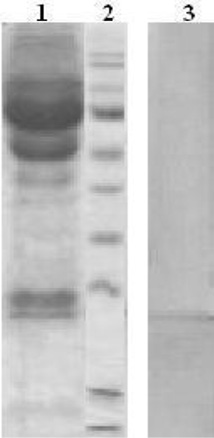
Рис. 2. Электрофоретическое разделение и электроблоттинг образцов сывороток крови:1 – электрофорез сыворотки пациента с сепсисом; 2 – стандартные белки; 3 – электрофоретически разделенная сыворотка пациента с сепсисом после переноса на PVDF мембрану и идентификации полосы, соответствующей СРБ, с помощью иммуноглобулинов против СРБ, меченных ферментной меткой
Как видно из рис. 3, образцы СРБ, выделенные из сыворотки больных сепсисом, содержат моносахариды Man, Glc, Gal, GlcNAc, GalNAc в соотношении 1:5:4:1:2.
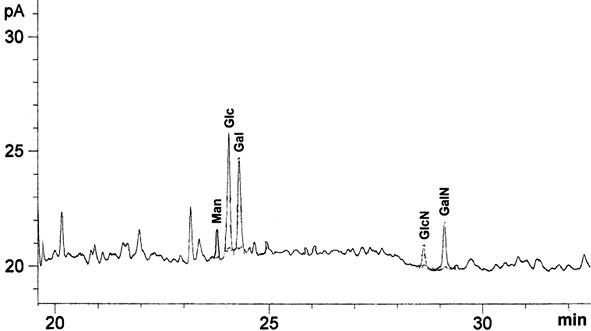
Рис. 3. Анализ углеводного состава СРБ методом ГЖХ
Ранее авторами было показано наличие трех нейтральных моносахаридов: Man, Glc, Gal в образце СРБ, полученном из сыворотки больного туберкулезом [11].
Таким образом, в настоящей работе на примере СРБ, выделенного из сывороток больных сепсисом, убедительно показано не только наличие гликозилирования этого острофазного белка, но и определены моносахаридные остатки, входящие в состав его углеводных цепей. Данные результаты могут существенно повысить значимость СРБ как потенциального клинического маркера. Не исключено, что разные модифицированные формы СРБ удастся соотнести с конкретными формами патологий. А определение уровня перегликозилирования ГП цельной сыворотки позволит не только получить сведения об общем состоянии организма, но, возможно, и осуществить первичную дифференциальную диагностику.
Рецензенты:
Богданович Л.Н., д.б.н., зам. главного врача по научной работе, заведующая лабораторией инновационных медико-биологических исследований и технологий, МО ДВО РАН, г. Владивосток.

Сепсис — наиболее частая причина смерти в некоронарных отделениях интенсивной терапии. На сегодняшний день в мире ежегодно регистрируется более 18 млн случаев сепсиса. В развивающихся странах случаи сепсиса составляют 2 % всех госпитализаций и 6–30 % госпитализаций в отделения реанимации и интенсивной терапии. Летальность при сепсисе, по данным литературы, достигает 30–50 %.
За последние 10 лет значительно улучшились методы диагностики, что позволило начинать лечение сепсиса раньше, но летальность продолжает увеличиваться. G. Martin и соавт. (2009) проанализировали более 11 000 пациентов с тяжелым сепсисом, среди которых 57 % страдали от грамотрицательной, 44 % — от грамположительной и 11 % — от грибковой инфекции. Легкие были первичным источником инфекции у 47 % больных, абдоминальная инфекция — у 23 %, инфекция мочевыводящих путей — у 8 %. Общая смертность достигала почти 50 %.
Приоритетом продолжают быть ранняя диагностика и наблюдение за больными с риском развития сепсиса.
Первым шагом к пониманию патогенеза сепсиса стало определение таких понятий, как синдром системной воспалительной реакции (ССВР), сепсис, тяжелый сепсис, септический шок и синдром полиорганной недостаточности, которое впервые было дано на Конференции American College of Chest Physicians / Society of Critical Care Medicine Consensus в 1991 г.
ССВР развивается в результате взаимодействия про- и антивоспалительных медиаторов воспалительного ответа. Термин ССВР соответствовал широкому спектру этиологических факторов, помимо инфекции. Неинфекционные причины ССВР — лихорадка, хирургическое вмешательство, травма, панкреатит и др. Клиническая практика показала, что концепция ССВР была слишком чувствительна и недостаточно специфична. Группа пациентов с диагнозом ССВР была гетерогенна для выработки критериев диагностики и лечения.
В 2003 г. была предложена новая концепция условий для определения сепсиса — PIRO (Р — predisposition (предрасположение), I — infection (инфекция), R — response (ответ), О — organ dysfunction (органная дисфункция)). Данная концепция позволила более точно определять пациентов с сепсисом и оценивать степень тяжести заболевания.
Однако изменения концепции сепсиса не позволяют окончательно решить существующие проблемы ранней постановки диагноза.
Более того, из-за применения антибиотиков, предшествовавшего взятию крови, гемокультура часто дает ложноотрицательный результат. Отсутствует возможность оценки вклада некультивируемых микроорганизмов в инфекционно-воспалительный процесс, что ограничивает диагностические возможности метода.
Существуют более современные высокоточные методики диагностики инфекций, такие как полимеразная цепная реакция (ПЦР), которые позволяют идентифицировать микроорганизмы за счет многократного копирования специфических последовательностей генетического материала.
Методом ПЦР можно обнаружить бактериальную и грибковую ДНК намного быстрее и с более высокой чувствительностью. Более того, не требуется предшествующая инкубация или получение чистой культуры, вследствие чего лаборатория может выдать результат в течение нескольких часов (1—6 ч) с момента взятия образца на исследование. Кроме этого, именно генетический код определяет резистентность микроорганизмов к действию антибиотиков, например, ген mec для метициллин-резистентного золотистого стафилококка.
Дополнительным преимуществом диагностики является независимость от проводимой антимикробной терапии, а также большая вероятность получения достоверного результата в случае микст-инфекции по сравнению с классическим исследованием крови на стерильность. К сожалению, эта методика еще не получила должного распространения в связи со своей относительно высокой стоимостью.
Данные проблемы привели к поиску лабораторных маркеров, которые могут быть связаны с наличием инфекции в организме, уровнем воспалительной реакции и сепсисом. На настоящий момент основными из этих маркеров являются С-реактивный белок (СРБ), интерлейкин-6 (ИЛ-6), прокальцитонин (РСТ), пресепсин (P-SEP) и новый биологический маркер neutrophil CD64.
С-реактивный белок, открытый в 1930 г., — белок, относящийся к пентраксинам, синтез которого происходит в печени под влиянием ИЛ-6 и других цитокинов. При воспалении концентрация СРБ в плазме крови увеличивается в сотни раз, и существует прямая связь между изменением уровня СРБ, тяжестью и динамикой клинических проявлений воспаления. Однако данный механизм делает его крайне неспецифичным маркером, уровни которого могут повышаться при ССВР без наличия инфекции.
Такая же проблема характерна для измерения уровня ИЛ-6, который синтезируется активированными макрофагами и Т-клетками. Как показывает исследование J. Schrode и соавт. (1999), повышение его уровня может быть связанно с тяжелым течением заболевания без инфекционных осложнений.
Прокальцитонин, который был открыт в 1984 г., является предшественником кальцитонина, пептидного гормона парафолликулярных клеток щитовидной железы, не имеющим собственной функции. При массивном воспалительном инфекционном процессе, вызванном бактериальной и грибковой микрофлорой, уровень РСТ повышается без дальнейшего повышения уровня кальцитонина.
Также было доказано, что при обширной воспалительной реакции инфекционного генеза РСТ вырабатывается разными типами клеток вне щитовидной железы. Этот процесс запускается после появления в крови большого количества провоспалительных цитокинов, в особенности ИЛ-6 и фактора некроза опухоли альфа, на фоне эндотоксемии.
За 30 лет использования РСТ как маркера ССВР накопился большой опыт как ложноположительных, так и ложноотрицательных результатов. Как показывают работы В. Uzzan и соавт. (2006) и S. Hunziker и соавт. (2010), уровень РСТ может повышаться без наличия инфекции при массовой гибели клеток. В частности, после тяжелой травмы и хирургического вмешательства уровень РСТ быстро повышается, а затем, при отсутствии инфекции, снижается и приходит к норме через 3—5 дней.
Также в работе М. Christ-Crain и соавт. (2005) было отмечено, что повышение РСТ при генерализации инфекции и развитии сепсиса часто происходит со значительной задержкой, что ведет к ложноотрицательным результатам.
Пресепсин, или sCD14-ST, — относительно новый высокоэффективный маркер сепсиса, который был открыт 10 лет назад. CD14 — это поверхностный мембранный гликопротеин моноцитов/макрофагов, являющийся рецептором для комплексов липополисахарида и липополисахаридсвязывающего белка (LPS—LPB). Он активирует Toll-подобный рецептор 4 провоспалительного каскада для презентации антигена.
Существуют 2 формы CD14: мембранная (mCD14) и растворимая (sCD14). Комплекс LPS— LPBP—sCD14 циркулирует с потоками крови, где расщепляется катепсином D и другими протеазами плазмы с высвобождением N-терминального фрагмента молекулярной массой 13 кДа — молекулы sCD14-subtype (sCD14-ST), названной P-SEP. Данному маркеру в последнее время уделяется особое внимание в связи с его высокой чувствительностью, специфичностью и малым временем реакции для появления в крови.
По сравнению с другими маркерами P-SEP более чувствителен и специфичен в диагностике сепсиса. Проведенные исследования показали, что концентрация P-SEP в плазме значительно выше у инфицированных пациентов, чем у неинфицированных.
Shozushima и соавт. (2011) обнаружили, что концентрация P-SEP составляла 333,5 + 130,6 пг/мл в группе ССВР, 721,0 + 611,3 пг/мл в группе с ограниченной инфекцией, 817,9 + 572,7 пг/мл в септической группе и 1992,9 + 1509,2 пг/мл в группе с тяжелым сепсисом. Концентрация P-SEP в крови между группами возрастала последовательно.
Spanuth и соавт. (2011) изучали концентрацию P-SEP у больных, поступающих в приемный покой, и обнаружили, что она была значительно выше при тяжелом сепсисе, чем у септических пациентов средней тяжести. Более того, концентрация P-SEP коррелировала со шкалами APACHE II и SOFA.
Для оценки значения 4 маркеров в диагностике сепсиса была использована ROC-кривая. AUC P-SEP составила 0,845. P-SEP был предпочтительнее РСТ (0,652), ИЛ-6 (0,672), и СРБ (0,815). При пороговом значении концентрации P-SEP 399 пг/мл чувствительность диагностики сепсиса была равна 80,3 %, а специфичность — 78,5 %, в то время как при пороговом значении 600 пг/мл чувствительность диагностики сепсиса составила 87,8 %, специфичность — 81,4 %, позитивная прогностическая величина — 88,6 %, негативная прогностическая величина — 80,3 %. Чувствительность P-SEP для диагностики сепсиса была равна 91,9 %, РСТ — 89,9 %, ИЛ-6 — 88,9 %, культуры крови — 35,4 %. Результаты проведенных исследований позволяют считать, что маркер P-SEP перспективен при диагностике сепсиса.
P-SEP как биомаркер подходит не только для ранней диагностики сепсиса, но также для оценки его тяжести и прогноза. В исследовании ALBIOS у 100 пациентов с тяжелым сепсисом и септическим шоком определяли концентрацию P-SEP и РСТ. Средняя концентрация P-SEP в 1-й день мониторинга составила 2268 (1145—4305) пг/мл у умерших пациентов, что существенно выше, чем у выживших (1184 (855—2158) пг/мл; р = 0,001). На 7-й день у выживших пациентов уровень P-SEP существенно снизился — до 974 (674—1927) пг/мл, а у умерших он составлял 2551 (1438—5624) пг/мл (р = 0,02). Более того, уровень P-SEP коррелировал со шкалами SOFA, MOF и стабильностью гемодинамики. Девяностодневная смертность пациентов с высоким уровнем P-SEP была существенно выше, чем у больных с низким его уровнем (75 и 42 % соответственно). P-SEP опережал РСТ в оценке прогноза (AUC 0,69 и 0,56; р = 0,07).
Другое исследование показало, что уровень P-SEP существенно различался в группах выживших и умерших пациентов, среди групп пациентов с сепсисом, тяжелым сепсисом и септическим шоком. P-SEP был точнее, чем ИЛ-6, СРБ и РСТ, в оценке риска смерти в течение 30 дней с момента начала развития сепсиса. Когда пороговое значение P-SEP составляло 1622 пг/мл, а пороговое значение РСТ — 13,43 нг/мл, в группе РСТ 23 % выживших пациентов и 40 % умерших не попадали в соответствующие группы.
Основные принципы терапии сепсиса — это ранняя диагностика очага инфекции и раннее начало интенсивной терапии, в том числе антибактериальной (в течение 1 ч). Анализ на приборе PATHFAST (Япония) занимает 21 мин для обнаружения P-SEP, в качестве образцов в этом исследовании могут использоваться как цельная кровь с антикоагулянтами гепарином или этилендиаминтетраацетатом, так и сыворотка крови.
В нескольких исследованиях показано, что циркулирующие уровни P-SEP повышаются при развитии системных инфекций и сепсиса, вызываемых грамположительными, грамотрицательными и грибковыми инфекциями. P-SEP имеет 100 % чувствительность к инфекциям, подтвержденным гемокультурами. Исследования показали, что чувствительность P-SEP, РСТ, и ИЛ-6 составляет 95,5; 95,5 и 100 % у пациентов с грамположительной бактериальной инфекцией и 77,8; 86,1 и 88,9 % соответственно при грамотрицательной микрофлоре.
Чувствительность P-SEP существенно не различается между пациентами с грамположительной и грамотрицательной бактериальной инфекцией. Уровень P-SEP возрастал у больных с грибковой инфекцией, но не у пациентов с вирусной инфекцией. При вирусных инфекциях и при воспалительных процессах, не связанных с системными инфекциями, уровень P-SEP не повышался.
При развитии сепсиса повышение циркулирующих концентраций P-SEP происходит раньше и быстрее, чем других маркеров сепсиса, а именно в течение 1,5—2,0 ч после начала системного ответа на инфекцию — раньше, чем повышение цитокина ИЛ-6, РСТ и СРВ. Время полужизни P-SEP в крови составляет 0,5—1,0 ч. Поэтому при мониторинге его уровень быстро и надежно отражает степень эффективности терапии, что позволяет оперативно принимать объективные клинические решения.
Neutrophil CD64 — мембранный белок, гликопротеин, Fc-рецептор к мономерным иммуноглобулинам изотипа IgG с высокой аффинностью. CD64 постоянно экспрессирован только на макрофагах и моноцитах. Может экспрессироваться на гранулоцитах после активации клеток цитокинами, такими как интерферон-гамма и гранулоцитарный колониестимулирующий фактор. Наличие CD64 на поверхности нейтрофилов является признаком инфекции и сепсиса.
Метаанализы по клиническому применению данного маркера продемонстрировали уровни его чувствительности и специфичности 85 и 76 % соответственно. Открытым остается вопрос о возможности применения биологических маркеров в контроле эффективности эмпирически назначенной антибиотикотерапии ж у больных сепсисом.
В работе V. Nobre и соавт. (2008) сравнивали стандартный алгоритм назначения и отмены антибиотиков у больных сепсисом и алгоритм, ориентированный на уровень РСТ. Результаты демонстрируют, что при применении алгоритма, ориентированного на уровень РСТ, длительность антибиотикотерапии снижалась в среднем на 3,5 дня, время нахождения в отделении реанимации и интенсивной терапии уменьшалось в среднем на 2 дня. Различий в летальности в контрольной и основной группах не наблюдалось.
По результатам ретроспективного рандомизированного исследования A. Hohn и соавт. (2013), за исследуемый период времени с появления РСТ в клинической практике — с 2005 по 2009 г. — средняя продолжительность антибиотикотерапии у больных с хирургическим сепсисом снижалась на 24 ч, а продолжительность искусственной вентиляции легких — на 48 ч за год.
Хотя более высокая чувствительность и специфичность P-SEP по сравнению с РСТ у различных групп больных была продемонстрирована неоднократно, работы по клиническому использованию P-SEP при контроле эффективности антибиотикотерапии в доступной литературе не найдены.
Сепсис является жизнеугрожающей проблемой, на решение которой приходится значительная часть расходов здравоохранения. Это гетерогенный процесс с выраженной индивидуальной вариабельностью, что усложняет его диагностику и лечение. Биологические маркеры и их комбинации помогают верифицировать диагноз вовремя и контролировать эффективность процесса лечения. Определение алгоритма практического применения маркеров сепсиса является перспективной клинической задачей.
С-реактивный белок (СРБ) – это очень чувствительный элемент крови, быстрее других реагирующий на повреждение тканей организма. Наличие С-реактивного белка в крови является признаком воспалительного процесса, травмы, проникновения в организм бактерий, паразитов, грибов. Определение СРБ является более надежным и чувствительным показателем воспалительного процесса, чем подсчет скорости оседания эритроцитов (СОЭ), однако повышается и исчезает раньше, чем изменяется СОЭ.
Появляется С-реактивный белок в острый период заболевания, поэтому его иногда называют белком острой фазы (БОФ). С переходом в хроническую фазу заболевания С-реактивный белок исчезает из крови и снова появляется при обострении процесса. Появление этого белка является самым ранним признаком заболевания. С-реактивный белок стимулирует защитные реакции, активизирует иммунитет.
С-реактивный белок норма
СРБ синтезируется в печени и в сыворотке крови здорового человека содержится в минимальных количествах. На содержание в сыворотке (плазме) крови СРБ не оказывают влияния гормоны, в том числе при беременности, пол, возраст, прием лекарственных препаратов и т.п.
Норма С-реактивного белка как у детей, так и у взрослых - менее 5 мг/л (или 0,5 мг/дл).
Для анализа на СРБ кровь берется из вены в утренние часы, натощак. При необходимости сдачи крови в другое время требуется воздержание от приема пищи в течение 4-6 часов.
Причины повышения С-реактивного белка
С-реактивный белок в крови повышен при: ревматизме, острых бактериальных, грибковых, паразитарных и вирусных инфекциях, заболеваниях органов пищеварения, очаговых инфекциях (например, хронический тонзиллит), сепсисе, ожогах, осложнениях после операций, при развитии инфаркта миокарда, при бронхиальной астме с поражением органов дыхания, при осложненном остром панкреатите, менингите, туберкулезе, злокачественных новообразованиях с метастазами, аутоиммунных заболеваниях (ревматоидный артрит, системный васкулит).
С-реактивный белок повышен
При воспалении концентрация СРБ в плазме крови увеличивается очень быстро (в первые 6-8 часов) и очень значительно в 10 –100 раз и есть прямая связь между изменением уровня СРБ и тяжестью и динамикой клинических проявлений воспаления. Чем выше концентрация СРБ, тем выше тяжесть воспалительного процесса и наоборот. Именно поэтому измерение его концентрации широко применяется для мониторинга и контроля эффективности лечения бактериальных и вирусных инфекций.
Разные причины воспалительных процессов по-разному повышают уровни СРБ:
При вирусных инфекциях вялотекущих хронических и некоторых системных ревматических заболеваниях СРБ повышается до 10—30 мг/л. Уровень СРБ при вирусной инфекции возрастает незначительно, поэтому при отсутствии травмы высокие значения его в сыворотке указывают на наличие бактериальной инфекции, что используется для дифференцирования вирусной инфекции от бактериальной.
При подозрении на сепсис новорожденных - уровень СРБ более 12 мг/л - указание на немедленное начало противомикробной терапии (у части новорожденных бактериальная инфекция может и не повышать СРБ).
При бактериальных инфекциях, обострении некоторых хронических воспалительных заболеваний, а также при повреждении тканей (хирургические операции, острый инфаркт миокарда) наблюдаются самые высокие уровни до 40-100 мг/л. При эффективной терапии концентрация СРБ снижается уже на следующий день, а если этого не происходит с учетом изменений уровней СРБ, решается вопрос о выборе другого антибактериального лечения. Если в течение 4-5 дней после операции СРБ продолжает оставаться высоким (или увеличивается), это указание на развитие осложнений (пневмонии, тромбофлебита, раневого абсцесса). После операции уровень СРБ будет тем выше, чем тяжелее прошедшая операция, чем более она травматична.
При инфаркте миокарда белок повышается через 18—36 ч после начала заболевания, к 18—20-му дню снижается и к 30—40-му дню приходит к норме. При рецидивах инфаркта СРБ вновь повышается. При стенокардии он остается в пределах нормы.
Повышение уровня СРБ наблюдается при опухолях различных локализаций: при раке легкого, предстательной железы, желудка, яичников и других опухолей и может служить тестом для оценки прогрессирования опухоли и рецидива заболевания.
Тяжелые генерализованные инфекции, ожоги, сепсис повышают СРБ почти запредельно - до 300 г/л и более. При любых заболеваниях присоединение бактериальной инфекции повышает СРБ более 100 мг/л.
При успешном лечении уровень С-реактивного белка снижается в течение последующих дней, нормализуясь обычно на 6-10 сутки.
Белок острой фазы, высокочувствительный и неспецифический маркер активного воспаления и повреждения тканей.
Синонимы английские
C-reactive protein (CRP), quantitative.
Мг/л (миллиграмм на литр).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
- Не принимать пищу в течение 12 часов перед исследованием.
- Исключить физическое и эмоциональное перенапряжение в течение 30 минут до исследования.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
С-реактивный белок – это гликопротеин, вырабатываемый печенью и относящийся к белкам острой фазы воспаления. Под действием противовоспалительных цитокинов (интерлейкина-1, фактора некроза опухолей – альфа и в особенности интерлейкина-6) его синтез увеличивается уже через 6 часов, а концентрация в крови возрастает в 10-100 раз в течение 24-48 часов после начала воспаления. Наиболее высокие уровни СРБ (более 100 мг/л) наблюдаются при бактериальной инфекции. При вирусной инфекции уровень СРБ, как правило, не превышает 20 мг/л. Концентрация СРБ также повышается при некрозе тканей (в том числе при инфаркте миокарда, опухолевых некрозах).
СРБ участвует в активации комплемента (группы белков, являющихся частью иммунитета), моноцитов, стимулировании экспрессии молекул адгезии ICAM-1, VCAM-1, Е-селектина на поверхности эндотелия (они обеспечивают взаимодействие клеток), связывании и модификации липидов низкой плотности (ЛПНП), то есть способствует развитию атеросклероза.
Прогрессивное увеличение СРБ связано с активностью воспалительного процесса и степенью повреждения тканей. Причем СРБ является более чувствительным показателем активного воспаления, чем скорость оседания эритроцитов (СОЭ), однако повышается и исчезает раньше, чем изменяется СОЭ.
Повышение СРБ может предшествовать появлению лихорадки, боли и других признаков болезни. Некоторые специалисты определяют длительность антибактериальной терапии в зависимости от сроков снижения СРБ.
В неосложненном послеоперационном периоде СРБ достигает максимальных значений на третий день и в течение недели снижается до нормального уровня. Сохранение высоких значений СРБ и отсутствие его постепенного снижения указывает на присоединение инфекции.
В отдельности определение СРБ не позволяет уточнить диагноз и характер заболевания, но с высокой чувствительностью дает возможность установить факт активного воспаления или повреждения ткани. Результаты анализа должны интерпретироваться с учетом показателей других лабораторных тестов, клинической картины болезни и заключений инструментальных исследований.
Для чего используется исследование?
- Для диагностики различных воспалительных заболеваний, обусловленных инфекцией или аутоиммунными процессами, и для оценки эффективности их лечения.
- Для дифференциальной диагностики бактериальной и вирусной инфекции (при вирусных уровень СРБ повышен незначительно).
- Для определения активности воспалительного, аутоиммунного процесса.
- Для диагностики послеоперационных инфекционных осложнений.
- Для диагностики скрытых инфекций.
- Для оценки необходимости антибактериальной терапии и ее длительности.
- Чтобы дать прогноз течения и возможного летального исхода при некоторых острых состояниях (например, панкреонекрозе).
- Чтобы оценить прогрессирование опухоли и рецидива заболевания (при совместном определении с другими онкомаркерами).
- Для дифференциальной диагностики воспалительных заболеваний кишечника: болезни Крона (высокий СРБ) и неспецифического язвенного колита (низкий СРБ).
- Для дифференциальной диагностики ревматоидного артрита (высокий СРБ) и неосложненной волчанки (низкий СРБ).
- Для мониторинга активности хронических заболеваний.
Когда назначается исследование?
- При подозрении на инфекционное заболевание у лихорадящих больных, при нейтропении, подозрении на менингит у детей, на сепсис у новорождённых.
- При обследовании пациентов с аутоиммунной патологией (артритом, васкулитом).
- При проведении антибактериальной терапии.
- В послеоперационном периоде (для раннего выявления инфекционных осложнений и оценки эффективности антибактериальной терапии) – при развитии осложнений уровень СРБ будет оставаться повышенным или увеличиваться в течение 4-5 дней после операции.
- При проведении терапии хронических воспалительных заболеваний.
- При трансплантации органов (почек, сердца).
- При профилактическом обследовании и наблюдении за пациентами с хроническими заболеваниями, новообразованиями.
Что означают результаты?
Референсные значения: 0 - 5 мг/л.
Если уровень СРБ превышает 10 мг/л, проводят дополнительное обследование, чтобы выявить инфекционные и воспалительные заболевания. СРБ больше 10 мг/л свидетельствует об остром воспалении, хроническом заболевании, травме и т. д. При вирусных инфекциях, метастазах, вялотекущих хронических и некоторых системных ревматических заболеваниях концентрация СРБ составляет 10-30 мг/л, при бактериальных инфекциях, обострении некоторых хронических воспалительных заболеваний (например, ревматоидного артрита) и повреждении тканей (хирургическая операция, острый инфаркт миокарда) – 40-100 мг/л (иногда 200 мг/л), при тяжелых генерализованных инфекциях, ожогах и сепсисе – до 300 мг/л и более.
Причины повышения уровня С-реактивного белка:
- острые вирусные и бактериальные инфекции;
- аутоиммунные заболевания (ревматоидный артрит, системный васкулит, ревматический полиартрит, анкилозирующий спондилоартрит);
- обострение хронических воспалительных (инфекционных и аутоиммунных) заболеваний;
- очаговые инфекции (например, хронический тонзиллит);
- повреждение тканей (травма, хирургическое вмешательство, острый инфаркт миокарда, острое нарушение мозгового кровообращения, острый панкреатит, панкреонекроз);
- воспалительные заболевания органов малого таза;
- инфекционный эндокардит;
- злокачественные новообразования и метастазы;
- миеломная болезнь;
- туберкулез;
- ожоги;
- сепсис;
- перитонит;
- артериальная гипертензия, атеросклероз, сахарный диабет, избыточная масса тела (небольшое увеличение);
- нарушение гормонального фона (повышение содержания эстрогенов и прогестерона).
Что может влиять на результат?
Факторы, повышающие уровень СРБ:
- беременность,
- интенсивные физические нагрузки;
- прием пероральных контрацептивов, заместительная гормональная терапия.
Факторы, снижающие уровень СРБ:
- прием нестероидных противовоспалительных препаратов (аспирина, ибупрофена), кортикостероидов, статинов, бета-блокаторов.
- Данный анализ не используется для определения риска развития сердечно-сосудистых заболеваний и их осложнений. Активность воспаления сосудистой стенки и атеросклероза оценивается благодаря высокочувствительному тесту на СРБ.
- При выявлении повышенного СРБ необходимо дополнительное обследование для уточнения локализации и характера патологического процесса.
Кто назначает исследование?
Терапевт, врач общей практики, анестезиолог-реаниматолог, педиатр, хирург, онколог, кардиолог, ревматолог, гастроэнтеролог, гематолог, акушер-гинеколог.
Читайте также:


