Биомаркеры для диагностики сепсиса
Подпишитесь на рассылку, чтобы получать новости сайта
Пресепсин: новый биомаркер для прогнозирования и диагностики сепсиса
Пресепсин: новый биомаркер
для прогнозирования и диагностики сепсиса
Иошиказу Окамура, Ральф Томэ
Департамент исследований и разработок Митсубиси Кемикл Медиенс Корпорэйшн,
Yoshikazu Okamura, Ralf Thomae, R&D Department, Research and Development Division, Mitsubishi Chemical Medience Corporation,
Сепсис – это крайне серьезное заболевание, характеризующееся синдромом
системного воспалительного ответа (ССВО), связанным с инфекцией. Сепсис
регистрируется у 1-2% всех госпитализированных пациентов и у 25% пациентов
отделений интенсивной терапии (ОИТ). Смертность при сепсисе составляет 20%, при
тяжелом сепсисе – 40%, при септическом шоке – более 60%. Диагностика сепсиса
основана на международных согласованных критериях [1, 2]. Прогнозирование
течения и исходов сепсиса оценивается по шкале MEDS (Mortality in Emergency
Department Sepsis) [3]. 20-35% пациентов с тяжелым сепсисом и септическим шоком
умирают в течение 30 дней после начала его развития. Шкала прогностической
стратификации критических пациентов APACHE II позволяет оценивать риск
смертности при тяжелом сепсисе. Септический шок – сильный предиктор смертности,
как в краткосрочном, так и в долгосрочном масштабе. Лечение сепсиса базируется на
антибиотикотерапии, хирургическом дренировании инфицированных жидкостей и на
мероприятиях по снижению дисфункции органов, которые могут включать гемодиализ
при почечной недостаточности, искусственную вентиляцию при легочной
недостаточности, трансфузию продуктами крови, мероприятия по нормализации
кровообращения и др.
Серьезной проблемой в лечении сепсиса является задержка начала
адекватной антибиотикотерапии. Результаты многочисленных исследований
показывают, что каждый час задержки начала введения адекватных антибиотиков
приводит к повышению смертности на 7% [4, 5].
Биомаркеры сепсиса. Различные методы идентификации микроорганизмов,
связанных с развитием сепсиса (микроскопия мочи, люмбальная пункция,
гемокультуры, высевы мокроты и др.) могут занимать несколько дней, что может
приводить к опасной задержке проведения жизненно важных мероприятий. Для
решения этой проблемы необходимы новые тесты, которые были бы способными
сразу при поступлении пациента с подозрением на сепсис давать врачу точную
информацию о наличии сепсиса, о его тяжести и о текущем прогнозе его развития.
Идеальный маркер сепсиса должен также обеспечивать надежный мониторинг
эффективности терапии и оперативно менять ее тактику.
Традиционные маркеры сепсиса, такие как С-реактивный белок,
прокальцитонин, лактат, эндотоксин и др. не отвечают вышеперечисленным
требованиям. Однако недавние клинические исследования нового биомаркера,
названного пресепсином, показали, что он является многообещающим ранним и
прогностическим маркером сепсиса [6, 7].
Пресепсин (ПСП) – это белок (мол. масса 13 КДа) являющийся N-концевым
фрагментом рецептора макрофагов CD14. CD14 – это белок, существующий в двух
формах: 1) связанной с мембраной (mCD14) и присутствующей на поверхности
макрофагов, моноцитов и гранулоцитов и 2) в растворимой (sCD14, s – soluble,
растворимый), циркулирующей в кровотоке. mCD14 – рецептор, ответственный за
трансдукцию эндотоксинового сигнала внутрь клеток. Выход mCD14 в кровоток и
образование sCD14 связаны с инфекцией и с некоторыми другими патологическими
состояниями. При активации бактериального фагоцитоза sCD14 и mCD14
расщепляются лизосомальными протеиназами с образованием фрагмента, исходно
названного sCD14-subtype (sCD14-ST), а потом переименованного в пресепсин [6, 7].
Один из механизмов образования ПСП связан с бактериальным фагоцитозом и
расщеплением mCD14 лизосомальными ферментам (рис. 1) [8].
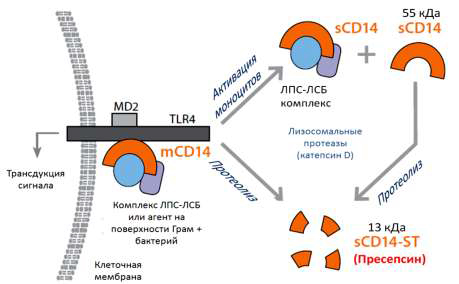
Рис. 1. Механизм образования ПСП.
mCD14 – СD14, связанный с мембраной, sCD14 – растворимый CD14, sCD14-ST – пресепсин, ЛПС –
липополисахарид, ЛСБ – липополисахарид связывающий белок, TLR4 – толл-подобный рецептор 4; MD2 – белок,
связанный с TLR4. Подробности в тексте.
Показано, что ПСП повышается в связи с инфекцией и специфически
продуцируется при сепсисе, связанном с грамотрицательными и
грамположительными бактериями, с грибками, при вирусных инфекция ПСП не
продуцируется [9, 10]. Недавно был разработан новый диагностический инструмент –
хемилюминесцентный иммуноферментный анализатор PATHFAST, который _______за 17
мин проводит полностью автоматические измерения важнейших биомаркеров
различных критических состояний и в особенности – пресепсина.
Эффективность ПСП для диагностики сепсиса. Измерения уровней ПСП при
разных патологических состояниях помощью экспресс-анализатора PATHFAST
показали, что этот маркер является высоко специфическим по отношении к сепсису
[7]. Анализ чувствительности и специфичности ПСП, проведенный в различных
исследованиях, продемонстрировал, что он обеспечивает: 1) раннюю диагностику
сепсиса непосредственно при поступлении пациента, 2) прогнозирование течения
заболевания и 3) оценку риска неблагоприятных исходов. Согласно результатам
клинических исследований уровни ПСП имеют сильную связь со степенью тяжести
сепсиса и 30-дневной смертностью.
В недавнем проспективном исследовании 859 пациентов с ССВО, поступивших
в отделения неотложной терапии (ОНТ) подтверждено, что ПСП – высоко
эффективный биомаркер, действительно пригодный для ранней диагностики сепсиса,
стратификации риска, мониторинга терапии и прогнозирования исходов у септических
пациентов [11]. Данное исследование показало, что одновременное измерение
уровней ПСП и оценка тяжести пациентов с помощью шкал MEDS и APACHE II
значительно улучшает точность прогнозирования развития тяжелого сепсиса.
Предварительные исследования показали также, что ПСП – весьма
перспективный маркер неонатального и педиатрического сепсиса [12].
К сожалению, несмотря на широкое применение современных антибиотиков и
высокотехнологичных методов реанимации, сепсис все еще является главной
причиной смертности пациентов в ОНТ и в ОРИТ, поэтому ранняя диагностика
сепсиса сразу при поступлении пациентов – ключевой момент для повышения
выживаемости таких больных. ПСП - многообещающий маркер для решения этой
Эффективность ПСП для прогнозирования сепсиса. При сепсисе
повышение ПСП сильно связано с повышением риска неблагоприятного исхода, а
снижение – с повышением шансов выживания. Более того, как показано в
специальном исследовании, именно ПСП, по сравнению с другими маркерами
сепсиса, наилучшим образом отражает динамику тяжести сепсиса (рис. 2) [13].
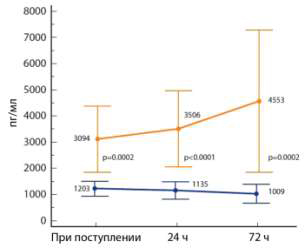
Рис. 2. Динамика ПСП у септических пациентов
с благоприятным исходом (внизу) и у не выживших (вверху).
Недавнее многоцентровое ретроспективное рандомизированное исследование,
в котором наблюдались пациенты, поступившие в ОИТ с сепсисом и септическим
шоком, показало, что уровни ПСП адекватно отражают изменение тяжести патологии
у впоследствии выживших и не выживших пациентов [14].
1.Согласно существующей практике, измерение широко используемых
маркеров сепсиса проводится в центральной лаборатории, что ведет к существенной
задержке получения срочной и жизненно важной диагностической информации.
2. Ни один из ныне широко используемых маркеров сепсиса не сочетает в себе
возможности для ранней диагностики сепсиса, стратификации рисков, с ним
связанных, прогнозирования и мониторинга течения сепсиса.
3. Пресепсин – новый, многообещающий маркер, который позволяет через 17
минут после взятия крови проводить:
а) раннюю и точную дифференциальную диагностику ССВО и сепсиса,
б) оценку тяжести сепсиса,
в) оперативный мониторинг эффективности его терапии,
г) прогнозирование его исхода, особенно эффективное при параллельной
оценке тяжести пациента согласно шкалам APACHEII, SOFA и MEDS.
4. Измерение уровней ПСП возможно оперативно проводить непосредственно
при поступлении пациента в ОНТ, ОИТ, ОРИТ и в операционном блоке (тестирование
Point-of-Care), что обеспечит своевременное принятие обоснованных клинических
Диагностические уровни пресепсина, пг/мл
| Уровень ПСП, пг/мл | Клинический диагноз |
| Сепсис может быть исключен. | |
| ≥300 | Системная инфекция (сепсис) возможны. |
| ≥500 | |
| ≥1000 | Высокий риск развития системной инфекции (тяжелого
сепсиса / септического шока). Высокий риск 30-дневной смертности, сравнимый с таковым 1. Levy MM, Fink MP, Marshall JC, et al. 2001 SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference. Crit Care Med. 2003;31(4):1250-6. 2. Bone RC, Balk RA, Cerra FB, et al. Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. The ACCP/SCCM Consensus Conference Committee. American College of Chest Physicians/Society of Critical Care Medicine. Chest. 1992;101(6):1644-55. 3. Shapiro NI, Wolfe RE, Moore RB, et al. Mortality in Emergency Department Sepsis (MEDS) score: A prospectively derived and validated clinical prediction rule. Crit Care Med. 2003;31(3):670-5. 4. Kumar A, Roberts D, Wood KE, et al. Duration of hypotension before initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock. Crit Care Med. 2006;34(6):1589-96. 5. Dellinger RP, Levy MM, Rhodes A, et al. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012. Crit Care Med. 2013;41(2):580-637. 6. Shozushima T, Takahashi G, Matsumoto N, et al. Usefulness of presepsin (sCD14-ST) measurements as a marker for the diagnosis and severity of sepsis that satisfied diagnostic criteria of systemic inflammatory response syndrome. J Infect Chemother. 2011;17(6):764-9. 7. Spanuth E, Wilhelm J, Loppnow H, et al. Diagnostic and Prognostic Value of Presepsin (Soluble CD14 Subtype) in Emergency Patients with Early Sepsis Using the New Assay PATHFAST Pesepsin. IFCC World Lab/EuroMedLab. 2011 May. 8. Naitoh K, Shirakawa K, Hirose J, et al. The new sepsis marker, sCD14-ST (PRESEPSIN), induction mechanism in the rabbit sepsis models. SEPSIS 2010; poster:P-19. 9. Yaegashi Y, Shirakawa K, Sato N, et al. Evaluation of a newly identified soluble CD14 subtype as a marker for sepsis. J Infect Chemother. 2005;11(5):234-8. 10. Kojika M, Takahashi G, Matsumoto N, et al. Serum levels of soluble CD14 subtype reflect the APACHE II and SOFA Scores. Medical Postgraduates 2010;48(1):46-50. 11. Liu B, Chen YX, Yin Q, et al. Diagnostic value and prognostic evaluation of Presepsin for sepsis in an emergency department. Crit Care. 2013;17(5):R244. 12. Mussap M, Puxeddu E, Burrai P et al. Soluble CD14 subtype (sCD14-ST) presepsin in critically ill preterm newborns: preliminary reference ranges. J Matern Fetal Neonatal Med. 2012;25(Suppl 5):51-3. 13. Endo S, Suzuki Y, Takahashi G, et al. Presepsin as a powerful monitoring tool for the prognosis and treatment of sepsis: A multicenter prospective study. J Infect Chemother. 2013, 14. Masson S, Caironi P, Spanuth E, et al. Presepsin (soluble CD14 subtype) and procalcitonin levels for mortality prediction in sepsis: data from the Albumin Italian Outcome Sepsis trial. Crit Care. 2014;18(1):R6.
За последние 10 лет значительно улучшились методы диагностики, что позволило начинать лечение сепсиса раньше, но летальность продолжает увеличиваться. G. Martin и соавт. (2009) проанализировали более 11 000 пациентов с тяжелым сепсисом, среди которых 57 % страдали от грамотрицательной, 44 % — от грамположительной и 11 % — от грибковой инфекции. Легкие были первичным источником инфекции у 47 % больных, абдоминальная инфекция — у 23 %, инфекция мочевыводящих путей — у 8 %. Общая смертность достигала почти 50 %. Приоритетом продолжают быть ранняя диагностика и наблюдение за больными с риском развития сепсиса. Первым шагом к пониманию патогенеза сепсиса стало определение таких понятий, как синдром системной воспалительной реакции (ССВР), сепсис, тяжелый сепсис, септический шок и синдром полиорганной недостаточности, которое впервые было дано на Конференции American College of Chest Physicians / Society of Critical Care Medicine Consensus в 1991 г. ССВР развивается в результате взаимодействия про- и антивоспалительных медиаторов воспалительного ответа. Термин ССВР соответствовал широкому спектру этиологических факторов, помимо инфекции. Неинфекционные причины ССВР — лихорадка, хирургическое вмешательство, травма, панкреатит и др. Клиническая практика показала, что концепция ССВР была слишком чувствительна и недостаточно специфична. Группа пациентов с диагнозом ССВР была гетерогенна для выработки критериев диагностики и лечения. В 2003 г. была предложена новая концепция условий для определения сепсиса — PIRO (Р — predisposition (предрасположение), I — infection (инфекция), R — response (ответ), О — organ dysfunction (органная дисфункция)). Данная концепция позволила более точно определять пациентов с сепсисом и оценивать степень тяжести заболевания. Однако изменения концепции сепсиса не позволяют окончательно решить существующие проблемы ранней постановки диагноза. Более того, из-за применения антибиотиков, предшествовавшего взятию крови, гемокультура часто дает ложноотрицательный результат. Отсутствует возможность оценки вклада некультивируемых микроорганизмов в инфекционно-воспалительный процесс, что ограничивает диагностические возможности метода. Существуют более современные высокоточные методики диагностики инфекций, такие как полимеразная цепная реакция (ПЦР), которые позволяют идентифицировать микроорганизмы за счет многократного копирования специфических последовательностей генетического материала. Методом ПЦР можно обнаружить бактериальную и грибковую ДНК намного быстрее и с более высокой чувствительностью. Более того, не требуется предшествующая инкубация или получение чистой культуры, вследствие чего лаборатория может выдать результат в течение нескольких часов (1—6 ч) с момента взятия образца на исследование. Кроме этого, именно генетический код определяет резистентность микроорганизмов к действию антибиотиков, например, ген mec для метициллин-резистентного золотистого стафилококка. Дополнительным преимуществом диагностики является независимость от проводимой антимикробной терапии, а также большая вероятность получения достоверного результата в случае микст-инфекции по сравнению с классическим исследованием крови на стерильность. К сожалению, эта методика еще не получила должного распространения в связи со своей относительно высокой стоимостью. Данные проблемы привели к поиску лабораторных маркеров, которые могут быть связаны с наличием инфекции в организме, уровнем воспалительной реакции и сепсисом. На настоящий момент основными из этих маркеров являются С-реактивный белок (СРБ), интерлейкин-6 (ИЛ-6), прокальцитонин (РСТ), пресепсин (P-SEP) и новый биологический маркер neutrophil CD64. С-реактивный белок, открытый в 1930 г., — белок, относящийся к пентраксинам, синтез которого происходит в печени под влиянием ИЛ-6 и других цитокинов. При воспалении концентрация СРБ в плазме крови увеличивается в сотни раз, и существует прямая связь между изменением уровня СРБ, тяжестью и динамикой клинических проявлений воспаления. Однако данный механизм делает его крайне неспецифичным маркером, уровни которого могут повышаться при ССВР без наличия инфекции. Такая же проблема характерна для измерения уровня ИЛ-6, который синтезируется активированными макрофагами и Т-клетками. Как показывает исследование J. Schrode и соавт. (1999), повышение его уровня может быть связанно с тяжелым течением заболевания без инфекционных осложнений. Прокальцитонин, который был открыт в 1984 г., является предшественником кальцитонина, пептидного гормона парафолликулярных клеток щитовидной железы, не имеющим собственной функции. При массивном воспалительном инфекционном процессе, вызванном бактериальной и грибковой микрофлорой, уровень РСТ повышается без дальнейшего повышения уровня кальцитонина. Также было доказано, что при обширной воспалительной реакции инфекционного генеза РСТ вырабатывается разными типами клеток вне щитовидной железы. Этот процесс запускается после появления в крови большого количества провоспалительных цитокинов, в особенности ИЛ-6 и фактора некроза опухоли альфа, на фоне эндотоксемии. За 30 лет использования РСТ как маркера ССВР накопился большой опыт как ложноположительных, так и ложноотрицательных результатов. Как показывают работы В. Uzzan и соавт. (2006) и S. Hunziker и соавт. (2010), уровень РСТ может повышаться без наличия инфекции при массовой гибели клеток. В частности, после тяжелой травмы и хирургического вмешательства уровень РСТ быстро повышается, а затем, при отсутствии инфекции, снижается и приходит к норме через 3—5 дней. Также в работе М. Christ-Crain и соавт. (2005) было отмечено, что повышение РСТ при генерализации инфекции и развитии сепсиса часто происходит со значительной задержкой, что ведет к ложноотрицательным результатам. Пресепсин, или sCD14-ST, — относительно новый высокоэффективный маркер сепсиса, который был открыт 10 лет назад. CD14 — это поверхностный мембранный гликопротеин моноцитов/макрофагов, являющийся рецептором для комплексов липополисахарида и липополисахаридсвязывающего белка (LPS—LPB). Он активирует Toll-подобный рецептор 4 провоспалительного каскада для презентации антигена. Существуют 2 формы CD14: мембранная (mCD14) и растворимая (sCD14). Комплекс LPS— LPBP—sCD14 циркулирует с потоками крови, где расщепляется катепсином D и другими протеазами плазмы с высвобождением N-терминального фрагмента молекулярной массой 13 кДа — молекулы sCD14-subtype (sCD14-ST), названной P-SEP. Данному маркеру в последнее время уделяется особое внимание в связи с его высокой чувствительностью, специфичностью и малым временем реакции для появления в крови. По сравнению с другими маркерами P-SEP более чувствителен и специфичен в диагностике сепсиса. Проведенные исследования показали, что концентрация P-SEP в плазме значительно выше у инфицированных пациентов, чем у неинфицированных. Shozushima и соавт. (2011) обнаружили, что концентрация P-SEP составляла 333,5 + 130,6 пг/мл в группе ССВР, 721,0 + 611,3 пг/мл в группе с ограниченной инфекцией, 817,9 + 572,7 пг/мл в септической группе и 1992,9 + 1509,2 пг/мл в группе с тяжелым сепсисом. Концентрация P-SEP в крови между группами возрастала последовательно. Spanuth и соавт. (2011) изучали концентрацию P-SEP у больных, поступающих в приемный покой, и обнаружили, что она была значительно выше при тяжелом сепсисе, чем у септических пациентов средней тяжести. Более того, концентрация P-SEP коррелировала со шкалами APACHE II и SOFA. Для оценки значения 4 маркеров в диагностике сепсиса была использована ROC-кривая. AUC P-SEP составила 0,845. P-SEP был предпочтительнее РСТ (0,652), ИЛ-6 (0,672), и СРБ (0,815). При пороговом значении концентрации P-SEP 399 пг/мл чувствительность диагностики сепсиса была равна 80,3 %, а специфичность — 78,5 %, в то время как при пороговом значении 600 пг/мл чувствительность диагностики сепсиса составила 87,8 %, специфичность — 81,4 %, позитивная прогностическая величина — 88,6 %, негативная прогностическая величина — 80,3 %. Чувствительность P-SEP для диагностики сепсиса была равна 91,9 %, РСТ — 89,9 %, ИЛ-6 — 88,9 %, культуры крови — 35,4 %. Результаты проведенных исследований позволяют считать, что маркер P-SEP перспективен при диагностике сепсиса. P-SEP как биомаркер подходит не только для ранней диагностики сепсиса, но также для оценки его тяжести и прогноза. В исследовании ALBIOS у 100 пациентов с тяжелым сепсисом и септическим шоком определяли концентрацию P-SEP и РСТ. Средняя концентрация P-SEP в 1-й день мониторинга составила 2268 (1145—4305) пг/мл у умерших пациентов, что существенно выше, чем у выживших (1184 (855—2158) пг/мл; р = 0,001). На 7-й день у выживших пациентов уровень P-SEP существенно снизился — до 974 (674—1927) пг/мл, а у умерших он составлял 2551 (1438—5624) пг/мл (р = 0,02). Более того, уровень P-SEP коррелировал со шкалами SOFA, MOF и стабильностью гемодинамики. Девяностодневная смертность пациентов с высоким уровнем P-SEP была существенно выше, чем у больных с низким его уровнем (75 и 42 % соответственно). P-SEP опережал РСТ в оценке прогноза (AUC 0,69 и 0,56; р = 0,07). Другое исследование показало, что уровень P-SEP существенно различался в группах выживших и умерших пациентов, среди групп пациентов с сепсисом, тяжелым сепсисом и септическим шоком. P-SEP был точнее, чем ИЛ-6, СРБ и РСТ, в оценке риска смерти в течение 30 дней с момента начала развития сепсиса. Когда пороговое значение P-SEP составляло 1622 пг/мл, а пороговое значение РСТ — 13,43 нг/мл, в группе РСТ 23 % выживших пациентов и 40 % умерших не попадали в соответствующие группы. Основные принципы терапии сепсиса — это ранняя диагностика очага инфекции и раннее начало интенсивной терапии, в том числе антибактериальной (в течение 1 ч). Анализ на приборе PATHFAST (Япония) занимает 21 мин для обнаружения P-SEP, в качестве образцов в этом исследовании могут использоваться как цельная кровь с антикоагулянтами гепарином или этилендиаминтетраацетатом, так и сыворотка крови. В нескольких исследованиях показано, что циркулирующие уровни P-SEP повышаются при развитии системных инфекций и сепсиса, вызываемых грамположительными, грамотрицательными и грибковыми инфекциями. P-SEP имеет 100 % чувствительность к инфекциям, подтвержденным гемокультурами. Исследования показали, что чувствительность P-SEP, РСТ, и ИЛ-6 составляет 95,5; 95,5 и 100 % у пациентов с грамположительной бактериальной инфекцией и 77,8; 86,1 и 88,9 % соответственно при грамотрицательной микрофлоре. Чувствительность P-SEP существенно не различается между пациентами с грамположительной и грамотрицательной бактериальной инфекцией. Уровень P-SEP возрастал у больных с грибковой инфекцией, но не у пациентов с вирусной инфекцией. При вирусных инфекциях и при воспалительных процессах, не связанных с системными инфекциями, уровень P-SEP не повышался. При развитии сепсиса повышение циркулирующих концентраций P-SEP происходит раньше и быстрее, чем других маркеров сепсиса, а именно в течение 1,5—2,0 ч после начала системного ответа на инфекцию — раньше, чем повышение цитокина ИЛ-6, РСТ и СРВ. Время полужизни P-SEP в крови составляет 0,5—1,0 ч. Поэтому при мониторинге его уровень быстро и надежно отражает степень эффективности терапии, что позволяет оперативно принимать объективные клинические решения. Neutrophil CD64 — мембранный белок, гликопротеин, Fc-рецептор к мономерным иммуноглобулинам изотипа IgG с высокой аффинностью. CD64 постоянно экспрессирован только на макрофагах и моноцитах. Может экспрессироваться на гранулоцитах после активации клеток цитокинами, такими как интерферон-гамма и гранулоцитарный колониестимулирующий фактор. Наличие CD64 на поверхности нейтрофилов является признаком инфекции и сепсиса. Метаанализы по клиническому применению данного маркера продемонстрировали уровни его чувствительности и специфичности 85 и 76 % соответственно. Открытым остается вопрос о возможности применения биологических маркеров в контроле эффективности эмпирически назначенной антибиотикотерапии ж у больных сепсисом. В работе V. Nobre и соавт. (2008) сравнивали стандартный алгоритм назначения и отмены антибиотиков у больных сепсисом и алгоритм, ориентированный на уровень РСТ. Результаты демонстрируют, что при применении алгоритма, ориентированного на уровень РСТ, длительность антибиотикотерапии снижалась в среднем на 3,5 дня, время нахождения в отделении реанимации и интенсивной терапии уменьшалось в среднем на 2 дня. Различий в летальности в контрольной и основной группах не наблюдалось. По результатам ретроспективного рандомизированного исследования A. Hohn и соавт. (2013), за исследуемый период времени с появления РСТ в клинической практике — с 2005 по 2009 г. — средняя продолжительность антибиотикотерапии у больных с хирургическим сепсисом снижалась на 24 ч, а продолжительность искусственной вентиляции легких — на 48 ч за год. Хотя более высокая чувствительность и специфичность P-SEP по сравнению с РСТ у различных групп больных была продемонстрирована неоднократно, работы по клиническому использованию P-SEP при контроле эффективности антибиотикотерапии в доступной литературе не найдены. Сепсис является жизнеугрожающей проблемой, на решение которой приходится значительная часть расходов здравоохранения. Это гетерогенный процесс с выраженной индивидуальной вариабельностью, что усложняет его диагностику и лечение. Биологические маркеры и их комбинации помогают верифицировать диагноз вовремя и контролировать эффективность процесса лечения. Определение алгоритма практического применения маркеров сепсиса является перспективной клинической задачей.
Ранняя диагностика сепсиса имеет решающее значение для проведения успешной терапии. Применение эффективной антибиотикотерапии в течение первого часа после развития гипотензии при сепсисе связано с выживаемостью в 79,9 %. Каждый час задержки такой терапии в течение первых 6 часов снижает выживаемость на 7,6 %. Согласно статистическому анализу, именно время начала эффективной антибиотикотерапии — самый сильный предиктор исходов. Медианное время для начала эффективной терапии — 6 часов. В США только 50 % пациентов с септическим шоком получают эффективную антибиотикотерапию в течение первых часов после его документирования (данные на 2006 г.). Врожденный иммунитет — первый барьер для бактериальной инфекции Продуктом расщепления CD14, задействованного в активации врожденного иммунитета, является растворимый подтип CD14 (sCD14-ST), или пресепсин, который начинает циркулировать после активации защитных механизмов и поэтому является маркером инфекции. Определение концентрации пресепсина может быть полезным для ранней диагностики и прогнозирования системных инфекций у пациентов. Этот биомаркер обладает высокой специфичностью, что доказывается результатами многочисленных экспериментальных и клинических исследований, в которых для сравнения использовался прокальцитонин (ПКТ). Для диагностики некоторых форм маркеры инфекционных заболеваний иногда могут быть бесполезны (инфекции мочевыводящих путей, менингит), но их исследование можно использовать для постановки неточного диагноза. Острые инфекции довольно часто имеют неясное течение и осложняются синдромом системной воспалительной реакции (SIRS), который в данной ситуации является синонимом сепсиса, хотя стоит помнить, что SIRS может развиваться и без инфекции. Тяжелый сепсис сопровождается полиорганной недостаточностью, часто приводящей к смерти. Широкое разнообразие микроорганизмов и низкая специфичность симптомов часто приводят к нерациональному использованию антибиотиков. Поэтому разработка стратегий диагностики инфекций и оценка их тяжести по-прежнему является для врачей приоритетом. Безусловно лучший способ диагностировать инфекцию — это определить патоген в физиологически стерильной ткани. Типичной иллюстрацией может быть присутствие бактерий в мочевыводящих путях. В то время, как тесты на многие микробы и вирусы все еще разрабатываются, стратегии, основанные на этих тестах, не могут быть разработаны, и неясно, какое место они займут в практической медицине. Таким образом, использование маркеров воспаления может быть полезным для установления или исключения сепсиса, выявления пациентов, которые могут извлечь выгоду из конкретных методов лечения, а также для оценки динамики терапии и тяжести течения. C-реактивный белок (CРБ) и прокальцитонин (ПКТ) были широко изучены в отношении инфекций, хотя их полезность все еще остается спорной. Врачи интегрировали эти маркеры в свою повседневную практику, ведь CРБ и ПКТ косвенно свидетельствуют о реакции взаимодействия патогена и человека. В ответ на IL-6 (основной инициативный провоспалительный цитокин) печень начинает выработку CРБ, в то время как ПКТ выделяется и печенью, и моноцитами, хотя его функция до сих пор неясна. Несомненно, ПКТ и СРБ являются маркерами SIRS, хотя для ПКТ более характерна бактериальная этиология SIRS. Немного иммунологии Пресепсин, растворимый подтип CD14 или sCD14-ST, является продуктом расщепления CD14, который высвобождается после связывания с бактериальным антигеном. Пресепсин стабилен в общем кровотоке и может быть определен автоматическим анализатором.Таким образом, он представляет собой потенциальный биомаркер начальной стадии системной инфекции. Литературные данные показывают, что механизмы образования пресепсина являются специфичными для инфекции. Выживание видов зависит от способности их иммунной системы распознавать патогены и обеспечивать быстрый и эффективный ответ на вторжение. Такой ответ можно схематически разделить на врожденный и приобретенный. Хоть каждый из них обладает своим набором систем рецепторов, они имеют довольно тесную взаимосвязь. Врожденный и приобретенный иммунитеты соответствуют различным этапам иммунного ответа. Первый полагается на немедленную и эффективную защиту антимикробных пептидов, альтернативного пути комплемента и фагоцитоза. Эти эффекторы позволяют контролировать распространение патогенов. Активация врожденного иммунитета происходит после распознавания паттерна микроорганизма рецепторами и корецепторами на мембранах моноцитов-макрофагов. Рецепторы врожденного иммунитета генетически детерминированы, крайне консервативны и обладают широким спектром молекул, с которыми они имеют сродство, что и определяет их групповую специфичность. После связывания PAMP с рецепторами эффекторные клетки активируются напрямую без какой-либо предшествующей пролиферации. Поэтому можно считать, что врожденный иммунитет обеспечивает быстрый и эффективный ответ на микробную инвазию. Активация рецепторов врожденного иммунитета посредством внутриклеточных каскадов индуцирует экспрессию генов, ответственных за развитие дальнейшего иммунного ответа, и генов провоспалительных цитокинов. CD14 распознает различные семейства лигандов, включая липиды, пептидогликан и другие поверхностные структуры грамположительных и грамотрицательных бактерий. Наиболее изученным PAMP является бактериальный липополисахарид (ЛПС). Для эффективного распознавания ЛПС требуется его ассоциация с сывороточным белком ЛСБ (липопротеид-связывающий белок). Являясь корецептором, CD14 не может самостоятельно запустить сигнальный каскад, поэтому необходимо его сочетание с основным toll-like рецептором (TLR), при котором образуется мультимолекулярный комплекс CD14-ЛПС-ЛСБ, активизирующий внутриклеточный сигналинг. После активации TLR моноцит-макрофаг фагоцитирует бактериальный паттерн, связанный с рецептором, а CD14 модулирует этот процесс. Далее экспрессия CD14 на мембране моноцитов снижается посредством протеолиза и интернализации, образуя небольшой растворимый пептид.
Продукт расщепления CD14 был назван растворимым CD14-подтипом (sCD14-ST), или пресепсином. Кроме того, sCD14-ST описан как регуляторный фактор. Он может модулировать клеточный и гуморальный иммунный ответ, взаимодействуя непосредственно с Т- и В-клетками. Циркулирование пресепсина может быть расценено как активация системы моноцит-макрофаг. Стоит помнить, что существуют базовая и физиологическая активности этих клеток, которые предполагают наличие пресепсина у здоровых людей. Поэтому концепция этого биомаркера подразумевает, что концентрация пресепсина должна быть определена у здоровых и больных людей, у которых она увеличивается на ранней стадии бактериальной инфекции, и это увеличение должно зависеть от интенсивности врожденного иммунитета. Пресепсин как ранний маркер при инфекционных заболеваниях Циркулирующие sCD14 определялись у людей с системной инфекцией, связанной с энтеробактериями, а также у новорожденных и взрослых для оценки тяжести сепсиса. В 2005 году пресепсин был описан как высокоспецифичный маркер в отношении сепсиса.Этот новый биомаркер, обнаруживаемый с помощью обычного иммуноанализа, значительно увеличивается в плазме крови на ранних стадиях сепсиса. Сегодня имеется не так много данных о кинетике пресепсина, о том, как долго устойчив его уровень во время сепсиса и особенностях его колебания. В экспериментальной модели сепсиса на кролике (лигирование и прокол слепой кишки с последующим развитием перитонита) пресепсин обнаруживался в крови животного уже через два часа после начала эксперимента. Было выяснено, что уровень пресепсина повышался раньше, чем IL-6 и ПКТ, с пиком через 3 часа и устойчивым повышением в течение по меньшей мере 5 часов. В другой работе концентрация пресепсина изучалась после стимуляции ЛПС моноцитов, собранных у 5 здоровых добровольцев. В клетках линии THP1 пресепсин был обнаружен через час после воздействия ЛПС, а его концентрация достигла максимума через 3 часа. В течение первого часа на линии PMNC наблюдалась секреция пресепсина одновременно с высвобождением IL-6. Также было описано, что при ожогах уровень пресепсина начинает увеличиваться раньше, чем ПКТ и СРБ, и остается повышенным в течение 7 дней. Все эти результаты подтверждают потенциальную пользу пресепсина в раннем обнаружении инфекционных заболеваний.
Рисунок 1 | Кинетика концентраций пресепсина (ПСП), ФНО-альфа, ИЛ-10, ИЛ-6, ПКТ и СРБ при индукции у лабораторных животных системного воспаления инфекционной природы Пресепсин в оценке инфекционного поражения По результатам исследований было установлено, что для выявления пациентов с инфекцией минимальное значение 399 пг/мл имеет хорошую чувствительность (80,3 %) и специфичность (78,5 %), а также лучшую эффективность, нежели другие биомаркеры, в число которых входят CРБ и ПКТ. Однако превосходство пресепсина не было показано во всех исследованиях, что может быть связано с особенностями возбудителя и течением инфекции. Пресепсин показал лучшую эффективность по сравнению с ПКТ, оценивая 60-дневную летальность у 105 пациентов с сепсисом, но ПКТ достоверно показывал на преддиагностическую точность. Кажется очевидным, что концентрация пресепсина увеличивается в ответ именно на инфекцию, ведь его уровень был значительно ниже у 41 пациента с несептическим SIRS (333,5 пг/мл). Интересно, что у этих пациентов концентрации пресепсина не отличались от 22 нормальных участников (294,2 пг/мл) и 128 контролей (190 пг/мл). В 83, по сравнению с 106, случаях сепсиса пресепсин обладал хорошей чувствительностью, но посредственной (61,9 %) специфичностью в отношении выявления инфекции при минимальной концентрации 600 пг/мл. Так как CD14 присутствует на мембранах циркулирующих моноцитов, можно предположить, что их количество может влиять на уровень пресепсина. Однако было установлено, что уровень пресепсина не коррелирует с количеством лейкоцитов.
В нескольких исследованиях сравнивались уровни пресепсина у пациентов с положительным и отрицательным посевами крови, и интересно, что пациенты с бактериемией имели более высокие концентрации пресепсина. Также стоит отметить одно исследование, в котором только ПКТ показывал значительную разницу между грамположительными и грамотрицательными результатами посева крови: в последнем он был более высокий уровень. Ни пресепсин, ни ПКТ не могли дифференцировать инфекцию, вызванную S. aureus, от инфекции, вызванной E. coli. Однако было установлено, что у пациентов с кандидемией по сравнению с пациентами с отрицательным посевом крови уровень пресепсина значительно выше. Это наблюдение подтверждает вероятность влияния природы патогена и степени его инвазии на уровень пресепсина. Как было выявлено в исследованиях несептических пациентов, эффективность пресепсина может снижаться у пациентов с почечными заболеваниями. Также было показано, что оценка пресепсина вместе с ПКТ имеет большую диагностическую ценность, нежели их оценка поодиночке. Пресепсин в оценке прогноза Постепенное повышение уровня пресепсина связано со степенью тяжести инфекции. Исследователи из Японии выяснили, что средняя концентрация пресепсина составляет 721 пг/мл для местных инфекций, 818 пг/мл для сепсиса и 1993 пг/мл для тяжелого сепсиса. Пресепсин показал значительную способность диагностировать сепсис и септический шок. Комбинирование определения пресепсина с обычными системами оценки тяжести состояния улучшало их эффективность в выявлении более тяжелых пациентов. Пресепсин также можно использовать для прогнозирования риска смерти: его показатели для определения риска смерти близки к таковым у ПКТ. В заключение стоит еще раз отметить, что пресепсин повышается раньше других маркеров сепсиса до его клинической манифестации, и его повышение не регистрируется при неинфекционных поражениях, а также его можно использовать для оценки динамики тяжести состояния.
Рисунок 2 | Связь уровней пресепсина и показателей тяжести критических пациентов согласно шкалам оценки тяжести критических пациентов
Рисунок 3 | Кинетика уровней пресепсина, ПКТ, ИЛ-6 и СРБ у септических пациентов с благоприятным и неблагоприятным прогнозом течения сепсиса согласно шкале SOFA. А – пресепсин, В – ПКТ, С – ИЛ-6, D – СБР, измерения при поступлении, на 3 и 7 день Источники : Читайте также:
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу. Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
|