Бактероиды что это такое если обнаружено в анализах
В толстой кишке у здорового человека микроорганизмы, составляющие основу микрофлоры, представлены анаэробами: бифидобактериями и лактобактериями, а также аэробами - кишечной палочкой (E. coli) с нормальными ферментативными свойствами. Эти микроорганизмы обеспечивают стабильность нормальной микрофлоры и предотвращают заселение толстого кишечника посторонними микроорганизмами.
Условно-патогенные микроорганизмы, обитающие в кишечнике, представители семейства энтеробактерий: клебсиеллы, энтеробактер, протей, цитробактер, синегнойная палочка, стафилококки и др., составляют значительную часть нормальной аэробной (нуждающейся для развития в притоке кислорода) флоры кишечника и обычно не вызывают заболеваний, а наоборот, участвуют в обеспечении его нормального функционирования. Но когда их количество превышает норму, это может вызвать кишечные расстройства.
| Микрофлора | Норма у детей | |
|---|---|---|
| Младше года | Старше года | |
| Патогенные энтеробактерии | 0 | 0 |
| Общее количество кишечной палочки | 300 - 400 млн/г | 400 -1млрд/г |
| Кишечная палочка с нормальной ферментативной активностью (эшерихии) (Escherichia coli). | 10 7 –10 8 | 10 7 –10 8 |
| Кишечная палочка со слабо выраженными ферментативными свойствами | 10 –10 11 | 10 9 –10 10 |
| Лактобактерии | 10 6 –10 7 | 10 7 –10 8 |
| Бактероиды | 10 7 –10 8 | 10 9 –10 10 |
| Энтерококки | 10 5 –10 7 | 10 5 –10 8 |
| Эубактерии | 10 6 –10 7 | 10 9 –10 10 |
| Пептострептококки | 5 | 10 9 –10 10 |
| Клостридии | 3 | 5 |
| Стафилококк золотистый (S. aureus) | 0 | 0 |
| Стафилококки (сапрофитный эпидермальный) | 4 | 4 |
| Дрожжеподобные грибы рода Candida | 3 | 4 |
| Другие условно-патогенные энтеробактерии | ||
| Клебсиелла (Klebsiella) | 4 | 4 |
| Энтеробактер (Enterobacter) | 4 | 4 |
| Графния (Hafnia) | 4 | 4 |
| Серрация (Serratia) | 4 | 4 |
| Протей (Proteus) | 4 | 4 |
| Morganella | 4 | 4 |
| Providecia | 4 | 4 |
| Цитробактер (Citrobacter) | 4 | 4 |
| Неферментирующие бактерии | ||
| Псевдомонады (Pseudomonas) | 3 | 4 |
| Ацинетобактер (Acinetobacter) | 3 | 4 |
Патогенные энтеробактерии - являются причиной большого числа различных заболеваний человека. К ним относятся бактерии, которые вызывают острую кишечную инфекцию (ОКИ): сальмонеллы, шигеллы – возбудители дизентерии. Выявление этих микроорганизмов является показателем серьезного инфекционного заболевания кишечника. Кишечная палочка (эшерихия коли, сокращенное e. coli) - входит в состав нормальной микрофлоры желудочно-кишечного тракта человека.
Снижение общего количества кишечной палочки может быть признаком присутствия в кишечнике таких паразитов как глисты.
Кишечная палочка со сниженной ферментативной активностью - это неполноценная кишечная палочка, от которой нет ни вреда, ни пользы. Однако присутствие показателя больше нормы является признаком начинающегося дисбактериоза.
В фекалиях здорового ребенка кишечные палочки (типичные) выявляются в количестве 10 7 —10 8 кое/г, при этом количество лактозонегативных кишечных палочек не должно превышать 10 5 кое/г, а гемолитические (гемолизирующие) кишечные палочки должны отсутствовать.
Гемолитические (гемолизирующие) кишечные палочки способны вырабатывать токсины, действующие на нервную систему и на кишечник, могут вызвать аллергические и кишечные проблемы, в норме должны отсутствовать
Лактозонегативные энтеробактерии - группа условно-патогенных бактерий, мешающая нормальному пищеварению и вызывающие диспептические явления у ребенка, то есть изжогу, отрыжку, чувство давления или распирания в животе. Их количество не должно превышать 5% (или в титрах: 10 4 – 10 5 – умеренное повышение).
Лактобактерии - один из важнейших в группе молочнокислых бактерий, расщепляют лактозу (молочный сахар) и препятствуют развитию лактазной недостаточности, поддерживают кислотность толстой кишки на уровне 5,5–5,6 рН. Лактобактерии активируют фагоцитоз (процесс, при котором специальные клетки крови и тканей организма (фагоциты) захватывают и переваривают возбудителей инфекционных заболеваний и отмершие клетки). Лактобактерии входят в состав материнского молока.
Бифидобактерии — важнейший представитель микрофлоры организма человека; в толстой кишке детей составляют около 95 % популяции бактерий. Бифидобактерии угнетают рост болезнетворных бактерий, тормозит их рост и размножение, поэтому дефицит бифидобактерий является одним из патогенетических факторов длительных кишечных нарушений у детей. Различные штаммы бифидобактерий и бактероиды появляются в желудочно-кишечном тракте спустя 10 дней после рождения. Дети, рожденные путём кесарева сечения, имеют значительно более низкое содержание бактерий, чем появившиеся естественным путем. Существенное снижение количества бифидобактерий – признак выраженного дисбактериоза.
Энтерококки входят в состав нормальной микрофлоры желудочно-кишечного тракта человека, однако они являются также и возбудителями инфекций мочевыводящих путей, инфекций органов малого таза. При избыточном росте энтерококков рекомендовано применение бактериофагов. Энтерококки присутствуют в кишечнике в количествах 10 5 – 10 8 кое/г фекалий и в норме не должны превышать общее количество кишечных палочек.
Клостридии входят в состав нормофлоры желудочно-кишечного тракта.
Протей - представитель нормальной, условно-патогенной микрофлоры кишечника. Протеи считаются санитарно-показательными бактериями. Количество обнаруживаемых протей рассматривают как показатель загрязнения. Пути передачи - внутрибольничное заражение, а также - заражение при несоблюдении правил личной гигиены.
Клебсиелла — условно-патогенная бактерия семейства энтеробактерий, входящая в состав нормальной микрофлоры желудочно-кишечного тракта, но может вызывать ряд гастроэнтерологических заболеваний. Клебсиеллез является одной из распространенных внутрибольничных инфекций. При больших титрах лечение проводят бактериофагами.
Цитробактер, энтеробактер, протеи, клебсиеллы и другие при снижении иммунитета организма могут приводить к изменению функции кишечника, формированию воспалительных процессов в различных органах.
Бактероиды - это условно-патогенные бактерии, представители нормальной микрофлоры человека. Заселение кишечника бактероидами происходит постепенно. Они обычно не регистрируются в бактерийных картах фекалий у детей первого полугодия жизни; у детей в возрасте от 7 месяцев до 1 - 2 лет содержание бактероидов не превышает 10 8 кое/г. Роль бактероидов до конца не выяснена, но установлено, что они принимают участие в пищеварении, расщепляют желчные кислоты, участвуют в процессах липидного обмена.
Стафилококки - негемолитические (эпидермальные, сапрофитирующие) - входят в группу сапрофитной микрофлоры, попадающей в организм из объектов окружающей среды. Количество их не должно превышать 10 4 кое/г фекалий.
Золотистый стафилококк грудничку может попасть через грудное молоко. Даже небольшие его количества может вызвать выраженные клинические проявления (сильнейший понос, рвоту, боли в животе), особенно у детей первых месяцев жизни. Поэтому в нормах, приведенных в бланке анализа, указывается, что его быть не должно. Патогенность золотистого стафилококка напрямую зависит от состояния нормальной флоры: чем больше бифидобактерий, лактобактерий и нормальной кишечной палочки, тем меньше вреда от стафилококка.
В клинической картине дисбактериоза кишечника, обусловленного стафилококком, отмечаются симптомы, связанные с интоксикацией и воспалительным процессом, развивающимся в кишечнике: повышение температуры (до 39 °C) с ознобом и потливостью, головная боль, слабость, плохой аппетит, нарушение сна, постоянная или схваткообразная боль в животе, жидкий обильный стул с кровью и слизью. Частота стула - до 7 - 10 раз в сутки. Регистрируется вздутие живота, длительная болезненность по ходу толстого кишечника, спазм. Изменения крови характеризуются увеличением количества лейкоцитов, сдвигом лейкоцитарной формулы влево и повышением СОЭ, снижением альбуминовой и повышением глобулиновой фракций, а при тяжелом течении - снижением содержания общего белка (до 6,1 г/л).
Дрожжеподобные грибы рода Candida - повышение титров может быть после применения антибиотиков. Если количество грибов повышено, а количество нормальной кишечной флоры резко снижено, при этом отмечается кандидоз (молочница) видимых слизистых оболочек (ротовая полость, половые органы) – это проявления системного кандидоза, то есть имеется инфицирование грибами кишечника.
При обнаружении в посевах дрожжеподобных грибов рода Candida до 10 7 кое/г фекалий ситуация оценивается как дисбактериоз кишечника. Если в посевах определяется более 10 7 кое/г фекалий и клиническая картина свидетельствует о генерализации процесса (поражение кожи, слизистых оболочек и внутренних органов), такие случаи рассматриваются как кандидомикоз или кандидомикозный сепсис.
При кандидомикозе у детей боль локализируется в области пупка, в животе чувство вздутия и тяжести. Стул жидкий или кашицеобразный со слизью, иногда с кровью или пенистый, с наличием беловато-серых или серовато-зеленых микотических комочков или пленок до 6 раз и более в сутки.

Бактероиды (лат. Bacteroides) — род грамотрицательных анаэробных бактерий. Бактероиды — наиболее типичные нормальные обитатели кишечника человека, составляющие около половины всей его микрофлоры. Бактероиды полиморфны, часто имеют форму палочки с закругленными концами размером 1–3 на 0,5–0,8 мкм. Бактероиды не образуют спор, но могут образовывать капсулы.
В связи с трудностью анаэробного культивирования и, следовательно, с высокой стоимостью исследования бактероиды при анализах во многих лабораториях не определяются (Ардатская М.Д., Минушкин О.Н.). Бактероиды — антагонисты шигелл, сальмонелл, некоторых видов эшерихий (Лобзин Ю.В. и др.).
Основными продуктами брожения являются уксусная кислота, изовалериановая кислота, янтарная кислота.
Различные штаммы бактероидов появляются у человека спустя 10 дней после рождения (Хавкин А.И. и др.). Основное место обитания бактероидов в человеческом организме — толстая кишка. В кале здоровых людей обнаруживается следующее количество бактероидов:
- у детей первого года — 10 7 –10 8 КОЕ/г
- у детей старше года и взрослых — 10 9 –10 10 КОЕ/г
- у пожилых — 10 10 –10 11 КОЕ/г

Наиболее часто и в заметном количестве в кишечнике здорового человека обнаруживают следующие виды бактероидов: Bacteroides vulgatus, Bacteroides dorei, Bacteroides uniformis и Bacteroides ovatus. Эти виды некоторые исследователи включают в так называемое филогенетическое ядро микрофлоры толстой кишки человека (см. рисунок выше; данное исследование относится к английской популяции, но и в других популяциях наблюдается близкая картина).
Присутствуя в организме человека бактероиды могут вызывать различные гнойно-воспалительные заболевания после травм, оперативных вмешательств, инструментальных исследований, при онкопатологиях или иммунодефиците, такие как перитонит, абсцессы, эндокардит, сепсис, тонзиллит, пародонтоз, анальная трещина и другие. Бактероиды являются причиной более чем половины всех внутрибрюшинных анаэробных инфекций.
Наиболее изучены патогенные свойства бактероидов вида Bacteroides fragilis. Этот вид может вызывать как внутрибрюшинные инфекции, такие как перитонит, хронический язвенный колит, но и синовиит, сальпингит, болезнь Рейтера, хронический тонзиллит. Бактероиды часто вызывают поражение женских внутренних половых органов: цервициты, эндометриты, аднекситы, инфекции в малом тазу. Обнаруживают бактероиды и при простатитах, хронически протекающих осложнённых уретритах у мужчин, у пациентов с упорным течением заболевания и частыми рецидивами.
Ассоциация бактероидов с Gardnerella vaginalis, Mobiluncus характерна для бактериального вагиноза.
Бактероидные инфекции лечатся метронидазолом, тинидазолом, левомицетином, эритромицином, рифаксимином.
Бактероиды устойчивы к аминогликозидам (стрептомицину, гентамицину, канамицину, мономицину). Большинство штаммов бактероидов устойчивы к тетрациклину. Доксициклин активен в отношении некоторых штаммов бактероидов, но большинство штаммов Bacteroides fragilis к нему устойчивы. В отношении бактероидов активен линкомицин.
Антимикробные препараты, к которым Bacteroides, по данным Дворецкого Л.И.:
- чувствительны: пенициллин G, амоксициллин + клавулановая кислота, мезлоциллин, пиперациллин, импенем, цефтриаксон, эритромицин, клиндамицин, хлораменикол, фузидин, офлоксацин, метронидазол
- слабочувствительны: карбенициллин, цефотаксим, цефтазидим, доксициклин, новобицин
- не чувствительны: оксациллин, клоксациллин, диклоксациллин, ампициллин, амоксициллин, цефазолин, цефалотин, цефамандол, цефоперазон, цефалексин, цефаклор, гентамицин, амикацин, тобрамицин, канамицин, эритромицин, азитромицин, ванкомицин, полимиксин В, рифампицин, ципрофлоксацин, пефлоксацин, триметроприм, котримоксазол, амфотерицин В, кетоконазол, флуцитозин.

Чувствительность Bacteroides spp. к антибактериальным препаратам (Косинец В.А.)
По современной систематике род бактероиды входит в семейство Bacteroidaceae, порядок Bacteroidales, класс Bacteroidia, тип Bacteroidetes, Bacteroidetes/Chlorobi group, Fibrobactere-Chlorobi-Bacteroidetes superphylum, царство Бактерии.
В состав рода бактероиды входят виды: B. acidifaciens, B. barnesiae, B. caccae, B. caecicola, B. caecigallinarum, B. cellulosilyticus, B. caecimuris, B. clarus, B. coprocola, B. coprophilus, B. coprosuis, B. denticanum, B. dorei, B. eggerthii, B. faecichinchillae, B. faecis, B. finegoldii, B. fluxus, B. fragilis, B. galacturonicus, B. gallinaceum, B. gallinarum, B. graminisolvens, B. helcogenes, B. heparinolyticus, B. intestinalis, B. luti, B. massiliensis, B. mediterraneensis, B. neonati, B. nordii, B. oleiciplenus, B. ovatus, B. paurosaccharolyticus, B. plebeius, B. propionicifaciens, B. pyogenes, B. reticulotermitis, B. rodentium, B. salanitronis, B. salyersiae, B. sartorii, B. stercorirosoris, B. stercoris, B. thetaiotaomicron, B. timonensis, B. uniformis, B. vulgatus, B. xylanisolvens, B. xylanolyticus, B. zoogleoformans.
Ранее к роду бактероиды относился целый ряд видов, впоследствии реклассифицированые в виды рода Prevotella. В частности, Bacteroides melaninogenicus и Bacteroides intermedius были реклассифицированы в Prevotella melaninogenica и Prevotella intermedia. Вид Bacteroides urealyticus перенесён в род Campylobacter и назван Campylobacter ureolyticus, виды Bacillus necrogenes, Bacteroides freundii и Bacteroides russii перенесены в род Fusobacterium и названы Fusobacterium necrogenes, Fusobacterium mortiferum и Fusobacterium russii, виды Bacteroides distasonis, Bacteroides goldsteinii и Bacteroides merdae реклассифицированы в виды Parabacteroides distasonis, Parabacteroides goldsteinii и Parabacteroides merdae рода парабактероидов, соответственно. Вид Bacteroides termitidis — в Sebaldella termitidis, Bacteroides corrodens — в Eikenella corrodens, Bacteroides hypermegas — в Megamonas hypermegale и т.д.
Струкова Л.А. (специалист по продукции), Атрошкина М. Е. (научный сотрудник) OOO НПФ "Литех"
В настоящее время отмечается значительное увеличение доли инфекционных заболеваний, в патогенезе которых ведущую роль играют анаэробные бактерии. Подобные инфекции, как правило, полимикробные, при этом анаэробные возбудители встречаются в ассоциации с другими анаэробными или аэробными микроорганизмами.
Выявление анаэробных микроорганизмов традиционно является серьезной проблемой для клинической бактериологической лаборатории. Большинство видов плохо культивируются или не культивируются вообще, кроме того стандартные микробиологические методы длительны по времени и их результаты становятся известны лишь на 3 – 4 день от момента взятия материала. Однако, во многих случаях, в частности при развитии анаэробной инфекции в ранах у хирургических больных, времени на длительные исследования просто нет, поскольку необходим срочный выбор адекватной антибактериальной терапии.
Ускорить диагностику и облегчить понимание генетических основ патогенности и антибиотикорезистентности анаэробных бактерий, вызывающих тяжелые инфекции человека, возможно путем применения в практике бактериологических лабораторий новых методов на основе анализа генетического материала бактерий, в частности метода полимеразной цепной реакции (ПЦР) (1).
Возбудителей анаэробных инфекций принято разделять на 2 группы. К первой группе относят спорообразующих анаэробов, или клостридий. Вторая группа представлена неспорообразующими, или неклостридиальными, анаэробами (бактероиды, фузобактерии, пептококки, пептострептококкиидр.).
Анализ видового состава бактерий, выделяемых из очагов воспаления с участием анаэробной микрофлоры, показал, что среди неспорообразующих анаэробов основную долю составляют Bacteroides fragilis (85,7 %), Peptococcus spp. (71,4 %), Peptostreptococcus spp. (69,8 %), Prevotella melaninogenica (68,7 %), Fusobacterium nucleatum (42,6 %) Частота выделения неспорообразующих анаэробов при тяжелых гнойных заболеваниях колеблется от 57,1 % до 98,8 % в зависимости от характера и локализации патологического процесса. (2).
1. Бактопол-1 (Bacteroides caccae);
2. Бактопол-2 (Bacteroides distasonis, merdae);
3. Бактопол-3 (Bacteroides eggerthii, stercoris, uniformis);
4. Бактопол-4 (Bacteroides fragilis ,vulgatus, thetaiotomicron, ovatus);
5. Бактопол-токсин (Bacteroides fragilis toxin, BFT).
На сегодняшний день к роду Bacteroides spp. относят 14 видов, 10 из которых принадлежат к группе B. fragilis: B. caccae, B. distasonis, B. eggerthii, B. fragilis, B. merdae, B. ovatus, B. stercoris, B. thetaiotaomicron, B. uniformisи B. vulgatus. Присутствуя в организме человека, бактероиды могут вызывать различные гнойно-воспалительные заболевания (перитонит, абсцессы, эндокардит, сепсис, тонзиллит, пародонтоз, поражения костей и суставов) после травм, оперативных вмешательств, инструментальных исследований, при онкопатологиях или иммунодефиците. Бактероиды являются причиной заболеваний женских внутренних половых органов: цервицитов, эндометритов, инфекций малого таза. Обнаруживают бактероиды и у мужчин (примерно у 6 % пациентов с осложненным постгонорейным уретритом), у больных с хроническим течением заболевания и частыми рецидивами. У детей наличие бактероидов отмечено при перитонитах, остеомиелитах, целлюлитах, бактериемии. Бактероиды могут быть ассоциированы с болезнью Крона (B. vulgatus) и другими заболеваниями кишечника (B. fragilis , B. thetaiotaomicron и B. caccae) (3). Смертность при бактериемии, вызванной Bacteroides, может составлять до 50% в зависимости от выявленного вида ( В. thetaiotaomicron> B. distasonis> B. fragilis); и пока не ясно, связано ли это с различиями в факторах вирулентности или с антимикробной чувствительностью (4). Несомненно, уровень смертности может быть существенно снижен за счет своевременной диагностики инфицирования бактероидами и назначения этиотропной антимикробной терапии.
В патогенезе анаэробных инфекций важную роль играет воздействие бактериальных токсинов на ткани и органы человека (2). Изоляты B. fragilis, выделяемые, как правило, при сепсисе и желудочно кишечных заболеваниях, продуцируют токсин -Bacteroides fragilis toxin, BFT, который является цинковой металлопротеазой с молекулярным весом 20 kDa. Энтеротоксигенные штаммы могут продуцировать три варианта (изотипа) энтеротоксинов, кодируемых генами bft-1, bft-2 и bft-3 (5). Энтеротоксигенные штаммы с высокой частотой выделяют также у пациентов с инфекциями легких, крови и при абсцессах. Энтеротоксин разрушает клеточные контакты между эпителиальными клетками и является потенциальной причиной диареи (до 10% случаев) (6). Продуцирующие энтеротоксин изоляты B. fragilis обнаружены у детей младшего возраста, страдающих диареей (1-5 лет) (3). Тем не менее, некоторые клинические исследования свидетельствуют, что до 20 % человеческой популяции являются асимптоматическими носителями энтеротоксигенных штаммов (5).
Лабораторная диагностика анаэробной инфекции в среднем занимает от 7 до 10 суток, что не может удовлетворять клиницистов. Основными способами диагностики анаэробной инфекции являются биохимический, культуральный, микроскопический, газожидкостной хроматографии, люминесцентной микроскопии, способы определения токсинов анаэробов в отделяемом из ран и крови больных. Но всем этим способам присущи те или иные недостатки: длительность исследования, малая точность, громоздкость анализа, неотработанность методик и др.
В последнее время накапливается все больше информации об успешном применении метода ПЦР для быстрого и качественного обнаружения бактерий рода Bacteroides по сравнению с традиционными способами идентификации анаэробных микроорганизмов. ПЦР-диагностика занимает всего несколько часов и отличается высокой чувствительностью и специфичностью. При изучении 400 образцов хирургической раневой инфекции путем количественной ПЦР в режиме реального времени (кРВ-ПЦР) Tong J. с соавт. в 132 образцах (33%) идентифицировали виды Bacteroides spp (7). Методом культивирования бактероиды были обнаружены только в 31 образце (8%). B. uniformis был наиболее распространенным видом (44 положительных образца) по результатам кРВ-ПЦР, в то время как метод культивирования идентифицировал эту бактерию как B. fragilis (16 положительных образцов). Данное исследование подтвердило, что ПЦР является быстрым, специфичным и чувствительным методом, который имеет большой потенциал для выявления группы B. fragilis и родственных организмов в образцах ран.
Liu C. и соавт. представили новую схему для идентификации 10 видов бактероидов из группы Bacteroides fragilis с помощью мультиплексной ПЦР. В результате были идентифицированы 155 изолятов этой группы, ранее определенных с помощью стандартных фенотипических тестов (8). Эффективность стандартных способов идентификации составила всего 84.5%. Таким образом, мультиплексная ПЦР оказалась простым, быстрым и надежным методом для определения видов группы B.fragilis. Этот метод может позволить более точно определять роль представителей этой группы в развитии инфекций и их степень устойчивости к противомикробным препаратам.
Для обнаружения токсинов "золотым стандартом" в мире является исследование цитотоксического эффекта на различные клеточные линии, в случае B. fragilis – это линия HT-29. Наличие цитопатического эффекта (ЦПЭ) должно сравниваться с отрицательным контролем (фосфатно-солевой буфер или клеточная среда). Если ЦПЭ обнаружен, проводят нейтрализацию с антитоксином для подтверждения энтеротоксина, поскольку некоторые вирусы и бактерии также могут привести к возникновению ЦПЭ у клеточных линий. Недостатками этого метода являются его трудоемкость и большие временные затраты (1).
В течение последних 5 лет было разработано много способов на основе метода ПЦР для обнаружения токсина B. fragilis. Чувствительность и специфичность этих способов по сравнению с культивированием составляют около 91 % и 100 %, соответственно, но эти значения могут быть немного меньше при работе с образцами кала из-за присутствия ингибиторов ПЦР (1).
В последние годы было отмечено повышение устойчивости к противомикробным препаратам для некоторых анаэробных бактерий, особенно для видов группы B. fragilis (9). Связанная с продукцией пенициллаз устойчивость к пенициллинам и цефалоспоринам среди анаэробов приближается к 100%, быстро растет резистентность к тетрациклинам; резистентность к цефамицину (цефокситину), эритромицину и клиндамицину составляет около 12-30% во всем мире, что делает их непригодными для эмпирической терапии против Bacteroides (1). Интересно, что B. fragilis более восприимчив к антимикробным препаратам, чем другие виды Bacteroides. B. vulgatus наиболее устойчив к ампициллину-сульбактаму и пиперациллин-тазобактаму. Штаммы B. thetaiotaomicron/ovatus показывают самый высокий уровень устойчивости к карбапенемам с неизвестным механизмом резистентности. B. vulgatus резистентен к моксифлоксацину (10).
Учитывая устойчивость отдельных видов Bacteroides spp. к разным антибиотикам, при выборе адекватной антимикробной терапии желательно опираться на данные ПЦР-тестирования, охватывающего все разнообразие видов, ассоциированных с тяжелыми инфекциями человека.
Наша клиника проводит все виды анализов (анализ на сахар, на аллергию, ПЦР, генетический анализ и др.) с применением современного оборудования и проверенных методов.
Литература:
1) Nagy E, et al. The place of molecular genetic methods in the diagnostics of human pathogenic anaerobic bacteria. A minireview. Acta Microbiol Immunol Hung. 2006 Jun; 53(2):183-94.
2) А. М. Светухин А. Б. Земляной В. Г. Истратов Л. А. Блатун Р. П. Терехова. Клиническое значение ранней диагностики анаэробной неклостридиальной инфекции.Хирургия. Журнал им. Н.И. Пирогова № 8. 2005.
3) Hannah M. Wexler. Bacteroides: the Good, the Bad, and the Nitty-Gritty. Clin Microbiol Rev. 2007 October; 20(4): 593–621.
4) Brook, I. 2002. Clinical review: bacteremia caused by anaerobic bacteria in children. Crit. Care. 6:205-211.
5) Merino VR et al. Quantitative detection of enterotoxigenic Bacteroides fragilis subtypes isolated from children with and without diarrhea. J Clin Microbiol. 2011 Jan; 49(1):416-8.
6) Durmaz B, Dalgalar M, Durmaz R. Prevalence of enterotoxigenic Bacteroides fragilis in patients with diarrhea: a controlled study. Anaerobe. Dec 2005; 11(6):318-21.Anaerobe. 2005 Dec; 11(6):318-21.
7) Tong J, Liu C, Summanen P, Xu H, Finegold SM. Application of quantitative real-time PCR for rapid identification of Bacteroides fragilis group and related organisms in human wound samples. Anaerobe.2011 Apr;17(2):64-8.
8) Liu C. et al. Rapid identification of the species of the Bacteroides fragilis group by multiplex PCR assays using group- and species-specific primers. FEMS Microbiol Lett. 2003 May 16; 222(1):9-16.
9) Simmon KE, Mirrett S, Reller LB, Petti CA. Genotypic diversity of anaerobic isolates from bloodstream infections. J Clin Microbiol. 2008 May; 46(5):1596-601.
10) Fernández-Canigia L. et al. First national survey of antibiotic susceptibility of the Bacteroides fragilis group: emerging resistance to carbapenems in Argentina. Antimicrob Agents Chemother. 2012 Mar;56(3):1309-14.
Речь пойдет о самых многочисленных обитателях нашего кишечника — бактероидах.
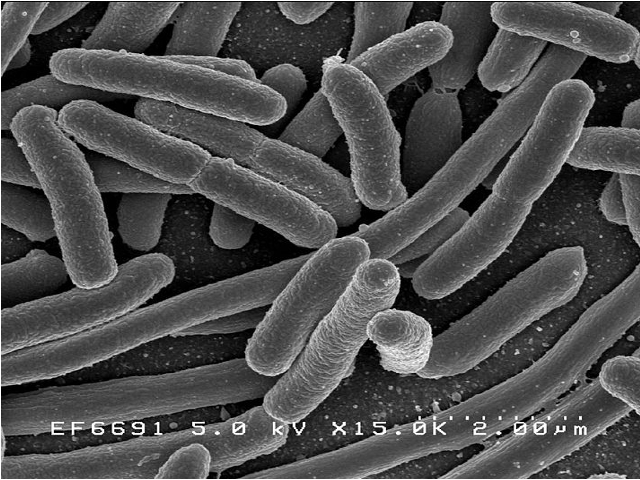
Бактероиды. Электронная микроскопия.
Каких вообще представителей микрофлоры кишечника мы знаем? Ну, например, кишечная палочка. Наверное потому, что кишечная, ее и вспоминают. Или лактобактерии. Потому что про них нам вдолбили рекламой. Хотя той же кишечной палочки в толстой кишке менее процента. Основную массу составляют другие микроорганизмы. Одни из таких — бактероиды.
В толстом кишечнике выявляется наибольшая популяция бактерий в организме и большая часть — анаэробы (то есть живут без доступа воздуха). 25% их — бактероиды (соотношение бактерий меняется с возрастом). О них и пойдет речь.
Что нам известно о бактероидах?
Бактерии очень древние, возникли на ранних этапах эволюции живых организмов. Анаэробы (им не нужен воздух), желчнорезистентны, не окрашиваются по Граму и не образуют спор. Имеют форму палочек. Сама таксономия бактероидов несколько раз пересматривалась, но сейчас в род Bacteroides входит только группа Bacteroides fragilis. А это чуть более 20 видов.
Бактероиды могут передаваться от матери ребенку через родовые пути в процессе рождения и становятся частью нашей с вами микрофлоры. Они являются комменсалами, то есть в норме заболевания они не вызывают. Однако, при травме, повреждении стенки кишечника они могут вызвать значительную патологию, в том числе образовывать абсцесс в разных частях тела (абсцессы печени, малого таза, легких, головного мозга). Последние исследование Bacteroides fragilis за счет секвенирования генома в 2004-2005 годах проливает свет на ряд уникальных адаптационных механизмов бактероидов:
— способность поддерживать гомеостаз (постоянство внутренней среды) за счет наличия в клетке развитых насосных систем для удаления токсичных веществ;
Бактероиды: польза
Бактероиды выявляются в кишечнике новорожденного примерно через 10 дней после рождения. Кстати, новорожденных, которых кормят грудью количество этих бактерий невелико и преобладают в основном бифидобактерии (их относят к актинобактериям). Количество бактероидов повышается, когда ребенка отнимают от груди. Поэтому грудное вскармливание значение имеет очень важное.
Адаптация и выживание бактероидов в желудочно-кишечном тракте
Эти виды бактерий обладают превосходной способностью использовать имеющиеся питательные вещества. В толстой кишке они используют простые и сложные углеводы. При патологическом процессе, когда бактероиды попадают, скажем, на брюшину — используют гликопротеины и гликолипиды поверхности клетки хозяина.
Если говорить о способности Bacteroides к расщеплению углеводов (к примеру, крахмал), то они могут расщеплять большую часть гликозидных связей, обнаруженных в природе.
Bacteroides thetaiotaomicron имеет для этого больше всего гликозилгидролаз, чем у любой другой известной бактерии.
Связь бактероидов и ожирения
В течение последних лет в научной литературе было опубликовано несколько сообщений, в которых указывалась на связь микробиома (как у людей, так и у мышей) с ожирением.
При ожирении выявлялось более энергетически эффективная работа бактероидов. То есть с одного и того же количество пищи организм получал большее количество калорий.
Как бактероиды влияют на клетки Панета.
На кишечных ворсинках есть участки, где располагаются стволовые клетки эпителия, служащие для постоянного обновления эпителиальных клеток, умирающих и теряющихся с ворсинок. Рядом с этими стволовыми клетками располагаются клетки Панета, которые защищают их от микробов, выделяя в просвет между ворсинками противомикробные молекулы (дефензины). Предполагают также, что защитный эффект распространяется и дальше — на уже зрелые клетки. В исследованиях выяснилось, что бактероиды способны стимулировать клетки Панета вырабатывать антибактериальные пептиды. Также выяснено, что отдельные виды бактероидов играют роль в предотвращении заражения Clostridium difficile (приводит к развитию псевдомембранозного колита).
Бактероиды: вред
Это наиболее часто выделяющийся анаэробные патогены толстой кишки. Причина этому — различные факторы вирулентности.
Можно разделить на три категории: факторы, связанные с адгезией (прилипанием) к тканям, устойчивостью к иммунной системе хозяина (например к токсичности кислорода и фагоцитозу, а также особенностями капсулы) и с разрушением тканей.
Бактероиды имеют фимбрии (жгутики) которые позволяют хорошо связываться с тканями хозяина. Адгезии также способствует наличие белков агглютининов.
Бактериальная капсула. У B. fragilis капсула инициирует уникальный иммунный ответ у хозяина: формирование абсцесса.
Фактически, формирование абсцесса является примером патологической реакции на вторгшуюся бактерию: происходит отграничение патогенных бактерий, поврежденных погибших тканей, погибших нейтрофилов и макрофагов. Именно фрагилис является единственной бактерией, для инвазии которой и характерно только формирование абсцессов. Причем бактериальная капсула играет здесь ключевую роль. Так, к примеру, введение в эксперименте животным только клеточных стенок бактерий приводило к абсцедированию. Такая особенность клеточной стенки связана с наличием высокомолекулярных полисахаридов: PS-A, PS-B и PS-C.
Аэротолерантность бактероидов (устойчивость к токсическому действию кислорода). Дело в том, что в кишечнике, чем ближе из просвета приближаться к слизистой кишки, тем выше парциальное давление кислорода (за счет кровообращения). Аэротолерантность не является очевидным фактором вирулентности, но влияет на вирулентность бактероидов.
Инфекции, вызываемые бактероидами
Анаэробные инфекции обычно являются полимикробными, а Bacteroides fragilis встречается в большинстве этих инфекций, при этом смертность от них достигает 20%. Если выявлена анаэробная инфекция с участием бактероидов, смертность может достигать 60%. Летальность значительно снижается с применением соответствующей антимикробной терапии.
Внутрибрюшной сепсис является наиболее распространенной инфекцией, вызванной бактероидами. Возникает при нарушении целостности стенки кишечника, разрыва дивертикула или перфорацией кишки при ранениях или хирургических операциях. Причем такие аэробы, как кишечная палочка, являются наиболее активными членами инфекции, предварительно разрушают ткани и снижают окислительно-восстановительный потенциал ткани (снижают в ней количество кислорода), после чего начинают преобладать бактероиды.
Вовлечение в эндокардит анаэробных бактерий нетипично, но если такое происходит, то может иметь очень серьезные последствия (включая разрушение клапанов, нарушение ритма сердца и кардиогенный шок) со смертностью до 43%.
Bacteroides fragilis — редкая причина септического артрита. Большинство пациентов имеют хроническое заболевание суставов, в частности — ревматоидный артрит. Если говорить об анаэробной инфекции протезов суставов, то сообщают о выделении Clostridium difficile, Clostridium perfringens, виды Veilonella. Бактероиды выявляются очень редко.
Одна из гипотез для объяснения потенциального патогенного механизма заключается в том, что колонизация B.fragilis приводит к острому или хроническому воспалению кишечника. Энтеротоксин расщепляет межклеточный адгезивный белок (соединяющий между собой энтероциты), что приводит в повышенной проницаемости кишечного эпителия клетки.
Бактероиды как резервуар генов резистентности
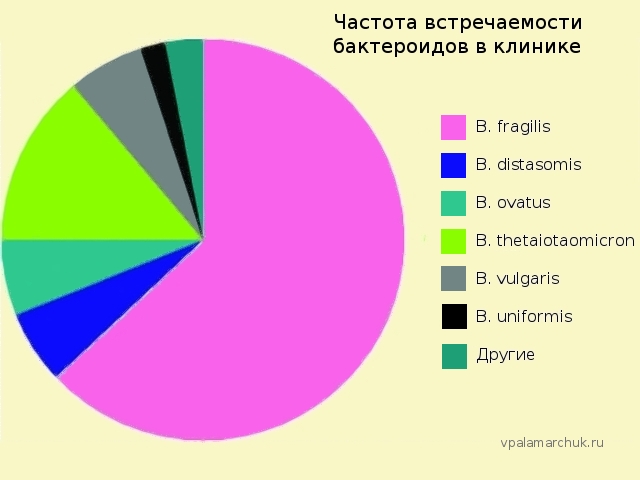
А теперь внимание! На таблице показана именно частота встречаемости заболеваний, при которых бактероиды выделяют. Если по количественным показателям — то B. fragilis — это только 0,5% кишечной флоры. Для клиницистов самая частая проблема — B. fragilis и B. thetaiotaomicron
Если вы нашли опечатку в тексте, пожалуйста, сообщите мне об этом. Выделите фрагмент текста и нажмите Ctrl+Enter.
Читайте также:


