Бактериологическая и биологическая диагностика бруцеллеза
3.1. Бактериологическую диагностику бруцеллеза проводят в случае аборта или при появлении у животных других признаков (бурситы, гигромы, орхиты, эпидидимиты и проч.), вызывающих подозрение на данное заболевание.
3.2. Бруцеллы обнаруживают тремя методами: бактериоскопией мазков из патологического
материала, выделением культуры бруцелл на питательных средах и, при необходимости, путем постановки биологической пробы на морских свинках.
3.3. Бактериоскопическое исследование.
Из доставленного на исследование патологического материала делают по 2 мазка из каждого объекта. При исследовании абортированных плодов мазки готовят из содержимого желудка,
жидкости брюшной и грудной полостей, печени, селезенки, а также котиледонов плодовых оболочек.
Из паренхиматозных органов, котиледонов и другого плотного материала делают мазки-отпечатки, жидкий материал наносят на предметные стекла пипеткой.
Мазки, фиксированные на пламени, окрашивают по Граму и одному из следующих специальных методов: по Стампу (модифицированный метод Циль-Нильсена), Козловскому или Шуляку-Шин (см.
Приложение N 1, п. 1). При микроскопии мазков учитывают, что бруцеллы - мелкие,
грамотрицательные, расположенные отдельно, попарно или кучно кокко-бактерии, окрашивающиеся по Стампу, Козловскому или Шуляку-Шин в красный цвет.
3.4. Бактериологическое исследование.
3.4.1. Для культивирования бруцелл используют мясо-пептонный печеночный бульон (МППБ), печеночно-глюкозно-глицериновый бульон (ПГГБ), мясо-пептонный печеночно-глюкозно- глицериновый агар (МППГГА), печеночно-глюкозно-глицериновый агар (ПГГА), картофельный агар, эритрит-агар или сывороточно-декстрозный агар (см. Приложение N 1, п. 2).
Культивирование возбудителя инфекционного эпидидимита баранов (бруцелла овис) проводят на плотных или полужидких печеночно-сывороточном или печеночно-аминопептидном агарах, а также на сывороточно-декстрозном агаре (см. Приложение N 1, п. 2).
3.4.2. Перед посевом материала кожу абортированного плода с поверхности по белой линии
протирают тампонами, смоченными 5-процентным раствором фенола. Стерильными ножницами вскрывают брюшную стенку и грудную клетку плода, содержимое грудной и брюшной полостей набирают пастеровскими пипетками и высевают в 1 пробирку с бульоном и 2 пробирки с агаром, а содержимое желудка - в 2 пробирки с бульоном и не менее 5 пробирок с агаром.
Из печенки и селезенки вырезают кусочки размером не менее 2,0 х 1,5 х 2,5 см, увлажняют их спиртом, обжигают с поверхности и растирают в стерильной ступке с песком. Затем в ступку добавляют равное количество стерильного физиологического раствора и вновь растирают. Полученную взвесь пастеровской пипеткой по 0,1 - 0,2 мл высевают на поверхность предварительно
подсушенных плотных сред (в пробирках или чашках). Допускается высев материала пастеровской пипеткой непосредственно из органов (место прокола органа предварительно прижигают
раскаленным шпателем). Из каждого органа делают посев на 1 пробирку с бульоном и 2 пробирки с агаром.
Если в лабораторию доставлен только желудок плода, высев проводят не менее чем на 10
пробирок агара. При поступлении нескольких плодов от одного животного посевы делают из органов и тканей каждого плода отдельно.
Из плодовой оболочки, плаценты вырезают кусочки тканей с утолщенными ворсинками и
стенками, наличием на поверхности фибрина или гнойного экссудата (выбирают менее загрязненные участки без некротических изменений). Для уничтожения посторонней микрофлоры кусочки плаценты помещают в чашку Петри и заливают 3-процентным раствором гидроокиси калия на 30 минут. Затем их обмывают стерильным физиологическим раствором, готовят из этого материала
суспензию в ступке со стерильным песком и делают посев пастеровской пипеткой на чашки со средой, содержащей бактериостатические препараты: генцианвиолет 1:200000 (0,1 мл 0,5- процентного спиртового раствора на 100 мл среды) или кристаллвиолет 1:100000, генцианвиолет и малахитовую зелень в концентрации каждой краски 1:200000, уксуснокислый натрий из расчета 0,125 мг на 1 мл среды.
Содержимое бурс, гигром высевают на 3 - 4 чашки с плотной питательной средой, содержащей бактериостатические препараты.
Пробы молока центрифугируют 30 минут при 3000 оборотов в минуту. Верхний слой (сливки) и осадок набирают в пастеровскую пипетку и по 0,1 - 0,2 мл вносят на 3 - 4 чашки с агаром, содержащим бактериостатические препараты. Молоко, консервированное генцианвиолетом, высевают на среды без бактериостатических веществ.
3.4.3. Для выращивания культур посевы помещают в термостат при 37 - 38 °С.
При исследовании материала от крупного рогатого скота половину засеянных пробирок и чашек инкубируют в атмосфере с повышенным содержанием углекислого газа (10 - 15%), другую - в обычных атмосферных условиях.
Для выделения возбудителя инфекционного эпидидимита баранов (бруцелла овис) все посевы инкубируют в атмосфере, содержащей 10 - 15% углекислого газа.
Для создания атмосферы с повышенным содержанием углекислого газа засеянные пробирки заливают парафином или помещают в эксикатор (микроанаэростат).
Перед парафинированием пробирки закрывают горящими ватными пробками, пронося
последние над пламенем горелки. Затем верхнюю часть пробки обрезают, а оставшуюся часть углубляют на 0,5 - 1 см внутрь пробирки и заливают расплавленным парафином.
Необходимое содержание углекислого газа в эксикаторе можно получить путем:
заполнения части объема углекислым газом из баллона или аппарата Киппа;
внесения бикарбоната натрия и серной или соляной кислоты (0,48 г бикарбоната натрия и 5 мл 25-процентного раствора серной кислоты или 0,4 г бикарбоната натрия и 0,35 мл
концентрированной соляной кислоты на 1 л объема);
сжигания ваты, смоченной спиртом. При этом пробирки и чашки с посевами должны занимать не более половины объема эксикатора.
Для определения концентрации углекислого газа в эксикаторе можно использовать химический
метод (см. Приложение N 1, п. 3).
3.4.4. Посевы выдерживают в термостате при 37 - 38 °С в течение 30 дней. Первый просмотр посевов проводят через 18 - 24 часа. Пробирки с агаром и бульоном, заросшие посторонней микрофлорой, отбраковывают.
В дальнейшем для обнаружения роста бруцелл посевы просматривают каждые 3 - 4 дня
визуально, при необходимости через лупу или при малом увеличении микроскопа. При отсутствии
роста часть поверхности агара орошают конденсационной жидкостью.
При значительном росте посторонней микрофлоры (80% и более засеянных пробирок)
бактериологическое исследование прекращают.
При просмотре посевов обращают внимание на характер роста микробов. На поверхности агара
бруцеллы образуют мелкие, блестящие, выпуклые, с ровными краями и гладкой поверхностью
просвечивающиеся колонии, имеющие в отраженном свете голубоватый оттенок, в падающем -
сероватый. С возрастом колонии мутнеют и приобретают более темную окраску, что связано с
В бульоне бруцеллы образуют равномерное помутнение и пристеночное кольцо,
возвышающееся над уровнем бульона, а в дальнейшем небольшой осадок на дне пробирки. В
отраженном свете пристеночное кольцо имеет голубоватый оттенок.
При обнаружении роста на жидких средах и отсутствии характерного роста на агаре из каждой
пробирки готовят мазки, которые окрашивают одним из специальных методов и делают пересев на
чашку с плотной средой для выделения чистой культуры. Пересевы на чашках культивируют так же,
как и высевы из патологического материала.
Выделенные культуры идентифицируют по тинкториальным (окраска мазков по Граму и одним
из специальных методов), морфологическим, культуральным свойствам и в реакции агглютинации на
стекле с позитивной бруцеллезной сывороткой.
При постановке реакции агглютинации на обезжиренное предметное стекло наносят каплю
бруцеллезной сыворотки в разведении 1:50 и каплю той же сыворотки в разведении 1:2 (для
выявления слабоагглютинабельных культур). В каждую каплю сыворотки бактериологической петлей
вносят агаровую культуру и тщательно растирают ее. Одновременно ставят контроль с негативной
сывороткой в тех же разведениях.
При положительной реакции через 1 - 3 мин. в капле позитивной сыворотки образуются хлопья
или комочки, а сама жидкость просветляется, что особенно заметно при покачивании стекла. В
контроле наблюдается равномерное помутнение без образования хлопьев.
При отрицательной реакции агглютинации с культурой из одной колонии дополнительно
исследуют не менее трех-четырех подозрительных колоний.
Культуры, обладающие типичными для бруцелл морфологическими, тинкториальными и
культуральными свойствами и дающие положительную реакцию агглютинации с позитивной
сывороткой, относят к бруцеллам.
Первичные культуры возбудителя инфекционного эпидидимита баранов подвергают
серологической идентификации. Для этого проводят гипериммунизацию двух кроликов массой 2 - 3
кг путем двукратного с интервалом 7 - 8 дней внутривенного введения им по 2 мл взвеси
двухсуточной исследуемой культуры, содержащей 3 - 4 млрд. микробных клеток в 1 мл
физиологического раствора. Через 10 - 12 дней после второго введения от кроликов получают
сыворотку крови и исследуют ее в реакции длительного связывания комплемента (РДСК) с овисным
Культура возбудителя инфекционного эпидидимита баранов вызывает образование антител в
крови кроликов (положительная РДСК). Отрицательный результат РДСК с овисным антигеном
означает, что изучаемая культура не относится к возбудителю инфекционного эпидидимита баранов.
3.5. Биологическое исследование.
3.5.1. Биологическое исследование проводят на морских свинках (не менее двух) массой 350 -
400 г, предварительно проверенных на бруцеллез исследованием сыворотки их крови в РА с
отрицательным результатом в разведении 1:5.
3.5.2. Для постановки биологической пробы используют тот же материал, что и для
Из органов и содержимого желудка абортированного плода готовят суспензию на стерильном
физиологическом растворе в соотношении 1:10 и вводят подкожно с внутренней стороны бедра
морской свинке в дозе 1 мл.
Из плаценты и плодовых оболочек (предварительно обработанных тампонами, смоченными
дезинфицирующим раствором, и подсушенных сухими стерильными тампонами) вырезают кусочки
размером 0,5 х 0,5 см, фламбируют их на пламени горелки, растирают в ступке со стерильным песком
и заливают физиологическим раствором в соотношении 1:10. Полученную суспензию вводят морской
свинке в дозе 1 мл.
Содержимое гигром, бурс вводят морской свинке подкожно в дозе 0,2 - 0,3 мл. При этом
необходимо учитывать возможность гибели животного от сопутствующей микрофлоры, особенно
Пробы молока центрифугируют 30 минут при 3000 об./мин. Морской свинке вводят подкожно 2
- 3 мл материала из верхнего слоя (сливки) и осадка молока после центрифугирования.
3.5.3. На 15-й, 25-й и 40-й дни после заражения у морских свинок берут кровь в количестве 1 - 2
мл из ушной вены путем надреза или из сердца - путем пункции и сыворотку крови исследуют в
пробирочной РА в разведениях от 1:10 до 1:80.
При положительной реакции агглютинации (в разведении 1:10 и выше) морских свинок
убивают, в случае необходимости получения культуры возбудителя материал от них исследуют
бактериологически. Высевы делают пастеровскими пипетками в 1 пробирку бульона и 2 пробирки
агара из паховых, парааортальных лимфатических узлов (правых и левых), селезенки (2 высева),
печени и костного мозга. Посевы культивируют, как описано в подпунктах 3.4.3 и 3.4.4.
При отрицательной РА у морских свинок в указанные выше сроки биопробу считают
отрицательной, подопытных животных убивают.
3.5.4. При выделении культуры бруцелл на питательных средах из исходного материала
биологическое исследование по данной экспертизе прекращают, а ранее зараженных морских свинок
3.6. Результат исследования на бруцеллез считают положительным при выделении культуры
возбудителя или при получении у морской свинки положительной РА в разведении сыворотки крови
1:10 и выше, если из исходного материала культура не выделена.
При положительных результатах бактериоскопии и отрицательных результатах
бактериологического исследования и биопробы материал считают подозрительным на бруцеллез.
3.7. Сроки исследования:
бактериологического - до 1 месяца;
биологического - до 2 месяцев.
3.8. В районных и межрайонных ветеринарных лабораториях все выделенные культуры бруцелл
после их идентификации подлежат уничтожению путем автоклавирования при 1,5 атмосферах в
3.9. При необходимости определения вида бруцелл, а также в целях дифференциации полевых
штаммов от вакцинных выделенные от животных культуры направляют в республиканские,
областные, зональные ветеринарные лаборатории или ветеринарные научно-исследовательские
учреждения, в которых имеются лаборатории или отделы, занимающиеся изучением бруцеллеза
животных и имеющие разрешение органов здравоохранения на работу с микроорганизмами второй
Возбудители бруцеллеза (Brucella melitensis, Brucella abortus, Brucella suis и Brucella canis) высоко контагиозны и работа с ними проводится в специализированных лабораториях особо опасных инфекций. Постановку серологических реакций и аллергических проб для диагностики бруцеллеза производят соответственно в обычных микробиологических лабораториях и больничных условиях.
Главным резервуаром бруцелл являются домашние сельскохозяйственные животные, а также другие виды животных, от которых человек заражается преимущественно контактным или контактно-бытовым, реже алиментарным путем. Клинические проявления бруцеллеза многообразны, поражаются лимфатическая, сосудистая, гепато-лиенальная системы и особенно опорно-двигательный аппарат Методы микробиологической диагностики бруцеллеза представлены в схеме 7.
Схема 7. Микробиологическая диагностика бруцеллеза
|
|
Серологический метод- постановка РА с сывороткой крови больного (реакция Райта, ставят в начале 2-й недели болезни, диагностический титр 1:200 и выше), ускоренной РА на стекле (реакция Хеддльсона), РСК и ИФА.
Диагностикумом в реакции Райта и Хеддльсона является взвесь убитых бруцелл с красителем генциановым фиолетовым или метиловым фиолетовым.
Реакцию агглютинации Хеддльсона ставят на стеклянной пластинке, на которую наносят микропипеткой неразведенную исследуемую сыворотку в количествах 0,08; 0,04; 0,02; 0,01 и 0,02 мл, добавляют по 0,03 мл бруцеллезного диагностикума, кроме последней дозы, в которую вносят 0,03 мл ФР (контроль сыворотки). Контролем диагностикума является смесь из 0,03 мл антигена и 0,03 мл ФР. Все капли перемешивают стеклянной палочкой или бактериологической петлей и после легкого покачивания стекла наблюдают за появлением мелкозернистого окрашенного агглютината. Отсутствие агглютинации во всех пробах сыворотки оценивается как отрицательная реакция, наличие агглютинации в 1-й пробе (0,08 мл сыворотки) - сомнительная, во 2-й (0,04 мл) - слабоположительная, в 3-й или 4-й пробах (0,02-0,01 мл) - положительная, во всех пробах - резко положительная реакция. Поскольку реакция агглютинации Хеддльсона иногда бывает положительной у здоровых людей за счет нормальных антител, она обязательно подтверждается реакцией Райта.
РИФ, РНГА, РСК и особенно ИФА более чувствительны, чем реакция агглютинации. Для ранней диагностики бруцеллеза особую ценность имеет ИФА, позволяющий выявить в сыворотке больных антибруцеллезные антитела класса IgM,которыев отличие от IgG появляются в ранние сроки болезни, свидетельствуя о свежем инфицировании.
Аллергический метод –постановка внутрикожной аллергической пробы Бюрне с 15-20 дня заболевания. Учет реакции проводится через 24-48 часов, положительной считается реакция в случае появления на месте введения аллергена (бруцеллина) болезненности, гиперемии и инфильтрации кожи диаметром 3 см и более. Положительная аллергическая реакция на бруцеллин сохраняется в течение длительного времени после перенесенного бруцеллеза, а также после прививки.
Бактериологический метод- посев крови для выделения гемокультуры в 2 флакона с 50 мл печеночного или асцитического бульона (рН 7,1-7,2) или МПБ с добавлением 1 % глюкозы, 2 % глицерина и антифаговой сыворотки (для инактивации бруцеллезного бактериофага) в первые дни болезни при наличии лихорадки. При отрицательных результатах исследование повторяют, т.к. бактериемия наблюдается в течение 1 года и более.
Один флакон выращивают в обычных аэробных условиях, другой — в герметично закрытом сосуде с 10 % углекислого газа (или СО2-инкубаторе) при температуре 37 0 С до 1 месяца, делая пересевы на скошенный печеночный агар или эритрит-агар каждые 4-5 дней. На жидких средах бруцеллы растут с образованием легкого помутнения и небольшого слизистого осадка, на плотных средах в виде округлых, диаметром до 5 мм, серовато-белых, блестящих, прозрачных с янтарным оттенком в проходящем свете колоний. Типичные колонии пересевают на скошенный агар и идентифицируют выделенную культуру до уровня вида.
Выполняются также посевы исследуемого материала в желток свежего куриного яйца или в желточный мешок куриного эмбриона с последующей их инкубацией в течение 5 дней при 37 0 С и пересевом содержимого желточного мешка на плотные и жидкие питательные среды для выделения чистой культуры бруцелл.
Бруцеллы идентифицируют на основании изучения морфологических (рис. 13 - грамотрицательные коккобактерии), культуральных, биохимических (они не ферментируют уг-
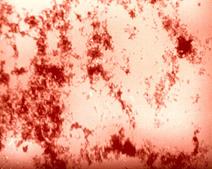
Рис. 13. Возбудитель бруцеллеза (Brucella melitensis). Окраска по Граму. Мелкие грамотрицательные коккобактерии.
леводы, не свертывают молоко и не разжижают желатину, выделяют сероводород), антигенных свойств (постановка РА с моноспецифическими сыворотками против антигеновА, М, R), чувствительности к специфическому бактериофагу и бактериостатическому действию анилиновых красителей (табл. 8).
Таблица 8.Дифференциация основных видов бруцелл
| Признак | Вид бруцелл | ||
| Br. melitensis | Br. abortus | Br. suis | |
| Условия культивирования | аэробные | 10% СО2 | аэробные |
| Рост на средах с красителями: | |||
| фуксином 1:50000 | + | + | - |
| тионином 1:25000 | + | - | + |
| пиронином 1:200000 | + | + | - |
| Образование Н2S | - | ± | ± |
| РА с монорецепторными сыворотками | |||
| А | ± | ± | + |
| М | ± | ± | ± |
| Чувствительность к бруцеллезному фагу | - | + | ± |
Возбудители Brucella melitensis, Brucella abortus, Brucella suis входящих в роду Brucella. Материалом для микробиологической диагностики является кровь, костный мозг, моча, грудное молоко, околосуставных жидкость, околоплодные воды, абортированные плоды животных. Микробиологическую диагностику бруцеллеза проводят микроскопическим, бактериологическим, серологическим, биологическим и аллергологическим методами.
Микроскопический метод. Из материала, который исследуют, готовят мазок и красят сначала карболовым фуксином (разведение 1: 5) в течение 3 минут. Затем препарат промывают водой и дополнительно окрашивают 2% водным раствором метиленовой синьки в течение 5 минут. При микроскопии обнаруживают на голубом фоне бруцеллы в виде коротких палочек с закругленными концами красного цвета.
Бактериологический метод. Поскольку возбудители бруцеллеза высоковирулентные и контагиозные, работать с культурами этих микробов могут только специалисты, имеющие соответствующую подготовку.
Материал, который исследуют, высевают в печеночный бульон или МПБ с 1% глюкозы и 1% глицерина. При этом используют 2 флакона со средой. Во втором флаконе создают условия для роста B. abortus. Этот вид бруцелл для роста требует СО2. Поэтому флакон с бульоном после посева в него материала, который исследуется, закрывают тлеющей ватно-марлевой пробкой. Посевы размещают в термостате при t 37 ° С и культивируют в течение нескольких дней. Далее делают пересел на плотные питательные среды: печеночный агар, сывороточно-декстрозных или кровяной агар.
На этих средах бруцеллы растут в виде нежных бесцветных выпуклых круглых колоний диаметром от 1 до 5 мм (S — формы). Их сравнивают с капельками росы. Иногда появляются R-формы колоний. В мазках из типичных колоний оказываются мелкие грамотрицательные бактерии шаровидной, овоподибнои или палочковидной формы.
Подозрительные колонии пересевают на скошенный печеночный агар и после выделения чистой культуры микробов идентифицируют их. При этом учитывают морфологические, тинкториальных, культуральные свойства, потребность в СО2 для роста, способность расти на средах в присутствии фуксина, тионином, выделять H2 S, образовывать уреазу, фосфатазу, каталазу, чувствительность к специфическому поливалентного бактериофага, агглютинацию моноспецифическими бруцеллезного сыворотками.
Серологический метод. Определяют титр антител к бруцелл в сыворотке обследуемого в реакциях Райта и Хеддльсона. В качестве антигена используют бруцеллезный единственный диагностикум. Этот диагностикум представляет собой гомогенную суспензию бруцелл, инактивированную нагриваннямфенолом и окрашенную в синий цвет. При постановке реакции агглютинации Райта из сыворотки больного готовят разведения 1:50, 1: 100, 1: 200, 1: 400, 1: 800 в физиологическом растворе, в который добавляют перед тем 0,5%
фенола в объеме 0,5 мл, а затем добавляют по 0,5 мл бруцеллезного единого диагностикума в разведении 1:10. Реакция считается положительной при титре 1: 100 — 1: 200, а при титре 1: 800 и выше — резко положительной.
Реакцию Хеддльсона ставят на хорошо обезжиренном стекле, расчерченном на 6 квадратов. На первом квадрате записывают номер сыворотки, а на второй, третий, четвертый, пятый квадрат наносят сыворотку, которую исследуют, в объемах 0,04; 0,02; 0,01 мл 0,02 мл (контроль сыворотки). В контроль сыворотки добавляют 0,03 физиологического раствора, в другие капли сыворотки — 0,03 мл не разбавленное бруцеллезного единого диагностикума. На шестом квадрате контроль антигена (0,03 мл антигена + 0,03 мл физиологического раствора). Учет реакции проводят в течение 8 мин. Негативная реакция — аглютинат отсутствует во всех объемах сыворотки. Сомнительная реакция — аглютинат есть только в объеме 0,04 м / л. Положительная реакция — аглютинат в объемах 0,02-0,01 мл. Резко положительная — аглютинат во всех объемах сыворотки. Реакцию применяют при массовом обследовании людей. Положительный результат позволяет отобрать лиц с подозрением на бруцеллез для дальнейшего углубленного обследования.
Биологический метод применяют для выделения бруцелл в чистой культуре из материалов, загрязненных сторонними микроорганизмами. Для этого используют морских свинок и белых мышей. Материал, который исследуют, вводят подкожно или внутрибрюшным путем.
Аллергологический метод (проба Бюрне). В среднюю часть внутренней поверхности предплечья внутрикожно вводят 0,1 мл бруцеллина (фильтрат из 3-4 недельных бульонных культур бруцелл трех типов). Положительная реакция характеризуется образованием через 24 часа патологического инфильтрата размером 4 х 6 см и гиперемией. Эта реакция специфична. Она проявляется через 1-2 недели после начала заболевания и сохраняется годами.
Разнообразные клинические проявления бруцеллеза приводят к необходимости широкого использования лабораторных методов исследования: бактериологического, биологического, серологического и аллергического. Комплекс лабораторных исследований с обязательным учетом клинических, эпидемиологических и эпизоотологических данных обеспечивает правильную диагностику заболевания.
Бактериологический метод.Для исследования на бруцеллез в лабораторию поступает патологический материал от больных людей (кровь, мокрота, гной, суставная жидкость, пунктат из селезенки, моча), сельскохозяйственных животных (абортированный плод, лимфатические узлы, паренхиматозные органы, кровь, моча, молоко, молочные продукты) и различные объекты окружающей среды (вода, навоз). Материал для исследования забирают в стерильную посуду.
Исследование крови необходимо проводить во время лихорадочного состояния больного до лечения антибиотиками, так как в этот период наблюдается наибольший процент выделения культур. Кровь в количестве не менее 10 мл стерильно берут из локтевой вены и засевают по 5 мл в два флакона среды Кастанеда. Начиная с четвертого дня, посевы ежедневно просматривают и, при отсутствии роста культуры, поверхность агара орошают бульоном путем осторожного покачивания флакона. При положительном результате на поверхности агара появляются колонии бруцелл. Если в течение месяца роста бруцелл не обнаруживают, то делают контрольный высев из бульона среды Кастанеда на твердую питательную среду.
При обследовании людей на бруцеллез для удобства доставки флаконов с кровью можно пользоваться транспортной жидкой средой, которую готовят заранее и хранят в лаборатории в течение полугода. Кровь доставляют в лабораторию в транспортной среде, засевают на среду Кастанеда и исследуют по общепринятой схеме.
Бруцеллы можно выделить из костного мозга, мочи, спинномозговой жидкости, грудного молока, желчи, мокроты, трупного материала и т. д. Исследуемый материал по 0,1 мл засевают на пластинки питательного агара и по 5-10 мл на жидкие питательные среды. Для задержки роста посторонней микрофлоры при исследовании загрязненного материала к среде добавляют генцианвиолет (1:200 000) или антибиотики (пенициллин 0,25 ед/мл и стрептомицин 0,05 ед/мл).
Особого внимания заслуживает получение культуры из молока сельскохозяйственных животных. Забор молока у овец, коров, верблюдов и коз рекомендуется проводить путем сдаивания его последних порций из каждого соска вымени по 10 мл в стерильную посуду. Если исследовать молоко в течение первых суток не удается, то его консервируют добавлением сухой борной кислоты 1 %, генцианвиолета 1:25 000. Для исследования молока из больших емкостей забирают 100 мл верхнего слоя, затем перемешивают и набирают еще 100 мл.
Лучшие результаты дает посев сливок, полученных центрифугированием молока при 2,5-3 тыс. об/мин в течение 3-5 мин или путем отстаивания в течение одних суток в холодильнике. Сливки в количестве 0,1-0,2 мл засевают на твердую питательную среду с подавителем посторонней микрофлоры (4-6 пробирок на 1 пробу).
Бактериологический метод считается самым достоверным, т. к. выделение бруцелл является неопровержимым доказательством бруцеллезной инфекции. Отрицательные результаты бактериологического исследования не дают права для заключения об отсутствии заболевания.
Биологический метод.Для выделения бруцелл из материала, загрязненного посторонней микрофлорой или содержащего малые концентрации возбудителя, в качестве биологической пробы используют морских свинок (весом 250-300 г) или белых мышей (весом 17-18 г). Исследуемый материал в объеме не более 0,5 мл вводят подкожно в паховую область белой мыши и 1 мл морской свинке.
Вскрытие белых мышей производят через 20-25 дней, а морских свинок - через 30-35 дней после введения материала. Перед вскрытием у свинок кровь из сердца исследуют в реакции агглютинации. Для посевов у морских свинок берут лимфатические узлы (паховый, подчелюстной, шейный, парааортальный), кусочки селезенки, печени, костный мозг, кровь, мочу; у белых мышей - лимфатические узлы (паховый, аксиллярный, парааортальный, подчелюстной), кусочки селезенки и печени. Лимфатические узлы, кусочки печени и селезенки помещают в стерильную чашку. Костный мозг извлекают пипеткой из рассеченной бедренной кости. Посевы крови из сердца, мочи и костного мозга производят стерильной пипеткой непосредственно на питательную среду (агар и бульон). Лимфатические узлы и органы перед посевом надсекают ножницами, берут стерильной деревянной палочкой, вносят первоначально в пробирку с агаром, раздавливают и тщательно втирают материал в поверхность питательной среды. Затем остатки посевного материала переносят в пробирку с бульоном. Палочка должна быть длиной 25-30 см, диаметром 4-5 мм, хорошо отструганная, с несколько заостренным концом. После использования ее погружают на 1 час в дезраствор.
Все посевы дублируют (часть помещают в условия повышенного содержания углекислоты), выдерживают при 37 °С до 30 дней. Для предотвращения высыхания питательных сред пробирки заливают парафином или закрывают резиновыми колпачками.
Посевы просматривают каждые 3-4 дня. Из помутневших бульонов делают высев в пробирки со скошенным агаром. Колонии бруцелл на пластинчатом агаре становятся видимыми на 5-7 сутки, иногда позднее. По истечении 30 дней наблюдение прекращают. Если за это время рост не появился, посевы уничтожают, а результаты бактериологического исследования считают отрицательными.
Результат оценивают положительно при выделении хотя бы одной колонии бруцелл. Идентификацию возбудителя бруцеллеза проводят по: по характеру роста культуры на плотных питательных средах; морфологии микроба в мазках, окрашенных по Граму, Козловскому; агглютинации со специфической бруцеллезной сывороткой на стекле и объемным методом; свечению на 3-4+ культур, обработанных бруцеллезной люминесцирующей сывороткой.
Культуры предварительно проверяют на наличие признаков диссоциации, одним из перечисленных выше методов.
Дифференциации (определение видов и биоваров) подлежат культуры в S-форме после идентификации.
Подкомитетом по таксономии бруцелл Международного комитета номенклатуры бактерий и Объединенным комитетом экспертов ФАО/ВОЗ по бруцеллезу в 1972 г. были определены единые тесты для проведения идентификации и дифференциации бруцелл для всех стран мира.
Серологические и аллергические методы исследования на бруцеллез.Серологические реакции и аллергическая проба являются общедоступными методами и применяются для диагностики бруцеллеза наряду с бактериологическим и биологическим методами.
В случае малой обсемененности пробы и отрицательных результатов, полученных при посеве исследуемого материала на питательные среды и заражении лабораторных животных, серологический метод может быть единственным, позволяющим диагностировать бруцеллез. В зависимости от целей исследования используют те или иные серологические методы.
При проведении эпидемиологического исследования в очагах применяют реакцию агглютинации пластинчатую (Хеддльсона) и объемную (Райта), реакцию Кумбса, РСК, РДСК, РПГА, кожную аллергическую пробу, иммуноферментный анализ (ИФА). Перед профилактической вакцинацией населения можно ограничиться постановкой пластинчатой реакции агглютинации (Хеддльсона) и кожной аллергической пробы.
Для диагностики острого и подострого бруцеллеза ставят реакцию Хеддльсона, Райта и РПГА. В случаях отрицательного результата используют реакцию Кумбса.
При диагностике хронического бруцеллеза и проведении диспансерного наблюдения за переболевшими рекомендуют наряду с реакциями Хеддльсона, Райта, РПГА, использовать реакцию Кумбса и аллергическую пробу (Бюрне).
Серологические реакции и аллергическая кожная проба по своему диагностическому значению в различные периоды заболевания не равноценны, вследствие чего не могут заменить друг друга. Это обусловливает необходимость применения комплексного серологического метода, являющегося наиболее надежным способом диагностики бруцеллеза.
В ранние сроки от начала заболевания (первые 6 месяцев) диагностическая ценность серологического метода выше, чем аллергического. Серологические реакции в этот период оказываются положительными почти в 95 % случаев. По мере удлинения срока заболевания процент положительных серологических реакций начинает снижаться. При проведении обследования необходимо учитывать, что высокие титры антител всегда указывают на наличие инфекции, антитела в низких титрах или их полное отсутствие не исключает возможности заболевания. В связи с этим рекомендуется проводить повторные исследования с интервалом 1-2 недели, особенно при подозрении на острую форму бруцеллеза.
Для постановки диагноза бруцеллеза у крупного рогатого скота применяют серологические и аллергические методы. Обследование начинают с постановки роз-бенгал пробы (РБП). Сыворотки, с которыми получена положительная РПБ, исследуют в РА Райта, РСК (РДСК), РПГА для установления титра агглютининов и наличия комплементсвязывающих антител. Исследование проводят двукратно с промежутком в 30 дней.
ПРАКТИЧЕСКИЕ ЗАНЯТИЯ
Занятие 3.
Последнее изменение этой страницы: 2016-12-30; Нарушение авторского права страницы
Читайте также:


