Вид фагоцитоза при туберкулезе
Клиническая иммунология при туберкулезе.
Определения и основные понятия из общей и частной клинической иммунологии.
Механизм развития и реализации противотуберкулезного иммунитета.
Иммунологический статус больных туберкулезом.
Определения и основные понятия из общей и частной клинической иммунологии.
Иммунитет
-способ защиты организма от живых тел и веществ, несущих на себе признаки генетической чужеродности - от бактерий, вирусов, простейших, червей, белков, клеток, тканей, измененных аутоантигенов, в том числе раковых ( Р.В. Петров, 1982).
- биологическая реактивность организма, направленная на поддержание гомеостаза генетически детерминированной физико-химической структуры макромолекул и клеток организма (А.Е. Вершигора, 1990).
Иммунная система – совокупность всех лимфоидных органов и скоплений лимфоидных клеток тела. Она характеризуется, прежде всего, специфичностью её реакций, спектром специфичности антител и лимфоцитов, а также существованием феномена иммунологической памяти.
Органы иммунной системы –центральные: костный мозг, вилочковая железа, лимфатические образования кишечника, червеобразный отросток. В них созревание лимфоцитов происходит без существенного влияния антигенов.
-периферические: селезенка, лимфатические узлы и скопления лимфоидной ткани. Их развитие непосредственно зависит от антигенного воздействия.. В периферических органах выделяют тимус – зависимые зоны: периартериальные области белой пульпы селезёнки, паракортикальная зона лимфатического узла, тимус-независимые зоны: кора лимфатического узла, лимфоидные муфты и фолликулы белой пульпы селезёнки.
Виды иммунитета: 1)Видовой * и приобретённый * .
Приобретенный: естественный * и искусственный * ,
активный * и пассивный.
2)Противоопухолевый, противовирусный,
3)Местный * и общий * .
* Виды иммунитета, имеющие значение при туберкулезе.
( Поствакцинальный иммунитет – приобретенный, искуственный, активный;
Постинфекционный иммунитет – приобретенный, естественный, активный).
Видовой иммунитет.Синонимы – конституциональный иммунитет, врожденный иммунитет, неспецифическая резистентность, естественная резистентность, неспецифическая реактивность. Он не зависит от предшествующей реакции Аг-Ат. Это врождённые неспецифические механизмы резистентности. Неспецифическая резистентность осуществляется клеточными и гуморальными факторами, тесно взаимодействующими в достижении конечного эффекта – катаболизма чужеродной субстанции: макрофагами и нейтрофилами, комплементом и лизоцимом и некоторыми другими клетками и растворимыми факторами (лейкины, эритрин, в-лизины, пропердин, нормальные антитела сыворотки крови, С- реактивный белок и др.). К неспецифической резистентности относится барьерная функция кожи и слизистых, которые являются механическим барьером и выделяют бактерицидные вещества. Ингибируют рост и убивают микробы и вирусы слюна, слёзная жидкость, желудочный сок и пищеварительные ферменты. Нормальная микрофлора подавляет развитие патогенных микроорганизмов. Выделительная функция почек способствует элиминации некоторых вирусов. Видовая резистентность к инфекционным заболеваниям – это генетически обусловленная невосприимчивость одного вида животных к инфекционным заболеваниям других видов. В её основе лежит биологическая особенность данного вида животных: температура тела, отсутствие специфических рецепторов, отсутствие определённых метаболитов. Так животные не болеют сифилисом, за исключением обезьян, человек не восприимчив к чуме свиней и холере кур.
Кожа и слизистые оболочки – первая линия защиты. Удаление прилипших микроорганизмов возможно при слущивании эпидермиса и в результате мерцания ресничек эпителия при нормальной работе мукоцилиарного аппарата. Кожа и слизистые вырабатывают бактерицидные вещества. Молочная кислота пота и ненасыщенные жирные кислоты сальных желёз обладают также бактерицидным действием. Слюна и молоко содержат лактопероксидазную систему, обладающую антибактериальной активностью. Слизистые оболочки продуцируют слизь, с которой удаляются бактерии. Слизь из носа, слёзы, слюна и моча содержат бактерицидный фермент лизоцим.
Содержимое желудка обладает бактерицидными свойствами из-за низкого pH – 6,0. Бактерицидными свойствами обладают продукты расщепления желчных кислот, образующиеся в тонкой кишке. Развитию бактерий препятствует кислый секрет влагалища. Бактерицидная активность присуща простатическому соку и семенной жидкости.
Проникновению вирусов и бактерий в слизистую препятствуют секреторные IgA. Бактерии, преодолевшие эту защиту, встречают внутренний барьер. Первыми здесь являются полиморфонуклеары. Если они не обеспечивают защиту, то вступают макрофаги.
Определенную роль в противотуберкулезной защите играет состояние фагоцитарной системы как в неиммунном, так и в иммунном организме. При первичном инфицировании микобактерии, попавшие в организм, распознаются макрофагами как инородные тела и фагоцитируются. Переваривающая способность неспецифически активированных макрофагов зависит от состояния макроорганизма и от вирулентности микобактерий.
В иммунном организме активация макрофагов и эффективный фагоцитоз микобактерий связаны с наличием сенсибилизированнных Т-лимфоцитов. Таким образом, специфический и неспецифический компоненты реакции, обеспечивающих разрушение и элиминацию микроорганизма, находятся в тесном взаимодействии и разделить их в ходе иммунного ответа не всегда возможно.
Приобретённый иммунитет –строго специфичен. Осуществляется с помощью клеточных ( Т- и В- лимфоцитов) и гуморальных факторов иммунитета (антитела). При этом в межклеточной кооперации участвуют макрофаги, система комплемента (неспецифический компонент реакций).
Приобретённый иммунитет может быть нескольких видов:1) естественный активный, возникающий после перенесённого заболевания; 2) естественный пассивный, обусловленный поступлением в организм плода специфических антител через плаценту и ребёнку с молоком матери; 3) искусственный активный, возникающий после вакцинации; 4) искусственный пассивный, возникающий после введения готовых антител с иммунной сывороткой. Активный иммунитет обычно сохраняется несколько лет, а пассивный – на протяжении нескольких недель, месяцев.
В настоящее время в иммунологии известны шесть форм специфических реакций, из которых складывается иммунологическая реактивность: 1) выработка антител, 2)гиперчувствительность немедленного типа, 3)гиперчувствительность замедленного типа, 4)иммунологическая память, 5)иммунологическая толерантность, 6)идиотип – антиидиотипическое взаимодействие.
Гиперчувствительность замедленного типа (ГЗТ) –реакция между антигеном и сенсибилизированными Т- лимфоцитами с последующим (через 24 - 48 часов) развитием аллергического воспаления.
Развитие ГЗТпроисходит:
1) при бактериальных инфекциях – туберкулезе, лепре, туляремии, бруцеллезе, сифилисе, гонорее, коклюше;
2) при вирусных инфекциях - корь, герпес, оспа;
3) при грибковых инфекциях – кандидоз, гистоплазмоз;
4) при протозойных инфекциях – токсаплазмоз, малярия, лейшманиоз, трипаносомоз;
5) при гельминтозах;
6) в неинфекционной иммунологии – развитие трансплантационного иммунитета; как особая форма аллергии - множество производственных и бытовых дерматитов, колитов и других заболеваний, вызываемых агентами, способными стимулировать ГЗТ.
Туберкулез является классической моделью ГЗТ.
Морфологическим проявлением развития ГЗТ является формирование гранулем.
Выявление ГЗТ при туберкулезе - in vivo - кожные пробы с антигеном (туберкулинодиагностика), in vitro наиболее часто используются - реакция бласттрансформации лимфоцитов с туберкулином и реакция торможения миграции лейкоцитов с тем же антигеном (выявление сенсибилизированных лимфоцитов).
Фагоцитоз –поглощение частиц специальными подвижными и фиксированными клетками крови и тканей.
У млекопитающих фагоцитоз осуществляют две системы клеток – полиморфонуклеары, или гранулоциты, и макрофаги. Распознавание чужеродности фагоцитами осуществляется непосредственно или при помощи антител и комплемента.
Исходы фагоцитоза – гибель микроба, гибель фагоцита и симбиоз.
Стадии фагоцитоза - хемотаксис, адгезия, инвагинация и образование фагосомы, затем фаголизосомы и разрушение чужеродного агента.
Фагоцитоз при туберкулезе осуществляется макрофагальной системой. Микобактерии, попадая в макрофаги, могут сохраняться и даже продолжать размножение. Корд-фактор, определяющий вирулентность микобактерий, тормозит образование фаголизосом и лизис микобактерий. В тех случаях, когда процесс переваривания микобактерий блокируется, происходит разрушение макрофагов и выход микобактерий из поглотивших их клеток.
Бактерицидное действие макрофагов осуществляется кислородзависимыми и кислороднезависимыми механизмами. При туберкулезе большинство исследователей подчеркивает ведущее значение кислородзависимой бактерицидности в отношении микобактерий, не отрицая роли кислороднезависимых механизмов.
Кислороднезависимая бактерицидность осуществляется: анаэробными условиями и снижением рН до 4.0 в вакуолях (не влияет на микобактерии туберкулеза); действием лизосомальных ферментов – протеаз, липаз, эстераз, карбогидраз и т.д. Этот процесс энергозависимый, поэтому в присутствии глюкозы переваривающая способность повышается, а при ее снижении – уменьшается.
О2 – оказывает выраженный бактерицидный эффект.
В результате эффективного фагоцитоза происходит захват, деградация чужеродных веществ, их переработка и презентация антигена, а также выработка и секреция целого комплекса биологически активных веществ (цитокинов), участвующих в иммуноморфологических реакциях: компонентов комплемента (С2,С3,С4,С5), лизоцима, интерферона (гамма – интерферона), фактора некроза опухолей, интерлейкина – 1 и др.
Таким образом, фагоцитоз инициирует развитие ГЗТ, презентируя переработанный антиген и выделяя интерлейкин –1, активирующий Т-лимфоциты, а в ходе развития ГЗТ образуются сенсибилизированные Т- лимфоциты, активирующие процесс фагоцитоза.
Иммунный статус – определяется количеством и активностью циркулирующих лимфоидных и фагоцитарных клеток, состоянием системы комплемента, факторов неспецифической резистентности, количеством и функцией киллерных клеток, концентрацией иммуноглобулинов, специфических антител, интерлейкинов и др. показателями иммунных нарушений.
Вторичный иммунодефицит (иммунная недостаточность) –приобретенное состояние, характеризующееся неспособностью реализовать какие – либо звенья иммунного ответа. Дефицит клеточного звена иммунитета может быть обусловлен не только уменьшением количества иммунокомпетентных клеток, но и нарушением их функциональной активности, а также нарушениями межклеточной кооперации в ходе иммунного ответа.
- Механизм развития и реализации противотуберкулезного иммунитета.
Изучению роли факторов неспецифической реактивности и специфического противотуберкулезного иммунитета, а так же механизмов индукции различных феноменов при туберкулезе и их взаимосвязи с резистентностью к туберкулезной инфекции посвящено большое число исследований. С современных позиций можно сформулировать следующие основные положения противотуберкулезного иммунитета.
В основе формирования и реализации противотуберкулезного иммунитета лежит развитие гиперчувствительности замедленного типа на антигены микобактерий туберкулеза. Антигенным компонентом микобактерий, индуцирующим и обнаруживающим ГЗТ, являются белки; полисахариды и липиды таким свойством не обладают.
Центральным звеном в проявлении резистентности организма к микобактериям являются Т-клетки, специфически сенсибилизированные к микобактериальным антигенам. Но непосредственного влияния на микобактерии они не оказывают. С помощью биологически активных веществ (лимфокинов) лимфоциты активируют процесс фагоцитоза, осуществляемый макрофагами, стимулируют миграцию макрофагов в очаги воспаления, тормозят миграцию лейкоцитов из очага.
Таким образом, эффекторным звеном при реализации противотуберкулезного иммунитета являются активированные макрофаги. Установлено, что бактерицидное действие активированных макрофагов осуществляется с помощью кислородзависимого механизма. В неиммунном организме неактивированые макрофаги могут фагоцитировать микобактерии, но из-за малой активности ферментных систем большинство из них не оказывает бактерицидного действия. В иммунном организме (поствакцинальный или постинфекционный иммунитет) макрофаги быстрее мигрируют к месту внедрения микобактерий, обладают значительно большей переваривающей способностью.
Развитие противотуберкулезного иммунитета схематически может быть представлено следующим образом:
Таким образом, под влиянием сенсибилизированных Т-лимфоцитов активируется фагоцитирующая активность макрофагов, приводящая к гибели микобактерий. Кроме указанных цитокинов в ходе иммунного ответа в результате гибели и активации клеток происходит каскадное выделение биологически активных веществ, оказывающих как провоспалительное, альтеративное, так и противовоспалительное действие.
В ходе иммунного ответа одновременно с формированием ГЗТ идет выработка гуморальных факторов – иммуноглобулинов, противотуберкулезных антител. В настоящее время их значение в противотуберкулезной защите не установлено.
Развитие реакции гиперчувствительности замедленного типа при туберкулезе клинически соответствует феномену первичного инфицирования. Формирование иммунитета при инфицировании микобактериями туберкулеза, вакцинации БЦЖ происходит параллельно размножению микобактерий и развитию специфической воспалительной реакции. По мере нарастания иммунного ответа размножение микобактерий замедляется, уменьшается вызванная ими воспалительная реакция. При достаточном уровне резистентности после формирования ГЗТ заболевание не развивается, процесс заканчивается образованием гранулем, отграничением микобактерий, переходом их в L – формы, формируются макроскопически не определяемые остаточные изменения. Клинически данное состояние соответствует понятию инфицирование. При снижении резистентности организма, массивном воздействии вирулентных МБТ сразу после формирования ГЗТ развиваются первичные формы туберкулеза.
Реакции ГЗТ выявляются через 2-3 недели после попадания в организм микобактерий, но достаточно выраженный иммунитет формируется через 8 недель.
Морфологическим проявлением развития ГЗТ является образование гранулемы. В ней выявляется альтеративный компонент – казеозный некроз, продуктивный – (клеточная инфильтрация лимфоцитами, макрофагами, эпителиоидными клетками, клетками Пирогова-Ланганса), экссудативный (пеифокальная инфильтрация) и репаративный (коллагенообразование).
В зависимости от массивности попадания в организм микобактерий, их вирулентности и реактивности организма морфологически может преобладать один из указанных компонентов. Туберкулезные бугорки могут быть преимущественно экссудативными, продуктивными, некротическими, что определяет форму и фазу развития заболевания.
- Иммунологический статус больных туберкулезом.
Развитие заболевания обусловлено снижением приобретенного иммунитета, что вызывает эндогенную реактивацию заживших очагов первичного туберкулеза или снижает резистентность к экзогенной инфекции. Таким образом, одним из условий развития заболевания является возникновение вторичного иммунодефицита. Наиболее часто встречающимися причинами, приводящими к значительному снижению резистентности организма, являются: длительная белково-витаминная недостаточность в питании, злоупотребление алкоголем, наркомания, наличие заболеваний, особенно тяжело протекающих – сахарного диабета, бронхиальной астмы и т.д., прием иммунодепрессантов, воздействие ионизирующей радиации и т.д.
Имеется много факторов, свидетельствующих о роли наследственности при туберкулезе. В последнее время появились данные о роли конкретных генетических систем в восприимчивости к туберкулезу. Установлено, что сила иммунного ответа контролируется HLA – системой, в которой ( в ее DR – локусе) локализуются гены иммунного ответа. В работах ряда авторов показано, что HLA– ( в первую очередь DR -) – фенотип отличается у больных разными формами туберкулеза. Неблагоприятное течение заболевания с преобладанием экссудативно – альтеративного компонента, как было установлено, нередко ассоциируется с носительством HLA – DR2 – антигена.
Развитие вторичного иммунодефицита у больных туберкулезом связано с длительным течением самого заболевания, а также влиянием противотуюберкулезных препаратов, значительная часть из которых обладает иммуносупрессивным действием.
Исследование иммунного статуса у больных туберкулезом в настоящее время используется для решения следующих практических задач: 1) диагностики и дифференциальной диагностики туберкулеза; 2) выявление нарушений иммунитета, прогноза течения заболевания, контроля за эффективностью лечения; 3) определения показаний для назначения иммуномодуляторов и контроля за их эффектом.
Оценка иммунного статуса проводится на основании лабораторных данных с учетом клинического статуса больного. С помощью различных методов исследуется количественная и функциональная оценка клеточного и гуморального иммунитета. Определяется общее число активных лимфоцитов, число Т- и В- лимфоцитов, Т-лимфоцитов – хелперов, Т-лимфоцитов – супрессоров, их соотношение, число активных клеток, несущих на себе рецепторы к интерлейкину – 2, уровень иммуноглобулинов, противотуберкулезных и противолегочных антител, уровень интерлейкинов (особенно ИЛ-1, ИЛ-2) и других цитокинов. Изучается РБТЛ на неспецифические и специфические митогены, РТМ с ППД и т.д. Учитывается уровень кожной чувтвительности к туберкулину ( р. Манту с 2ТЕ).
Из наиболее распространенных тестов, используемых для выявления иммунологических нарушений при туберкулезе необходимо отметить определение общего числа Т-лимфоцитов, Т-лимфоцитов – хелперов, Т-лимфоцитов – супрессоров, их соотношение, РБТЛ, РТМ. Отмечено, что неблагоприятное течение заболевания сопряжено не только с уменьшение числа Т-лимфоцитов, но и с нарушением хелперно-супрессорного соотношения, преобладающим количеством Т-лимфоцитов – супрессоров, снижением РБТЛ, повышением РТМ с ППД, значительным увеличением уровня противотуберкулезных антител. При благоприятном течении заболевания наблюдаются, как правило, обратные показатели.
При выявлении признаков вторичного иммунодефицита назначается соответствующая иммунокоррегирующая терапия. Оптимальным вариантом подбора иммуномодуляторов является не только теоретическое соответствие мишеней действия препарата и выявленных лабораторно нарушений, но и индивидуальная оценка эффективности их действия in vitro, с последующим контролем in vivo.
Учитывая, что в клинической картине туберкулеза доминируют нарушения Т-клеточного звена иммунитета, то чаще назначают Т-клеточные иммуностимуляторы (тактивин, тимостимулин, тималин, тимозин, левамизол, диуцифон, нуклеинат натрия и др.).
Таким образом, многообразие иммунобиологических реакций на внедрение в организм микобактерий обуславливает множество существующих клинических форм туберкулеза. Смена фаз туберкулезного процесса (прогрессирование, стабилизация, регрессирование) у больного также во многом определяется изменением уровня специфической резистентности.
Методическую разработку составила ассистент кафедры туберкулеза
Не нашли то, что искали? Воспользуйтесь поиском:
Патогенез.Туберкулез наиболее часто поражает легкие — основные входные ворота инфекции. Заражение (инфицирование) туберкулезом чаще всего происходит через дыхательные пути (аспирационный путь) при контакте с заразным больным, который при кашле выделяет во внешнюю среду капельки мокроты, содержащие МБТ. Причем только менее 10% этих частиц размером менее 5 мкм попадают в альвеолы и вызывают туберкулезное воспаление. Подавляющее большинство остальных более крупных частиц оседают на слизистой оболочке полости рта и верхних дыхательных путей и удаляются оттуда благодаря функции мукоциллиарного клиренса.
Инфицирование туберкулезом реже возникает при энтеральном попадании МБТ (при употреблении продуктов питания от больных туберкулезом животных).
Для инфицирования и развития заболевания туберкулезом основное значение имеют:
• массивность инфекции, доза и длительность поступления МБТ в организм человека;
• состояние естественной реактивности и факторов защиты организма в период воздействия инфекционного агента.
Механизмы защиты бронхолегочной системы действуют на уровне проводящих и респираторных отделов и осуществляются за счет конденсирования воздуха, механической очистки, фагоцитоза клетками неспецифической защиты и местного иммунитета.
Неповрежденная слизистая полости рта, носоглотки и верхних дыхательных путей — непроницаемый барьер для МБТ. Здесь осуществляется механическая очистка воздуха за счет фильтрации и осаждения инородных частиц, удаления их вследствие чихания и кашля. Наиболее значимая часть механической очистки — мукоцилиарный клиренсна уровне бронхов и бронхиол. Клиренс обеспечивается секретом, содержащим лизоцим, протеазы, сурфактант, иммуноглобулин A (IgA), который обволакивает (опсонизирует) МВТ и движением ресничек реснитчатого эпителия выводит их из организма.
Нарушение целостности слизистой полости рта и носоглотки, кариозные зубы, афтозные стоматиты, парадонтоз, синуситы, хронические тонзиллиты, а также периоды возрастной смены зубов у детей могут являться входными воротами для туберкулезной инфекции.
В трахее и крупных бронхах МВТ, как правило, не задерживаются и оседают в нижних дыхательных путях и альвеолах, где они фагоцитируются нейтрофилами и альвеолярными макрофагами. При этом фагоцитоз — единственный естественный механизм уничтожения МВТ в организме человека.
Локальные изменения в месте внедрения МВТ обусловлены прежде всего неспецифической реакцией нейтрофильных лейкоцитов, которые фагоцитируют, но не разрушают возбудитель (рис. 3.1).
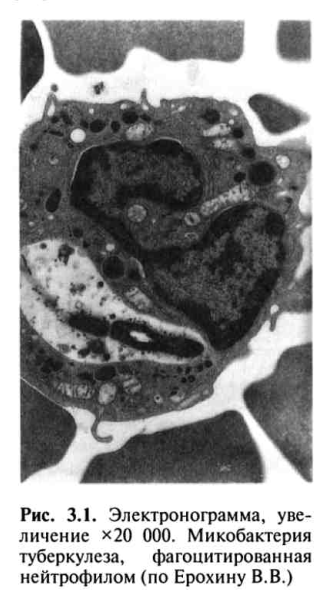
Под влиянием токсинов МВТ нейтрофилы разрушаются, вызывая воспалительную реакцию, которая сменяется более совершенной защитной реакцией с участием альвеолярных макрофагов, также осуществляющих неспецифический фагоцитоз возбудителя (рис. 3.2, см. цветную вклейку). От активности фагоцитоза во многом зависит эффективность всей системы противотуберкулезной защиты организма.
Однако при туберкулезе макрофаги самостоятельно уничтожить МВТ не могут. Необходимо активирующее воздействие на них сенсибилизированных Т-лимфоцитов, в частности субпопуляции Т-хелперов (CD4+ лимфоцитов).
На слизистой альвеол МВТ опсонизируются иммуноглобулином М (IgM), и этот комплекс связывается с Fs-рецептором, расположенным на поверхности макрофага для распознавания чужеродных микроорганизмов. Затем МВТ погружаются (инвагинируют) в цитоплазму клетки с образованием фагосомы, которая сливается с лизосомой с образованием фагосомо-лизосомного комплекса.
Лизосомы представляют весьма сложный комплекс органелл, содержащих большое число протеолитических ферментов, способных разрушать самые различные макромолекулы. Оптимальные условия для функционирования этих ферментных систем обеспечиваются благодаря слабой кислотности среды внутри лизосом (pH около 5).
Однако МВТ, попадая в макрофаги, могут сохраняться в фагосомах и даже продолжать размножение. При этом не происходит слияния фагосомы с лизосомой и неспецифический фагоцитоз носит незавершенный характер.
Механизмы, способствующие незавершенному фагоцитозу, до конца не установлены, но имеются данные, что в процессе размножении МВТ могут продуцировать аммиак и корд-фактор (фактор вирулентности).
Аммиак, с одной стороны, способен ингибировать слияние фаго-сомы с лизосомой, а с другой — путем защелачивания содержимого лизосомы снижать его ферментативную активность. Корд-фактор разрушительно действует на энергетический метаболизм макрофагов, вызывая поражение митохондрий и нарушение синтеза АТФ, что ведет к клеточной дистрофии и гибели клеток и в то же время тормозит синтез лизосомальных ферментов, что предохраняет МВТ от разрушения и повышает внутриклеточную выживаемость возбудителя, защищая его от механизмов лизиса в макрофаге (рис. 3.3).
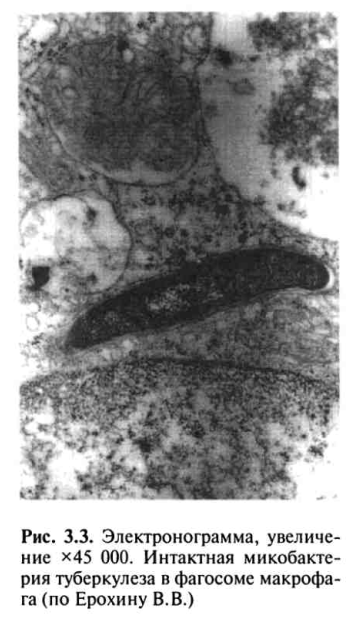
В случаях блокирования процесса переваривания МВТ происходят разрушение макрофагов и выход МВТ из поглотивших их клеток, которые в свою очередь вновь фагоцитируются другими макрофагами. Незавершенный фагоцитоз макрофагами МВТ играет двоякую роль, обеспечивая не только защиту от туберкулеза, но и создавая благоприятные условия для выживания МВТ.
Иммунопатогенез. В процессе фагоцитоза макрофаги синтезируют биологически активные вещества (цитокины) (см. рис. 3.2, см. цветную вклейку):
• фактор некроза опухоли альфа (TNF-α) — вызывает воспаление, тормозит размножение МВТ, усиливает миграцию и активирует новые макрофаги, поступающие из кровеносных сосудов;
• интерлейкин-1 (ИЛ-1) — привлекает и активирует Т-лимфоциты-хелперы (CD4+ лимфоциты), поступающие из кровеносных сосудов.
При этом основная роль в развитии противотуберкулезного иммунитета отводится субпопуляции Т-лимфоцитов-хелперов или CD4+ лимфоцитам.
Координация взаимодействия между макрофагами и CD4+ лимфоцитами рассматривается как центральное звено в формировании противотуберкулезного иммунитета. При этом макрофаги представляют собственно эффекторы, а CD4+ лимфоциты выполняют функцию индукторов ГЗТ.
Развитие первичного и вторичного Т-клеточного иммунного ответа при туберкулезе представлено на рис. 3.4, см. цветную вклейку.
Первичный Т-клеточный иммунный ответ развивается при первичном заражении. При этом поступающие из капилляров периферической крови CD4+ лимфоциты вступают в контакт с макрофагами и получают информацию о фагоцитированных МВТ.
CD4+ лимфоциты (Т-хелперы) активируются и синтезируют цитокины:
• интерлейкин-2 (ИЛ-2) специфически активирует новые макрофаги, поступившие из крови, в отношении МВТ;
• интерферон-гамма (IF-ϒ) усиливает специфический фагоцитоз макрофагами МВТ.
При первичном заражении инфекционный иммунитет развивается через 2-3 нед после первичного инфицирования, а достаточно выраженный иммунитет формируется через 6—8 нед.
Точные механизмы, с помощью которых уничтожаются МБТ, еще полностью не установлены. Тем не менее уже хорошо известны антимикобактериальные функции активированных макрофагов:
• качественное образование фагосомо-лизосомных комплексов;
• генерация реактивных продуктов кислорода (O2) при кислородном взрыве и образование перекиси водорода (Н3O3) в фагосомо-лизосомных комплексах под влиянием IF-ϒ;
• генерация реактивных продуктов азота (N) и образование оксида азота (NO) по L-аргинин-зависимому цитотоксическому пути в фагосомо-лизосомных комплексах под влиянием IF-ϒ и с помощью TNF-α.
Таким образом, фагоцитоз МБТ становится завершенным, а уничтожение МБТ активированными макрофагами возрастает в 100-1000 раз (рис. 3.5).
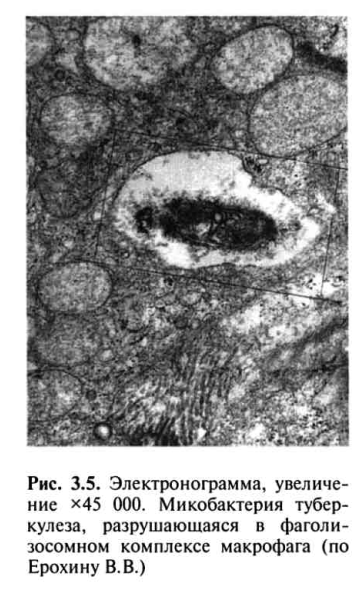
Вторичный Т-клеточный иммунный ответ развивается в иммунном организме при повторном заражении МБТ в течение 24-72 ч. Это связано с циркуляцией в крови специфически активированных CD4+ лимфоцитов памяти, которые тут же мигрируют в ткани органа, куда проникли МБТ, и с помощью цитокинов (ИЛ-2 и IF-ϒ) активируют антимикобактериальные функции макрофагов по уничтожению МБТ.
Морфологический эквивалент формирования защитных иммунных клеточных механизмов организма против туберкулезной инфекции — специфическая гранулема. В гранулеме имеются 3 вида морфологических элементов (рис. 3.6, см. цветную вклейку):
• центр гранулемы представлен казеозным некрозом ткани, который создает неблагоприятные условия для роста МБТ из-за снижения парциального давления кислорода (рО2);
• казеозный некроз окружен макрофагами и лимфоцитами;
• по периферии гранулемы располагаются нейтрофильные лейкоциты.
В некоторых туберкулезных гранулемах по периферии формируются эпителиоидные клетки и гигантские многоядерные клетки Пирогова-Лангханса — несколько слившихся малоактивных макрофагов, являющихся хранилищем МВТ, которые не в состоянии уничтожить своих внутриклеточных паразитов (рис. 3.7, см. цветную вклейку).
По мере формирования противотуберкулезного иммунитета происходит заживление гранулемы, которое начинается с обезвоживания и уплотнения казеозных масс с отложением солей кальция. По периферии гранулемы увеличивается количество фибробластов и фибрилл коллагена, образуется соединительнотканная капсула. В последующем в течение 5-10 лет гранулема полностью замещается соединительной тканью с солями кальция, формируется фиброзный или кальцинированный очаг (рис. 3.8, см. цветную вклейку).
Развитие специфического иммунитета и формирование фиброзных и кальцинированных очагов при первичном туберкулезе не в состоянии полностью уничтожить МВТ. Полное устранение возбудителя при туберкулезе не достигается даже при хорошо скоординированном взаимодействии макрофагов и CD4+ лимфоцитов, в результате чего организм остается инфицирован, хотя активный патологический процесс развивается далеко не во всех случаях. В фиброзных и кальцинированных очагах МВТ трансформируются в L-формы, которые поддерживают иммунитет. Однако любое нарушение иммунного баланса в последующие годы в сторону развития иммунодефицита создает условия для реактивации туберкулеза и развития клинически выраженных форм заболевания.
В развитии туберкулеза можно проследить 3 основных патогенетических варианта течения туберкулеза, когда клеточные реакции организма на внедрение МВТ носят четко разграниченные иммунологические, морфологические и клинические проявления (рис. 3.9).
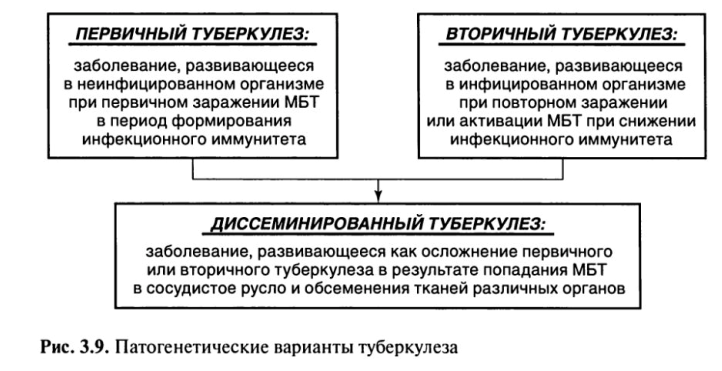
• Вариант течения туберкулеза, связанный с реакцией организма на первичное экзогенное заражение, определяется как первичный туберкулез.
• Вариант течения туберкулеза, связанный с реакцией организма на вторичное заражение (экзогенная суперинфекция) или реактивацию уже заживших постпервичных изменений (эндогенная инфекция), рассматривается как вторичный туберкулез.
• При обоих вариантах течения болезни возможно осложнение, связанное с проникновением МБТ в лимфатические и кровеносные сосуды и обсеменением тканей различных органов, определяемое как диссеминированный туберкулез.
При первичном туберкулезе(рис. 3.10) в зависимости от места входных ворот первичного внедрения МБТ воспалительный очаг (первичный очаг) может образоваться в полости рта, миндалинах, легких, кишечнике — первичный аффект.
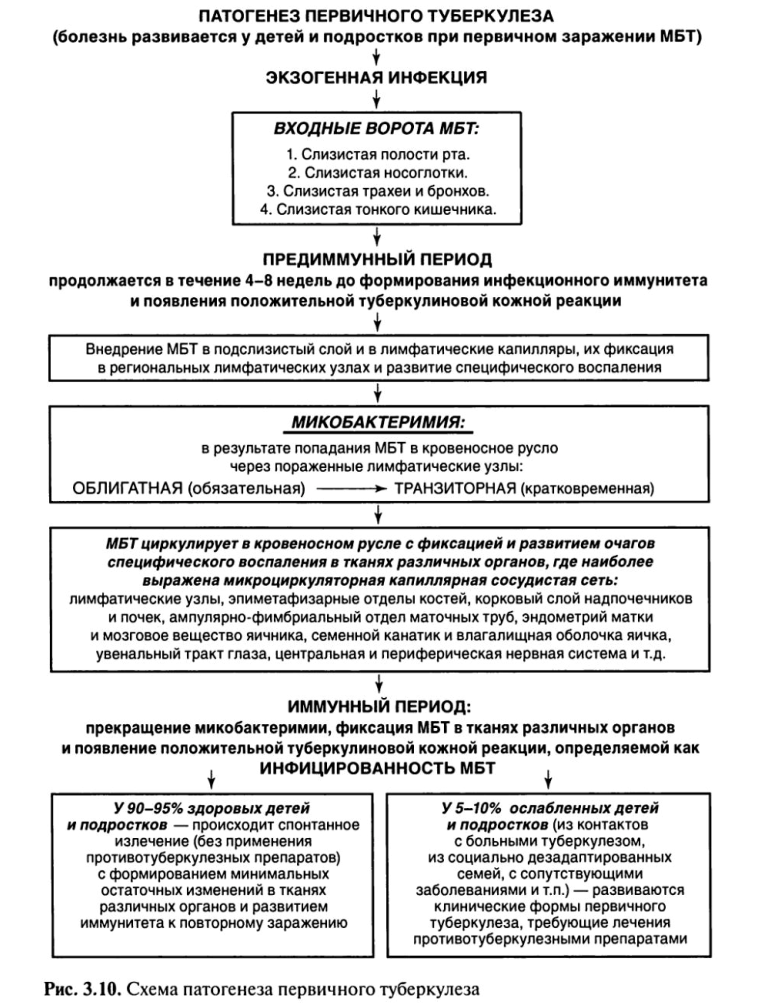
Некоторая часть МБТ остается на месте проникновения, другая с током лимфы и крови переносится к месту внедрения — в региональные лимфатические узлы. В зависимости от локализации входных ворот инфекции могут поражаться подчелюстные, шейные, над- и подключичные, подмышечные, внутригрудные и другие региональные лимфатические узлы.
Последующее размножение МБТ происходит как в легких, так и в лимфатических узлах, и организм реагирует образованием специфической гранулемы.
МБТ, продолжая размножаться, разносятся по организму с током крови и лимфы, возникает так называемая первичная, или облигатная (обязательная), микобактеримия. МБТ оседают и фиксируются в тканях различных органов, где наиболее выражена микроциркуляторная капиллярная сеть (капилляры лимфатических узлов, клубочков коркового слоя почек, эпиметафизарных отделов трубчатых костей, ампулярно-фимбриального отдела маточной трубы, увеального тракта глаз).
Таким образом, с момента первичного заражения туберкулезная инфекция носит генерализованный и системный характер, дающий в последующем возможность развития внелегочных форм туберкулеза.
Первичный туберкулез у 90—95% впервые инфицированных лиц протекает без клинических проявлений, и о наступившем заражении свидетельствует только переход отрицательной туберкулиновой реакции в положительную — вираж туберкулиновых проб. Он может также завершиться спонтанным излечением (без применения противотуберкулезных препаратов) с минимальными (малыми) фиброзными или кальцинированными остаточными специфическими изменениями в легких, внутригрудных лимфатических узлах и тканях других органов.
Только у 5—10% впервые инфицированных лиц развиваются клинические формы туберкулеза с выраженными клиническими проявлениями, что требует лечения противотуберкулезными препаратами. При излечении формируются выраженные остаточные изменения в легких (кальцинированные очаги Гона и Симона), лимфатических узлах (петрификаты или кальцинаты) и тканях других органов.
Отсутствие клинических проявлений первичной туберкулезной инфекции может быть объяснено высоким уровнем естественной резистентности организма человека к туберкулезу, а также приобретенным в результате вакцинации БЦЖ искусственным иммунитетом.
Первичное заражение МБТ, возникающее на фоне послевакцинного иммунитета у вакцинированного вакциной БЦЖ ребенка, происходит по типу вторичного Т-клеточного иммунного ответа и развивается в течение 24—72 ч. Это происходит за счет специфически активированных CD4+ лимфоцитов памяти, которые сразу мигрируют в зону внедрения МБТ и активируют антимикобактериальные функции макрофагов. При этом отсутствуют поражение региональных лимфатических узлов, микобактеримия и развитие очагов в тканях различных органов.
Длительность поствакцинного иммунитета определяется специфически активированными CD4+ лимфоцитами памяти, которые циркулируют в крови в течение 5—6 лет, активируя макрофаги при повторных случаях заражения МБТ. В связи с этим для поддержания поствакцинного иммунитета на достаточно высоком уровне необходимы повторные ревакцинации детей и подростков в возрасте 6—7 и 13-14 лет.
Необходимое условие для развития вторичного туберкулеза — снижение естественной резистентности и специфического иммунитета под влиянием неблагоприятных внешних и внутренних факторов. К таким факторам относят социально-экономическое неблагополучие, социальные стрессы и войны, неблагоприятную экологию, недостаточность питания, сопутствующие заболевания, в том числе алкоголизм, наркоманию, ВИЧ-инфекцию и др. При этом, как правило, у больных вторичным туберкулезом развиваются клинические проявления болезни и практически отсутствует тенденция к спонтанному излечению, что характерно для первичного туберкулеза (рис. 3.11).

Вторичный туберкулез развивается в результате экзогенной суперинфекции (новое заражение) и эндогенной реактивации при обострении остаточных посттуберкулезных изменений различных форм первичного туберкулеза.
Противотуберкулезное лечение может полностью привести к клиническому излечению, однако его отсутствие ведет к летальному исходу. При этом важное значение имеют состояние защитных механизмов макроорганизма, способность противостоять действию возбудителя, развитие полноценных репаративных процессов.
Необходимое условие для развития диссеминированного туберкулеза — выраженный иммунодефицит (рис. 3.12).
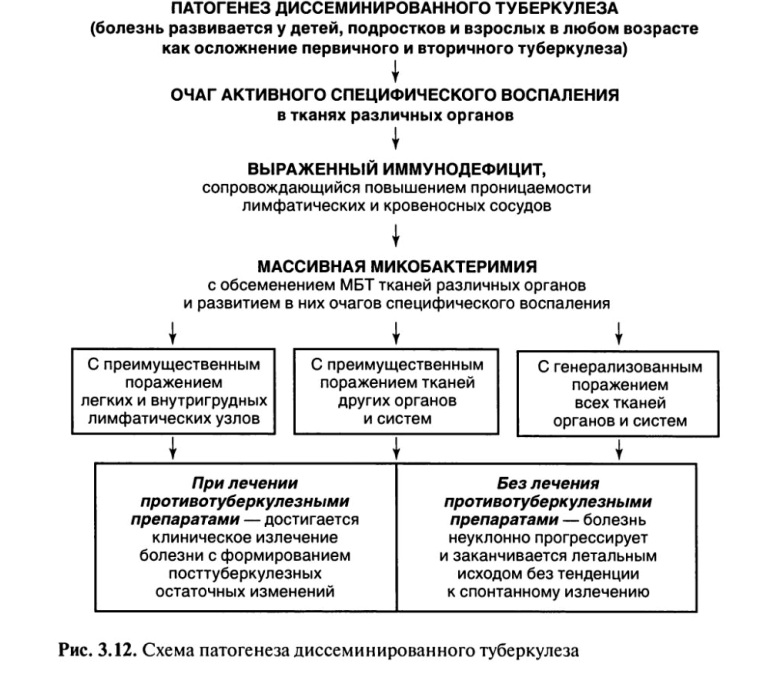
В этих случаях туберкулез развивается при осложненном течении первичного или вторичного туберкулеза, когда из очага специфического воспаления МВТ попадают в кровеносное русло и обсеменяют ткани различных органов с развитием в них очагов туберкулезного воспаления. Течение болезни сопровождается выраженными клиническими проявлениями и высокой вероятностью летального исхода.
| | | следующая лекция ==> | |
| Антигенная структура | | | Патоморфология туберкулеза |
Дата добавления: 2019-10-17 ; просмотров: 1285 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Читайте также:


